2. 江苏省物质循环与污染控制重点实验室, 南京 210023;
3. 南京师范大学地理科学学院, 南京 210023;
4. 上海市环境科学研究院, 上海 200000
2. Jiangsu Provincial Key Laboratory of Materials Cycling and Pollution Control, Nanjing 210023;
3. School of Geography Science, Nanjing Normal University, Nanjing 210023;
4. Shanghai Academy of Environmental Sciences, Shanghai 200000
工厂排放的未经处理的废水是造成河流、湖泊等湿地水体污染的主要原因.工业的快速发展、工厂不定期多次排放污水, 给湿地带来了大量的重金属污染物, 当水体中的重金属积累到一定的限度, 会破坏湿地生态, 甚至会威胁到人类健康(Wu et al., 2016;刘静等, 2018).传统的监测湿地重金属污染的方法有原子吸收法、ICP-OES等(Brayner et al., 2001;Bai et al., 2011), 这些方法依赖于人工定期或不定期采样检测, 耗时费力, 而且不能做到实时连续监测, 导致对湿地重金属污染事件的发现比较滞后, 从而影响对污染的及时处理.而且目前已有的方法很难及时监测到某个排污口的重金属排放时间和次数.虽然摄像探头能够拍摄到排放过程, 但对于水下的暗管排放也无能为力.
近年来, 微生物燃料电池(microbial fuel cells, MFC)传感器因为具有可持续性、低成本以及在线监测水污染的能力, 受到了广泛的关注(Stein et al., 2012).目前研究报道的MFC传感器主要是双室MFC构型(Zhou et al., 2017), 其工作原理为:将待测的污水引入MFC的阳极室, 若污水中包含重金属等有毒污染物, 产电细菌会受到抑制, 表现为电压和电流的降低(Kim et al., 2007;Shen et al., 2012;Li et al., 2016).然而, 这类MFC传感器存在着若干问题:①产电细菌需要接种到阳极室并且至少需要一到两周的时间进行驯化, 因此, 在这段时间内无法进行监测(Shen et al., 2012;Xu et al., 2015);②污水进入阳极室会抑制产电细菌活性, 对产电细菌造成伤害, 因此通常只能完成一次污染监测(Li et al., 2016).最近报道了生物阴极传感器, 该传感器需要在双室MFC的阴极表面培养具有还原O2功能的细菌, 将废水引入阴极室而不是阳极室.当有毒物质与生物阴极接触时会抑制生物阴极对O2的还原能力, 导致电压降低(Jiang et al., 2017).虽然生物阴极传感器避免扰动产电细菌, 但仍然需要培养产电细菌和生物阴极, 并且监测过程中会扰动生物阴极, 仍然难以监测多次污染冲击.因此, 目前已报道的MFC传感器依赖于细菌的培养, 且监测过程易对产电细菌或生物阴极造成不可恢复的伤害, 难以连续监测多次水污染事件.
为了克服微生物燃料电池传感器的上述不足, 本课题组发明了一种新型沉积物-微生物燃料电池传感器(SMFC传感器)(邓欢等, 2017).为了以示区别并便于表述, 本文将其命名为DH-I型SMFC传感器.在我们之前的研究中对该传感器的性能和原理做了报道(Wu et al., 2018).该传感器的优势包括:①它利用底泥中的土著产电细菌进行产电, 因此不需要接种和培养产电细菌;②该传感器阴极响应重金属污染, 避免了重金属与产电细菌接触;③它可以对水体的重金属污染事件进行原位在线监测.值得注意的是, 本课题组还发现该传感器的电压信号在响应一次重金属污染之后, 仍然能够保持稳定的输出, 这预示着该传感器能够用于响应多次重金属污染冲击.相比于传统微生物燃料电池传感器只能响应一次污染来说, 这将是一个比较大的突破.因此, 有必要探索该传感器电压信号对连续多次重金属污染冲击的响应特征以及响应原理.
本研究用淹水水稻土模拟湿地环境, 并在其中放置DH-I型SMFC传感器.传感器连续运行27 d, 每天早上9:00和晚上7:00分别向上覆水中加入含Cd2+溶液, 一共加入53次, 用于模拟水体多次重金属污染事件.采用数据采集卡连续记录该传感器运行期间的电压信号.而解释该传感器能响应多次污染冲击的关键在于揭示水中的重金属离子迁移到土壤之后, 是否被土壤吸附和固定, 从而减轻对土壤中产电细菌的毒害作用.为此, 所有Cd2+溶液添加完成之后, 我们对淹水土壤中的Cd2+形态进行分析;并对供试土壤中主要的产电细菌类群地杆菌科(Geobacteraceae)和梭菌属(Clostridium)的16S rRNA基因进行定量分析.本研究的目的是为了阐明DH-I型SMFC传感器电压信号能够在湿地环境中, 响应连续多次的Cd2+污染冲击的可行性和响应特征, 并揭示相关机制.
2 材料与方法(Materials and methods) 2.1 土壤采集供试土壤于2018年3月采集于南京市江宁区水稻田(32°05′18″N;118°59′28″E), 采样深度为0~20 cm.样地为亚热带湿润气候, 年平均降水量1100 mm, 年平均气温15 ℃.土壤采集后研磨过2 mm筛并充分混匀待用.部分样品自然风干后进行理化性质的测定.土壤pH采用pH计(FE20, Mettler Toledo, Switzerland)按土水比1:2.5测定;土壤电导率(EC)采用电导率仪(DDSJ-308F, 上海雷磁)按土水比1:5测定;土壤总有机碳(TOC)和可溶性有机碳(DOC)采用TOC分析仪(TOC-L, Shimadzu, Kyoto, Japan)测定;土壤总氮(TN)采用元素分析仪(Vario EL III, Elementar, Germany)测定.土样的理化性质如下:土壤pH:7.31;EC:118.95 μS·cm-1;TOC:10.64 mg·g-1;DOC:0.12 mg·g-1;TN 2.87 g·kg-1.
2.2 DH-I型SMFC传感器的构建和运行本实验采用的是我们自主研发的DH-I型SMFC传感器(图 1)(邓欢等, 2017).该传感器的阳极由不锈钢管制成, 阴极为铂网, 阳极和阴极分别连在聚四氟乙烯塑料管的两端.阳极和阴极通过导线连接到外部负载电阻, 负载两端的电压是监测湿地水污染的电信号.本课题组在之前的研究中对该传感器的性能和原理做了报道(Wu et al., 2018).
 |
| 图 1 本实验采用的DH-I型SMFC传感器照片 Fig. 1 A photo of a DH-I type SMFC |
将约1.5 kg(干土重)的水稻土分别加入5只2 L的玻璃烧杯中, 然后将去离子水缓慢加入烧杯中, 使土壤上覆水深度保持在5 cm以模拟湿地环境.每个烧杯中放置一个DH-I型SMFC传感器.具体方法是:将该传感器阳极不锈钢管插入水稻土中, 不锈钢管底部深度约为10 cm, 同时阴极铂网位于上覆水的水面下方1 cm处.阳极和阴极通过钛丝导线与1000 Ω外阻串联.该传感器在室温下运行.温度数据从南京市气象局官网上记录(http://www.njqxi.gov.cn).
2.3 镉污染响应试验本实验使用CdCl2溶液添加到DH-I型SMFC传感器阴极上方的上覆水中来模拟含重金属废水向湿地的排放.分别配制Cd2+浓度为25、50、100和200 mg·L-1的溶液, 命名为Cd-25、Cd-50、Cd-100和Cd-200处理, 另外, 以不加Cd2+的去离子水作为对照.CdCl2溶液的理化性质分析如下:溶液pH采用pH计(FE20, Mettler Toledo, Switzerland)测定;电导率使用电导率仪(DDSJ-308F, 上海雷磁)测定.上述测定结果见表 1.从上述4个Cd2+浓度的溶液中分别取50 mL缓慢加入4个传感器阴极上方的上覆水中, 向对照传感器加入50 mL去离子水.因此, 每个传感器均对应一个Cd2+浓度(25、50、100或200 mg·L-1), 之后反复向每个传感器添加其对应的Cd2+浓度, 添加频率为每天加入2次Cd2+溶液(对照加水), 连续加入27 d.在此时间内, 采用数据采集卡(7660B, 中泰研创)每隔6 s记录一次传感器外阻两端的电压数据.为了保持上覆水深度不变, 每次加完溶液待电压恢复稳定后, 从烧杯中吸取50 mL上覆水并弃去.停止记录电压之后, 将阳极附近土壤分成3层(0~3 cm, 3~6 cm, 6~9 cm), 采集每层土样.部分土样直接保存于-20 ℃冰箱用于分子生物学检测, 剩余的分层土样自然风干, 过100目筛后, 用于土壤中不同形态镉浓度检测.
| 表 1 CdCl2溶液理化性质 Table 1 Physiochemical properties of CdCl2 solution |
使用土壤DNA快速提取试剂盒(Fast DNASPIN Kit for Soil, MP)按照制造商说明书提取上述分层土壤的DNA用于基因定量.地杆菌科(Geobacteraceae)和梭菌属(Clostridium)细菌16S rRNA基因丰度采用CFX96实时荧光定量PCR仪(BIO-RAD, Laboratories Inc., USA)进行测定.这两个类群细菌的qPCR反应体系都为20 μL, 其中包括10 μL 2 × SYBR Premix Ex Taq (Takara, Japan), 上下游引物各0.4 μL, 2 μL模板DNA及7.2 μL ddH2O.引物序列和反应程序见表 2.采用溶解曲线分析扩增产物的特异性, 反应程序为65~95 ℃, 每间隔0.5 ℃升温测定荧光信号.采用10倍稀释含有标靶基因的重组质粒制作标准曲线.地杆菌科(Geobacteraceae)和梭菌属(Clostridium)细菌16S rRNA基因标准曲线模板的浓度分别为1.42 × 109~1.42 × 103 copies·μL-1和4.23 × 109~ 4.23 × 103 copies·μL-1.扩增效率分别为99.8%(R2= 1.000)和83.8%(R2= 0.994).设置3个无模板样品为阴性对照.
| 表 2 细菌定量PCR的引物和反应条件 Table 2 Primers and reaction conditions for quantitative real-time PCR |
电压记录完毕后, 抽取Cd-25、Cd-50、Cd-100和Cd-200处理的阴极附近的上覆水, 采用原子吸收光谱法检测其Cd2+浓度;并采集这4种处理3层不同深度(0~3 cm, 3~6 cm, 6~9 cm)的土壤, 对每层土壤中不同形态镉采用Tessier法提取, 并用原子吸收光谱法进行分析测定.Tessier法已广泛应用于土壤样品的重金属形态分析(Tessier et al., 1979), 该方法将沉积物中重金属形态分为5种:可交换态、碳酸盐结合态、铁锰氧化物结合态、有机结合态和残渣态.分析过程如表 3所示.
| 表 3 Tessier法的提取步骤 Table 3 Extraction steps of the Tessier method |
由于该传感器的基线电压是随着温度昼夜变化的, 因此本研究采用Origin 8.5软件中的Peaks and Baseline功能, 通过拟合加镉前后2 h内所记录的电压曲线来确定基线电压, 并进行模拟计算得出电压增量.图 2以Cd-200处理某次出现的Cd2+污染响应峰为例(黑色箭头标注):灰色曲线代表拟合后的基线电压, 峰值电压相对于基线电压的电压增量为6.17 mV, 以此方法计算出所有峰值电压的电压增量.采用SPSS 14.0软件分析不同Cd2+浓度下, 53个响应峰的电压增量均值和误差.
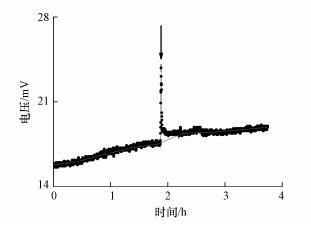 |
| 图 2 Cd-200处理添加CdCl2溶液后出现峰值的拟合电压曲线示意图 Fig. 2 Diagram of fitting voltage curve showing the peak value after the addition of CdCl2 solution to Cd-200 treatment |
向上覆水中加入Cd2+污染前开始记录电压数据.运行结果显示, DH-I型SMFC传感器的基线电压随温度昼夜变化(图 3、图 4).为了将加Cd2+引起的响应峰展现的更加清楚, 本课题组选取3 d(第12~14 d)的电压曲线进行放大, 如图 3所示, 用黑色箭头标出的即为响应峰出现的地方.每次添加Cd2+污染, 电压信号均出现响应峰.向对照加入去离子水, 电压仅出现了微弱的上升, 但上升幅度小于0.6 mV.这可能是在加入去离子水的过程中扰动了阴极附近上覆水, 引入了少量氧气, 导致电压出现微弱升高.相同Cd2+浓度溶液, 加入53次引起的电压增量具有较好的一致性, 且电压增量随着Cd2+浓度的增加而升高(图 5).
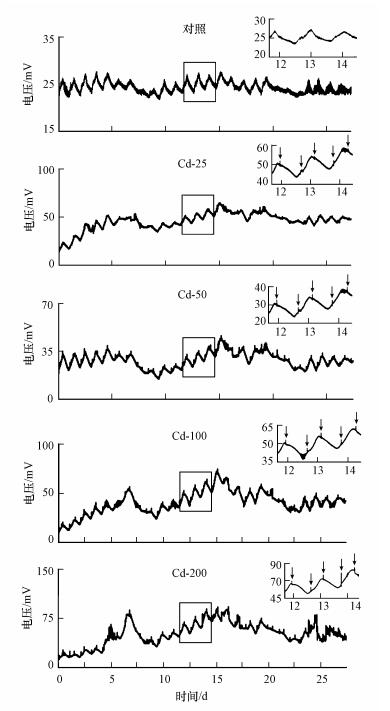 |
| 图 3 DH-I型SMFC传感器电压曲线 Fig. 3 The voltage curves generated by DH-I type SMFC sensors |
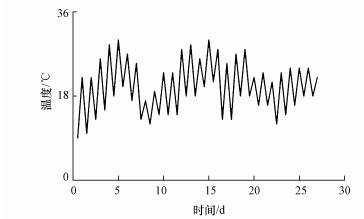 |
| 图 4 DH-I型SMFC传感器运行期间温度变化曲线 Fig. 4 Temperature curve of DH-I type SMFC sensors during operation |
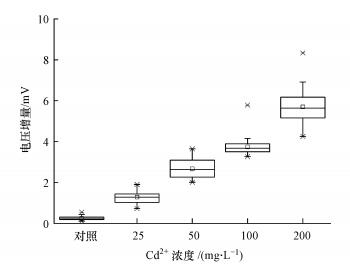 |
| 图 5 不同Cd2+浓度处理下的电压增量 Fig. 5 Voltage increments in treatments with different Cd2+ concentrations |
连续添加Cd2+污染结束后, 分别对阳极周围3层不同深度土壤的地杆菌科(Geobacteraceae)和梭菌属(Clostridium)细菌16S rRNA基因进行定量分析.结果显示, 地杆菌科和梭菌属16S rRNA基因拷贝数变化范围分别为6.91 × 108~2.32 × 109 g-1干土重和5.80 × 1010~1.57 × 1011 g-1干土重.其中, 梭菌属16S rRNA基因拷贝数高于地杆菌科, 表层土壤的16S rRNA基因拷贝数低于中层和深层的.与对照相比, Cd2+污染未明显减少每层土壤中地杆菌科和梭菌属16S rRNA基因丰度.
| 表 4 地杆菌科(Geobacteraceae)和梭菌属(Clostridium)细菌16S rRNA基因定量 Table 4 Copies of 16S rRNA gene for Geobacteraceae and Clostridium |
不同Cd2+浓度处理下(图 6), 表层土壤中镉浓度远高于中下层, 其中毒性较低的残渣态镉在5种形态镉中含量较高, 占表层土壤中5种形态镉总含量的28.7%~89.1%;毒性较高的可交换态镉在5种形态镉中含量较低, 占表层土壤中5种形态镉总含量的1.8%~13.5%.不同处理的阴极附近上覆水中检测出的Cd2+浓度很低, Cd-200处理的Cd2+浓度最高仅为0.29 mg·kg-1.
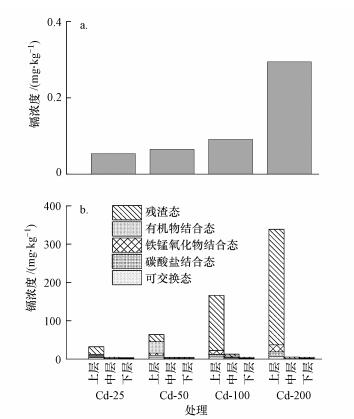 |
| 图 6 不同处理上覆水的Cd2+含量(a)和3层土壤中不同形态镉的含量(b) Fig. 6 Concentrations of Cd2+ in the overlying water (a) and different forms of Cd2+ in three layers of soils (b) under different treatments |
本研究考察了DH-I型SMFC传感器在模拟湿地环境中连续运行27 d, 产电信号对连续多次Cd2+污染冲击的响应特征.其中, 电压曲线呈现出随气温变化而波动的趋势, 这是因为土壤微生物(包括土壤产电细菌)活性和环境温度存在相关性(Deng et al., 2014).产电电压对每次Cd2+污染的响应均十分迅速, 向阴极上方上覆水中加入Cd2+污染后电压立刻上升, 达到峰值后又回落到稳定平滑状态.加入53次Cd2+污染引起的电压增量具有较好的一致性, 且电压增量随着Cd2+浓度的增加而升高.前期研究表明, 该传感器出现针对重金属的响应峰与重金属溶液的酸性pH值有关(Wu et al., 2018).酸性溶液中大量H+能够促进阴极反应, 从而引起电压出现响应峰.而上述研究也发现加入pH7、电导率在79~266 μS·cm-1范围内的磷酸缓冲液都不能引起电压信号的响应.而本研究采用的Cd2+溶液电导率范围是75~130 μS·cm-1, 因此我们认为Cd2+溶液电导率对于响应峰的峰值没有显著影响.另外, 标准电极电势较高的重金属离子(如Cu2+)能够作为阴极的电子受体, 促进电压升高.而本研究中Cd2++ 2e = Cd的标准电极电势为负, 无法作为电子受体.因此本研究的响应峰主要是Cd2+溶液的H+引起.由于阴极附近上覆水的Cd2+浓度逐渐被稀释, 导致电压达到峰值后很快就回落至稳定状态(Hu et al., 2017).尽管该传感器的电压信号会随温度变化, 但其变化十分缓慢, 而Cd2+污染的响应峰上升迅速, 峰型尖锐, 因而温度引起的电压波动不会影响对响应峰的判断.这里需要说明的是, 由于DH-I型SMFC传感器的信号响应来自于重金属溶液中的H+以及一些重金属离子的较强的氧化性, 因此该信号不能用于区分重金属的种类.研究发现, 该传感器对含有不同重金属的溶液均有相似的信号响应.因此在应用中, 可以将该传感器布设在排放已知重金属种类的排污口, 只要出现信号响应, 就可以认为发生了重金属排放事件.由于排放的重金属种类已知, 因此无需通过电信号去判断种类.
本研究最大的创新之处在于所采用的DH-I型SMFC传感器能够进行原位在线监测, 以及对多达53次镉污染均产生电压信号峰, 表明镉污染并未抑制土壤中的产电细菌活性.已有文献大多采用代表性的产电细菌如地杆菌科、希瓦氏菌属等来表征产电细菌(Schiliro et al., 2016).在前期的实验研究中, 我们发现地杆菌科和梭菌属是供试土壤中的优势产电细菌类群, 因此对这两类细菌的16S rRNA基因进行定量来表征产电细菌数量.结果显示, 每层土壤中地杆菌科和梭菌属16S rRNA基因丰度均未随着Cd2+浓度的增加而降低, 因此证实了加入到上覆水中的Cd2+未影响到土壤中的产电细菌的数量.土壤产电细菌不受镉污染抑制主要有两个方面原因:首先, 我们通过测定发现上层土壤吸附了大量的Cd2+, 它们主要以残渣态和有机物结合态的形式存在, 这两种形态的镉能够长期稳定在土壤中, 毒性较低;可交换态镉毒性较高(Gadd et al., 1977;Xian et al., 1989), 但它们在表层土壤中所占比例较低.因此表层土壤的产电细菌几乎没有受到Cd2+的毒害, 而更深层土壤中的Cd2+对产电细菌的毒害和抑制更加微弱;其次, 地杆菌科和梭菌属的细菌普遍为铁还原细菌, 这类细菌对于重金属污染具有较强的耐受能力(Burkhardt et al., 2011).0~3 cm表层土壤的地杆菌科和梭菌属16S rRNA基因丰度比中下层土壤的要低, 这可能是因为表层土壤的厌氧程度不及中下层土壤.这也表明了即便表层土壤吸附的Cd2+对产电细菌产生毒害, 也不会对传感器的信号输出产生不利影响, 因为厌氧程度更高的中下层土壤才是产电细菌活跃的场所.
综上, DH-I型SMFC传感器适用于有底泥(或土壤)和上覆水的湿地环境.底泥(或土壤)中的产电细菌产生电压信号, 通过传感器的阴极来响应上覆水的镉污染.同时, 底泥(或土壤)有效阻隔水体中的镉, 对产电细菌形成保护, 从而能够监测多次镉污染.
5 结论(Conclusions)本研究表明, DH-I型SMFC传感器的电压信号能够在湿地环境中, 原位在线监测多次Cd2+污染, 电压信号对每次Cd2+污染响应均十分迅速, 且多次加入相同Cd2+浓度引起的电压增量具有较好的一致性.虽然基线电压随着气温昼夜变化, 但不影响电压信号对Cd2+污染的响应.由于表层土壤吸附和阻隔了大量的Cd2+, 并防止其渗入到更深层的土壤中, 因此产电细菌未受到Cd2+的抑制或毒害, 从而该传感器产电信号能够连续监测多次Cd2+污染事件.传统的双室微生物燃料电池传感器是将重金属废水引入阳极室中, 通过毒害和抑制产电细菌产生降低的电流和电压信号, 因此不适合原位监测连续发生的污染事件.本研究采用的DH-I型SMFC传感器与传统的MFC相比, 具有一定的优势和创新之处.该传感器是否对不同重金属的连续冲击均有响应、响应次数是否存在上限, 以及不同重金属对土壤产电细菌产生毒害的程度有何不同, 还需进一步研究确定.
Bai J, Cui B, Chen B, et al. 2011. Spatial distribution and ecological risk assessment of heavy metals in surface sediments from a typical plateau lake wetland, China[J]. Ecological Modelling, 222(2): 301–306.
DOI:10.1016/j.ecolmodel.2009.12.002
|
Brayner F M, Silva H K D, Barbosa A M. 2001. Speciation of heavy metals in estuarine sediments in the northeast of Brazil[J]. Environmental Science and Pollution Research, 8(4): 269–274.
DOI:10.1007/BF02987405
|
Burkhardt E M, Bischoff S, Akob D M, et al. 2011. Heavy metal tolerance of Fe(Ⅲ)-reducing microbial communities in contaminated creek bank soils[J]. Applied & Environmental Microbiology, 77(9): 3132–3136.
|
Cummings D E, Lovley D R. 2003. Diversity of geobacteraceae species inhabiting metal-polluted freshwater lake sediments ascertained by 16S rDNA analyses[J]. Microbial Ecology, 46(2): 257–269.
|
Deng H, Wu Y C, Zhang F, et al. 2014. Factors affecting the performance of single-chamber soil microbial fuel cells for power generation[J]. Pedosphere, 24: 330–338.
DOI:10.1016/S1002-0160(14)60019-9
|
邓欢, 许静, 郭颖颖, 等. 2017.一种快速响应水体污染的监测系统[P].专利授权号: ZL201720575719.7
|
Gadd G M, Griffiths A J. 1977. Microorganisms and heavy metal toxicity[J]. Microbial Ecology, 4(4): 303–317.
DOI:10.1007/BF02013274
|
Hu S, Wu Y, Yi N, et al. 2017. Chemical properties of dissolved organic matter derived from sugarcane rind and the impacts on copper adsorption onto red soil[J]. Environmental Science and Pollution Research, 24(26): 1–11.
|
Jiang Y, Liang P, Liu P, et al. 2017. A novel microbial fuel cell sensor with biocathode sensing element[J]. Biosensors and Bioelectronics, 94: 344–350.
DOI:10.1016/j.bios.2017.02.052
|
Kim M, Hyun M S, Gadd G M, et al. 2007. A novel biomonitoring system using microbial fuel cells[J]. Journal of Environmental Monitoring, 9: 1323–1328.
DOI:10.1039/b713114c
|
Li T, Wang X, Zhou L, et al. 2016. Bioelectrochemical sensor using living biofilm to in situ evaluate flocculant toxicity[J]. ACS Sensors, 1(11): 1374–1379.
DOI:10.1021/acssensors.6b00571
|
刘静, 马克明, 曲来叶. 2018. 湛江红树林湿地水体重金属污染评价及来源分析[J]. 水生态学杂志, 2018, 39(1): 3–31.
|
Schiliro T, Tommasi T, Armato C, et al. 2016. The study of electrochemically active planktonic microbes in microbial fuel cells in relation to different carbon-based anode materials[J]. Energy, 106: 277–284.
DOI:10.1016/j.energy.2016.03.004
|
Shen Y J, Lefebvre O, Tan Z, et al. 2012. Microbial fuel-cell-based toxicity sensor for fast monitoring of acidic toxicity[J]. Water Science and Technology, 65: 1223–1228.
DOI:10.2166/wst.2012.957
|
Stein N E, Hamelers H M V, van Straten G, et al. 2012. On-line detection of toxic components using a microbial fuel cell-based biosensor[J]. Journal of Process Control, 22: 1755–1761.
DOI:10.1016/j.jprocont.2012.07.009
|
Tessier A. 1979. Sequential extraction procedure for the speciation of particulate trace metals[J]. Analytical Chemistry, 51(7): 844–85l.
DOI:10.1021/ac50043a017
|
Wu Q H, Zhou H C, Tam N F Y, et al. 2016. Contamination, toxicity and speciation of heavy metals in an industrialized urban river:Implications for the dispersal of heavy metals[J]. Marine Pollution Bulletin, 104(1/2): 153–161.
|
Wu S S, Deng H, Han C, et al. 2018. A novel sediment microbial fuel cell based sensor for on-line and in situ monitoring copper shock in water[J]. Electroanalysis, 30: 1–9.
DOI:10.1002/elan.201880101
|
Wang Y Y, Ni Z H, Yu T, et al. 2008. Raman studies of monolayer graphene:The substrate effect[J]. Journal of Physical Chemistry C, 112(29): 10637–10640.
DOI:10.1021/jp8008404
|
Xian X. 1989. Effect of chemical forms of cadmium, zinc, and lead in polluted soils on their uptake by cabbage plants[J]. Plant and Soil, 113(2): 257–264.
DOI:10.1007/BF02280189
|
Xu Z H, Liu B C, Dong Q C, et al. 2015. Flat microliter membrane-based microbial fuel cell as "on-line sticker sensor" for self-supported in situ monitoring of wastewater shocks[J]. Bioresource Technology, 197: 244–251.
DOI:10.1016/j.biortech.2015.08.081
|
Zhou T Y, Han H W, Liu P, et al. 2017. Microbial fuels cell-based biosensor for toxicity detection:A review[J]. Sensors, 17: 2230.
DOI:10.3390/s17102230
|
 2019, Vol. 39
2019, Vol. 39


