2. 中国科学院安徽光学精密机械研究所大气物理化学实验室, 合肥 230031
2. Laboratory of Atmospheric Physico-Chemistry, Anhui Institute of Optics and Fine Mechanics, Chinese Academy of Sciences, Hefei 230031
挥发性有机化合物(Volatile Organic Compounds, VOCs)是大气中重要的污染物, 其本身具有一定的毒性, 可引起各种类型的疾病, 进而危害人类身体健康(Ahmed et al., 2018).排放到大气中的VOCs会与OH自由基等氧化剂发生光化学反应产生难挥发性和半挥发性产物, 这些产物通过气-粒分配形成二次有机气溶胶(Secondary Organic Aerosol, SOA)粒子(陈文泰等, 2013).SOA粒子能够吸收、散射太阳光, 导致气候变化、大气能见度降低, 还可以深入到支气管和肺部诱发多种肺病, 因而引起了人们的广泛关注(曹军骥等, 2016).此外, VOCs能够溶于大气水滴、云雾、液相气溶胶等水相中, 发生液相反应生成低挥发性和难挥发性产物, 在水分蒸发后, 这些产物保留在颗粒相中形成SOA粒子(叶招莲等, 2018).研究表明, 水相反应产生的SOA与气相反应形成的SOA对大气SOA的贡献基本相当, 而且能够解释外场观测与烟雾腔模拟SOA在颗粒浓度、大小和老化等方面的差异(祁骞等, 2014).水相反应形成SOA的研究已成为当前大气化学领域研究的热点.
目前, 研究水相反应形成SOA的主要途径是黑暗条件下的非自由基反应和光照条件下的自由基氧化反应.黑暗条件的水相反应研究主要集中在乙二醛、甲基乙二醛等羰基物的水合和催化反应方面.二醛化合物在水相中发生水合、缩醛/半缩醛、醇醛缩合等反应形成低聚物, 在水分蒸发后形成SOA粒子(Haan et al., 2009; 周欢等, 2016).当水相中存在NH4+时, 二醛化合物在NH4+催化下形成亚胺产物, 该产物与二醛水合物反应形成吸光性咪唑类含氮有机物, 反应溶液呈现棕黄色(Kampf et al., 2012; Lin et al., 2015).而当水相中存在氨基酸、甲基胺等含氮化合物时, 能够发生类似NH4+的催化反应形成咪唑类化合物, 溶液均变为棕黄色(Haan et al., 2009; Haan et al., 2017).咪唑类吸光产物形成后, 可以改变气溶胶的光学特性, 对研究SOA的光辐射影响具有一定意义(Laskin et al., 2015).光照条件的水相反应研究主要侧重在醛类和生物源VOCs与OH自由基的液相光氧化反应.Lee等(2011)将乙二醛和H2O2水相光氧化后的溶液雾化成颗粒, 通过干燥管除去水分形成SOA粒子, 采用气溶胶质谱仪测量得到甲酸等羧酸是SOA的主要组分.Kameel等(2013)研究了异戊二烯与OH自由基的水相光氧化反应, 测得难挥发性的C10H15OH为主要的水相产物.Aljawhary等(2016)则开展了α-蒎烯与OH自由基的水相光氧化反应动力学、反应机理及SOA产率研究.然而, 关于人为源VOCs的水相反应的研究则鲜见报道.
来源于汽车尾气和溶剂使用的芳香烃化合物是人为源VOCs的主要组分(陈天增等, 2018).其中, 苯是最简单的苯系物, 人们利用烟雾腔系统已经详细地研究了OH自由基启动苯发生大气光化学反应形成SOA粒子的化学组分和反应机理(Wang et al., 2013; Huang et al., 2014).苯在常温下水相中的亨利常数为1.8×10-3 mol · m-3 · Pa-1(李建权等, 2008), 具有一定的水溶性, 能够溶于液相气溶胶等水相中.尽管Heath等(2013)开展了温度、pH值等环境因素对苯和OH自由基水相反应速率和苯酚等产物产率的影响研究, 但有关苯水相SOA的形成机理仍需进一步完善.课题组前期已经开展了氨气存在下, 苯、甲苯与OH自由基气相反应形成SOA粒子化学组分的测量研究(Huang et al., 2018; 徐俊等, 2018), 近期检测了苯液相光氧化反应产物(冯状状等, 2018).在此基础上, 本文采用雾化器(TSI 9302)将羟基启动苯水相光氧化反应溶液雾化产生气溶胶粒子, 通过扩散干燥管除去水蒸气后产生SOA粒子, 利用紫外可见吸收光谱仪、气溶胶激光飞行时间质谱仪、傅里叶变换衰减全反射红外光谱仪和高效液相色谱串联质谱在线和离线测量SOA的化学组分, 以期为研究人为源VOCs水相反应形成SOA的机理提供实验依据.
2 材料与方法(Materials and methods) 2.1 实验药品苯(AR, ≥99.5%)购于汕头市达濠精细化学品有限公司, 过氧化氢(AR, 30.0%)、甲醇(GR, ≥99.7%)、正己烷(GR, ≥98%)、盐酸(AR, 36.0%~38.0%)和高锰酸钾(AR, ≥99.5%)购于汕头市西陇科学股份有限公司.以上药品未作提纯处理, 直接用于实验.
2.2 实验方法外场实验测得苯在液相气溶胶等水相中的浓度为nmol · L-1量级(Matsumoto et al., 2010; Mullaugh et al., 2015).考虑到本文所使用仪器的检测限, 为了更好地测量苯水相光氧化反应形成SOA粒子的组分, 将苯反应溶液浓度定为2 mmol · L-1.尽管该浓度大于大气水相中苯的实际浓度, 但本文主要采用检测仪器定性分析SOA组分信息, 由此获得的反应机理有助于理解芳香烃水相反应生成SOA的机制.为了更好地模拟大气水相环境, 将2 mmol · L-1苯和10 mmol · L-1过氧化氢的混合溶液用盐酸调节pH为5(大气水相中pH值约为5)(Carlton et al., 2007), 再转移到自制的液相反应器内在紫外光的照射下进行光氧化反应.液相反应器是由有机玻璃制成的高25.5 cm、直径9.0 cm、体积为1.26 L的圆柱体, 其顶部是一个可装卸并且具有采样口和紫外灯放置口的盖子.紫外灯采用一体浸没式紫外灯, 其直径为2.6 cm, 发光区域长度为9.6 cm, 功率为7 W, 发射的紫外波长范围为200~300 nm, 中心波长为254 nm.在该紫外光的照射下, H2O2光解产生OH自由基(Ao et al., 2017), 启动苯的水相光氧化反应.液相反应器置于磁力搅拌器上, 以1200 r · min-1的转速进行磁力搅拌以保证反应产物混合均匀.对于10 mmol · L-1过氧化氢的反应体系, 开启紫外光照后每隔15 min, 用移液管准确移取20 mL溶液, 利用KMnO4方法测量溶液中H2O2的浓度.根据测得的平均每分钟消耗过氧化氢的量和过氧化氢光解产生OH自由基的速率常数1.0×10-4 s-1(Liao et al., 1995), 算出反应体系中OH自由基平均产生速率约为0.64 μmol · L-1 · min-1, 略小于Heath等(2013)得到的酸性溶液反应体系1.64 μmol · L-1 · min-1的平均产生速率.此外, 紫外光照会使溶液温度上升3~5 ℃, 苯水相光氧化反应是在25~30 ℃的条件下进行的.光照过程温度稍微增加, 会加快苯与OH自由基的反应速率, 但不会显著改变水相光氧化产物, 因而不会影响对苯水相SOA组分的定性分析.
对于2 mmol · L-1苯和10 mmol · L-1过氧化氢反应体系, 开启紫外光照后每隔15 min从取样口取5 mL水相反应溶液, 采用UV-6100s型紫外-可见分光光度计(上海Mapada公司)测量水相光氧化产物在200~600 nm范围内的吸光度.如图 1所示, 反应一定时间后将水相反应溶液转移至TSI 9302雾化器中, 以12 psi的压强产生气溶胶粒子, 通过扩散干燥管除去水蒸气后产生SOA粒子.利用气溶胶激光飞行时间质谱仪在线测量SOA的粒径分布和化学组分.每个实验平行进行3次, 在线测量结束后, 采用装有10 mL 3%甲醇溶液的洗瓶收集SOA粒子进行红外和质谱离线测量.
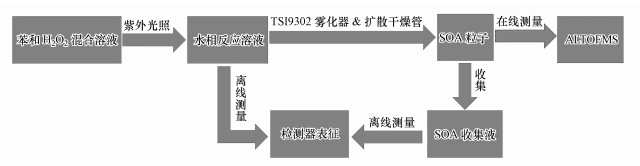 |
| 图 1 苯水相光氧化反应形成SOA粒子实验流程图 Fig. 1 The experimental schematic diagram of SOA particles formed from the aqueous photooxidation of benzene |
苯水相光氧化反应形成的SOA粒子采用气溶胶激光飞行时间质谱仪(Aerosol Laser Time-of-Flight Mass Spectrometer, ALTOFMS)进行在线检测.SOA粒子通过单粒子进样系统进入粒径测量区, 先后与两个相距一定距离的532 nm激光相遇, 产生的散射光被光电倍增管接收, 并由计时电路算出SOA粒子的飞行速度, 从而获得其粒径大小.随后, SOA粒子进入真空腔中, 被Nd:YAG激光器的四倍频266 nm激光解吸附电离, 产生的离子经飞行时间质谱仪测量后得到质谱图, 由离子峰获得SOA粒子化学成分信息(Huang et al., 2018; 徐俊等, 2018).
2.4 SOA粒子的离线测量ALTOFMS测量结束后, 用装有10 mL 3%甲醇溶液的洗瓶收集SOA粒子3 h, 获得的SOA收集液进行红外和质谱离线测量.采用美国赛默飞世尔科技公司生产的、基于OMNI采样器的NICOLET iS 10傅里叶变换衰减全反射红外分光光度计(ATR-FTIR)测量SOA收集液的红外谱图.该仪器扫描光谱范围为400~4000 cm-1, 扫描速度为0.47 cm · s-1, 分辨率可达0.1 cm-1(徐俊等, 2018; 冯状状等, 2018).利用美国Applied Biosystems公司生产的ABI 3200QTRAP高效液相色谱串联质谱仪测量SOA收集液的质谱.该质谱仪采用电喷雾(ESI)电离, 质量测量范围5~1700 amu, 分辨率>6900, 扫描速度4000 amu · s-1.采用甲醇和正己烷的混合溶液作为流动相, 其体积比为2 : 3, 流速为0.20 mL · min-1.
3 结果与讨论(Results and discussion) 3.1 苯水相光氧化反应产物紫外可见吸收光谱研究为了确认苯水相光氧化产物, 开展了2 mmol · L-1苯紫外光照反应、10 mmol · L-1过氧化氢紫外光照反应、2 mmol · L-1苯与10 mmol · L-1过氧化氢暗反应及其紫外光照反应实验, 反应3 h后水相产物溶液的紫外可见吸收光谱如图 2所示.从图中可以看出, 过氧化氢光照3 h后的紫外可见吸收光谱没有吸收峰, 苯的紫外光照反应及苯与过氧化氢混合溶液的暗反应都在204 nm附近存在较强的吸收带, 该吸收是由苯环的π→π*跃迁和振动能级跃迁叠加而产生的特征吸收(曾泳淮等, 2010), 在其他位置没有吸收峰, 可以断定苯不会与H2O2反应, 水相中只有苯有机物, 没有新的水相产物产生.而苯与过氧化氢在紫外光照情况下的水相反应溶液的紫外可见吸收光谱除了在204 nm附近存在苯环的特征吸收带外, 在275 nm附近出现了新的吸收带.根据李红霞等(2000)的实验结果, 该吸收带是酚类化合物的特征吸收峰.紫外光照过氧化氢产生OH自由基(Ao et al., 2017), 启动苯发生水相光氧化反应产生了酚类产物.不同光照时间下水相反应产物在275 nm的吸光度如图 3所示.光照75 min后在275 nm处出现吸收峰, 表明形成了酚类产物.此后, 水相反应产物在275 nm的吸光度随着光照时间的增加而缓慢减小, 形成的部分酚类产物在OH自由基存在下继续反应转化成其他产物.紫外光照165 min后, 水相产物在275 nm处的吸光度几乎保持不变, 体系产物趋于稳定.光照3 h后将水相产物溶液转移至TSI 9302雾化器雾化、干燥后产生SOA粒子.
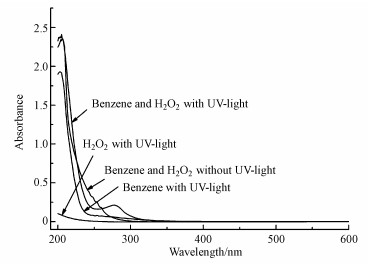 |
| 图 2 苯与过氧化氢水相光氧化反应及其对照实验产物溶液的紫外可见吸收光谱 Fig. 2 UV-visible absorption spectra of products solution formed from aqueous photooxidation of benzene with hydrogen peroxide and its control experiments |
 |
| 图 3 苯与过氧化氢水相光氧化反应溶液在275 nm处的吸光度随时间的变化情况 Fig. 3 The absorbance at 275 nm of products solution formed from aqueous photooxidation of benzene and hydrogen peroxide with different illumination time |
根据ALTOFMS的设计原理, 气溶胶粒子先测量粒径后再被激光解吸附电离测量化学组分.ALTOFMS可以测量单个气溶胶粒子的粒径和化学成分, 统计测得的大量气溶胶颗粒在不同粒径范围的数量分布情况可以得到粒径分布(Huang et al., 2018; 徐俊等, 2018).苯紫外光照反应、过氧化氢紫外光照反应、苯与过氧化氢暗反应的实验用ALTOFMS未能探测到粒子存在, 表明这些实验没有产生SOA粒子.而苯与过氧化氢光照反应的实验用ALTOFMS探测到大量不同粒径的粒子存在, 说明该反应生成了SOA粒子.
ALTOFMS采用Nd:YAG激光器的四倍频266 nm激光对SOA粒子进行解吸附电离, 其功率密度在108 W · cm-3量级, 具有较强的能量, 将SOA粒子的组分进行解吸附电离, 并导致分子离子裂解, 因而主要得到碎片离子的质谱峰(Huang et al., 2018;徐俊等, 2018).如图 4所示, 苯水相SOA的激光解吸附质谱图除了含有m/z=12 (C+)和24 (C2+)等有机碳碎片峰外, 还存在m/z=29、39、44、57、65碎片峰.根据有机质谱知识, m/z=39和65对应于芳香环裂解产生的C3H3+和C5H5-.m/z=44是羧酸化合物的羧基失去氢后产生的COO+.而m/z=29可能对应的结构为醛基离子(HCO+)和乙基离子(C2H5-), m/z=57可能对应的结构为二醛基离子(HCOCO+)和丁基离子(C4H9+)(王光辉等, 2005; Huang et al., 2013).根据羟基启动苯水相光氧化反应机理, 不能产生含有乙基和丁基的产物, 因此, m/z=29和57对应于醛类化合物的特征裂解峰CHO+和HCOCO+.这表明醛类、羧酸化合物和芳香环保留产物是苯水相SOA粒子的主要化学组分.
 |
| 图 4 苯水相光氧化反应形成的SOA粒子激光解吸附质谱图 Fig. 4 The laser desorption mass spectra of the SOA particles formed from the aqueous photooxidation of benzene |
值得注意的是, 在干燥过程中也有可能影响半挥发性有机物的气-粒分配从而影响SOA的化学组成(Zhang et al., 2011).为了考察干燥过程对苯水相SOA组分的影响情况, 利用9302雾化器产生气溶胶粒子后, 不经过扩散干燥管, 直接进入ALTOFMS测量, 得到的苯水相SOA粒子的激光解吸附电离质谱与图 4所示的质谱图基本相似, 表明干燥过程不能显著改变苯水相SOA粒子的化学组分.干燥过程可能会导致部分半挥发性有机产物从粒子相转化气相, 从而导致SOA粒子组分含量降低.而干燥过程导致部分半挥发性有机产物的损失不会影响对苯水相SOA组分的定性分析.为了进一步确认组分信息, 开展了离线红外光谱和液相质谱检测.
3.3 SOA粒子的红外吸收光谱采用傅里叶变换衰减全反射红外光谱仪测量3%甲醇溶液收集到的苯水相SOA粒子的红外光谱, 扣除掉3%甲醇溶液背景吸收得到的红外谱图如图 5所示.该红外光谱图在2988 cm-1和1405 cm-1处存在苯环上—C—H和—C═C双键伸缩振动吸收峰, 同时在3674 cm-1处出现了游离羟基的伸缩振动吸收峰(吴瑾光等, 1994), 这表明酚类化合物是苯水相SOA粒子的主要组分.在1646 cm-1处存在C═O双键伸缩振动吸收峰(Huang et al., 2013), 这进一步确认苯水相SOA粒子含有羰基化合物.此外, 红外谱图在1229 cm-1处存在C—O单键伸缩振动吸收峰, 在1066 cm-1处出现较强的吸收峰, 该峰对应于醚中C—O—C键的伸缩振动(吴瑾光等, 1994), 可以推测苯水相SOA粒子含有芳香醚产物.
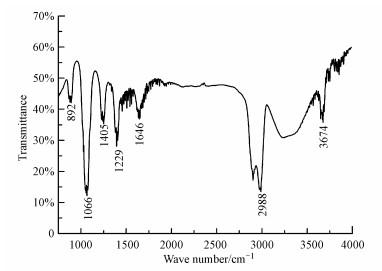 |
| 图 5 苯水相光氧化反应形成的SOA粒子的红外光谱图 Fig. 5 Infrared spectra of the SOA particles formed from the aqueous photooxidation of benzene |
过氧化氢在紫外光的照射下光解产生的羟基自由基启动水相中的苯发生如图 6所示的加合反应.羟基自由基添加到苯环上形成OH—苯加合物, 水相中的氧气分子提取该自由基的氢原子形成苯酚产物.羟基自由基继续与苯酚反应产生的酚氧自由基亲核进攻苯酚分子形成4-羟基-二苯基醚.Sun等(2010)研究了苯酚等酚类化合物的水相光氧化反应, 测量得到4-羟基-二苯基醚等芳香醚产物.此外, 氧气分子也可以加合到OH—苯加合物形成过氧自由基并通过芳香环断裂产生2, 4-己二烯二醛.同时, 过氧自由基亦可异构化产生氧桥自由基并经过环断裂等反应形成2-丁烯-二醛和乙二醛, 产生的醛类化合物可继续被羟基自由基氧化形成羧酸产物.因此, 醛类、羧酸、苯酚和4-羟基-二苯基醚等芳香醚是羟基自由基启动苯水相光氧化反应产物.这些产物具有较低的挥发性, 在水分蒸发后, 这些产物保留在颗粒相中形成SOA粒子.
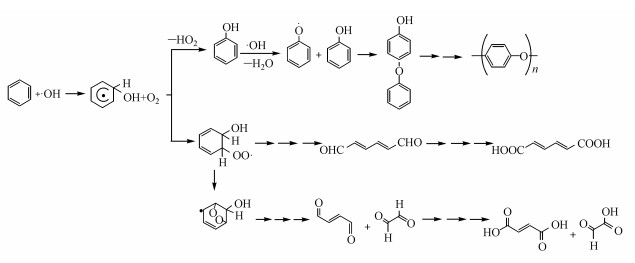 |
| 图 6 羟基自由基启动苯水相光氧化反应形成苯酚、醛类、羧酸等产物的可能反应机理 Fig. 6 The possible reaction mechanism of the OH-initiated aqueous photooxidation of benzene to form phenol, aldehydes, carboxylic acids and other products |
苯水相SOA粒子收集液不经色谱柱分离, 进入质谱仪经电喷雾电离后测量质谱.电喷雾电离是软电离技术, 采用低电压的方法不会使分子离子峰发生断裂.为了减少溶剂对电喷雾电离质谱图的影响, 将质量扫描测量范围设为50~1700 amu.根据Carlton等(2007)的实验结果, 负电离模式使有机化合物去质子化, 负离子质谱中的质谱峰主要来源于去质子化分子离子[M-H]-, 它提供了有机化合物分子量的信息.测得的苯水相SOA粒子的负离子质谱图如图 7所示.m/z=73可能对应于乙二醛酸去质子化分子离子(HCOCOO-), m/z=83可能对应于2-丁烯二醛去质子化分子离子(HCOCH═CHCO-), 而m/z=93则对应于苯酚去质子化分子离子(C6H5O-), m/z=115可能对应于2-丁烯二酸去质子化分子离子(HOOCCH═CHCOO-), 而m/z=141则对应于2, 4-己二烯二醛去质子化分子离子(HOOCCH═CHCH═CHCOO-).这进一步验证了苯水相SOA粒子存在苯酚、醛类、羧酸和芳香醚产物.
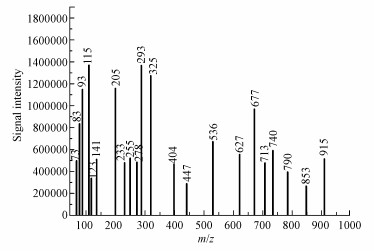 |
| 图 7 苯水相光氧化反应形成的SOA粒子的电喷雾电离质谱图 Fig. 7 The electrospray ionization mass spectra of the SOA particles formed from the aqueous photooxidation of benzene |
此外, 质谱图还存在许多m/z大于200的质谱峰, 其最大m/z达915, 表明SOA粒子中含有高分子量产物.Sun等(2010)的实验结果表明, 羟基自由基能够启动苯酚发生聚合反应形成二聚体(4-羟基-二苯基醚)、三聚体等苯酚多聚体高分子量产物((C6H5O)n).图 7所示的m/z 278可能对应苯酚三聚体去质子化分子离子((C6H5O)3-).Chang等(2010)的实验结果显示, 羟基自由基启动苯酚等酚类化合物水相反应产物溶液的红外光谱与外场测量的气溶胶吸光物质类腐殖质(Humic-like substances, HULIS)的红外光谱相似, 酚类水相反应产生的酚类聚体产物是大气气溶胶类腐殖质的主要来源之一.本文利用高效液相色谱串联质谱仪探测到苯水相反应形成的SOA粒子中含有酚类聚体高分子量产物.在机动车尾气污染比较严重的地区, 当大气湿度较大时, 苯系物等VOCs可能发生类似的水相反应形成酚类聚体高分子产物, 这些产物具有吸光能力, 从而改变大气气溶胶的化学组分和光学特性, 进而影响大气能见度, 导致灰霾污染的产生.
4 结论(Conclusions)本文利用TSI 9302雾化器将苯水相光氧化反应溶液雾化, 通过干燥器除去水蒸气后产生SOA粒子, 采用气溶胶飞行时间质谱仪、紫外可见吸收光谱仪、傅里叶变换衰减全反射红外光谱仪和高效液相色谱串联质谱联用仪测量苯水相产物, 结果发现, 羟基自由基启动苯发生加合反应形成的苯酚、由芳香环裂解产生的醛类和羧酸化合物, 以及苯酚与羟基自由基后续反应产生的芳香醚和酚聚类高分子量产物是SOA粒子的主要化学组分.这为研究人为源挥发性有机化合物水相反应形成SOA的机理提供了实验依据.然而, 参与反应的各组分浓度高于大气水相中的实际浓度, 后续的实验可尝试开展接近水相中苯的实际浓度的光氧化实验, 采用合适的色谱柱分离组分, 定量分析水相反应产物, 更好地研究苯系物水相SOA粒子的形成机理.
Ahmed J, Fahmida A, Sohini R C, et al. 2018. Prospects and challenges of volatile organic compound (VOC) sensors in human healthcare[J]. ACS Sensors, 3: 1246–1263.
DOI:10.1021/acssensors.8b00400
|
Aljawhary D, Zhao R, Lee A K Y, et al. 2016. Kinetics, mechanism, and secondary organic aerosol yield of aqueous phase photo-oxidation of α-pinene oxidation products[J]. Journal of Physical Chemistry A, 120(9): 1395–1407.
DOI:10.1021/acs.jpca.5b06237
|
Ao X L, Liu W J. 2017. Degradation of sulfamethoxazole by medium pressure UV and oxidants:Peroxymonosulfate, persulfate, and hydrogen peroxide[J]. Chemical Engineering Journal, 313(1): 629–637.
|
曹军骥, 李建军. 2016. 二次有机气溶胶的形成及其毒理效应[J]. 地球环境学报, 2016, 7(5): 431–441.
|
Carlton A G, Turpin B J, Altieri K E, et al. 2007. Atmospheric oxalic acid and SOA production from glyoxal:Results of aqueous photooxidation experiments[J]. Atmospheric Environment, 41(35): 7588–7602.
DOI:10.1016/j.atmosenv.2007.05.035
|
Chang J L, Thompson J E. 2010. Characterization of colored products formed during irradiation of aqueous solutions containing H2O2 and phenolic compounds[J]. Atmospheric Environment, 44(4): 541–551.
|
陈天增, 葛艳丽, 刘永春, 等. 2018. 我国机动车排放VOCs及其大气环境影响[J]. 环境科学, 2018, 39(2): 478–492.
DOI:10.3969/j.issn.1000-6923.2018.02.009 |
陈文泰, 邵敏, 袁斌, 等. 2013. 大气中挥发性有机物(VOCs)对二次有机气溶胶(SOA)生成贡献的参数化估算[J]. 环境科学学报, 2013, 33(1): 163–172.
|
冯状状, 黄明强, 徐俊, 等. 2018. 羟基启动苯液相光氧化产物的傅里叶变换红外光谱研究[J]. 红外, 2018, 39(8): 40–45.
DOI:10.3969/j.issn.1672-8785.2018.08.08 |
Haan D O D, Corrigan A L, Smith K W, et al. 2009. Secondary organic aerosol-forming reactions of glyoxal with amino acids[J]. Environmental Science & Technology, 43(8): 2818–2824.
|
Haan D O D, Corrigan A L, Tolbert M A, et al. 2009. Secondary organic aerosol formation by self-reactions of methylglyoxal and glyoxal in evaporating droplets[J]. Environmental Science & Technology, 43(21): 8184–8190.
|
Haan D O D, Hawkins L N, Welsh H G, et al. 2017. Brown carbon production in ammonium-or amine-containing aerosol particles by reactive uptake of methylglyoxal and photolytic cloud cycling[J]. Environmental Science & Technology, 51(13): 7458–7466.
|
Heath A A, Ehrenhauser F S, Valsaraj K T. 2013. Effects of temperature, oxygen level, ionic strength, and pH on the reaction of benzene with hydroxyl radicals in aqueous atmospheric systems[J]. Journal of Environmental Chemical Engineering, 1(4): 822–830.
|
Huang M Q, Hao L Q, Guo X Y, et al. 2013. Characterization of secondary organic aerosol particles using aerosol laser time-of-flight mass spectrometer coupled with FCM clustering algorithm[J]. Atmospheric Environment, 64: 85–94.
DOI:10.1016/j.atmosenv.2012.09.044
|
Huang M Q, Lin Y H, Huang X Y, et al. 2014. Chemical analysis of aged benzene secondary organic aerosol using aerosol laser time-of-flight mass spectrometer[J]. Journal of Atmospheric Chemistry, 71(3): 213–224.
DOI:10.1007/s10874-014-9291-z
|
Huang M Q, Xu J, Cai S Y, et al. 2018. Characterization of brown carbon constituents of benzene secondary organic aerosol aged with ammonia[J]. Journal of Atmospheric Chemistry, 75(2): 205–218.
DOI:10.1007/s10874-017-9372-x
|
Kameel F R, Hoffmann M R, Colussi A J. 2013. OH radical-initiated chemistry of isoprene in aqueous media.Atmospheric implications[J]. Journal of Physical Chemistry A, 117(24): 5117–5123.
DOI:10.1021/jp4026267
|
Kampf C J, Jakob R, Hoffmann T. 2012. Identification and characterization of aging products in the glyoxal/ammonium sulfate system-implications for light-absorbing material in atmospheric aerosols[J]. Atmospheric Chemistry and Physics, 12(14): 6323–6333.
DOI:10.5194/acp-12-6323-2012
|
Laskin A, Laskin J, Nizkorodov S A. 2015. Chemistry of atmospheric brown carbon[J]. Chemical Reviews, 115(10): 4335–4382.
DOI:10.1021/cr5006167
|
Lee A K Y, Zhao R, Gao S S, et al. 2011. Aqueous-phase OH oxidation of glyoxal:application of a novel analytical approach employing aerosol mass spectrometry and complementary off-line techniques[J]. Journal of Physical Chemistry A, 115(38): 10517–10526.
DOI:10.1021/jp204099g
|
李红霞, 张俊杰, 唐桂芬. 2000. 因子分析-紫外吸光光度法同时测定苯酚甲苯酚和间苯二酚[J]. 理化检验(化学分册), 2000, 36(5): 193–194+197.
|
李建权, 沈成银, 王鸿梅, 等. 2008. 质子转移反应质谱动态测量苯系物的亨利常数[J]. 物理化学学报, 2008, 24(4): 705–708.
DOI:10.3866/PKU.WHXB20080428 |
Liao C H, Gurol M D. 1995. Chemical oxidation by photolytic decomposition of hydrogen peroxide[J]. Environmental Science and Technology, 29(12): 3007–3014.
DOI:10.1021/es00012a018
|
Lin P, Laskin J, Nizkorodov S A, et al. 2015. Revealing brown carbon chromophores produced in reactions of methylglyoxal with ammonium sulfate[J]. Environmental Science & Technology, 49(24): 14257–14266.
|
Matsumoto K, Matsumoto K, Mizuno R, et al. 2010. Volatile organic compounds in ambient aerosols[J]. Atmospheric Research, 97(1/2): 124–128.
|
Mullaugh K M, Hamilton J M, Avery G B, et al. 2015. Temporal and spatial variability of trace volatile organic compounds in rain water[J]. Chemosphere, 134: 203–209.
DOI:10.1016/j.chemosphere.2015.04.027
|
祁骞, 周学华, 王文兴. 2014. 二次有机气溶胶的水相形成研究[J]. 化学进展, 2014, 26(Z1): 458–466.
|
Sun Y L, Zhang Q, Anastasio C, et al. 2010. Insights into secondary organic aerosol formed via aqueous-phase reactions of phenolic compounds based on high resolution mass spectrometry[J]. Atmospheric Chemical & Physics, 10(2): 4809–4822.
|
王光辉, 熊少祥. 2005. 有机质谱解析[M]. 北京: 化学化工出版社.
|
Wang L M, Wu R R, Xu C. 2013. Atmospheric oxidation mechanism of benzene.Fates of alkoxy radical intermediates and revised mechanism[J]. Journal of Physical Chemistry A, 117(51): 14163–14168.
DOI:10.1021/jp4101762
|
吴瑾光. 1994. 近代傅里叶变换红外光谱技术及应用(第1版)[M]. 北京: 科学技术文献出版社.
|
徐俊, 黄明强, 冯状状, 等. 2018. 氨对甲苯二次有机气溶胶形成和化学组分的影响研究[J]. 环境科学学报, 2018, 38(8): 3243–3251.
|
叶招莲, 瞿珍秀, 马帅帅, 等. 2018. 气溶胶水相反应生成二次有机气溶胶研究进展[J]. 环境科学, 2018, 39(8): 3954–3964.
|
曾泳淮. 2010. 分析化学(仪器分析部分)(第4版)[M]. 北京: 高等教育出版社.
|
Zhang H, Surratt J D, Lin Y H, et al. 2011. Effect of relative humidity on SOA formation from isoprene/NO photooxidation:enhancement of 2-methylglyceric acid and its corresponding oligoesters under dry conditions[J]. Atmospheric Chemistry Physics, 11(13): 6411–6424.
DOI:10.5194/acp-11-6411-2011
|
周欢, 冯艳丽, 姜知明, 等. 2016. 大气中二羰基化合物及其生成的二次有机气溶胶[J]. 上海大学学报(自然科学版), 2016, 22(2): 159–171.
|
 2019, Vol. 39
2019, Vol. 39


