2. 成都理工大学环境学院, 国家环境保护水土污染协同控制与联合修复重点实验室, 成都 610059;
3. 丹麦哥本哈根大学, 植物与环境科学系, 丹麦 401871
2. National Key Laboratory of Environmental Pollution Control and Joint Restoration, College of Environmental Sciences, Chengdu University of Technology, Chengdu 610059;
3. Department of Plant and Environmental Sciences, University of Copenhagen, Denmark, Denmark 401871
随着现代工业的快速发展, 重金属污染已经成为影响严重且危害巨大的环境问题之一(郭晶等, 2016).常见的重金属废水处理技术主要有吸附法(Wang et al., 2018)、沉淀法(Bhattacharya et al., 2018)、电解法(Zhang et al., 2018)、离子交换法(Ribeiro et al., 2018)、膜分离技术(Chen et al., 2018)等.其中, 吸附法相较于其他方法, 具有吸附材料来源广泛, 成本低廉, 对低浓度重金属废水去除效率高和易再生等优点(Bailey et al., 1999), 为重金属废水的高效经济处理提供了可能.常见的吸附材料主要有膨润土(Rio et al., 2003)、沸石(Fu et al., 2011)、活性炭(Kong et al., 2018)等, 对废水中重金属离子有较好去除效果, 但存在难以回收、易造成二次污染等缺点(Jacob et al., 2018).
相比之下, 生物质基吸附剂来源广泛, 环境友好(黄鸽等, 2012), 自身含有的大量活性基团能选择性吸附重金属(刘晨, 2017), 具有广阔的发展前景.其中, 以天然高分子壳聚糖及其衍生物为基材制备的吸附剂成为研究人员关注的一个研究热点(林志艳, 2003).壳聚糖分子主链上含有大量氨基和羟基等活性官能团(Ma et al., 2018), 对过渡金属离子、腐殖酸和染料等污染物均有一定的去除效果(王帅, 2017).然而, 壳聚糖的典型特征是其在低pH值溶液中(pH<4)的不稳定性(Luk et al., 2014).想要实现在广泛pH值范围内去除污染物的商业用途需要稳定吸附剂结构, 通过交联壳聚糖改性是解决这一问题的有力途径(Jó et al., 2017).其中, 戊二醛和环氧氯丙烷为交联剂的相关研究较多, 但以乙二醇双缩水甘油醚(李一民等, 2011)为交联剂的研究较少.乙二醇双缩水甘油醚是一种新颖的环氧交联剂, 多用于改性支链高分子、壳聚糖等有机材料(曹佐英等, 2001).此交联剂可与壳聚糖分子中多种基团发生交联反应, 与传统交联剂(如醛基)相比, 环氧基团的反应活性低, 反应条件相对温和, 并易使壳聚糖的链式结构变成网状结构(王宇等, 2016).同时尝试将磁性粒子引入吸附剂以实现快速分离回收的目的(Reddy et al., 2013).磁性改性壳聚糖吸附剂的制备方法包括水热法(王建龙等, 2010)、热溶剂法(张淑琴等, 2008)、原位共沉淀法(王泽红等, 2012)、微乳液法(丁述理等, 2006)等.其中, 原位共沉淀法因其成本低廉且制备条件要求较低受到了广泛关注(陈志军等, 2006).
本实验研究通过原位共沉淀法结合乙二醇二缩水甘油醚交联法制备得到了一种磁性多孔壳聚糖凝胶微球, 并选取典型重金属Pb(Ⅱ)、Cu(Ⅱ)、Zn(Ⅱ)作为目标污染物进行静态和动态吸附实验, 对吸附动力学及吸附机理进行了探究, 以期为重金属废水处理提供一种新的研究思路和技术路线.
2 材料与方法(Materials and methods) 2.1 主要试剂主要试剂见表 1.
| 表 1 实验试剂 Table 1 Experimental reagent |
KW-400恒温水浴振荡器, 上虞佳星仪器厂;SCIENTZ-50F冷冻干燥机, 宁波新芝生物科技股份有限公司;GGX-9火焰原子吸收分光光度计, 北京海光仪器有限公司.
2.3 CS-EGDE/Fe3O4凝胶微球的制备首先, 将3 g壳聚糖溶于80 mL 2%乙酸溶液中, 机械搅拌30 min, 使得壳聚糖充分溶解;其次, 向壳聚糖溶胶中加入10 mL摩尔比为2:1的Fe3+/Fe2+混合溶液, 继续搅拌30 min, 溶液由亮黄色变为棕红色;然后, 将壳聚糖/Fe混合溶液用蠕动泵滴入NaOH浸泡液(NaOH 1.25 mol·L-1)中, 静置陈化4 h;将制得的凝胶微球磁分离后用超纯水多次洗涤, 除去残余的NaOH后, 加入到w(EGDE)=0.89%的交联剂水混合溶液(0.8 mL EGDE和100 mL超纯水)中, 25 ℃下交联4 h;最后, 用超纯水和乙醇交替洗涤多次, 冷冻干燥30 h后备用.
2.4 表征方法采用德国sigma300型扫描电子显微镜(SEM)观察样品表面形貌;日本FEI Tecnai-G20型透射电子显微镜(TEM)观察样品内部形貌;美国Nicolet-1170SX型傅里叶红外光谱仪(FTIR)进行红外谱图的绘制;德国Sigma300型扫描电子显微镜对磁性壳聚糖微球表面元素组成进行同步分析(EDS);采用振动样品磁强计(VSM)确定壳聚糖凝胶微球的磁力性能.
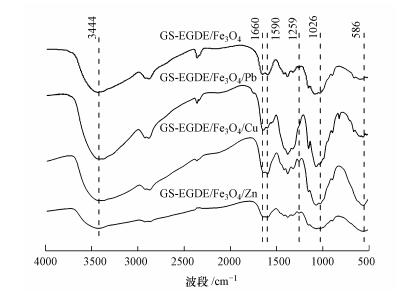
2.5 静态吸附实验将0.12 g磁性壳聚糖凝胶微球投加到60 mL一定浓度的重金属(Pb(Ⅱ)、Cu(Ⅱ)、Zn(Ⅱ))溶液中, 在25 ℃下恒温振荡(150 r·min-1), 测定吸附量q随时间t的变化情况.吸附量采用公式(1)进行计算.
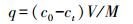
|
(1) |
式中, c0和ct为在Pb(Ⅱ)溶液的初始浓度和吸附t时间后的浓度(mg·L-1);V为Pb(Ⅱ)溶液的体积(L);M为吸附剂的投加量(g).
2.6 吸附动力学实验配置60 mL初始浓度为50 mg·L-1的重金属(Pb(Ⅱ), Cu(Ⅱ)和Zn(Ⅱ))模拟废水, 置于150 mL锥形瓶中, 分别投加所制备的磁性壳聚糖吸附剂0.12 g.所有吸附动力学实验条件相同, 设置恒温水浴振荡器温度为25 ℃, 振荡速度为150 r·min-1, 连续振荡24 h.在不同采样时间通过外加磁场分离并测定溶液中重金属离子浓度.
2.7 吸附等温线实验将0.12 g吸附剂加入到一系列各金属离子初始浓度为20~500 mg·L-1的拟废水中, 置于25 ℃, 振荡速度150 r·min-1的恒温水浴振荡器中振荡24 h后, 磁性分离并测定各重金属离子浓度.
2.8 多元体系竞争吸附实验配置60 mL初始浓度为100 mg·L-1的重金属离子二元体系(Pb(Ⅱ)+Cu(Ⅱ), Pb(Ⅱ)+Zn(Ⅱ), Cu(Ⅱ)+Zn(Ⅱ))模拟废水和三元体系(Pb(Ⅱ)+Cu(Ⅱ)+Zn(Ⅱ))模拟废水, 置于25 ℃, 振荡速度150 r·min-1的恒温水浴振荡器中连续振荡24 h后, 磁性分离并测定溶液各重金属离子浓度.
2.9 固定床动态吸附实验将所制吸附剂装填入内径3 cm, 长10 cm的固定床模拟实验装置内, 配制初始浓度100 mg·L-1的三元重金属离子混合污染液.在25 ℃下, 采取底部进水, 顶部出水方式, 保持流速15 mL·min-1进行动态吸附实验.每隔0.5 h进行取样, 取样总时长13 h.对所取水样进行重金属离子浓度测定.
3 结果与讨论(Results and discussion) 3.1 CS-EGDE/Fe3O4凝胶微球的制备与表征CS-EGDE/Fe3O4凝胶微球的制备思路及重金属离子吸附实验流程如图 1所示.先将溶解在乙酸中的壳聚糖溶液与Fe3+/Fe2+溶液充分混合, 使其经螯合作用形成Fe3+-CS-Fe2+混合溶胶;然后, 利用蠕动泵将混合溶胶缓慢滴入NaOH浸泡液形成凝胶微球, 继而用乙二醇二缩水甘油醚作为交联剂, 对壳聚糖进行交联.期间Fe3+/Fe2+在碱性溶液中发生原位共沉淀反应生成Fe3O4纳米颗粒, 壳聚糖和乙二醇二缩水甘油醚发生交联反应.最后, 将制得的吸附剂用于水中多元重金属离子的静态吸附和固定床动态吸附实验.
 |
| 图 1 CS-EGDE/Fe3O4凝胶微球制备及吸附性能研究流程图 Fig. 1 Schematic illustration of preparation of CS-EGDE/Fe3O4 gel microsphere and adsorption characteristics |
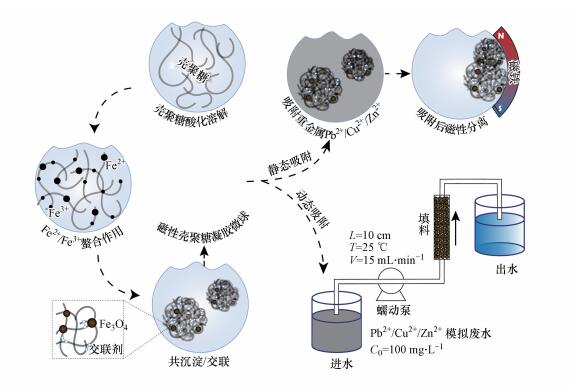
SEM图 2a和a′分别为放大50倍和2.5 k倍数下的CS-EGDE/Fe3O4凝胶微球, 由图可看出CS-EGDE/Fe3O4呈现出表面略有褶皱、形态良好的球型结构.将微球剥开, 可见内部形成了良好的多孔网状结构, 孔径为18 μm.而不含磁性的壳聚糖凝胶微球内部SEM图(图 2a″)未见有明显孔隙, 通过两图对比, 可判断磁性吸附剂比表面积显著增大, 对吸附作用的发生有促进作用(Ma et al., 2018).为了更加深入地了解CS-EGDE/Fe3O4中Fe3O4纳米颗粒的形态, 对吸附剂进行了TEM分析.由图 2b可知, Fe3O4纳米颗粒较均匀地分散在壳聚糖内部, 没有出现明显团聚现象, 其平均粒径约为ci (3±1) nm (图 2b′).从图 2c可以看到复合材料中含有C、O、Fe元素, C和O是壳聚糖的主要成分.添加Fe前的材料中并不含有铁离子, 因而推断Fe来自于原位共沉淀生成的Fe3O4, 这表明Fe3O4纳米颗粒稳定存在于材料当中.由CS-EGDE/Fe3O4的磁滞回线(图 2d)可知所制吸附剂饱和磁强可达到10.08 emμ·g-1, 表明所制吸附剂有良好磁性, 可以通过外加磁场实现固液分离.
 |
| 图 2 CS-EGDE/Fe3O4 SEM、TEM、EDS及VSM图 (注:a. CS-EGDE/Fe3O4外观SEM图, ×50;a′. CS-EGDE/Fe3O4内部网状SEM图, ×2.5 k;a″.CS-EGDE内部SEM图, ×200;b. CS-EGDE/Fe3O4TEM图;b′.粒径分布图; c) CS-EGDE/Fe3O4 EDS图;d.CS-EGDE/Fe3O4 VSM及磁分离图) Fig. 2 SEM、TEM、EDS and VSM of CS-EGDE/Fe3O4 gel microspheres |
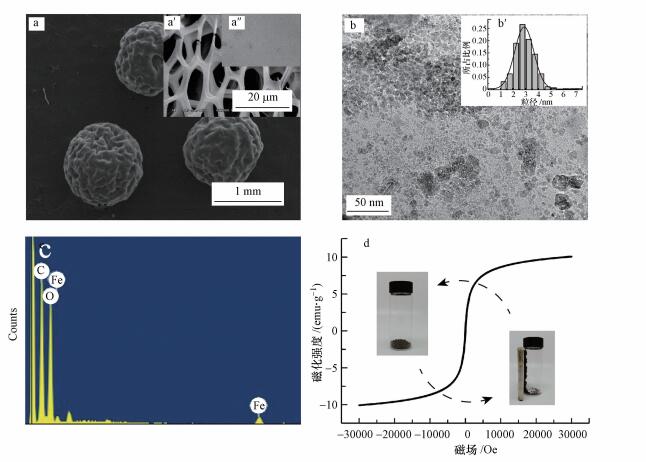
为确定磁性多孔壳聚糖凝胶微球和重金属离子之间的相互作用对官能团的影响, 利用傅里叶红外光谱对吸附前后的CS-EGDE/Fe3O4进行了表征.如图 3所示, 对于吸附前的CS-EGDE/Fe3O4, 3444 cm-1附近出现的峰值代表壳聚糖固有的O—H(Pu et al., 2017), 1259 cm-1和1026 cm-1附近出现的峰代表C—N和C—O伸缩振动峰(Zhou et al., 2009;Zhu et al., 2012), 1590 cm-1附近出现的峰对应着胺中的—NH基团.此外586 cm-1附近出现的Fe—O伸缩振动峰证明了材料中有磁性纳米颗粒Fe3O4的存在(林霞等, 2010).在吸附了Pb(Ⅱ), Cu(Ⅱ)和Zn(Ⅱ)之后, 波数为1590、1259和1026 cm-1处发现了红外光谱发生显着变化, 表明—NH3和—OH是CS-EGDE/Fe3O4上发生金属吸附的主要吸附位点, 吸附剂与3种重金属离子均发生了有效络合反应.
 |
| 图 3 吸附前后CS-EGDE/Fe3O4红外谱图 Fig. 3 Infrared spectra before and after adsorption of CS-EGDE/Fe3O4 |
为探究pH值对吸附效果的影响, 调节初始pH值为2~6考察对所制备的吸附剂的吸附性能.如图 4a所示, 吸附剂对Pb(Ⅱ)、Cu(Ⅱ)、Zn(Ⅱ)3种离子的吸附量随初始pH值的变化呈现出相同的变化趋势, 随着初始pH值的增大, 吸附剂对3种重金属离子的吸附量也逐渐增加.其原因可能与吸附剂的表面特性有关.实际考察了磁性吸附剂表面Zeta电位随pH值的变化.从图 4d可观察到在考察pH范围内, 随pH的增加, 水中H+浓度逐渐减小, 吸附剂的Zeta电位虽然下降, 但仍然为正.说明溶液中存在的H+使得CS-EGDE/Fe3O4中所存在的官能团质子化, 让吸附剂表面带正电(Rosique et al., 2016).此时溶液中H+、H3O+与同样带正电的重金属离子在CS-EGDE/Fe3O4表面产生竞争吸附, 加之静电排斥作用就会使得吸附剂吸附率降低.而升高pH后, 溶液中H+浓度减小, CS-EGDE/Fe3O4中所存在的官能团去质子化产生孤对电子, 让吸附剂表面带上负电, 通过静电作用会增加所吸附的重金属离子, 从而使吸附剂的吸附效率明显提高.
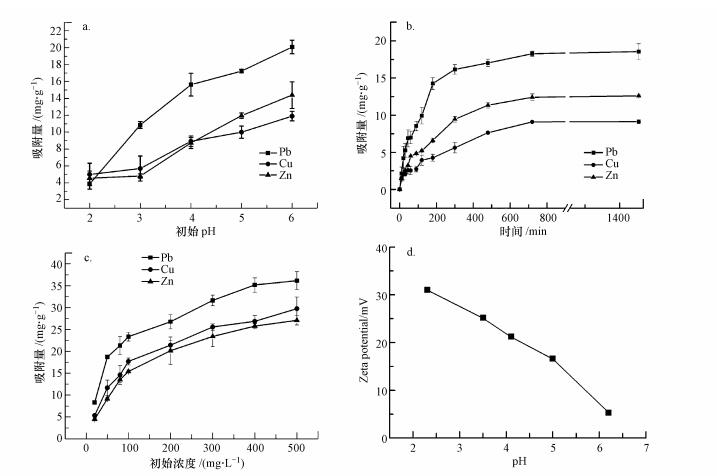 |
| 图 4 初始pH值(a)、接触时间(b)和初始浓度(c)对Pb(Ⅱ)、Cu(Ⅱ)、Zn(Ⅱ)吸附效果的影响及Zeta电位分析(d) Fig. 4 Effects of initial pH(a), contact time(b) and initial concentration(c) on adsorption of Pb(Ⅱ), Cu(Ⅱ) and Zn(Ⅱ), and Zeta potential analysis(d) |
图 4b讨论了在0~1400 min内吸附剂对Pb(Ⅱ)、Cu(Ⅱ)、Zn(Ⅱ) 3种离子吸附量的变化, 从而判断接触时间对吸附效果所造成的影响.从图上可以看出, 整个吸附作用主要发生在0~500 min内, 在700 min后达到吸附平衡, Pb(Ⅱ)、Cu(Ⅱ)、Zn(Ⅱ)的平衡吸附量分别为18.55、13.53、11.59 mg·g-1.针对吸附剂随接触时间对重金属离子吸附效果的变化过程, 本实验从吸附化学过程进行了探究.吸附剂对重金属离子的吸附量在0~3 h内升高较快, 说明Pb(Ⅱ)、Cu(Ⅱ)、Zn(Ⅱ)与多孔磁性壳聚糖凝胶微球的基团发生螯合反应, 被成功地吸附到样品表面上, 使得溶液中金属离子浓度下降.随着吸附反应的进行, 吸附到多孔磁性壳聚糖凝胶微球的金属离子逐渐占据了大部分活性基团, 导致活性基团的数目下降, 吸附剂对重金属离子的吸附量也就随之下降, 直到12 h时吸附剂对重金属离子的吸附量趋于平衡.
3.2.3 初始浓度对吸附性能的影响通过初始浓度分别为20、50、80、100、200、300、400和500 mg·L-1的模拟废水来考察CS-EGDE/Fe3O4凝胶微球吸附效果的影响.如图 4c所示, 随着初始浓度的增加, Pb(Ⅱ)、Cu(Ⅱ)、Zn(Ⅱ) 3种离子的吸附量的呈现出相同的变化趋势, 均随其初始浓度的增加而增大, 但增大趋势随浓度增大而变缓.出现这一变化的主要原因是随着浓度的增大, 吸附剂活性位点数量逐渐减少, 吸附渐渐趋于饱和.
3.3 吸附动力学及吸附等温线采用准一级和准二级动力学模型对所得动力学数据进行拟合, 计算出相应速率常数, 研究其吸附过程的动力学行为并探讨吸附机理.所用拟合方程的线性表达式如下:
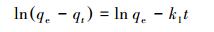
|
(2) |
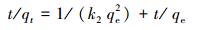
|
(3) |
式中, qt为t时刻吸附剂对Pb(Ⅱ)、Cu(Ⅱ)、Zn(Ⅱ)的吸附量(mg·g-1);qe为平衡吸附量(mg·g-1);k1为准一级速率常数(min-1);k2为准二级速率常数(mg·g-1·min-1).qe、k2可分别由截距和直线斜率求得.动力学分析结果见表 2和图 5.
| 表 2 Pb(Ⅱ)、Cu(Ⅱ)、Zn(Ⅱ)吸附动力学方程拟合参数 Table 2 Adsorption kinetics equation fitting parameters of Pb (Ⅱ), Cu (Ⅱ), Zn (Ⅱ) |
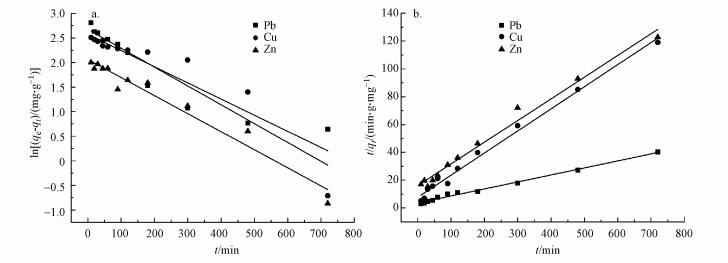 |
| 图 5 吸附动力学曲线 (a.准一级方程;b.准二级方程) Fig. 5 Absorption kinetics curve |
准一级动力学相关系数最高为0.9535, 而准二级动力学相关系数均高于0.99, 因此, 准二级动力学方程能更好地描述3个金属的吸附过程.这证实了CS-EGDE/Fe3O4凝胶微球吸附剂对重金属的吸附作用为化学吸附.比表面积大小决定了与界面接触表面活性位点数量(解春雨, 2018), 是影响吸附性能的重要因素.
3.3.2 等温吸附拟合采用Langmuir和Freundlich吸附等温线模型来解释等温吸附过程.Langmuir方程假设吸附过程为单层吸附, 其线性表达式如下:
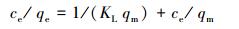
|
(4) |
式中, ce表示吸附质在溶液中的平衡浓度(mg·L-1), qe表示吸附质的吸附量(mg·g-1), KL为Langmuir吸附平衡常数(L·mg-1), qm表示在吸附剂上单层形成的最大吸附能力(mg·g-1).
Freundlich等温线是用于描述非均相表面的经验方程, 其线性表达式:
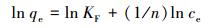
|
(5) |
式中, KF为Freundlich常数, 1/n表示吸附指数.
吸附等温线拟合结果见表 3和图 6, 分析实验数据可看出Langmuir等温线拟合度更高, 这表明吸附主要为单层吸附.Pb(Ⅱ), Cu(Ⅱ)和Zn(Ⅱ)离子的最大吸附值分别为41.17、30.72、30.03 mg·g-1.与使用其他交联剂改性的壳聚糖吸附剂对重金属离子的吸附容量进行对比, 仍然具有绿色高效、制备简洁、环境友好的优点.Langmuir等温线常数qm和KL遵循Pb(Ⅱ)> Cu(Ⅱ)> Zn(Ⅱ)的顺序.相比Cu(Ⅱ)和Zn(Ⅱ), Pb(Ⅱ)具有最高KL值, 表明Pb与官能团结合的亲和力最高, 吸附剂对其单层吸附能力最大.
| 表 3 Pb(Ⅱ)、Cu(Ⅱ)、Zn(Ⅱ)吸附等温线拟合参数 Table 3 Adsorption isotherms of Pb(Ⅱ), Cu(Ⅱ) and Zn(Ⅱ) |
| 表 4 不同交联改性方式CS吸附剂对Pb(Ⅱ)、Cu(Ⅱ)、Zn(Ⅱ)的吸附量对比 Table 4 Comparison of adsorption capacity of different adsorbent modified CS adsorbents on Pb(Ⅱ), Cu(Ⅱ) and Zn(Ⅱ) |
 |
| 图 6 等温吸附曲线 (a. Langmuir;b. Freundlich) Fig. 6 Sorption isotherm |
为探究在多元吸附体系中吸附剂对各重金属离子的亲和顺序和吸附效果, 考察了二元和三元重金属离子竞争吸附, 混合溶液中每种金属离子的初始浓度都为100 mg·L-1.由图 7和表 5实验数据比较可以看出, 在二元体系中, Pb(Ⅱ)的存在大大降低了Cu(Ⅱ)和Zn(Ⅱ)的吸附, 但Zn(Ⅱ)对CS-EGDE/Fe3O4吸附Pb(Ⅱ)和Cu(Ⅱ)没有明显影响.在三元体系中获得的结果和二元体系中的结果类似, Pb(Ⅱ)的吸附受Cu(Ⅱ)和Zn(Ⅱ)的影响较小, 而Zn(Ⅱ)受到的竞争压力最大, 吸附量变化也是最大的.由此可见, 当3种金属共存时, 吸附按Pb(Ⅱ)> Cu(Ⅱ)> Zn(Ⅱ)的顺序进行, 这在单一金属吸附研究中也显示出相似的规律.
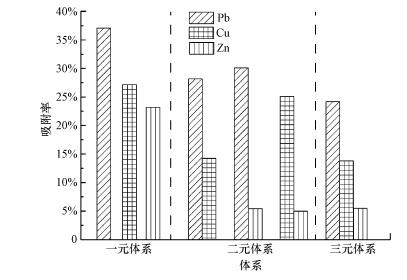 |
| 图 7 多元体系竞争吸附率比较图 Fig. 7 Multi-system competitive adsorption rate comparison chart |
| 表 5 Pb(Ⅱ)、Cu(Ⅱ)、Zn(Ⅱ)多元体系竞争吸附率 Table 5 Pb(Ⅱ), Cu(Ⅱ), Zn(Ⅱ) multi-system competition adsorption rate |
考察了CS-EGDE/Fe3O4对Pb(Ⅱ)、Cu(Ⅱ)、Zn(Ⅱ)静态吸附效果后, 为进一步探究其动态吸附能力, 设置了以CS-EGDE/Fe3O4为填料的固定床动态吸附实验.由图 8a及b可知, CS-EGDE/Fe3O4吸附Zn(Ⅱ)在2 h左右就完全穿透, 即达到吸附饱和(ct/c0=0.98).对于Cu(Ⅱ)的动态吸附, ct/c0达到0.9以上的时间延长到了8 h.而对于Pb(Ⅱ)的动态吸附在13 h左右完全穿透, 是Zn(Ⅱ)的6.5倍和Cu(Ⅱ)的1.6倍, 有效吸附时间大大增加.该结果表明, CS-EGDE/Fe3O4固定床对Pb(Ⅱ)的吸附效果较好、稳定性较高且持续时间较长, Cu(Ⅱ)的吸附效果次之, 而对Zn(Ⅱ)的吸附容量较小, 吸附效果较差.从动态试验中可以看出, CS-EGDE/Fe3O4在实际应用中有一定废水处理效果, 但这是实验室条件下所进行的动态吸附实验, 在实际应用上还有需要加强和改进的地方.
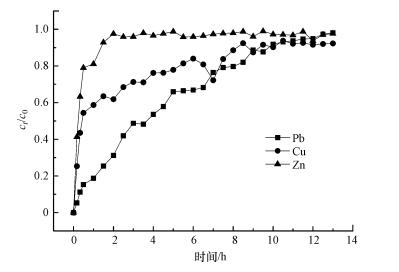 |
| 图 8 CS-EGDE/Fe3O4固定床吸附穿透曲线 Fig. 8 Dynamic adsorption rate and adsorption breakthrough curve of CS-EGDE/Fe3O4 |
如图 9所示, 针对CS-EGDE/Fe3O4吸附多元重金属的过程进行机理探究.较多研究显示, 壳聚糖主要与重金属离子发生螯合反应对其进行吸附(季君晖, 2000;丁纯梅等, 2004), 且普遍认为是壳聚糖分子中的—NH2和—OH基团与重金属离子发生配位反应, 形成配位键, 不同离子的配位原子也是不同的(朱再盛等, 2008), 这与材料的FTIR表征结果一致.其中, 推测CS-EGDE/Fe3O4在吸附3种重金属离子时, Cu(Ⅱ)和Zn(Ⅱ)都只有N原子参与了配位, 而吸附Pb(Ⅱ)时, N、O原子都参与了配位(邢云等, 2014).大量文献研究中交联壳聚糖吸附重金属离子前后XPS检测结果均表明, 磁性吸附剂在吸附重金属离子后N1s能均变大, O1s能只在吸附Pb2+、Co2+时变大(季君晖, 2000;施晓文等, 2003;丁纯梅等, 2004;朱再盛等, 2008;Pu et al., 2014;邢云等, 2014;俞洁等, 2017;杨虎城等, 2017;万仲豪等, 2018).而共价指数(Zhu et al., 2012)的差异很可能是导致CS-EGDE/Fe3O4选择性吸附的原因.根据Nieboer和Richardson(HSAB理论)(Nieboer et al., 1980), 金属离子按官能团所含原子S > N > O的顺序与官能团相互作用, 共价指数则按Pb(6.41)> Cu(2.64)> Zn(2.04)的顺序降低.表明Pb(Ⅱ)比Cu(Ⅱ)和Zn(Ⅱ)对孤对电子具有更强的吸引力在N原子上形成复合物(Chen et al., 2007).
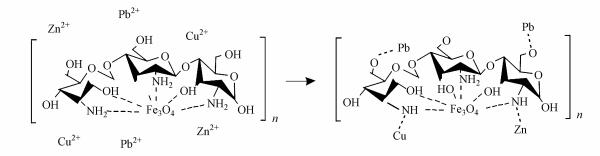 |
| 图 9 CS-EGDE/Fe3O4吸附多元重金属过程机理图 Fig. 9 Diagram of adsorption Mechanism of multi-component heavy metals by CS-EGDE/Fe3O4 |
1) 以壳聚糖为基材, 通过原位共沉淀法和乙二醇二缩水甘油醚交联法制备得到新型CS-EGDE/Fe3O4凝胶微球.该吸附剂内部孔隙结构良好, 比表面积大, Fe3O4纳米颗粒在基质中分布较均匀, 粒径约为(3±1) nm; 凝胶微球主要活性官能团为—NH3和—OH, 具有良好的顺磁性, 可外加磁场实现固液分离.
2) CS-EGDE/Fe3O4凝胶微球能够有效去除水中Pb(Ⅱ)、Cu(Ⅱ)、Zn(Ⅱ), 吸附反应在700 min内达到平衡, 吸附容量随溶液初始pH升高而增大, 最佳初始pH为6.
3) 在二元体系中, Zn(Ⅱ)受到的竞争压力最大, 吸附量变化也是最大的, Pb(Ⅱ)受到的竞争压力最小;在三元体系中明显发生拮抗作用, 金属吸附顺序为Pb(Ⅱ)> Cu(Ⅱ)> Zn(Ⅱ), 出现选择性吸附的主要原因是重金属离子共价指数的差异.
4) CS-EGDE/Fe3O4凝胶微球对重金属离子的吸附过程满足准二级动力学方程, 且较好符合Langmuir等温吸附方程.吸附剂对Pb(Ⅱ)的吸附活性最佳, 对Pb(Ⅱ)、Cu(Ⅱ)、Zn(Ⅱ)最大饱和吸附容量分别为41.17、30.72、30.03 mg·g-1.
5) 以CS-EGDE/Fe3O4作为填料的固定床对重金属模拟废水的处理效果依然遵循Pb(Ⅱ)> Cu(Ⅱ)> Zn(Ⅱ).模拟实验显示固定床对重金属废水有一定处理效果, 该吸附剂具有一定的实际应用价值.
Anitha T, Kumar P S, Kumar K S, et al. 2015. Adsorptive removal of Pb(Ⅱ) ions from polluted water by newly synthesized chitosan-polyacrylonitrile blend:Equilibrium, kinetic, mechanism and thermodynamic approach[J]. Process Safety and Environmental Protection, 98(Complete): 187–197.
|
Bhattacharya A, Naik S N, Khare S K. 2018. Harnessing the bio-mineralization ability of urease producing Serratia marcescens and Enterobacter cloacae EMB19 for remediation of heavy metal cadmium (Ⅱ)[J]. Journal of Environmental Management, 215: 143–152.
DOI:10.1016/j.jenvman.2018.03.055
|
Bailey S E, Olin T J, Bricka R M, et al. 1999. A review of potentially low-cost sorbents for heavy metals[J]. Water Research, 33(11): 2469–2479.
DOI:10.1016/S0043-1354(98)00475-8
|
Chen C H, Lin Y S, Wu S J, et al. 2018. Mutlifunctional nanoparticles prepared from arginine-modified chitosan and thiolated fucoidan for oral delivery of hydrophobic and hydrophilic drugs[J]. Carbohydrate Polymers, 193: 163–172.
DOI:10.1016/j.carbpol.2018.03.080
|
Chen C, Wang J. 2007. Influence of metal ionic characteristics on their biosorption capacity bySaccharomyces cerevisiae[J]. Applied Microbiology and Biotechnology, 74(4): 911–917.
DOI:10.1007/s00253-006-0739-1
|
Luk C J, Yip J, Yuen C M, et al. 2014. A comprehensive study on adsorption behaviourof direct, reactive and acid dyes on crosslinked and non-crosslinked chitosan beads[J]. Journal of Fiber Bioengineering and Informatics, 7(1): 35–52.
DOI:10.3993/jfbi
|
Chen M, Shafer-Peltier K, Randtke S J., et al. 2018. Competitive association of cations with poly(sodium 4-styrenesulfonate) (PSS) and heavy metal removal from water by PSS-assisted ultrafiltration[J]. Chemical Engineering Journal, 344: 155–164.
DOI:10.1016/j.cej.2018.03.054
|
Chang Y C, Chen D H. 2005. Preparation and adsorption properties of monodisperse chitosan-bound Fe3O4 magnetic nanoparticles for removal of Cu(Ⅱ) ions[J]. Journal of Colloid & Interface Science, 283(2): 446–451.
|
陈志军, 彭凯, 路文忠, 等. 2006. Fe3O4/聚合物磁性高分子微球的制备[J]. 材料导报, 2006, 20(s2): 198–200.
|
曹佐英, 张启修, 赖声礼. 2001. 微波辐射下模板法乙二醇双缩水甘油醚交联壳聚糖树脂的制备及吸附性能的研究[J]. 湿法冶金, 2001, 20(4).
|
丁述理, 孙晨光. 2006. 膨润土吸附水中Cr(Ⅵ)的影响因素研究[J]. 非金属矿, 2006, 29(3): 45–48.
DOI:10.3969/j.issn.1000-8098.2006.03.018 |
丁纯梅, 宋庆平, 孔霞, 等. 2004. 壳聚糖/Pb(Ⅱ)模板壳聚糖膜与Pb(Ⅱ)螯合反应的动力学及机理探讨[J]. 无机化学学报, 2004, 20(6): 711–714.
DOI:10.3321/j.issn:1001-4861.2004.06.019 |
Nieboer E, Richardson D H S. 1980. The replacement of the nodescript term 'heavy metals' by a biologically and chemicall significant classification of metal ions[J]. Environmental Pollution Series B, Chemical and Physical, 1(1): 3–26.
DOI:10.1016/0143-148X(80)90017-8
|
Fu F L, Wang Q. 2011. Removal of heavy metal ions from wastewaters:a review[J]. Journal of Environmental Management, 92(3): 407–418.
DOI:10.1016/j.jenvman.2010.11.011
|
郭晶, 李利强, 黄代中, 等. 2016. 洞庭湖表层水和底泥中重金属污染状况及其变化趋势[J]. 环境科学研究, 2016, 29(1): 44–51.
|
王宇, 高建峰, 胡拖平, 等. 2016. 乙二醇双缩水甘油醚交联壳聚糖印迹材料对稀土中Cu(Ⅱ)的选择性吸附[J]. 材料导报, 2016, 30(4): 29–32.
|
黄鸽, 姜霞, 完颜华, 等. 2012. 不同稳定剂对污染沉积物中重金属的稳定效果[J]. 环境科学研究, 2012, 25(5): 563–567.
|
解春雨. 2018.功能性材料对铀的吸附行为及机制研究[D].上海: 中国科学院大学(中国科学院上海应用物理研究所).
http://cdmd.cnki.com.cn/Article/CDMD-80014-1018705583.htm |
季君晖. 2000. Cu2+-壳聚糖螯合物及壳聚糖吸附Cu2+机理的XPS研究[J]. 应用化学, 2000, 1: 115–116.
DOI:10.3969/j.issn.1000-0518.2000.01.035 |
Jacob J M, Karthik C, Saratale R G, et al. 2018. Biological approaches to tackle heavy metal pollution:A survey of literature[J]. Journal of Environmental Management, 217: 56–70.
|
Jó wiak, Tomasz, Filipkowska U, Szymczyk P, et al. 2017. Effect of ionic and covalent crosslinking agents on properties of chitosan beads and sorption effectiveness of Reactive Black 5 dye[J]. Reactive and Functional Polymers, 114: 58–74.
DOI:10.1016/j.reactfunctpolym.2017.03.007
|
Kong J J, Gu R, Yuan J N, et al. 2018. Adsorption behavior of Ni(Ⅱ) onto activated carbons from hide waste and high-pressure steaming hide waste[J]. Ecotoxicology and Environmental Safety, 156: 294–300.
DOI:10.1016/j.ecoenv.2018.03.017
|
刘晨. 2017.生物质基聚合物功能材料的组装及吸附性能研究[D].北京: 中国地质大学.
http://cdmd.cnki.com.cn/Article/CDMD-10491-1017740231.htm |
李建军, 鲍旭, 吴先锋, 等. 2017. 磁性壳聚糖复合微球的制备及其Cu2+吸附性能[J]. 无机化学学报, 2017, 33(3): 383–388.
|
梁莎, 冯宁川, 郭学益. 2009. 生物吸附法处理重金属废水研究进展[J]. 水处理技术, 2009, 35(3): 13–17.
|
林霞, 陈培丰, 黄风华, 等. 2010. SiO2表面包覆对Fe3O4磁性微球性能的影响[J]. 合成化学, 2010, 18(4): 507–510.
DOI:10.3969/j.issn.1005-1511.2010.04.029 |
李一民, 廖建和, 赵艳芳, 等. 2011. 微波辐射凝固天然橡胶的性能研究[J]. 弹性体, 2011, 21(6): 29–33.
DOI:10.3969/j.issn.1005-3174.2011.06.008 |
林志艳, 陈亮, 陈东辉. 2003. 壳聚糖分子量与絮凝剂投加量的关系模型[J]. 环境科学研究, 2003, 5: 45–47.
DOI:10.3321/j.issn:1001-6929.2003.05.012 |
Ma H, Pu S Y, Hou Y Q, et al. 2018. A highly efficient magnetic chitosan "fluid" adsorbent with a high capacity and fast adsorption kinetics for dyeing wastewater purification[J]. Chemical Engineering Journal, 345: 556–565.
DOI:10.1016/j.cej.2018.03.115
|
Ma H, Pu S Y, Ma J, et al. 2018. Formation of multi-layered chitosan honeycomb spheres via breath-figure-like approach in combination with co-precipitation processing[J]. Materials Letters, 211: 91–95.
DOI:10.1016/j.matlet.2017.09.091
|
Pu S Y, Ma H, Zinchenko A, et al. 2017. Novel highly porous magnetic hydrogel beads composed of chitosan and sodium citrate:an effective adsorbent for the removal of heavy metals from aqueous solutions[J]. Environmental Science and Pollution Research, 24: 16520–16530.
DOI:10.1007/s11356-017-9213-0
|
Ribeiro C, Scheufele F B, Espinoza-Quinones F R., et al. 2018. A comprehensive evaluation of heavy metals removal from battery industry wastewaters by applying bio-residue, mineral and commercial adsorbent materials[J]. Journal of Materials Science, 53: 7976–7995.
DOI:10.1007/s10853-018-2150-6
|
Reddy D H K, Lee S M. 2013. Application of magnetic chitosan composites for the removal of toxic metal and dyes from aqueous solutions[J]. Advances in Colloid and Interface Science, 201: 68–93.
|
Rosique M, Angosto J M, Guibal E, et al. 2016. Fernandez-lopez, factorial design methodological approach for enhanced cadmium ions bioremoval by opuntia biomass[J]. Clean-Soil Air Water, 44: 959–966.
DOI:10.1002/clen.v44.8
|
Rio S, Delebarre A. 2003. Removal of mercury in aqueous solution by fluidized bed plant fly ash[J]. Fuel, 82(2): 153–159.
DOI:10.1016/S0016-2361(02)00237-5
|
施晓文, 杜予民, 覃采芹, 等. 2003. 交联羧甲基壳聚糖微球的制备及其对Pb2+的吸附性能[J]. 应用化学, 2003, 20(8): 715–718.
DOI:10.3969/j.issn.1000-0518.2003.08.001 |
王建龙, 陈灿. 2010. 生物吸附法去除重金属离子的研究进展[J]. 环境科学学报, 2010, 30(4): 673–701.
|
Wang Q, Wang B, Lee X Q, et al. 2018. Sorption and desorption of Pb(Ⅱ) to biochar as affected by oxidation and pH[J]. The Science of the total environment, 634: 188–194.
DOI:10.1016/j.scitotenv.2018.03.189
|
王帅. 2017.磁性壳聚糖微球吸附剂的制备及对水中重金属离子去除性能[D].郑州: 华北水利水电大学
http://cdmd.cnki.com.cn/Article/CDMD-10078-1017251126.htm |
万仲豪, 李孟, 张倩. 2018. 间苯二胺改性磁性壳聚糖对六价铬的还原-吸附协同作用机制研究[J]. 环境科学学报, 2018, 38(8): 3118–3126.
|
王泽红, 陶士杰, 于福家, 等. 2012. 天然沸石的改性及其吸附Pb2+, Cu2+的研究[J]. 东北大学学报(自然科学版), 2012, 33(11): 1637–1640.
DOI:10.12068/j.issn.1005-3026.2012.11.029 |
邢云, 李素娟, 李步海. 2014. 交联壳聚糖对常见金属离子的吸附性能及机理探讨[J]. 冶金分析, 2014, 34(9): 58–65.
|
俞洁, 郑继东, 陆泉芳, 等. 2017. 壳聚糖/聚乙二醇/丙烯酸吸附剂对Cu2+、Co2+和Ni2+的吸附选择性和重复利用性[J]. 环境科学学报, 2017, 37(3): 1003–1012.
|
杨虎城, 龚继来, 曾光明. 2017. 掺杂聚乙烯醇的壳聚糖小球对铜离子-腐殖酸的单一和连续吸附行为[J]. 环境科学学报, 2017, 37(10): 3735–3745.
|
余宙, 仵彦卿, 刘预. 2009. 新型交联壳聚糖材料对地下水重金属Zn2+的吸附性能[J]. 生态环境学报, 2009, 18(6): 2102–2107.
DOI:10.3969/j.issn.1674-5906.2009.06.018 |
Zhang C M, Duan N, Jiang L H, et al. 2018. Influence of Mn2+ ions on the corrosion mechanism of lead-based anodes and the generation of heavy metal anode slime in zinc sulfate electrolyte[J]. Environmental Science and Pollution Research International, 25: 11958–11969.
DOI:10.1007/s11356-018-1443-2
|
张淑琴, 童仕唐. 2008. 活性炭对重金属离子铅镉铜的吸附研究[J]. 环境科学与管理, 2008, 33(4): 91–94.
DOI:10.3969/j.issn.1673-1212.2008.04.024 |
Zhou Y T, Branford-white C, Nie H L, et al. 2009. Adsorption mechanism of Cu2+ from aqueous solution by chitosan-coated magnetic nanoparticles modified with-ketoglutaric acid[J]. Colloids and Surfaces B-Biointerfaces, 74: 244–252.
DOI:10.1016/j.colsurfb.2009.07.026
|
Zhu Y H, Hu J, Wang J L. 2012. Competitive adsorption of Pb(Ⅱ), Cu(Ⅱ) and Zn(Ⅱ) onto xanthate-modified magnetic chitosan[J]. Journal of Hazardous Materials, 221: 155–161.
|
朱再盛, 罗三来, 钟娜, 等. 2008. 交联壳聚糖对Zn2+的吸附性能[J]. 应用化学, 2008, 25(5): 617–621.
DOI:10.3969/j.issn.1000-0518.2008.05.026 |
 2019, Vol. 39
2019, Vol. 39


