二氧化硫(SO2)是一种常见的大气污染物, 主要来源于含硫矿物的燃烧和工业冶炼.当土壤中含硫不足时, 大气中低浓度的SO2可作为硫营养来源, 促进植物生长发育;但高浓度的SO2会对植物产生毒害作用, 干扰植物的光合作用过程, 破坏叶绿体结构, 分解叶绿素, 引起叶片失绿甚至坏死(Choi et al., 2014; Liu et al., 2017).SO2通过气孔进入植物体内, 有研究发现SO2对植物的毒性大小与叶面气孔开度有关(van der Kooij et al., 1997).SO2在植物细胞中水解形成亚硫酸根(SO32-)和亚硫酸氢根(HSO3-), SO32-可被还原成半胱氨酸, 进入硫同化途径;也可被氧化成硫酸根(SO42-), 同时伴随活性氧的产生(Brychkova et al., 2007).活性氧能诱发细胞抗氧化酶活性增强, 诱导抗氧化酶基因表达, 提高植物对SO2的抗性(Li et al., 2012a; 2012b).但胞内活性氧过量时可引起细胞氧化损伤, 导致膜质过氧化、细胞膜结构破坏, 甚至引发细胞死亡(Yi et al., 2012; 韩彦莎等, 2016).近年来, 关于SO2对植物体毒性的研究大多集中在氧化损伤方面.
脯氨酸是一种渗透调节物质, 普遍存在于植物体内.逆境条件下脯氨酸的积累对于植物维持渗透平衡、清除自由基、保护细胞膜结构具有重要意义(Szabados et al., 2010).此外, 脯氨酸还可作为胁迫条件下碳、氮及NADPH的重要来源(Szabados et al., 2010).植物通过促进合成、抑制降解在体内累积大量脯氨酸, 以减轻逆境对植物的伤害(Su et al., 2018).研究表明, 细胞内过量的脯氨酸能够诱导活性氧的产生, 继而引发细胞凋亡, 最终导致植株生长受到抑制(Chen et al., 2011).因此, 防止脯氨酸过度积累对于维持植物在逆境条件下的正常生长至关重要.脯氨酸合成发生在胞质和叶绿体中, 主要通过谷氨酸(Glu)途径来完成;而降解发生在线粒体内(Szabados et al., 2010).大量研究认为, 吡咯啉-5-羧酸合成酶(P5CS)、吡咯啉-5-羧酸还原酶(P5CR)和脯氨酸脱氢酶(PDH)是脯氨酸合成和降解的关键酶, 在脯氨酸累积和代谢过程中起重要的调节作用(Ren et al., 2018; Su et al., 2018).迄今为止, 关于SO2对植物脯氨酸代谢的影响及相关分子机制的研究还很少.
谷子(Setaria italica L)是一种传统的优质杂粮作物, 具有耐贫瘠、抗旱等特征, 因此, 在我国北方干旱和半干旱地区广泛种植.目前, 国内外有关SO2对谷子的毒害效应研究尚未见报道.因此, 本文通过研究SO2气体暴露对谷子幼苗气孔开闭、脯氨酸代谢及抗氧化酶活性的影响, 旨在探讨SO2对谷子的毒性效应及谷子响应SO2胁迫的相关机制, 以期为提高谷子的SO2抗性提供理论依据.
2 材料与方法(Materials and methods) 2.1 植物培养与处理实验谷子品种长农44号由山西省农业科学院谷子研究所培育提供.种子经自来水冲洗3次, 28 ℃黑暗浸泡12 h, 播种于无菌营养土中.植株培养条件为:光/暗周期为16 h/8 h, 温度26~28 ℃, 光照强度300 μmol·m-2·s-1, 相对湿度50%~60%.
取生长15 d的谷子幼苗, 在熏气箱中适应24 h后, 采用密闭箱静态熏气法, 用0、10、30 mg·m-3 SO2分别处理6、24、72 h.SO2产生根据K2S2O5+2HCl→2KCl+H2O+2SO2原理, 并采用甲醛吸收-副玫瑰苯胺分光光度法测定SO2浓度(Li et al., 2016).
2.2 气孔开度测量取谷子幼苗第2片成熟叶, 浸泡在表皮条缓冲液MES-Tris中, 暗处理2 h后, 取叶片下表皮, 置于载玻片上, 在光学显微镜下观察气孔, 并测量气孔宽度和气孔长度, 根据式(1)计算气孔开度.每个表皮随机选取6个视野, 每个视野随机测量10个气孔.
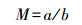
|
(1) |
式中, M为气孔开度, a为气孔宽度, b为气孔长度.
2.3 生理指标检测 2.3.1 叶片相对含水量测定参考王敏瑞等(2017)的方法测定并计算叶片相对含水量(RWC).取谷子幼苗的第2和第3片成熟叶, 立即测鲜重(FW);然后将叶片浸泡于蒸馏水中过夜, 取出后用滤纸擦干, 称饱和鲜重(TW);最后将叶片于65 ℃条件下烘干2~3 d至恒重, 称干重(DW).RWC计算公式如下所示:
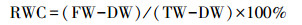
|
(2) |
脯氨酸含量测定采用酸性茚三酮法(王敏瑞等, 2017).PDH活性测定采用Ren等(2018)的方法, 以每分钟340 nm处的吸光度增加0.01为一个活力单位(U).
2.3.3 H2O2含量和O2·-产生速率测定使用过氧化氢试剂盒(A064, 南京建成)检测H2O2含量, O2·-产生速率的测定参考He等(2011)的方法.
2.3.4 CAT和SOD活性测定取谷子叶片0.1 g, 置于遇冷研钵中, 加入1 mL磷酸缓冲液(50 mmol·L-1, pH=7.4, 含1 mmol·L-1 EDTA和1%PVP), 冰浴上研磨成匀浆, 12000 r·min-1低温离心20 min, 取上清液即为粗酶提取液.CAT、SOD活性的测定参考李利红等(2008)的方法, CAT以每分钟吸光度降低0.01为一个酶活性单位(U), SOD以抑制氮蓝四唑(NBT)光化还原50%所需酶量为一个酶活性单位(U).
2.4 基因表达水平检测通过Real-Time PCR检测基因表达水平.利用Trizol法提取谷子叶片总RNA, 使用PrimeScript RT reagent Kit with gDNA Eraser(Takara, Japan)反转录合成cDNA.以cDNA为模板, 使用SYBR Premix Ex TaqTM Ⅱ PCR Kit(Takara, Japan)进行Real-Time PCR扩增.以SiActin作为内参基因, 所用引物序列见表 1.
| 表 1 本文中使用的引物序列 Table 1 Primers used in this study |
应用SPSS 17.0软件对数据进行统计分析, 采用Duncan方法对不同处理之间进行比较, 不同字母表示差异显著(p < 0.05).通过独立样本T检验对数据进行组间差异分析, *表示组间差异显著(p < 0.05).
3 结果(Results) 3.1 SO2暴露对叶表型和相对含水量的影响暴露于10 mg·m-3 SO2时, 谷子幼苗叶表型和相对含水量(RWC)与对照(0 mg·m-3 SO2)相比无明显差异(图 1a、1b).当SO2浓度为30 mg·m-3时, 随暴露时间的延长, 叶面逐渐受到损伤(图 1a), RWC逐渐下降(图 1b).暴露72 h后, 与对照相比, 相对含水量下降8.1%(图 1b);同时, 明显出现叶缘卷曲、叶片坏死的受损症状(图 1a).
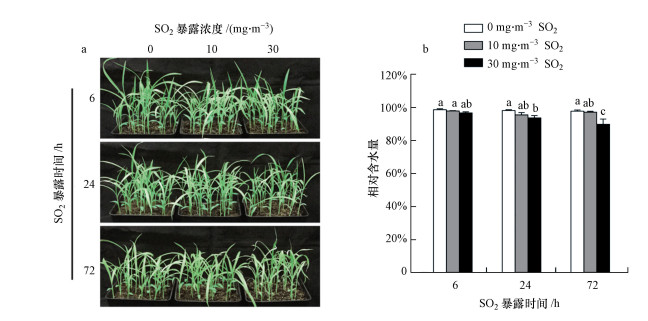 |
| 图 1 SO2暴露对谷子叶表型(a)和相对含水量(b)的影响 Fig. 1 Effect of SO2 exposure on leaf phenotype(a) and relative water content(b) of foxtail millet seedlings |
植物遭受SO2胁迫时, 气孔会发生复杂的变化, 且与物种、暴露时间和浓度有关.谷子幼苗暴露于10 mg·m-3 SO2时, 在不同的处理时间下(6、24、72 h), 气孔开度与对照(0 mg·m-3 SO2)相比均无显著变化(图 2b).较高浓度的SO2(30 mg·m-3)能够诱导叶面气孔开度减小(图 2a), 暴露24 h和72 h后, 气孔开度分别为对照的65.2%和39.4%(图 2b).
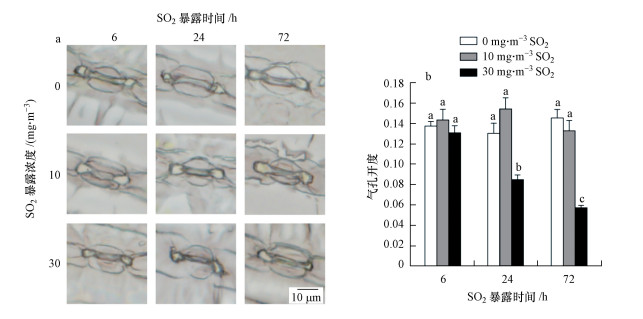 |
| 图 2 SO2暴露对谷子叶片气孔开度的影响 Fig. 2 Effect of SO2 exposure on stomatal aperture in the leaves of foxtail millet seedlings |
谷子幼苗在10 mg·m-3 SO2中暴露6、24、72 h后, 与对照(0 mg·m-3 SO2)相比叶片中的脯氨酸含量无显著变化(图 3a), PDH酶活性也无明显改变(图 3b).当SO2浓度为30 mg·m-3时, 随着暴露时间的延长, 脯氨酸含量逐渐增加(图 3a), PDH活性呈升高趋势, 暴露72 h后PDH活性较6 h时提高24.3%(图 3b).
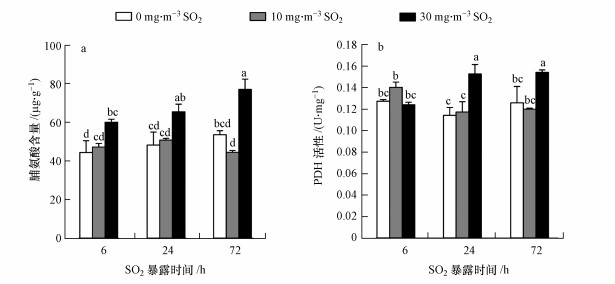 |
| 图 3 SO2暴露对谷子叶片脯氨酸含量(a)及PDH酶活性(b)的影响 Fig. 3 Effect of SO2 exposure on proline content(a) and PDH activity(b) in the leaves of foxtail millet seedlings |
为了进一步解析SO2暴露对谷子幼苗脯氨酸代谢的影响, 本文通过Real-Time PCR检测脯氨酸合成相关基因SiP5CS、SiP5CR和脯氨酸脱氢酶基因SiPDH的表达情况.结果发现, 谷子幼苗在30 mg·m-3 SO2中暴露72 h后, SiPDH表达显著上调, 为对照的14.0倍, 而SiP5CS和SiP5CR表达显著下调(图 4).
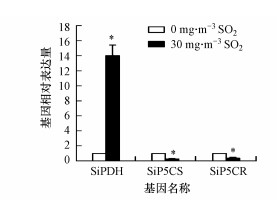 |
| 图 4 SO2暴露对谷子叶片SiPDH、SiP5CS、SiP5CR基因表达的影响 Fig. 4 Effect of SO2 exposure on the expression of SiPDH, SiP5CS, and SiP5CR genes in the leaves of foxtail millet seedlings |
SO2暴露浓度为10 mg·m-3时, 谷子叶片中O2·-产生速率与对照(0 mg·m-3 SO2)相比无明显差异(图 5a).当SO2浓度为30 mg·m-3时, 随着暴露时间的延长, O2·-产生速率逐渐增加, 在胁迫24 h和72 h后, 分别为对照组的2.5倍和3.4倍(图 5a).H2O2含量在各组之间无明显变化(图 5b).SOD和CAT是抗氧化系统中两种重要的酶, 分别负责清除O2·-和H2O2.谷子幼苗暴露于10 mg·m-3 SO2时, SOD活性在暴露72 h后较对照显著升高(图 5c), 而CAT活性与对照相比变化不明显(图 5d).当SO2浓度为30 mg·m-3时, 暴露6、24、72 h后CAT活性明显增加, 分别是对照的2.3、1.5、2.1倍(图 5d);SOD活性呈现相同的趋势, 分别比对照提高了15.8%、33.8%、28.1%(图 5c).
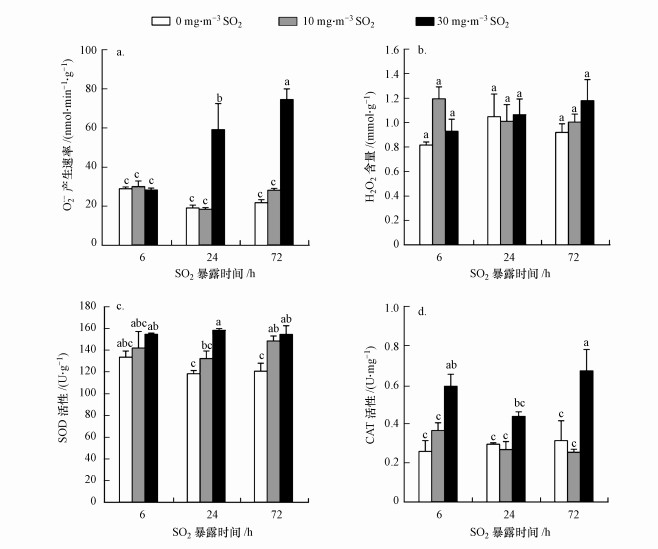 |
| 图 5 SO2暴露对谷子叶片活性氧水平和抗氧化酶活性的影响(a.O2·-产生速率, b.H2O2含量, c.SOD活性, d. CAT活性) Fig. 5 Effect of SO2 exposure on ROS level and antioxidant enzyme activities in the leaves of foxtail millet seedlings |
SO2是常见的大气污染物之一.研究表明, SO2对植物的毒性具有浓度和时间依赖性(Lang et al., 2007; 韩彦莎等, 2016).高浓度长时间的SO2暴露会对植物产生毒害效应, 干扰植物正常生理过程, 诱发不可逆的遗传损伤(李利红等, 2008; Yi et al., 2012; Choi et al., 2014).本研究发现, 10 mg·m-3 SO2熏气对谷子幼苗叶片形态和相对含水量无明显影响(图 1), 而30 mg·m-3 SO2暴露72 h后, 幼苗出现叶缘卷曲甚至坏死的受损症状(图 1a), 叶片相对含水量与对照相比亦显著降低(图 1b).
大气中的SO2主要经气孔进入植物体内.谷子幼苗长时间暴露于较高浓度SO2(30 mg·m-3)时, 叶面气孔开度与对照相比显著降低(图 2).曾有学者在拟南芥、豌豆、甘薯等植物的叶片中也发现了类似现象(Olszyk et al., 1981; 李利红等, 2008; Hu et al., 2014).这种变化一方面有助于减少进入叶组织中的SO2量;另一方面, 气孔开度减小有助于降低叶面水分蒸腾速率, 在一定程度上缓解SO2暴露导致的谷子叶片含水量降低, 这也是谷子对SO2胁迫的一种适应机制.Olszyk等(1981)推测SO2诱导的植物气孔关闭可能与保卫细胞内ABA含量增加及胞质酸化引起的K+外流有关.此外, 有研究表明, 信号分子硫化氢(H2S)和一氧化氮(NO)在SO2诱导植物气孔运动的过程中发挥重要作用(Hu et al., 2014; 赵均等, 2014; 李蕊等, 2015).作为公认的气体信号分子, H2S参与调节植物在逆境胁迫下的气孔运动(Jin et al., 2016; Tian et al., 2016).进入植物细胞的SO2水解形成SO32-, 在亚硫酸盐还原酶的催化作用下, SO32-可被直接还原为H2S(Brychkova et al., 2007).因此, 可推测SO2很可能通过促进谷子幼苗内源H2S产生从而诱导气孔关闭.目前关于SO2调节谷子叶片气孔开度减小的具体机制尚不明确, 还需进一步的研究.但值得注意的是, 气孔开度减小可能影响植物与外界的气体交换, 导致叶片光合效率下降, 使植株生长发育受到抑制.
脯氨酸是植物体内一种重要的渗透调节物质, 在植物细胞中以游离状态广泛存在.研究表明, 在干旱、低温等逆境胁迫下, 植物体内脯氨酸含量明显增加(Ren et al., 2018; Su et al., 2018).本研究发现, 当谷子幼苗暴露于较高浓度SO2(30 mg·m-3)时, 随着暴露时间的延长, 其叶片中的脯氨酸含量逐渐增加(图 3a).SO2胁迫下, 大量积累的脯氨酸能够通过调节细胞渗透势来维持细胞膨压, 防止植株过度失水.但有研究显示, 过量的脯氨酸会抑制植物生长(Chen et al., 2011).本研究结果发现, 当谷子幼苗长时间暴露于高浓度SO2胁迫中时, 脯氨酸脱氢酶PDH活性较对照显著升高(图 3b), SiPDH基因表达水平显著上调(图 4).同时, 脯氨酸合成相关基因SiP5CS、SiP5CR的表达受到明显抑制(图 4).由此可知, SO2胁迫下谷子幼苗中的脯氨酸合成与积累是一个受细胞内脯氨酸浓度调控的生理生化过程.当脯氨酸含量过多时, 谷子体内启动反馈调节机制, 通过促进降解和抑制合成来防止脯氨酸过度积累.
目前普遍认为SO2对植物的伤害与活性氧诱发的氧化损伤有关(李利红等, 2008; Li et al., 2012a).谷子幼苗长时间暴露于高浓度SO2时, 叶片中的O2·-产生速率与对照相比明显提高(图 5a), 从而诱导SOD活性增强(图 5c), 催化O2·-歧化生成H2O2.与此类似, Li等(2012b)在拟南芥中的研究也发现, 30 mg·m-3 SO2暴露下叶片中SOD活性与对照相比明显提高.CAT是植物体内负责清除H2O2的关键抗氧化酶.高浓度SO2暴露后, 谷子叶片中CAT活性增高(图 5d), 有助于进一步将H2O2清除, 从而使H2O2含量维持在正常水平(图 5b).
5 结论(Conclusions)1) SO2对谷子的毒性效应具有浓度依赖性.10 mg·m-3 SO2暴露对谷子幼苗的叶片形态、叶相对含水量、脯氨酸含量及抗氧化酶(SOD、CAT)活性均无明显影响.30 mg·m-3 SO2暴露下, 谷子叶片出现明显的受损症状, 叶片相对含水量降低, 脯氨酸含量显著增加, O2·-产生速率明显提高.
2) 高浓度SO2暴露下, 谷子可通过以下应答机制来适应SO2胁迫:一方面, 通过减小叶面气孔开度以控制进入植株体内的SO2量;另一方面, 还可通过增加渗透调节物质脯氨酸的含量来维持细胞膨压, 防止细胞过度失水, 在一定程度上缓解SO2胁迫诱发的含水量下降;同时, 通过增强脯氨酸脱氢酶基因SiPDH表达、抑制脯氨酸合成相关基因SiP5CS、SiP5CR表达来避免脯氨酸过度积累.此外, 高浓度SO2暴露导致抗氧化酶(SOD、CAT)活性提高, 从而有效清除SO2诱导产生的过量活性氧.
Brychkova G, Xia Z, Yang G, et al. 2007. Sulfite oxidase protects plants against sulfur dioxide toxicity[J]. The Plant Journal, 50(4): 696–709.
DOI:10.1111/j.1365-313X.2007.03080.x
|
Chen J, Zhang Y, Wang C, et al. 2011. Proline induces calcium-mediated oxidative burst and salicylic acid signaling[J]. Amino Acids, 40(5): 1473–1484.
DOI:10.1007/s00726-010-0757-2
|
Choi D, Toda H, Kim Y. 2014. Effect of sulfur dioxide (SO2) on growth and physiological activity in Alnus sieboldiana at Miyakejima Island in Japan[J]. Ecological Research, 29(1): 103–110.
DOI:10.1007/s11284-013-1103-4
|
韩彦莎, 李琳, 王朝阳, 等. 2016. H2O2和NO互作调控SO2诱导的胡杨细胞死亡[J]. 环境科学学报, 2016, 36(8): 3073–3080.
|
He J, Qin J, Long L, et al. 2011. Net cadmium flux and accumulation reveal tissue-specific oxidative stress and detoxification in Populus×canescens[J]. Physiologia Plantarum, 143(1): 50–63.
|
Hu K, Tang J, Zhao D, et al. 2014. Stomatal closure in sweet potato leaves induced by sulfur dioxide involves H2S and NO signaling pathways[J]. Biologia Plantarum, 58(4): 676–680.
DOI:10.1007/s10535-014-0440-7
|
Jin Z, Pei Y. 2016. Hydrogen sulfide:The shutter button of stomata in plants[J]. Science China Life Sciences, 59(11): 1187–1188.
DOI:10.1007/s11427-016-0265-3
|
Lang C, Popko J, Wirtz M, et al. 2007. Sulphite oxidase as key enzyme for protecting plants against sulphur dioxide[J]. Plant, Cell and Environment, 30(4): 447–455.
DOI:10.1111/pce.2007.30.issue-4
|
Li L, Yi H. 2012a. Effect of sulfur dioxide on ROS production, gene expression and antioxidant enzyme activity in Arabidopsis plants[J]. Plant Physiology and Biochemistry, 58: 46–53.
DOI:10.1016/j.plaphy.2012.06.009
|
Li L, Yi H. 2012b. Differential expression of Arabidopsis defense-related genes in response to sulfur dioxide[J]. Chemosphere, 87(7): 718–724.
DOI:10.1016/j.chemosphere.2011.12.064
|
Li L, Xue M, Yi H. 2016. Uncovering microRNA-mediated response to SO2 stress in Arabidopsis thaliana by deep sequencing[J]. Journal of Hazardous Materials, 316(5): 178–185.
|
李利红, 仪慧兰, 王磊, 等. 2008. 二氧化硫暴露对拟南芥叶片形态和生理生化指标的影响[J]. 农业环境科学学报, 2008, 27(2): 525–529.
DOI:10.3321/j.issn:1672-2043.2008.02.023 |
李蕊, 仪慧兰, 仪民. 2015. 一氧化氮合酶途径参与SO2胁迫下蚕豆气孔运动调节[J]. 环境科学学报, 2015, 35(10): 3406–3410.
|
Liu Y, Li Y, Li L, et al. 2017. Attenuation of sulfur dioxide damage to wheat seedlings by co-exposure to nitric oxide[J]. Bulletin of Environmental Contamination and Toxicology, 99(1): 146–151.
DOI:10.1007/s00128-017-2103-9
|
Olszyk D M, Tibbitts T W. 1981. Stomatal response and leaf injury of Pisum sativum L.with SO2 and O3 exposures[J]. Plant Physiology, 67(3): 539–544.
|
Ren Y, Miao M, Meng Y, et al. 2018. DFR1-mediated inhibition of proline degradation pathway regulates drought and freezing tolerance in Arabidopsis[J]. Cell Reports, 23(13): 3960–3974.
DOI:10.1016/j.celrep.2018.04.011
|
Su J, Zhang Y, Nie Y, et al. 2018. Hydrogen-induced osmotic tolerance is associated with nitric oxide-mediated proline accumulation and reestablishment of redox balance in alfalfa seedlings[J]. Environmental and Experimental Botany, 147: 249–260.
DOI:10.1016/j.envexpbot.2017.12.022
|
Szabados L, Savouré A. 2010. Proline:A multifunctional amino acid[J]. Trends in Plant Science, 15(2): 89–97.
|
Tian B, Qiao Z, Zhang L, et al. 2016. Hydrogen sulfide and proline cooperate to alleviate cadmium stress in foxtail millet seedlings[J]. Plant Physiology and Biochemistry, 109: 293–299.
DOI:10.1016/j.plaphy.2016.10.006
|
van der Kooij T A W, De Kok L J, Haneklaus S, et al. 1997. Uptake and metabolism of sulphur dioxide by Arabidopsis thaliana[J]. New Phytologist, 135(1): 101–107.
DOI:10.1046/j.1469-8137.1997.00619.x
|
王敏瑞, 仪慧兰. 2017. 二氧化硫对拟南芥植株干旱生理的调节作用[J]. 生态学杂志, 2017, 36(5): 1285–1291.
|
Yi H, Yin J, Liu X, et al. 2012. Sulfur dioxide induced programmed cell death in Vicia guard cells[J]. Ecotoxicology and Environmental Safety, 78(1): 281–286.
|
赵均, 薛美昭, 白鹤丽, 等. 2014. 硝酸还原酶介导的NO合成参于SO2引发的拟南芥气孔运动的调节[J]. 环境科学学报, 2014, 34(3): 796–800.
|
 2019, Vol. 39
2019, Vol. 39


