2. 中国水产科学研究院黄海水产研究所海洋渔业环境与生物修复实验室, 青岛 266071;
3. 中国科学院大学, 北京 100049;
4. 浙江工业大学环境学院, 杭州 310014
2. Marine Fishery Environment and Bioremediation Laboratory, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071;
3. University of Chinese Academy of Sciences, Beijing 100049;
4. College of Environment, Zhejiang University of Technology, Hangzhou 310014
来自居民区、医院、制药厂等源头的抗生素可以随污水进入环境, 并通过吸附、地表径流、生物富集等作用在环境介质间迁移转化(Van Doorslaer et al., 2014;Gothwal et al., 2015).抗生素残留可以促进抗药菌及抗药基因的形成和传播, 从而对人类健康造成威胁(张俊等, 2014;Qiao et al., 2018).污水处理厂是污水中抗生素进入自然环境的最后屏障.然而, 现行的活性污泥工艺并非为去除抗生素而设计, 很多抗生素难以通过生物降解得以有效去除, 相当部分保留在出水中或转移到剩余污泥中(Li et al., 2010;Wang et al., 2017;张翔宇等, 2018).随着污水处理要求的提高及中水回用的增加, 污水深度处理受到越来越多的关注.以往的研究表明, 化学氧化、活性炭吸附、膜滤等污水深度处理技术可以有效去除水中多类抗生素(Jiang et al., 2013;Ganiyu et al., 2015), 但与污水相比, 污泥中抗生素的行为更加复杂, 其去除更加困难.污泥中累积了很多生物降解性较差的抗生素, 它们在常见的污泥处理工艺(脱水、调理、消化、堆肥等)中往往难以得到有效去除(Narumiya et al., 2013;Semblante et al., 2015), 而随污泥处置(如填埋、土地利用)进入土壤、水体等环境介质.因此, 污泥中抗生素的高效去除技术对于控制其环境污染具有重要意义.
剩余污泥不仅是抗生素污染的重要媒介, 而且其逐年上升的产量及不断提高的处理处置标准使得传统的污泥处理技术正面临着日益严峻的挑战.因此, 国内外学者提出了多种污泥减量机制(如溶解-隐性生长、解偶联代谢、维持代谢和生物捕食), 并发展出了多种污泥原位减量技术(Khursheed et al., 2011;Guo et al., 2013).其中, 污泥臭氧原位减量(SOR)受到了广泛关注.污泥经过臭氧处理后, 部分微生物细胞溶解, 释放出胞内物;回流至活性污泥系统后, 微生物利用释放物质进行代谢活动, 从而降低了系统的污泥产量(汪鲁等, 2014;Qiang et al., 2015).臭氧处理不仅可以取得良好的污泥溶胞效果, 还可以降解水相和污泥中很多种类的抗生素(Homem et al., 2011;Wang et al., 2018).然而, 目前有关污泥臭氧处理过程中抗生素去除的报道仍然较少, 关于SOR工艺中抗生素去除规律的研究(尤其是长期连续运行研究)更是有限.
因此, 本研究选取污泥中检出率较高的3种四环素类抗生素(四环素(TCN)、土霉素(OTC)、强力霉素(DOX))和1种大环内酯类抗生素(阿奇霉素(AZN))作为目标物, 构建了一套中试规模的SOR系统, 连续运行111 d(分为3阶段), 考察污泥减量及抗生素去除的效果, 以期为抗生素污染控制提供理论和技术支持.
2 材料与方法(Materials and methods) 2.1 化学药品TCN、OTC、DOX和AZN标准品购自Dr Ehrenstorfer GmbH(德国).地美环素(Dr Ehrenstorfer GmbH, 德国)和AZN-D3(Toronto research Chemicals Inc., 加拿大)分别作为四环素类抗生素和AZN的内标物.目标抗生素及内标物标准品的纯度均大于98%.目标抗生素的单标储备液配制在Milli-Q水(Advantage A10, Millipore, 美国)中, 地美环素(1000 mg·L-1)和AZN-D3(100 mg·L-1)的单标储备液配制在甲醇里.色谱纯甲醇(Fisher Scientific, 比利时)、乙腈(Fisher Scientific, 比利时)和甲酸(Di kma Technologies, Inc., 美国)用于目标抗生素的分析测试.配制人工模拟污水所需的葡萄糖、蛋白胨、NH4Cl、KH2PO4、NaHCO3及微量元素等分析纯化学药品购自国药集团化学试剂有限公司(北京).
2.2 中试系统组成如图 1所示, 中试系统可以分为厌氧/缺氧/好氧(A/A/O)单元、污泥臭氧处理单元、磷回收单元三部分.A/A/O单元主要由生物反应器(厌氧池84 L、缺氧池84 L、好氧池252 L)和竖流式沉淀池(42 L)组成.厌氧池和缺氧池内设置机械搅拌装置;缺氧池和好氧池内设置微孔曝气管, 溶解氧浓度分别控制在0.5和2.0 mg·L-1左右.生物反应器各池内安装恒温加热装置(Jebo, 广东), 水温控制在22 ℃左右.污泥臭氧处理单元主要由臭氧发生器和臭氧反应器构成.臭氧发生器(同林, 北京)以纯氧作为气源.臭氧反应器为圆柱形容器(内径0.2 m, 高1.2 m), 底部安装曝气盘, 进出气中臭氧浓度通过臭氧检测仪(Ideal, 淄博)进行实时监测.磷回收单元由两个沉淀池和一个磷回收池组成, 以Ca(OH)2作为除磷剂, 钙磷物质的量比控制在10左右.中试系统各池体均采用不锈钢制造.采用人工模拟污水作为进水, 主要水质指标为:化学需氧量(COD) (404±16) mg·L-1、总氮(TN) (40.2±1.6) mg·L-1、氨氮(NH3-N) (30.3±1.6) mg·L-1、总磷(TP) (5.00±0.17) mg·L-1、碱度(以NaHCO3计)0.15 g·L-1.
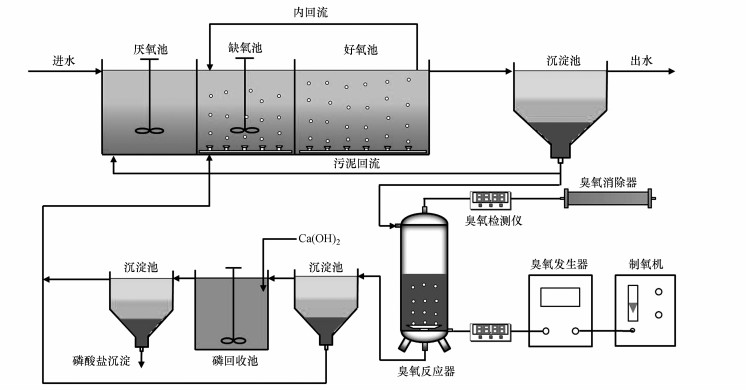 |
| 图 1 中试系统示意图 Fig. 1 Schematic diagram of the pilot-scale system |
将某中试规模A/A/O系统(Qiang et al., 2015)的剩余污泥(50 L)作为种泥加入到生物反应器中, 利用人工模拟污水对其进行培养和驯化.通过调节内回流比、污泥回流比和排泥量使得生物反应器内污泥混合液悬浮固体(MLSS)浓度及各项水质指标的去除性能趋于稳定.达到稳态后, 中试系统连续运行111 d, 分为3个阶段.阶段Ⅰ(1~20 d)和Ⅲ(21~65 d)内只有A/A/O单元运行, 相关参数如下:进水流量为1.0 m3·d-1, 水力停留时间为10 h(厌氧池2 h、缺氧池2 h, 好氧池6 h), 污泥龄为17 d, 污泥回流比为50%, 内回流比为150%, 每天排放10 L剩余污泥;阶段Ⅰ进水中不含抗生素, 而阶段Ⅲ进水中每种目标抗生素的浓度为100 μg·L-1.阶段Ⅲ(66~111 d)内, A/A/O单元正常运行, 每天将30 L污泥进行臭氧处理, 臭氧投加量控制在100 mg·g-1(以MLSS计)左右, 污泥溶解率为33.1%±2.9%;臭氧处理后污泥进入磷回收单元, 上清液经化学除磷后与污泥固体一同回流至缺氧池;该阶段不排放剩余污泥, 进水中每种目标抗生素的浓度为100 μg·L-1.采用单因素方差分析确定不同阶段实验数据之间是否存在显著性差异.
2.4 分析方法MLSS浓度通过重量法测定.按照哈希水质分析方法, 采用DR6000紫外-可见分光光度计(哈希, 上海)测定中试系统进出水中COD、NH3-N、TN和TP浓度.
污水样品经0.45 μm玻璃纤维滤膜(Whatman, 英国)过滤后, 利用体积比40%的硫酸溶液将pH调整至2.5~3.0, 加入一定量的Na2EDTA和内标储备液;采用Oasis HLB(500 mg/6 mL)萃取柱(Waters, 美国)对目标抗生素进行固相萃取;然后, 用甲醇将HLB萃取柱上的目标抗生素洗脱下来, 用氮气吹干后, 将残留物复溶于体积比40%的甲醇水溶液中.污泥样品在7000 r·min-1下离心15 min后, 污泥固体依次经过冷冻干燥、研磨、过筛, 并向干污泥中加入一定量的内标储备液;以甲醇和0.2 mol·L-1的柠檬酸溶液(1:1, 体积比)作为萃取剂, 通过超声溶剂萃取将目标抗生素提取出来;然后, 按照污水样品处理程序对提取液进行固相萃取、氮吹、复溶等处理.采用超高效液相色谱-质谱联用系统(UPLC-MS/MS)对目标抗生素进行定量分析.其中, 目标抗生素的色谱分离由配备Zorbax SB-C18(100 mm × 2.1 mm, 1.8 μm)色谱柱的安捷伦1290 UPLC系统(美国)完成, 主要操作参数如下:柱温30 ℃, 进样体积10 μL, 纯乙腈和体积比0.2%的甲酸水溶液作为流动相, 二者按一定程序线性梯度混合, 流动相流速为0.3 mL·min-1.质谱为安捷伦6420三重四级杆质谱(美国), 采用电喷雾正离子模式, 在多反应监测模式下对目标抗生素进行定性和定量, 喷雾气压为35 psi, 以氮气作为脱溶剂气(温度300 ℃, 流量12 L·min-1), 毛细管电压为4.0 kV.污水和污泥样品预处理程序的具体步骤及详细的色谱和质谱参数参见文献(Yuan et al., 2014).
3 结果与讨论(Results and discussion) 3.1 污泥减量及污水处理效果SOR工艺将污泥臭氧溶解与活性污泥系统结合起来, 生物反应器内的微生物利用污泥臭氧处理过程中释放出的内源基质进行隐性生长, 从而大幅降低污泥表观生长率.阶段Ⅲ内SOR系统取得了100%的污泥减量率, 而以往研究采用类似策略获得的最大污泥减量率为85%(Qiang et al., 2015).图 2为阶段Ⅰ~Ⅲ内中试系统的污水处理效果.COD、NH3-N、TN和TP去除率在阶段Ⅰ和Ⅲ之间无显著差异(p>0.05), 表明进水中的目标抗生素(各100 μg·L-1)未对常规A/A/O工艺的污水处理效果造成影响.阶段Ⅲ内COD、NH3-N和TN去除率与阶Ⅰ和Ⅲ无显著差异(p>0.05), 而TP去除率明显低于阶段Ⅰ和Ⅲ.因此, SOR工艺在实现剩余污泥零排放的同时, 可以保持与常规A/A/O工艺相近的有机物去除和脱氮性能;然而, 除磷性能较常规A/A/O工艺有所下降, 需要将臭氧处理后污泥上清液除磷与其他除磷方式相结合.
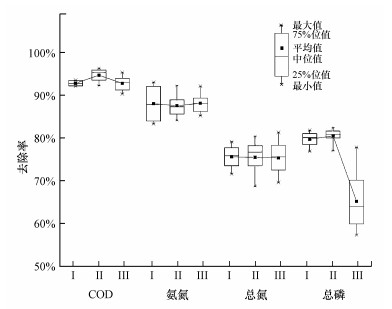 |
| 图 2 中试系统COD、N和P的去除 Fig. 2 Removal of COD, N and P in the pilot-scale system |
污泥培养驯化和阶段Ⅰ的进水中未添加抗生素, 且种泥中抗生素浓度可忽略, 因此, 阶段Ⅰ出水和污泥中均未检出目标抗生素.阶段Ⅲ和Ⅲ出水中目标抗生素浓度变化如图 3a所示.在阶段Ⅲ内, 目标抗生素出水浓度均在较小范围内波动, 表明A/A/O单元中活性污泥对目标抗生素的去除效果保持相对稳定.阶段Ⅲ内目标抗生素出水浓度与阶段Ⅲ无显著差异(p>0.05), 表明臭氧处理后污泥回流没有明显改变活性污泥对目标抗生素的去除能力.在活性污泥工艺中, 目标抗生素主要通过吸附作用转移到污泥中, 而其生物降解可忽略(Wang et al., 2018).目标抗生素在活性污泥中的吸附平衡时间为4 h(Wang et al., 2018), 小于中试系统的水力停留时间(10 h), 因此, 目标抗生素在生物反应器内达到了吸附平衡.在阶段Ⅲ和Ⅲ内, 目标抗生素的进水浓度及A/A/O单元的运行参数均保持一致;而且, 以往研究表明臭氧处理后污泥回流不会对生物反应器内MLSS浓度和污泥特性产生显著影响(Qiang et al., 2015;汪鲁等, 2018), 阶段Ⅲ和Ⅲ内稳定的有机物去除和脱氮能力也印证了这一点.因此, 阶段Ⅲ内活性污泥对目标抗生素的吸附能力与阶段Ⅲ相近, 从而使得两阶段内目标抗生素出水浓度接近.
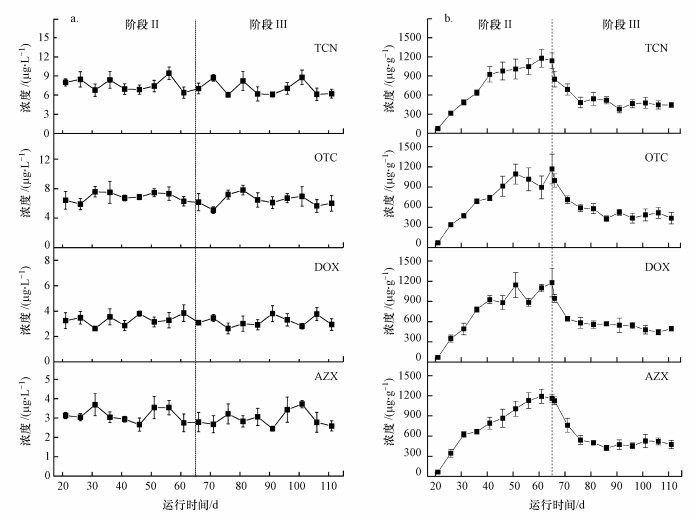 |
| 图 3 中试系统出水中(a)和污泥中(b)目标抗生素浓度 Fig. 3 Target antibiotic concentrations in the effluent (a) and sludge (b) of the pilot-scale system |
图 3b为阶段Ⅲ和Ⅲ内污泥中目标抗生素浓度的变化.在阶段Ⅲ内, 污泥中抗生素浓度先快速上升, 而后上升趋势变缓, 并渐趋于平衡;在阶段Ⅲ内, 抗生素浓度先快速下降, 而后保持稳定状态.由此可见, 与常规A/A/O工艺相比, SOR工艺在不提高目标抗生素出水浓度的前提下, 可以明显降低污泥中目标抗生素的浓度.
3.3 目标抗生素质量衡算目标抗生素随污水进入中试系统的A/A/O单元.在阶段Ⅲ和Ⅲ内, 根据进水浓度和流量可以估算目标抗生素的每日输入量.由于目标抗生素在活性污泥工艺中难以进行生物降解, 因此, 只考虑它们在污泥中的吸附及在臭氧处理单元中的降解.在阶段Ⅲ内, 目标抗生素随出水和剩余污泥排出A/A/O单元.由于阶段Ⅲ内无剩余污泥排放, 且臭氧处理后的污泥全部回流至生物反应器, 因此, 目标抗生素通过出水排放和臭氧降解离开A/A/O单元.
图 4为阶段Ⅲ和Ⅲ内目标抗生素的每日质量衡算, 两阶段内目标抗生素的出水排放量均保持相对稳定.在阶段Ⅲ初期, 污泥中抗生素浓度较低, 其剩余污泥排放量较小, 目标抗生素在生物反应器内逐渐累积;随着运行时间延长, 污泥中抗生素含量逐渐上升, 其剩余污泥排放量也逐渐增加;在阶段Ⅲ末期, 抗生素的剩余污泥排放量达到相对稳定状态, 其输出量与输入量也达到相对平衡.在阶段Ⅲ内, 每天将大约3倍于阶段Ⅲ每日排泥量的污泥用于臭氧处理, 而且污泥中目标抗生素的去除率均超过80%.因此, 阶段Ⅲ初期目标抗生素输出量大于输入量;随着运行时间延长, 抗生素的臭氧降解量逐渐降低, 输出量与输入量趋于平衡.因此, 在A/A/O和SOR工艺长期运行过程中, 目标抗生素的输入和输出渐趋平衡, 这也印证了污水处理厂抗生素迁移转化研究中通常采用的“输入-输出平衡”假设.根据阶段Ⅲ和Ⅲ最后10 d的数据分别估算常规A/A/O和SOR工艺中目标抗生素各输出途径的相对质量负荷, 具体如表 1所示.大部分输入常规A/A/O工艺的目标抗生素(82.3%~91.2%)随剩余污泥排出系统, 而输入SOR工艺的目标抗生素则主要被臭氧降解(91.2%~98.1%).因此, SOR工艺可以大幅削减污水处理厂的抗生素排放量.
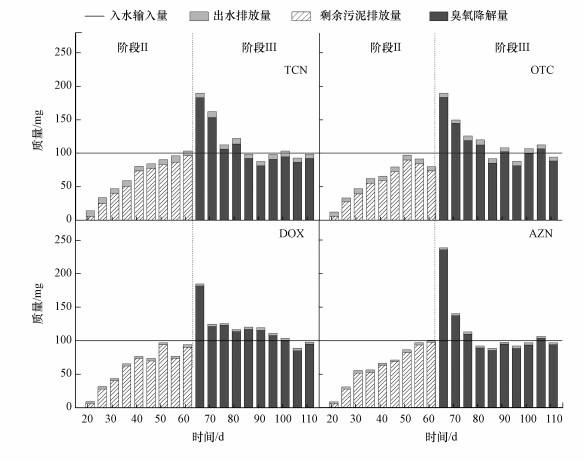 |
| 图 4 中试系统目标抗生素的每日质量衡算 Fig. 4 Daily mass balances of target antibiotics in the pilot-scale treatment system |
| 表 1 目标抗生素出水排放、剩余污泥排放及臭氧降解的相对质量负荷 Table 1 Relative mass loads of target antibiotics in the effluent and excess sludge as well as degraded by ozonation |
本研究表明, SOR工艺可以有效去除进水及污泥中的目标抗生素.然而, 抗生素抗菌活性的变化及其臭氧降解产物的生态毒性仍值得关注.抗生素抗菌活性由其化学结构决定, 根据臭氧攻击位点可以大体判断抗菌活性的变化.图 5为目标抗生素化学结构中的臭氧攻击位点.四环素类抗生素的母核为氢化并四苯, 是其抗菌活性必不可少的骨架单元;C1~C4上的取代基为基本药效基团;C1和C11上的双酮结构对抗菌活性具有重要作用.臭氧为亲电试剂, 容易攻击分子结构中的富电子区域(Wang et al., 2018).四环素类抗生素分子中C2C3和C11aC12双键、C4上的二甲胺基及C6a与C10之间的苯环都是臭氧的攻击位点(Dodd et al., 2006;Dalmazio et al., 2007;Khan et al., 2010;Wang et al., 2011a;2011b;2012;Hopkins et al., 2014).AZN的基本结构单元为十五元酯环, 环内叔胺基为非药效基团, 环外脱氧氨基糖上的二甲氨基为药效基团(Dodd et al, 2006;Ikehata et al., 2006;Lange et al., 2006), 二者均为臭氧的攻击位点.因此, 臭氧处理可以降低目标抗生素的抗菌活性(Dodd et al., 2009), 从而降低它们对环境微生物的选择性压力.然而, 臭氧对目标抗生素的不完全氧化可以产生多种降解产物, 其种类、含量及毒性受pH、臭氧投加量、基质等条件的影响.有研究表明, 臭氧投加量较小时容易生成毒性较大的降解产物, 随着臭氧投加量的增加, 产物的毒性逐渐降低;而且, pH升高通常有利于臭氧处理过程中产物毒性的降低(Lange et al., 2006;Li et al., 2008;Wu et al., 2010;Wang et al., 2011a).然而, 相关研究都是在水相中进行的, 尚缺乏有关SOR工艺中目标抗生素降解产物行为及生态毒性的研究.此外, 有研究表明, 臭氧处理可以提升高浓度抗生素废水的可生化性(Li et al., 2008;Gomez-Pacheco et al., 2011;El-taliawy et al., 2018), 这是由于臭氧可以破坏抗生素分子中一些难生物降解的基团(如苯环), 使得降解产物更容易被微生物利用.因此, SOR工艺可能有效控制目标抗生素臭氧降解产物的潜在环境风险, 这值得进一步考察.
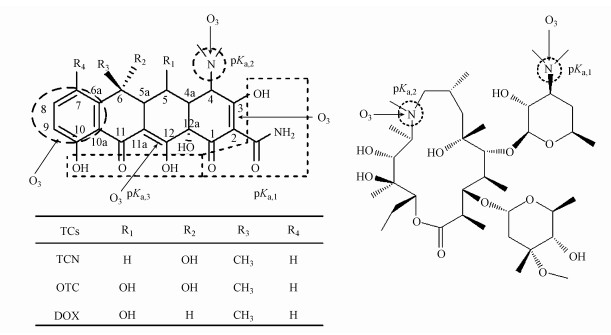 |
| 图 5 目标抗生素分子结构中的臭氧攻击位点 Fig. 5 Potential ozone attack sites in the molecular structures of target antibiotics |
1) SOR工艺可获得100%的污泥减量率, 有机物去除和脱氮性能保持相对稳定, 且与常规A/A/O工艺无显著差别, 但除磷效果有所降低, 需将臭氧处理后污泥上清液除磷与其他除磷方式结合.
2) 与常规A/A/O工艺相比, SOR工艺在不提高出水中目标抗生素浓度的前提下, 可以明显降低污泥中目标抗生素的含量.
3) 在常规A/A/O及SOR工艺运行过程中, 目标抗生素的输入和输出均逐渐达到相对平衡.常规A/A/O工艺中, 随剩余污泥排放的四环素类抗生素和AZN分别占其进水输入量的85.6%和91.2%;SOR工艺进水中94.3%的四环素类抗生素和96.9%的AZN被臭氧降解.
4) 臭氧处理可以降低目标抗生素的抗菌活性, 而目标抗生素臭氧降解产物在SOR工艺中的行为及其生态毒性值得进一步研究.
Dalmazio I, Almeida M O, Augusti R, et al. 2007. Monitoring the degradation of tetracycline by ozone in aqueous medium via atmospheric pressure ionization mass spectrometry[J]. Journal of the American Society for Mass Spectrometry, 18(4): 679–687.
DOI:10.1016/j.jasms.2006.12.001
|
Dodd M C, Buffle M O, von Gunten U. 2006. Oxidation of antibacterial molecules by aqueous ozone:Moiety-specific reaction kinetics and application to ozone-based wastewater treatment[J]. Environmental Science & Technology, 40(6): 1969–1977.
|
Dodd M C, Kohler H P E, von Gunten U. 2009. Oxidation of antibacterial compounds by ozone and hydroxyl radical:Elimination of biological activity during aqueous ozonation processes[J]. Environmental Science & Technology, 43(7): 2498–2504.
|
El-taliawy H, Casas M E, Bester K. 2018. Removal of ozonation products of pharmaceuticals in laboratory moving bed biofilm reactors (MBBRs)[J]. Journal of Hazardous Materials, 347: 288–298.
DOI:10.1016/j.jhazmat.2018.01.002
|
Ganiyu S O, van Hullebusch E D, Cretin M, et al. 2015. Coupling of membrane filtration and advanced oxidation processes for removal of pharmaceutical residues:A critical review[J]. Separation and Purification Technology, 156: 891–914.
DOI:10.1016/j.seppur.2015.09.059
|
Gomez-Pacheco C V, Sanchez-Polo M, Rivera-Utrilla J, et al. 2011. Tetracycline removal from waters by integrated technologies based on ozonation and biodegradation[J]. Chemical Engineering Journal, 178: 115–121.
DOI:10.1016/j.cej.2011.10.023
|
Gothwal R, Shashidhar T. 2015. Antibiotic pollution in the environment:A review[J]. Clean-Soil Air Water, 43(4): 479–489.
DOI:10.1002/clen.v43.4
|
Guo W Q, Yang S S, Xiang W S, et al. 2013. Minimization of excess sludge production by in-situ activated sludge treatment processes:A comprehensive review[J]. Biotechnology Advances, 31(8): 1386–1396.
DOI:10.1016/j.biotechadv.2013.06.003
|
Homem V, Santos L. 2011. Degradation and removal methods of antibiotics from aqueous matrices:A review[J]. Journal of Environmental Management, 92(10): 2304–2347.
DOI:10.1016/j.jenvman.2011.05.023
|
Hopkins Z R, Blaney L. 2014. A novel approach to modeling the reaction kinetics of tetracycline antibiotics with aqueous ozone[J]. Science of the Total Environment, 468: 337–344.
|
Ikehata K, Naghashkar N J, Ei-Din M G. 2006. Degradation of aqueous pharmaceuticals by ozonation and advanced oxidation processes:A review[J]. Ozone-Science & Engineering, 28(6): 353–414.
|
Jiang J Q, Zhou Z, Sharma V K. 2013. Occurrence, transportation, monitoring and treatment of emerging micro-pollutants in waste water:A review from global views[J]. Microchemical Journal, 110: 292–300.
DOI:10.1016/j.microc.2013.04.014
|
Khan M H, Bae H, Jung J Y. 2010. Tetracycline degradation by ozonation in the aqueous phase:Proposed degradation intermediates and pathway[J]. Journal of Hazardous Material, 181(1/3): 659–665.
|
Khursheed A, Kazmi A A. 2011. Retrospective of ecological approaches to excess sludge reduction[J]. Water Research, 45(15): 4287–4310.
DOI:10.1016/j.watres.2011.05.018
|
Lange F, Cornelissen S, Kubac D, et al. 2006. Degradation of macrolide antibiotics by ozone:A mechanistic case study with clarithromycin[J]. Chemosphere, 65(1): 17–23.
DOI:10.1016/j.chemosphere.2006.03.014
|
Li B, Zhang T. 2010. Biodegradation and adsorption of antibiotics in the activated sludge process[J]. Environmental Science & Technology, 44(9): 3468–3473.
|
Li K X, Yediler A, Yang M, et al. 2008. Ozonation of oxytetracycline and toxicological assessment of its oxidation by-products[J]. Chemosphere, 72(3): 473–478.
DOI:10.1016/j.chemosphere.2008.02.008
|
Narumiya M, Nakada N, Yamashita N, et al. 2013. Phase distribution and removal of pharmaceuticals and personal care products during anaerobic sludge digestion[J]. Journal of Hazardous Material, 260: 305–312.
DOI:10.1016/j.jhazmat.2013.05.032
|
Qiang Z M, Wang L, Dong H Y, et al. 2015. Operation performance of an A/A/O process coupled with excess sludge ozonation and phosphorus recovery:A pilot-scale study[J]. Chemical Engineering Journal, 268: 162–169.
DOI:10.1016/j.cej.2015.01.054
|
Qiao M, Ying G G, Singer A C, et al. 2018. Review of antibiotic resistance in China and its environment[J]. Environment International, 110: 160–172.
DOI:10.1016/j.envint.2017.10.016
|
Van Doorslaer X, Dewulf J, Van Langenhove H, et al. 2014. Fluoroquinolone antibiotics:an emerging class of environmental micropollutants[J]. Science of the Total Environment, 500: 250–269.
|
Wang L, Ben W W, Li Y G, et al. 2018. Behavior of tetracycline and macrolide antibiotics in activated sludge process and their subsequent removal during sludge reduction by ozone[J]. Chemosphere, 206: 184–191.
DOI:10.1016/j.chemosphere.2018.04.180
|
汪鲁, 贲伟伟, 李彦刚, 等. 2018. 污泥臭氧原位减量工艺中抗生素的去除[J]. 环境科学, 2018, 39(4): 1739–1747.
|
汪鲁, 强志民, 董慧峪, 等. 2014. 城市污水处理厂污泥臭氧减量技术研究[J]. 环境科学学报, 2014, 34(2): 363–369.
|
Wang L, Qiang Z M, Li Y G, et al. 2017. An insight into the removal of fluoroquinolones in activated sludge process:sorption and biodegradation characteristics[J]. Journal of Environmental Sciences, 56: 263–271.
DOI:10.1016/j.jes.2016.10.006
|
Wang Y, Zhang H, Chen L. 2011. Ultrasound enhanced catalytic ozonation of tetracycline in a rectangular air-lift reactor[J]. Catalysis Today, 175(1): 283–292.
DOI:10.1016/j.cattod.2011.06.001
|
Wang Y, Zhang H, Zhang J H, et al. 2011. Degradation of tetracycline in aqueous media by ozonation in an internal loop-lift reactor[J]. Journal of Hazardous Material, 192(1): 35–43.
|
Wang Y, Zhang H, Chen L, et al. 2012. Ozonation combined with ultrasound for the degradation of tetracycline in a rectangular air-lift reactor[J]. Separation and Purification Technology, 84: 138–146.
DOI:10.1016/j.seppur.2011.06.035
|
Wu J G, Jiang Y X, Zha L Y, et al. 2010. Tetracycline degradation by ozonation, and evaluation of biodegradability and toxicity of ozonation byproducts[J]. Canadian Journal of Civil Engineering, 37(11): 1485–1491.
DOI:10.1139/L10-100
|
Semblante G U, Hai F I, Huang X, et al. 2015. Trace organic contaminants in biosolids:impact of conventional wastewater and sludge processing technologies and emerging alternatives[J]. Journal of Hazardous Materials, 300: 1–17.
DOI:10.1016/j.jhazmat.2015.06.037
|
Yuan X J, Qiang Z M, Ben W W, et al. 2014. Rapid detection of multiple class pharmaceuticals in both municipal wastewater and sludge with ultra high performance liquid chromatography tandem mass spectrometry[J]. Journal of Environmental Sciences, 26(9): 1949–1959.
DOI:10.1016/j.jes.2014.06.022
|
张俊, 杨晓洪, 葛峰, 等. 2014. 长期施用四环素残留猪粪对土壤中耐药菌及抗性基因形成的影响[J]. 环境科学, 2014, 35(6): 2374–2380.
|
张翔宇, 李茹莹, 季民. 2018. 污水生物处理中抗生素的去除机制及影响因素[J]. 环境科学, 2018, 39(11): 5276–5288.
|
 2019, Vol. 39
2019, Vol. 39


