2. 石河子大学医学院附属第一医院, 石河子 832002
2. The First Affiliated Hospital, School of Medicine, Shihezi University, Shihezi 832002
邻苯二甲酸酯(phthalates, PAEs)作为一种增塑剂, 在玩具、食品容器、个人护理产品、医疗设备、电子产品、PVC地板和建筑材料等方面被广泛使用, 添加量从1%~10%(Ma et al., 2014).作为一种半挥发性有机化合物, PAEs与宿主通过范德华力或氢键结合, 在加工、使用、处置的过程中容易迁移至环境中(梁浩花等, 2018), 分布到室内空气和其他表面上.大量的研究已表明室内降尘可以是包括PAEs在内的许多环境污染物的储存场所(Butte et al., 2002; Bi et al., 2015).另一方面, 作为一种潜在的内分泌干扰物, 多项研究已表明PAEs的急性或慢性接触可能对人类健康造成多方面的危害, 包括生殖系统毒性(Liu et al., 2016;Sathyanarayana et al., 2016)、神经发育不良(Kim et al., 2018)和肺功能损害(Lin et al., 2018), 且美国环保署已指出DEHP会对动物和人体造成潜在的癌症效应, 综合风险信息系统(IRIS)已将其列为可能的致癌物(EPA, 2016).此外, 与成年人相比, 由于婴幼儿发育不完全, 且室内暴露时间较长, 口手接触较多, 单位体重的污染物摄入量更大, 而专门针对婴幼儿的研究较少(Gaspar et al., 2014;Bu et al., 2016), 因此应尤为重视该部分人群的室内PAEs暴露风险.
PAEs污染的普遍性及其毒理学证据促使大部分地区已经进行了室内降尘中PAEs浓度水平的测定, 但目前国内有关PAEs污染水平的时间分布特征知之甚少.有学者对悬浮颗粒物(Kong et al., 2013;Chen et al., 2018)、水体(Fan et al., 2008)及室内隔热膜(Huo et al., 2016)中PAEs的季节分布特征进行了研究, 且结果表明PAEs的污染水平具有明显的季节差异性, 但关于住宅降尘中PAEs时间分布特征的研究甚少.国内一项关于天津地区的研究表明PAEs在室内降尘中的浓度存在夏季高于冬季的情况(王夫美等, 2012), 但在新疆地区还没有关于PAEs时间分布特征的相关研究.此前的一项研究还发现, 与北京、上海、济南、齐齐哈尔和济南等5个城市相比, 新疆维吾尔自治区乌鲁木齐市住宅降尘中总PAEs的污染水平最高(Guo et al., 2011), 这可能是由于该地区PAEs的使用量较大造成的.因此, 非常有必要对新疆其他城市开展进一步的研究.
本研究针对新疆石河子市区50户住宅采暖季(10—4月)和非采暖季(5— 9月)降尘中7种PAEs:DMP、DEP、DIBP、DBP、邻苯二甲酸丁苄酯(Butyl phthalate, BBP)、DEHP、邻苯二甲酸二正辛酯(Di-n-octyl phthalate, DNOP)进行检测.DIBP除外, 其他6种PAEs均被美国环保署(U. S. EPA)列为“重点控制污染物”(张文娟等, 2016).分析了石河子市住宅降尘中PAEs的污染水平, 及其在两个时期的时间分布特征, 并对婴幼儿(0~3岁)通过降尘摄入产生的室内暴露风险进行了评估.该研究对全面地了解PAEs在石河子市住宅中的污染特征及潜在的风险, 进一步制定相关标准具有重要的意义.
2 材料与方法(Materials and methods) 2.1 仪器与试剂仪器:超声波清洗器(中国新芝公司); N-EVAPTM 112型氮吹仪(美国Organomation公司); 超纯水制造系统(北京优普公司); Agilent7890A/5975C气相色谱-质谱联用仪(GC/MS)(美国Agilent公司); 恒温振荡器(上海精宏公司).
试剂:二氯甲烷和正己烷; PAEs标准品, 包含:DMP、DEP、DIBP、DBP、BBP、DEHP、DNOP; 内标:苯甲酸苄酯(Benzyl benzoate, BB), 均购自上海百灵威公司.胃蛋白酶、胰酶、胆盐均购自日本东京化成工业公司.苹果酸钠、柠檬酸钠、乳酸、冰醋酸均购自上海国药集团化学试剂有限公司.标准品的纯度均> 98%, 所有溶剂和试剂均为农残级或分析纯.
2.2 样品的采集采样时间和地点:2017年11—12月(采暖季)和2018年8— 9月(非采暖季)分别对石河子市区50户住宅的卧室、客厅及其室外窗台上的降尘进行采集, 共采集了300个样品.
采样方法:使用二氯甲烷萃取清洗过的毛刷从长期未经打扫的室内墙角、门框、家具等平时不易接触的表面和室外窗台上采集降尘样品.样品采集于一片用二氯甲烷清洗过的铝箔纸上, 装入铝箔袋中带回实验室.样品经冷冻干燥后, 用60目不锈钢筛除去毛发等杂物, 然后将样品用铝箔纸包好, 放回铝箔袋中, -20 ℃保存至进一步处理.另外, 采样期间记录室内温度(T).
住宅要求:①采样家庭至少有1名0~3岁婴幼儿; ②最近1年内未装修; ③住宅均位于人口密度较高的市区.
2.3 样品前处理称取0.05~0.2 g样品于30 mL的聚四氟乙烯离心管中, 加入7 mL正己烷:二氯甲烷(V/V=5 : 1)混合液并加盖密封, 超声提取30 min后冷却, 并以6000 r · min-1离心5 min, 移取上清液至20 mL玻璃离心管中.重复提取3次, 合并上清液.在40 ℃下N2吹至约1 mL, 加入5 μg的BB, 正己烷定容至2 mL, 使用0.45 μm聚四氟乙烯(PTFE)膜过滤, 转移至测样瓶中, 待GC/MS检测.
2.4 GC/MS测试条件HP-5MS色谱柱:30 m × 0.25 mm × 0.25 μm; 升温程序:60 ℃, 保持1 min, 以20 ℃ · min-1升至220 ℃, 保持1 min, 以5 ℃ · min-1升至250 ℃, 保持1 min, 以20 ℃ · min-1升至290 ℃, 保持7.5 min; 进样口温度:260 ℃, 离子源温度:230 ℃, 传输线温度:280 ℃, 四级杆温度:150 ℃; 不分流进样, EI电离电压:70 eV, 进样量:1 μL, 载气:高纯氦气, 载气流速:1.0 mL · min-1, 监测方式:SIM.根据标准溶液中各物质的保留时间及扫描离子定性, 用扫描离子和内标法定量.根据标准曲线的最低浓度确定定量限(LOQ), 7种PAEs的定量限为0.05~0.5 μg · g-1.
2.5 质量保证和质量控制(QA/QC)实验过程中严格控制塑料制品的使用, 尽量使用玻璃制品, 且所有的玻璃制品均先于重铬酸钾与浓硫酸配制的洗液中浸泡12 h, 然后分别用自来水、超纯水冲洗干净, 再于马弗炉中400 ℃下烘12 h, 降至室温后用铝箔纸密封好, 使用之前用二氯甲烷清洗.
在进行降尘中各PAEs总量测定实验时, 每批样品(10个)均跟随3个方法空白和3个空白加标(DMP、DEP、BBP、DNOP:1 μg, DIBP、DBP、DEHP:10 μg)实验.方法空白和空白加标中不加入降尘样品, 其他操作与样品处理步骤相同.DMP、DIBP、DBP和DEHP的空白浓度分别为0.009~0.013, 0.153~0.206, 0.901~0.991, 0.361~0.465 μg · mL-1, BBP、DEP和DNOP在空白实验中均未检出.DMP、DEP、DIBP、DBP、BBP、DEHP和DNOP的空白加标回收率分别为(95% ± 6%)、(71% ± 9%)、(82% ± 12%)、(93% ± 10%)、(85% ± 12%)、(90% ± 11%)、(80% ± 10%) (mean ± SD).方法空白的浓度和空白加标回收率用于校正样品的PAEs浓度.为保证方法精确度, 每批样品(10个)检测时跟随3个空白加标, 相对标准偏差(RSD)为2.4%~13.6%, 满足精确度的要求.
2.6 暴露量及风险评估日暴露量:当使用单点进行暴露计算来估计人群的暴露风险时, 会出现很高的不确定度.本研究使用Oracle Crystal Ball软件, 通过Monte Carlo模拟方法对婴幼儿的暴露量进行估计.降尘经口部进入体的日暴露量(DI)由式(1)(Bu et al., 2016)计算得出:
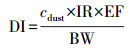
|
(1) |
式中, cdust为室内降尘中PAEs的浓度(μg · g-1); IR为每日摄取室内降尘的量(g · d-1); EF为室内暴露系数(暴露时间占全天的比例); BW为体重(kg).BW和IR值参考美国环保署的人体暴露参数手册(EPA, 2011).通过对研究对象的调查并参考针对中国婴幼儿的其他研究对EF值进行假设(Bu et al., 2016; Fan et al., 2018).假设0~1岁、1~2岁、2~3岁年龄组在室外活动时间分别为2、2、4 h, 卧室暴露时间分别为15、13、11 h, 其他时间均在客厅中活动, 得到卧室和客厅的EF值.上述参数的具体值见表 1.BW为正态分布, IR为对数正态分布(Gaspar et al., 2014; Bu et al., 2016).在Monte Carlo模拟的假设设定中, 用分布拟合DBP和DEHP的浓度数据, 结果显示对数正态分布的拟合度最高, 因此, DBP和DEHP的浓度均采用对数正态分布.进行Monte Carlo模拟时, 输入参数均从概率分布中随机选择.本实验进行100000次(足以达到输入参数的稳定均值和标准差)随机抽样, 计算婴幼儿的暴露量.
| 表 1 不同年龄组的暴露量参数值 Table 1 Mean (CV) values of exposure factors for different age groups |
风险评估:基于California′s Proposition 65 of OEHHA文件来进行DBP的生殖风险和DEHP的癌症风险评估, 方法详情见Gaspar等的研究(Gaspar et al., 2014).采用风险指数HQ分别评估婴幼儿(0~3岁)DBP暴露的生殖风险和DEHP暴露的癌症风险, 其计算方法详见公式(2)和(3).
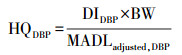
|
(2) |
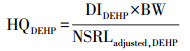
|
(3) |
式中, DIDBP和DIDEHP分别为婴幼儿通过降尘口部摄入的途径产生的DBP和DEHP日摄入量(μg · d-1 · kg-1); MADLadjusted, DBP为DBP的生殖风险安全暴露水平(μg · d-1); NSRLadjusted, DEHP为DEHP的癌症风险安全暴露水平(μg · d-1); MADLadjusted, DBP和NSRLadjusted, DEHP的值见表 2(Gaspar et al., 2014), 当HQ ≥ 1时, 表明存在相应的健康风险; HQ < 1时, 则认为相对安全.另外, 越来越多的证据表明, 利用降尘中污染物的总浓度可能会高估摄入污染物的风险(Ehlers et al., 2003).为了更准确的评估PAEs的暴露风险, 本研究采用基于生理学的提取实验(physiologically based extraction test, PBET)测定降尘中各PAEs的生物可及性(He et al., 2016;Liu et al, 2018), 利用生物可及率作了进一步的暴露风险评估.考虑生物可及性后的风险指数(HQBio)计算方法见公式(4).
| 表 2 婴幼儿特定的MADLs和NSRLs汇总表 Table 2 Summary of child-specific MADLs and NSRLs |
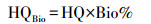
|
(4) |
式中, Bio%为通过生物可及性实验得到的DBP和DEHP的生物可及率.
2.7 统计分析方法使用SPSS 23软件进行统计分析.Shapiro-Wilk检验表明降尘中各PAEs的浓度不符合正态分布, 因此本研究采用相关样本非参数检验的方法:Wilcoxon符号秩检验来分析两个时期各PAEs浓度的差异性及各PAEs生物可及性的差异性.p < 0.05(双尾)则表明具有统计学意义.低于定量限的浓度值在进行统计分析时设为0.
3 结果与讨论(Results and discussion) 3.1 石河子市住宅内PAEs的总体水平及国内外比较石河子市住宅采暖季和非采暖季的卧室、客厅PAEs污染水平见表 3.由表可知, 采暖季和非采暖季DIBP、DBP、DEHP 3种物质在卧室和客厅中的检出率为88.2%~100%, 在大部分住宅中均检出.DMP和DEP在不同时期的检出率差异较大, 采暖季的检出率为70.0%~96.7%, 非采暖季的检出率仅为13.3%~52.9%, 但BBP和DNOP两种物质的检出率在两个时期采集的室内降尘中均低于54.0%.考察Fan等对中国其他城市住宅降尘中PAEs的研究结果, 发现除DBP外, 其他物质的检出率表现出与本研究相同的时间分布特征(Fan et al., 2018).考虑两个时期BBP和DNOP的检出率均比较低, 本研究只针对DMP、DEP、DIBP、DBP、DEHP 5种PAEs开展进一步的分析.在采暖季和非采暖季DEHP均为室内降尘中的主要PAEs物质, 采暖季卧室和客厅中DEHP的浓度中位数值分别为455和462 μg · g-1, 非采暖季卧室和客厅中DEHP的浓度中位数值分别为411和361 μg · g-1.DBP和DIBP的浓度与DEHP相比较低, 但也是主要的两种PAEs物质, 采暖季卧室和客厅中DBP的浓度中位数值分别为166和139 μg · g-1, DIBP的浓度中位数值分别为20.5和16.9 μg · g-1, 非采暖季卧室和客厅中DBP的浓度中位数值分别为94.9和109 μg · g-1, DIBP的浓度中位数值分别为74.9和82.3 μg · g-1.两个时期卧室和客厅降尘中DEHP、DBP和DIBP的浓度和均占总PAEs的99.5%以上, 表明不同时期DEHP、DBP和DIBP均为室内PAEs的主要部分.DMP和DEP在室内降尘中浓度非常低, 中位数浓度范围为nd~0.71 μg · g-1, 接近定量限(0.5 μg · g-1), 检出率易受其浓度变化的影响, 这可能是导致不同时期两种物质检出率差异较大的原因.5种PAEs在住宅降尘中表现出的浓度水平与他们的使用量和自身的理化性质, 如蒸气压、化学稳定性等息息相关(Kashyap et al., 2018).
| 表 3 不同时期石河子市住宅降尘中PAEs的检出率和浓度水平 Table 3 Phthalate concentrations and detection frequency in residential dust in Shihezi during different periods |
石河子市两个时期室内降尘中的PAEs浓度水平与2014年以来国内外相关研究(Blanchard et al., 2014;Mercier et al., 2014;Wang et al., 2014;Bekö et al., 2015;Bu et al., 2016;Li et al., 2016;Luongo and Östman, 2016; He et al., 2016; Wang et al., 2017;刘文龙, 2017; Albar et al., 2017;Subedi et al., 2017)结果的比较见图 1.由图可见, 采暖季石河子市的浓度水平与乌鲁木齐市相当(Guo et al., 2011), 这表明石河子市和乌鲁木齐市住宅中可能具有相同的PAEs污染特征, 且有必要对周边更大的区域进行相关研究, 以确定住宅中较高的PAEs水平是否为整个区域内的普遍现象.与本研究结果相同, 在所有研究结果中DEHP均为首要PAEs污染物(浓度中位数值:73.1~1543 μg · g-1).这与DEHP在国内外普遍的大量使用及较低的蒸气压相关.相反, DMP在国内外研究中浓度普遍较低, 浓度中位数为0.04~3.4 μg · g-1, 与其较高的蒸气压呈负相关.而各研究结果中DEP、DIBP和DBP的浓度均处于DMP和DEHP之间, 表明蒸气压是决定PAEs在降尘中浓度水平的关键因素之一.另外, 由图 1可以看出, 与国内外研究结果相比, 石河子市住宅降尘中采暖季和非采暖季的DIBP浓度均处于较低水平(浓度中位数值分别为16.9~20.5, 74.9~82.3 μg · g-1); DMP和DEP的浓度在不同时期表现出较大的差异, 采暖季两者浓度均处于中等水平, 而非采暖季两者浓度中位数值均低于定量限; 两个时期DEHP的浓度均处于中等水平, 但DBP的浓度在采暖季处于较高水平(浓度中位数值为139~166 μg · g-1), 这可能与石河子市DBP的使用量较大有关.
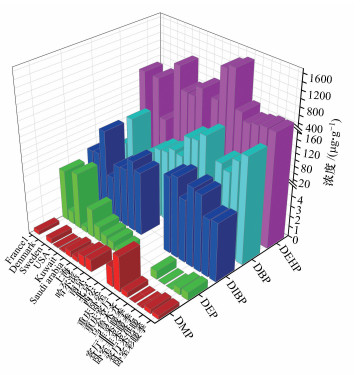 |
| 图 1 近年来国内外住宅内相关研究中PAEs污染水平的比较 Fig. 1 Comparison with phthalate concentrations in dust from residences reported in recent relevant studies |
比较相同采样地点采暖季和非采暖季降尘中PAEs的污染水平, 见图 2.
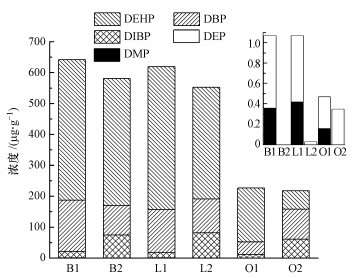 |
| 图 2 石河子市不同时期住宅降尘中PAEs浓度水平的比较 (B、L、O分别指卧室、客厅和室外窗台, 1、2分别指采暖季和非采暖季) Fig. 2 Comparison of PAEs concentration levels in different periods in residential dust in Shihezi |
与天津市住宅降尘中PAEs的浓度水平所表现出的夏季高于冬季的情况不同(王夫美等, 2012), 本研究结果显示除DIBP外, 卧室采暖季(10—4月)PAEs浓度均高于非采暖季(5— 9月), 且具有统计学显著性(p=0.021~0.040)(非采暖季DMP的检出率过低, 未对其进行统计分析).DBP在采暖季的浓度中位数值为166 μg · g-1, 在非采暖季的浓度中位数值为94.9 μg · g-1, DEHP在采暖季的浓度中位数值为455 μg · g-1, 在非采暖季的浓度中位数值为411 μg · g-1, DBP和DEHP在采暖季的浓度均高于非采暖季, 不过值得注意的是DMP和DEP在采暖季的浓度分别为0.36、0.71 μg · g-1, 但在非采暖季的浓度中位数值均低于定量限.客厅降尘中的PAEs污染水平在不同时期表现出的时间分布特征与卧室一致.总体而言, 室内降尘中PAEs浓度表现出采暖季高于非采暖季的趋势, 此趋势对分子质量较小的PAEs物质更加明显.这可能是由于以下原因产生的:①非采暖季室内温度较高, PAEs的蒸气压增大, 增加了半挥发性物质在空气中的分配; ②采暖季居民为了保证室内温度, 很少通风, 不利于污染物的扩散.通过采样时实地检测的室内温度, 发现采暖季室内温度平均值为22.6 ℃, 非采暖季室内温度平均值为24.9 ℃, 两个时期室内温度的差异存在较弱的统计学显著性(p = 0.047).通风频率可能是影响室内降尘中PAEs浓度水平的关键因素.
对于室外窗台而言, DEP在采暖季的浓度中位数值为0.31 μg · g-1, 在非采暖季的浓度中位数值为0.35 μg · g-1, 非采暖季略高于采暖季, 但无统计学显著性(p > 0.05), DIBP和DBP在非采暖季的浓度显著高于采暖季(p=0.021~0.034), 而DMP和DEHP在非采暖季的浓度显著低于采暖季(DEHP: P=0.018).室外窗台降尘中PAEs的浓度水平在采暖季和非采暖季表现出的差异性较复杂, 这与室外干扰因素较多有关, 其中可能包括:①室外雨水冲刷等作用使室外降尘中的PAEs不同程度地流失; ②室外高浓度的羟基自由基(OH)、紫外线可增强PAEs的光降解, 不同PAEs的光降解程度不同(Chen et al., 2018;刘芃岩等, 2008).
3.3 婴幼儿PAEs暴露的健康风险评估本研究基于MADLadjusted, DBP、NSRLadjusted, DEHP, 通过Monte Carlo模拟对0~3岁的婴幼儿进行了生殖风险和癌症风险评估.不考虑生物可及性时, 采暖季和非采暖季3个年龄组(0~1岁、1~2岁、2~3岁)的DBP和DEHP暴露风险指数(HQDBP、HQDEHP)见图 3, 当HQ ≥ 1时, 表明存在相应的健康风险; HQ < 1时, 则认为相对安全.
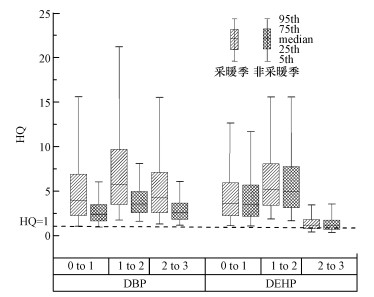 |
| 图 3 不同时期各年龄组婴幼儿的DBP和DEHP暴露风险指数HQ Fig. 3 HQ of DBP and DEHP for infants and young children of different age groups in different periods |
关于DBP暴露生殖风险评估:采暖季3个年龄组DBP暴露的生殖风险指数HQDBP均较大, 中位数值为3.94~5.79, 各年龄组HQDBP差异较小, 0~1岁、1~2岁、2~3岁3个年龄组的HQDBP 均大于1.婴幼儿的DBP暴露水平均超过安全值, 尤其是> 13%的婴幼儿的DBP暴露水平是安全值的10倍以上, 这表明采暖季石河子市住宅中DBP暴露对婴幼儿可能产生极大的生殖风险.非采暖季3个年龄组的HQDBP略低于采暖季, 中位数值为2.62~3.57, 这与非采暖季DBP的浓度水平略低于采暖季有关.但由图可见, 非采暖季几乎所有0~3岁婴幼儿的HQDBP也均大于1.本研究中HQDBP值小于Bu等(2016)的研究(HQDBP = 5.17~6.39), 这是由于Bu等的HQDBP是基于降尘和空气中的DBP经口摄入、皮肤吸附和经呼吸道进入人体等多种途径得到的暴露风险指数, 而本研究仅考虑了降尘中DBP经口摄入这一种途径.不过, 虽未考虑其他途径, 仍可看出采暖季和非采暖季室内DBP暴露可能会对石河子市婴幼儿产生较大的生殖风险.
关于DEHP暴露癌症风险评估:采暖季3个年龄组DEHP暴露的癌症风险指数HQDEHP中位数值为1.19~5.22, 各年龄组的HQDEHP小于Bu等的研究结果(2.71~7.39).各年龄组癌症风险指数由大到小为1~2岁> 0~1岁> 2~3岁, 2~3岁年龄组的HQDEHP远远小于0~2岁年龄组, 这与该年龄组每日摄入量除以较大的BW有关.0~1岁、1~2岁、2~3岁3个年龄组中, HQDEHP > 1的比例分别为96.6%、99.7%、61.1%, 表明DEHP室内暴露可能对石河子市几乎所有0~2岁婴幼儿产生癌症风险, 0~1岁和1~2岁年龄组的HQDEHP中位数值分别为3.62、5.22.非采暖季各年龄组DEHP的暴露风险指数与采暖季相当, 中位数值为1.11~4.93, 其中0~1岁和1~2岁年龄组的HQDEHP中位数值分别为3.51、4.93.因此, 石河子市采暖季和非采暖季DEHP室内暴露可能会对0~2岁婴幼儿产生较大的癌症风险.
通过PBET法初步估计室内降尘样品中DBP和DEHP的生物可及率, 具体值见表 4.采暖季和非采暖季DBP的生物可及率平均值分别为13.4%和19.1%, 均远高于He等(2016)的研究结果(3.06%), DEHP的生物可及率平均值分别为5.86%和7.51%, 远高于He等(2016)的研究结果(1.21%).本研究结果中DEHP的生物可及率远小于DBP(p < 0.01), 与He等的结果相同, 且采暖季均小于非采暖季.有研究表明室内降尘中PAEs生物可及性的差异与降尘的粒径特征(Wang et al., 2013)、降尘中总有机碳的含量(He et al., 2016)有关.考虑生物可及性后, 采暖季和非采暖季各年龄组婴幼儿的DBP和DEHP暴露风险指数(HQDBP, Bio、HQDEHP, Bio)见图 4.由图可知, 考虑降尘样品中PAEs的生物可及性后, 采暖季和非采暖季DBP暴露的生殖风险中位数值HQDBP, Bio分别为0.53~0.78和0.46~0.68, HQDBP, Bio虽远小于HQDBP, 但仍有8%~37%的婴幼儿可能存在生殖风险.采暖季和非采暖季DEHP暴露的癌症风险指数HQDEHP, Bio中位数值分别为0.07~0.31和0.08~0.37.非采暖季1~2岁年龄组中仅有7.6%的HQDEHP, Bio值> 1, 其他年龄组的HQDEHP, Bio值在两个时期均小于1, 表明考虑生物可及性后, 几乎所有婴幼儿均不存在室内DEHP暴露导致的癌症风险.因此, 在暴露风险评估时, 考虑污染物的生物可及性是非常必要的.
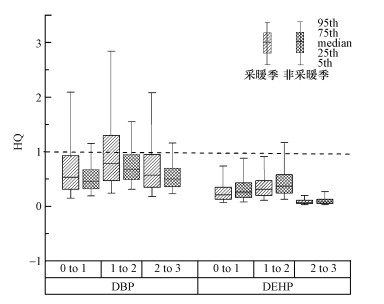 |
| 图 4 考虑生物可及性后不同时期各年龄组婴幼儿的DBP和DEHP暴露风险指数HQ Fig. 4 HQ of DBP and DEHP for infants and young children of different age groups during different periods after considering the bioaccessibility |
| 表 4 不同时期石河子市住宅降尘中DBP和DEHP的生物可及率 Table 4 Bioavailabilityof DBP and DEHP in residential dust in Shihezi in different periods |
本研究在进行暴露风险评估时, 不可避免地会产生不确定性.①婴幼儿的暴露参数, 如体重(BW)和日降尘摄入量(IR)的取值参考了美国环保署暴露参数手册中的推荐值(EPA 2011).虽然大量关于中国人群的研究证明该方法是可行的(Bu et al., 2016; Wang et al., 2017; Hou et al., 2018), 但实际上, 由于饮食习惯的不同, 中国和美国婴幼儿的实际情况是有差异的.因此, 直接采用美国婴幼儿的相关参数可能会使暴露量的计算存在小的偏差.②对于婴幼儿在不同房间的暴露系数(EF), 目前各个国家还没有权威的推荐值.在暴露量计算时, 假设婴幼儿在住宅内的所有活动均在卧室和客厅中进行, 参考两项针对中国婴幼儿的研究(Bu et al., 2016; Hou et al., 2018), 并结合实际情况对各年龄组婴幼儿在卧室和客厅暴露时间进行了固定值假设.但即使是同一个年龄组, 每个婴幼儿在各个房间的暴露时间受复杂因素的影响, 难免存在差异.③虽然本研究在一定程度上说明考虑污染物的生物可及性对于准确地开展暴露风险评估是非常重要的.但与体内吸收代谢过程相比, 体外方法仅关注污染物从降尘到胃肠溶液的过程, 没有考虑胃肠细胞对污染物的摄取和代谢(Rostami et al., 2011).因此, 在未来的研究中需进一步地开展活体实验, 对体外生物可及性测量的方法进行验证, 更加准确地评估暴露风险.
4 结论(Conclusions)1) 不同时期DIBP、DBP和DEHP均为室内PAEs的主要成分, 占总PAEs浓度的比例均>99.5%, 其中DEHP为石河子市住宅降尘中首要的PAEs物质.与国内外研究结果相比, 石河子市住宅降尘中DIBP的浓度在两个时期均处于较低水平(16.9~82.3 μg · g-1), DBP的浓度在采暖季处于较高水平(139~166 μg · g-1), DEHP的浓度均处于中等水平(361~462 μg · g-1).
2) 除DIBP外, 采暖季室内环境降尘中各PAEs的浓度高于非采暖季, 且具有统计学显著性(p < 0.05), 这可能与采暖季室内通风频率较小, 不利于污染物的扩散有关.
3) 对婴幼儿的健康风险评估表明, 采暖季和非采暖季石河子市住宅内DBP暴露可能会对0~3岁婴幼儿产生较大的生殖风险, HQDBP = 2.62~5.79;DEHP暴露可能会对0~2岁婴幼儿产生较大的癌症风险, HQDEHP = 3.51~5.22.考虑降尘中DBP和DEHP的生物可及性后, HQ Bio均远小于HQ值, 仍有部分婴幼儿(8%~37%)可能存在DBP暴露导致的生殖风险, 几乎所有婴幼儿无DEHP暴露导致的癌症风险.这表明暴露风险评估时, 考虑生物可及性是非常必要的.
Albar H M S A, Ali N, Shahzad K, et al. 2017. Phthalate esters in settled dust of different indoor microenvironments; source of non-dietary human exposure[J]. Microchemical Journal, 132: 227–232.
DOI:10.1016/j.microc.2017.02.008
|
Bekö G, Callesen M, Weschler C J, et al. 2015. Phthalate exposure through different pathways and allergic sensitization in preschool children with asthma, allergic rhinoconjunctivitis and atopic dermatitis[J]. Environmental Research, 137: 432–439.
DOI:10.1016/j.envres.2015.01.012
|
Bi C Y, Liang Y R, Xu Y. 2015. Fate and transport of phthalates in indoor environments and the influence of temperature:A case study in a test house[J]. Environmental Science & Technology, 49(16): 9674–9681.
|
Blanchard O, Glorennec P, Mercier F, et al. 2014. Semivolatile organic compounds in indoor air and settled dust in 30 French dwellings[J]. Environmental Science & Technology, 48(7): 3959–3969.
|
Bu Z M, Zhang Y P, Mmereki D, et al. 2016. Indoor phthalate concentration in residential apartments in Chongqing, China:Implications for preschool children's exposure and risk assessment[J]. Atmospheric Environment, 127: 34–45.
DOI:10.1016/j.atmosenv.2015.12.010
|
Butte W, Heinzow B. 2002. Pollutants in house dust as indicators of indoor contamination[J]. Reviews of Environmental Contamination and Toxicology, 175(1): 1–46.
|
Chen Y, Lv D, Li X, et al. 2018. PM2.5-bound phthalates in indoor and outdoor air in Beijing:Seasonal distributions and human exposure via inhalation[J]. Environmental Pollution, 241: 369–377.
DOI:10.1016/j.envpol.2018.05.081
|
Ehlers L J, Luthy R G. 2003. Contaminant bioavailability in soil and sediment[J]. Environmental Science & Technology, 37(15): 295A.
|
EPA U.S. 2011. Exposure factors handbook. Environmental Protection Agency Web[OL].2019-01-10. https://cfpub.epa.gov/si/si_public_record_report.Cfm?Lab=NCEA&Direntryid=236252
|
EPA U.S. 2016. Di(2-ethylhexyl) phthalate (DEHP). Environmental Protection Agency Web[OL]. 2019-01-10. https://19january2017snapshot.epa.gov/sites/production/files/2016-09/documents/bis-2-ethylhexyl-phthalate.pdf
|
Fan G, Xie J C, Yoshino H, et al. 2018. Common SVOCs in house dust from urban dwellings with schoolchildren in six typical cities of China and associated non-dietary exposure and health risk assessment[J]. Environment International, 120: 431–442.
DOI:10.1016/j.envint.2018.08.031
|
Fan W, Xia X, Sha Y. 2008. Distribution of phthalic acid esters in Wuhan section of the Yangtze River, China[J]. Journal of Hazardous Materials, 154(1): 317–324.
|
Gaspar F W, Castorina R, Maddalena R L, et al. 2014. Phthalate exposure and risk assessment in California child care facilities[J]. Environmental Science & Technology, 48(13): 7593–7601.
|
Guo Y, Kannan K. 2011. Comparative assessment of human exposure to phthalate esters from house dust in China and the United States[J]. Environmental Science & Technology, 45(8): 3788–3794.
|
He R, Li Y, Xiang P, et al. 2016. Organophosphorus flame retardants and phthalate esters in indoor dust from different microenvironments:Bioaccessibility and risk assessment[J]. Chemosphere, 150: 528–535.
DOI:10.1016/j.chemosphere.2015.10.087
|
Hou M M, Wang Y, Zhao H X, et al. 2018. Halogenated flame retardants in building and decoration materials in China:Implications for human exposure via inhalation and dust ingestion[J]. Chemosphere, 203: 291–299.
DOI:10.1016/j.chemosphere.2018.03.182
|
Huo C Y, Liu L Y, Zhang Z F, et al. 2016. Phthalate esters in endoor window films in a northeastern Chinese urban center:Film growth and implications for human exposure[J]. Environmental Science & Technology, 50(14): 7743–7751.
|
Kashyap D, Agarwal T. 2018. Concentration and factors affecting the distribution of phthalates in the air and dust:A global scenario[J]. Science of the Total Environment, 635: 817–827.
DOI:10.1016/j.scitotenv.2018.04.158
|
Kim S, Eom S, Kim H J, et al. 2018. Association between maternal exposure to major phthalates, heavy metals, and persistent organic pollutants, and the neurodevelopmental performances of their children at 1 to 2 years of age- CHECK cohort study[J]. Science of the Total Environment, 624: 377–384.
DOI:10.1016/j.scitotenv.2017.12.058
|
Kong S F, Ji Y Q, Liu L L, et al. 2013. Spatial and temporal variation of phthalic acid esters (PAEs) in atmospheric PM10 and PM2.5 and the influence of ambient temperature in Tianjin, China[J]. Atmospheric Environment, 74: 199–208.
DOI:10.1016/j.atmosenv.2013.02.053
|
Li H L, Song W W, Zhang Z F, et al. 2016. Phthalates in dormitory and house dust of northern Chinese cities:Occurrence, human exposure, and risk assessment[J]. Science of the Total Environment, 565: 496–502.
DOI:10.1016/j.scitotenv.2016.04.187
|
Lin L Y, Tsai M S, Chen M H, et al. 2018. Childhood exposure to phthalates and pulmonary function[J]. Science of the Total Environment, 615: 1282–1289.
DOI:10.1016/j.scitotenv.2017.08.318
|
Liu R, He R, Cui X, et al. 2018. Impact of particle size on distribution, bioaccessibility, and cytotoxicity of polycyclic aromatic hydrocarbons in indoor dust[J]. Journal of Hazardous Materials, 357: 341–347.
DOI:10.1016/j.jhazmat.2018.05.058
|
Liu R, Jian Z, Yang D, et al. 2016. Di(2-ethylhexyl) phthalate induced reproductive toxicity involved in DNA damage-dependent oocyte apoptosis using alternative Caenorhabditis elegans model[J]. Toxicology Letters, 258: S70–S71.
|
梁浩花, 王亚娟, 陶红, 等. 2018. 银川市东郊设施蔬菜基地土壤中邻苯二甲酸酯污染特征及健康风险评价[J]. 环境科学学报, 2018, 38(9): 3703–3713.
|
Luongo G, Östman C. 2016. Organophosphate and phthalate esters in settled dust from apartment buildings in Stockholm[J]. Indoor Air, 26(3): 414–425.
|
刘文龙. 2017.上海城区室内灰尘中双酚A和邻苯二甲酸酯的研究[D].上海: 上海大学
http://cdmd.cnki.com.cn/Article/CDMD-10280-1018701691.htm |
刘芃岩, 冯关涛, 刘金巍, 等. 2008. 邻苯二甲酸酯的光降解研究[J]. 环境科学学报, 2008, 29(5): 1049–1055.
|
Ma W L, Subedi B, Kannan K. 2014. The occurrence of bisphenol A, phthalates, parabens and other environmental phenolic compounds in house dust:A review[J]. Current Organic Chemistry, 18(17): 2182–2199.
DOI:10.2174/1385272819666140804230205
|
Mercier F, Gilles E, Saramito G, et al. 2014. A multi-residue method for the simultaneous analysis in indoor dust of several classes of semi-volatile organic compounds by pressurized liquid extraction and gas chromatography/tandem mass spectrometry[J]. Journal of Chromatography A, 1336(7): 101–111.
|
Rostami L, Juhasz A L. 2011. Assessment of persistent organic pollutant (POP) bioavailability and bioaccessibility for human health exposure assessment:A critical review[J]. Critical Reviews in Environmental Science & Technology, 41: 623–656.
|
Sathyanarayana S, Grady R, Barrett E S, et al. 2016. First trimester phthalate exposure and male newborn genital anomalies[J]. Environmental Research, 151: 777–782.
DOI:10.1016/j.envres.2016.07.043
|
Subedi B, Sullivan K D, Dhungana B. 2017. Phthalate and non-phthalate plasticizers in indoor dust from childcare facilities, salons, and homes across the USA[J]. Environmental Pollution, 230: 701–708.
DOI:10.1016/j.envpol.2017.07.028
|
Wang L, Gong M, Xu Y, et al. 2017. Phthalates in dust collected from various indoor environments in Beijing, China and resulting non-dietary human exposure[J]. Building and Environment, 124: 315–322.
DOI:10.1016/j.buildenv.2017.08.006
|
Wang W, Wu F Y, Huang M J, et al. 2013. Size fraction effect on phthalate esters accumulation, bioaccessibility and in vitro cytotoxicity of indoor/outdoor dust, and risk assessment of human exposure[J]. Journal of Hazardous Materials, 261: 753–762.
DOI:10.1016/j.jhazmat.2013.04.039
|
Wang X K, Tao W, Xu Y, et al. 2014. Indoor phthalate concentration and exposure in residential and office buildings in Xi'an, China[J]. Atmospheric Environment, 87: 146–152.
DOI:10.1016/j.atmosenv.2014.01.018
|
张文娟, 王利军, 王丽, 等. 2016. 西安城区地表灰尘中邻苯二甲酸酯分布_来源及人群暴露[J]. 环境科学, 2016, 37(10): 3758–3765.
|
王夫美, 姬亚芹, 陈丽, 等. 2012. 住宅室内降尘中邻苯二甲酸酯污染特征及暴露评价[J]. 中国环境科学, 2012, 32(5): 780–786.
DOI:10.3969/j.issn.1000-6923.2012.05.002 |
 2019, Vol. 39
2019, Vol. 39


