2. 东北电力大学化学工程学院, 吉林 132012;
3. 北京市北运河管理处, 北京 101100
2. Chemical Engineering College, Northeast Electric Power University, Jilin 132012;
3. Beijing North Canal Management Division, Beijing 101100
随着工农业的快速发展, 我国磷的排放量也急剧增加, 进而引起水体中磷含量过高.磷是引起水体富营养化的重要因素之一, 当水体中磷的浓度超过0.03 mg·L-1时, 就容易造成藻类与水生植物大量繁殖(Lu et al., 2016).另一方面, 自然界中的磷也是一种不可再生资源.不同于石化资源, 没有任何物质能够代替磷在工业和农业生产中的作用(Matsubae et al., 2016).我国磷资源总体上处于紧张状态, 据统计数据, 我国磷储备量仅占世界储量4.6%, 按照静态储采比计算仅够开采26.8 a(马鸿文等, 2017).
当前, 我国环保领域废水处理还主要以除磷为主, 磷回收利用还存在严重不足.从水体中回收磷元素正是磷资源重复利用和提升水体水质的有效途径(Mayer et al., 2016), 直接从受污染水体或废水中回收磷, 潜力巨大(Mehta et al., 2015; Zhou et al., 2017), 以北运河(北京段)为例, 总磷仍然是影响河流水质的主要污染物之一(北京市生态环境局, 2019).
海绵铁是一种新型零价铁材料, 它具有低碳多孔、比表面积大、价格低廉、不易板结、活性铁含量高等优点, 并且还有较强的电化学富集、物理吸附及絮凝沉淀特性.海绵铁目前多用于工业用水除氧, 已有研究表明海绵铁具有良好的吸附除磷特性(范军辉等, 2016;钟丽燕等, 2017), 但对海绵铁进行改性以提升其磷吸附性能, 构建基于海绵铁渗滤床去除并回收磷产品的研究尚未开展.因此, 本文研究了海绵铁改性方法并探讨了改性前后海绵铁的吸附动力学特性, 考察了基于改性海绵铁的渗滤床动态除磷特性, 探讨了海绵铁再生活化方法, 以及磷资源回收制备鸟粪石方法.
2 材料与方法(Materials and methods) 2.1 材料试剂与仪器本实验中使用的海绵铁购自某粉末冶金厂, 外观呈灰黑色, 内部多孔似海绵状, 主要成分为铁单质, 其活性铁含量>90%, 容重为2.2 g·cm-3, 粒径为5~8 mm.磷的测定采用钼酸铵分光光度法, 分光光计(HACH-DR600);pH的测定采用PB-10型酸度计;鸟粪石的表征采用X射线粉末衍射仪(X′ Pert PRO MPD, PANalytical).本文中使用的药剂除特殊说明外, 皆为分析纯.
2.2 海绵铁的改性及磷吸附动力学采用硫酸对海绵铁改性:用去离子水冲洗海绵铁3遍, 去除表面污垢及杂质, 然后将海绵铁浸入6%硫酸溶液中, 活化0.5 h, 期间搅拌混匀, 然后用去离子水冲洗海绵铁至中性, 在将其于105 ℃烘干1 h, 待用.
静态吸附实验:分别取4 g改性前后海绵铁颗粒, 置于250 mL锥形瓶中, 加入不同浓度的含磷溶液150 mL, 放入摇床中恒温25 ℃以150 r·min-1速度连续振荡, 每隔一定时间间隔取样, 测定溶液含磷量, 计算出海绵铁对磷的吸附量q, 绘制吸附速率曲线和吸附等温线.海绵铁磷吸附量q计算公式如下所示:
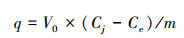
|
(1) |
式中, q为单位海绵铁磷吸附量(mg·g-1);m为海绵铁质量(g);Cj、Ce分别为溶液中磷的初始和平衡浓度(mg·L-1);V0为含磷溶液体积(L).
2.3 海绵铁解吸及再活化取10 g改性海绵铁置于250 mL锥形瓶中, 加入100 mL用KH2PO4配制的磷浓度为1000 mg·L-1的溶液, 连续振荡12 h, 直至海绵铁吸附容量达到饱和, 测定液相磷含量, 按照式(1)计算出单位重量海绵铁的磷吸附量qa0.
收集上述达到吸附饱和的海绵铁, 先用去离子水冲洗3遍, 加入一定体积的NaOH作为解吸液, 以150 r·min-1速度恒温(25 ℃)连续振荡12 h, 分离上清液, 测定液相磷浓度C, 计算可得单位改性海绵铁磷解吸量qd、解吸率Zd;对解吸后改性海绵铁用6%硫酸进行再活化, 经干燥后得到再生后的改性海绵铁, 在与qa0相同试验条件下重新进行静态吸附试验, 得到吸附剂再生后的吸附量qal.单位改性海绵铁磷解吸量qd、解吸率Zd、再生后吸附剂的活化率Zr计算方法如下:

|
(2) |

|
(3) |
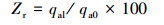
|
(4) |
式中, qd为单位改性海绵铁磷解吸量(mg·g-1);Zd为解吸率;Zr为再生后吸附剂的活化率;V为解吸液体积(L);C为碱再生废液磷浓度(mg·L-1);m为饱和改性海绵铁质量(g);qal为再生后单位改性海绵铁磷吸附量(mg·g-1);qa0为单位改性海绵铁磷吸附量(mg·g-1).每个条件重复3次.
2.4 海绵铁除磷渗滤床连续流除磷实验海绵铁除磷渗滤床采用有机玻璃构造, 内径10 cm, 高度100 cm, 内部填充高60 cm海绵铁, 有效容积为1.7 L, 运行方式为连续下向流.为了考察基于海绵铁的渗滤床在动态连续流条件下对磷的去除性能及富集磷的潜能, 本研究采用了较高的进水磷负荷, 通过向自来水中加入一定量的KH2PO4模拟含磷水体, 含磷量约为10 mg·L-1, 运行水力停留时间HRT=1 h, 温度25 ℃.当磷去除率趋于稳定后, 停止运行, 用1 mol·L-1氢氧化钠对海绵铁进行解吸, 然后用6%浓度硫酸进行再活化, 并开始下一周期的动态除磷实验.
2.5 碱再生废液回收磷制取鸟粪石将2.3节中所产生的碱再生废液移至300 mL烧杯中, 开动电动搅拌器, 搅拌速度150 r·min-1, 用硫酸调节再生液至预期pH.测定碱再生废液的磷浓度C0, 按照设计的不同镁、磷、氮摩尔比, 相隔10 min依次投加铵盐、镁盐, 反应结束后静置30 min.从烧杯中取上清液经孔径为0. 45 μm的滤膜过滤, 测定其磷含量Ce, 应用式(5)计算磷回收率η.用2 μm的定量滤纸进行固液分离, 所得沉淀物于40 ℃下恒温干燥48 h, 再放入干燥器中保存.
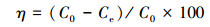
|
(5) |
式中, η为磷回收率;C0和Ce分别为碱再生废液中磷的初始浓度和生成鸟粪石后的剩余磷浓度(mg·L-1).在该研究中每个条件实验重复3次.
3 结果与讨论(Results and discussion) 3.1 海绵铁磷吸附动力学 3.1.1 吸附时间对磷吸附量的影响用改性前后的海绵铁进行了磷吸附动力学对比实验.海绵铁磷吸附容量随时间变化如图 1所示.
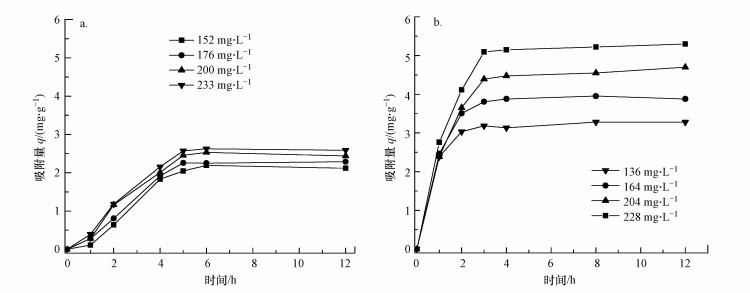 |
| 图 1 吸附时间对磷吸附量的影响(a.未改性海绵铁, b.改性海绵铁) Fig. 1 Time curve of phosphorus adsorption with (a.unmodified sponge iron, b. modified sponge iron) |
由图 1可见, 不同初始磷浓度下, 海绵铁对磷的吸附量随吸附时间的增加而增加, 经过一段时间后趋于平衡.未改性海绵铁经历6 h达到吸附平衡, 而改性海绵铁达到平衡时间缩减至4 h.在吸附过程前期, 海绵铁对磷的吸附速率最快, 磷去除率达到90%.可能是因为吸附初期海绵铁表面的吸附点位较多, 固相液相表面离子浓度差较大, 磷容易结合到海绵铁表面(Xiong et al., 2017).随着海绵铁表面吸附位点的减少, 吸附速率变慢并达到吸附饱和.
3.1.2 吸附等温线吸附等温线体现了吸附材料吸附能力的强弱, 反应体系中平衡浓度与表面吸附量之间的关系(Lai et al., 2016).Langmuir吸附等温式基于吸附剂表面是均质的和吸附质分子间无相互作用两个基本假设, 其主要用于单分子层吸附的拟合;Freundlich吸附等温式则适用于非均质或多层吸附的拟合.按照1.2节中的方法, 改性前后海绵铁对磷的吸附等温线分别采用Langmuir方程和Freundlich方程进行拟合分析, 式(6)为Langmuir吸附等温式线性形式, 式(7)为Freundlich吸附等温式线性形式:
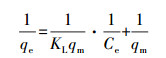
|
(6) |
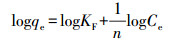
|
(7) |
式中, qe为吸附平衡时对磷的吸附量(mg·g-1);Ce为磷吸附达到平衡时的浓度(mg·L-1);qm为理论最大吸附量(mg·g-1);KL为Langmuir吸附速率常数(L·mg-1);KF为吸附平衡常数(mg·g-1·mgn·L-n), n为吸附强度指数.
从图 2和表 1可以看出改性前后海绵铁对磷的吸附表现为非线性吸附, Langmuir和Freundlich吸附等温式拟合系数均大于0.95, 均能较好地拟合海绵铁磷吸附过程.但海绵铁磷吸附过程更符合Freundlich吸附等温式, 表明该液/固吸附过程较为复杂, 吸附和改性过程中海绵铁表面可能有腐蚀缺陷和铁氧化物产生形成非均质表面, 单层吸附和多层吸附同时存在.
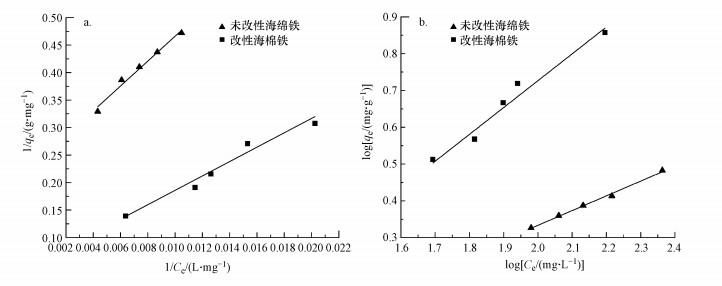 |
| 图 2 海绵铁对磷的吸附等温线(a.Langmuir拟合, b. Freundlich拟合) Fig. 2 Adsorption isotherm of phosphorus by sponge iron (a. Langmuir isotherm, b. Freundlich isotherm) |
| 表 1 海绵铁吸附磷的等温方程参数 Table 1 Isotherm parameters of phosphorus adsorption by iron sponge |
从Langmuir吸附等温式可知对海绵铁进行改性可以提高海绵铁的理论磷吸附容量, 改性前理论最大吸附量为4.17 mg·L-1, 改性后提升到18.18 mg·L-1, 提高了335%.改性后海绵铁磷吸附能力的提升主要是由于酸改性后海绵铁表面生成更多的铁氧化物, 铁氧化物的增多使配位体交换反应更容易发生, 海绵铁表面活性点位增加.Freundlich吸附等温式的n与吸附的难易程度有关, 改性前后n均大于1, 表明材料有较好的吸附性能, 吸附易于进行(Wang et al., 2013).
3.2 海绵铁的解吸及再活化取吸附饱和改性海绵铁10 g进行再生, 再生液分别为H2SO4溶液、HCl溶液(mol·L-1)和NaOH溶液(mol·L-1), 再生液中的H2SO4溶液、HCl溶液及NaOH溶液的不同浓度再生液对解吸率的影响见图 3.
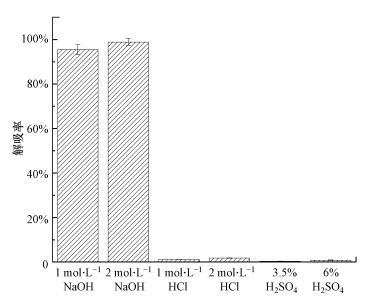 |
| 图 3 不同溶液对饱和改性海绵铁的解吸能力 Fig. 3 Desorption of saturated modified sponge iron by different solutions |
从图 3的结果可以看出, H2SO4溶液、HCl溶液几乎没有对磷的脱附解吸能力;2 mol·L-1的NaOH溶液对磷的脱附解吸效果最佳, 但相比于1 mol·L-1的NaOH溶液的解吸率提升不高.综合考虑选用1 mol·L-1的NaOH溶液作为解吸液可以达到效率和经济的平衡.
磷解吸后还应进行再活化以恢复海绵铁的吸附性能, 不同溶液的再活化效果如图 4所示.未进行再活化的海绵铁吸附活性为吸附前的33.8%, 磷吸附能力相比初始海绵铁显著下降.相比于盐酸, 硫酸的活化效果更优, 用6% H2SO4进行改性海绵铁再活化后, 其活化率可达98.2%, 海绵铁磷吸附能力有明显恢复.
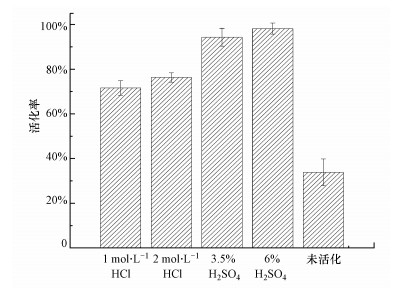 |
| 图 4 不同溶液对解吸后海绵铁再活化能力 Fig. 4 Reactivation ability of sponge iron after desorption by different solutions |
海绵铁的主要成分是零价铁, 因此二者具有相似的除磷机制, 可能有:①海绵铁表面的铁氧化物解离或单质铁腐蚀析出铁离子, 与磷酸盐发生化学反应生成难溶性的盐, 如FePO4、Fe3(PO4)2等(Du et al., 2017);②铁离子通过水解及聚合反应生成较长线性结构的多核羟基络合物, 与磷酸盐发生配位交换作用(李杰等, 2013), 如公式(8)所示;③酸性条件下, 海绵铁会结合质子带正电, 从而与带负电荷的磷酸根离子发生静电吸附(吴秋月等, 2015).
零价铁除磷过程中, 磷元素价态一般不发生改变, 主要以磷酸盐形式存在(张颖纯等, 2015).海绵铁在不同的氧化还原及介质环境中存在复杂的界面过程.因此, 处于渗滤床不同空间位置的海绵铁, 其表面发生的反应过程可能不同, 本研究并未对其作逐一分析.如果海绵铁表面结合的磷主要以FePO4、Fe3(PO4)2为主, 则采用酸可以将其解吸.但本研究发现, 硫酸对海绵铁表面吸附的磷的解吸率很低, 不足1%, 由此推断海绵铁吸附的磷并非FePO4、Fe3(PO4)2为主.相反, 利用NaOH溶液解吸时, 解吸率高达95.5%, OH-可以破坏了海绵铁表面配位体与磷酸盐相结合的状态, OH-与海绵铁表面结合的磷酸盐竞争吸附点位, 使磷脱附下来(Almeelbi et al., 2012).由此可以初步推断, 磷酸盐与海绵铁表面的羟基络合物通过配位交换作用结合, 是本研究中磷脱除的主要机制.这与Wen对于纳米零价铁除磷机理的研究(Wen et al., 2014)相同.
3.3 海绵铁渗滤柱连续流动态除磷研究利用海绵铁构建了除磷渗滤床系统, 通过连续流实验考察了海绵铁动态除磷特性及再生除磷.磷去除率与运行时间的关系见图 5.
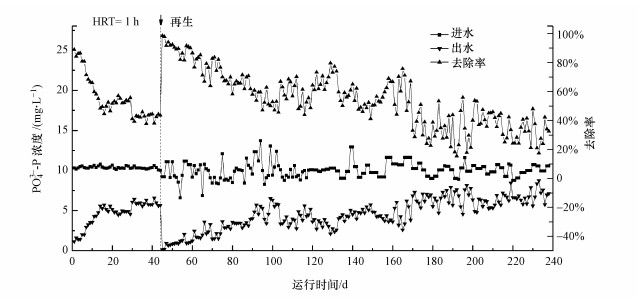 |
| 图 5 海绵铁渗滤柱连续流动态除磷 Fig. 5 Continuous operation of phosphorus removal by sponge iron infiltration column |
整个运行分为两个阶段, 初始运行阶段和再生后运行阶段.运行初始阶段, 海绵铁渗滤床磷去除率较高, 可以达到90%, 随着时间延长, 磷去除开始下降, 当运行至第18 d, 磷去除率下降并稳定到50%左右.运行至第43 d, 依次采用NaOH和H2SO4对海绵铁渗滤床进行原位磷解吸及活化, 然后继续开始再生后运行阶段.再生后系统除磷能力恢复, 初始磷去除率可达到90%以上.随着时间运行, 磷去除率逐渐下降, 当运行100 d时, 磷去除率下降至约60%.与再生前相比, 磷去除率下降速度比较缓慢, 说明再生后海绵铁渗滤床除磷性能反而有所提升.分析可能是, 碱的解吸及酸活化过程, 使海绵铁表面产生了更多的吸附活性位点.当运行至240 d, 渗滤床并未表现出完全穿透, 除磷率最终下降至约30%.在整个运行阶段, 渗滤床处理含磷河水的容积负荷达到120 g·d-1·m-3, 磷综合去除率30%~90%.再生后改性海绵铁累积吸附量达到43709 mg, 单位容积吸附量达到6.95 kg·m-3.海绵铁渗滤床表现出优异的连续流除磷能力, 并能够有效将磷富集回收, 原位再生方式可以有效恢复渗滤床的除磷性能.在实际应用过程中, 除磷渗滤床可以作为某些工艺的预处理, 如与人工湿地系统联用, 减缓高磷负荷冲击, 提高出水水质, 同时回收磷资源.
3.4 再生废液回收磷制取鸟粪石 3.4.1 pH对磷回收率的影响上述研究表明, 海绵铁具有良好的磷吸附富集性能, 为了进一步将解吸后的磷回收利用, 本研究探讨了以再生废液回收磷制取鸟粪石的方法.首先考察了pH和Mg2+、PO43-、NH4+投加摩尔比对再生废液磷回收率的影响.鸟粪石生成反应的主要反应方程式为:

|
(11) |
根据化学反应原理, 在含有正磷酸盐的废液中投加适当的铵盐与镁盐, 当Mg2+、PO43-和NH4+浓度乘积大于反应生成物MgNH4PO4·6H2O的溶度积常数, 达到过饱和状态后会生成鸟粪石晶体沉淀(Tansel et al., 2018).虽然pH不会直接影响鸟粪石的离子活度积平衡, 但pH会影响组成鸟粪石的各种离子在水中达到平衡的存在形态和活度(Lee et al., 2003).当再生废液的含磷量为826 mg·L-1、n(Mg2+):n(PO43-):n(NH4+)=1:1:1, 不同pH下再生废液的磷回收率如图 6a所示.
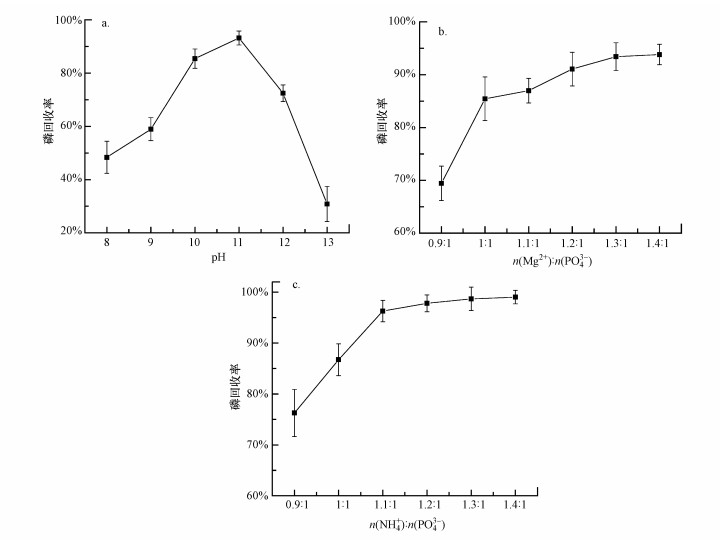 |
| 图 6 pH(a)、Mg2+投加量(b)和NH4+投加量(c)对磷回收率的影响 Fig. 6 Effect of pH(a), Mg2+ dosage(b) and NH4+ dosage(c) on phosphorus recovery |
图 6a为初始pH对再生废液中鸟粪石回收率的影响.在实验过程中发现, 当体系pH < 8时, 几乎没有沉淀物产生;随着pH的增加, 开始出现白色沉淀, 磷的回收率逐渐升高.虽然溶液中磷回收率在pH=11时达到最大, 为93.2%, 但发现沉淀物中出现乳胶状物质, 与pH=9~10时有较明显差别, 分析可能是产生了鸟粪石外的副产物, 在接下来的产物分析中也验证了这一猜测.理论计算表明, 当pH为10~11时, 固定氨会从MgNH4PO4中解离出来, 生成更难溶的Mg3(PO4)2;当pH>11时则会有Mg(OH)2生成(仝武刚等, 2002).pH>12时, 溶液中有明显的氨气逸出, 氨氮的利用率下降, 不利于生成鸟粪石.综合比较, 当pH=10时, 酸添加量少, 且磷回收生成鸟粪石比率最高, 为回收鸟粪石的最佳pH.
3.4.2 镁盐投加量的影响镁、氮投加量也会对磷回收率产生影响, 生成鸟粪石的Mg2+、PO43-、NH4+的理论摩尔比为1:1:1, 但再生废液的成分较为复杂, 其中含有铁、钙、碳、硅等元素, Mg2+、PO43-可能在反应中生成其它沉淀物, 因此需要增加某种离子投加含量, 促使平衡正向移动, 提高磷回收率.控制pH=10、n(PO43-):n(NH4+)=1:1, 改变Mg2+投加量, 其投加量对磷回收率的影响如图 6b所示.
增加Mg2+投加量, 磷回收率也随之提高.当n(Mg2+):n(PO43-)比值从0.9增加至1.3时, 磷回收率从69.4%明显提升至93.4%, 说明当n(Mg2+):n(PO43-) < 1.3时, 生成鸟粪石反应进行不彻底.此后继续提升Mg2+投加量至1.4:1, 磷回收率并未有明显提高, 说明此时Mg2+过量, 与其它离子反应生成非鸟粪石沉淀.因此, n(Mg2+):n(PO43-)的最佳投加比例为1.3:1.
3.4.3 氨氮投加量的影响控制镁盐投加比例为n(Mg2+):n(PO43-)为1.3:1, pH=10, 改变氨氮投加量, 考察了其对磷回收的影响(图 6c).结果表明, 随氨氮投加量的加大, 磷回收率逐步升高, 但增加幅度逐渐降低.当n(NH4+):n(PO43-)比值从0.9增至1.1时, 磷回收率从76.3%提升至96.3%, 此后继续增加氨氮投加量, 磷回收率提升并不显著.从环保性和经济性角度综合考虑, 最佳n(NH4+):n(PO43-)比为1.1:1.
3.4.4 整体试验在上述研究基础上, 为检测最佳工艺条件的可靠性, 进行了多组整体试验.结果见图 7.可以看出当n(Mg2+):n(PO43-):n(NH4+)从1:1:1提升至1.3:1:1.1时, 磷回收率有较明显提升;提升至1.4:1:1.2时, 磷的回收率提升不大.pH是制约磷回收率的主要因素, 最终确定最佳工艺条件为:pH=10, n(NH4+):n(PO43-)=1.1, n(Mg2+):n(PO43-)=1.3.
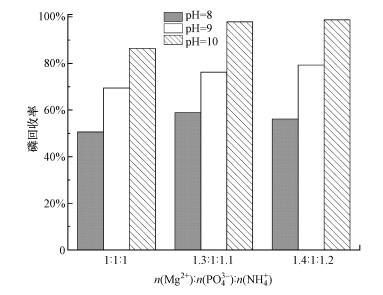 |
| 图 7 整体试验 Fig. 7 Integral testing |
在最佳摩尔比条件下, 分析了pH=9、10、11的试验产物XRD衍射图谱, 结果见图 8.
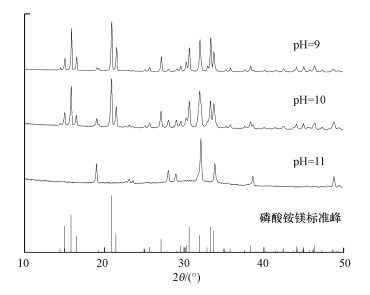 |
| 图 8 不同pH产物XRD图谱 Fig. 8 XRD patterns of phosphorous products under different pH |
可以看出, pH为9时, 沉淀物的X射线衍射图谱的峰型与MgNH4PO4·6H2O的标准谱图对比, 特征峰基本吻合, 且杂峰最少, 并未显示出其它晶像, 说明所得沉淀物主要成份为鸟粪石, 沉淀物纯度较高.但根据观察生成物量很小, 磷回收率明显较低.pH为10时, 生成物的大部分为鸟粪石, 其衍射峰位置基本不变, 但衍射峰强度变大.对比pH为9时的图谱, 其中掺杂了一些杂峰, 说明其中掺杂了少部分副产物, 但产物质量明显高于pH为9时的产物质量, 这也与试验过程观察到的pH=10磷回收率较高, 沉降时有明显成层界限、沉降性能较好现象一致.当pH为11时, 反应所得沉淀物没有明显的晶态特征峰, 与MgNH4PO4·6H2O标准谱图的衍射峰完全不吻合, 说明所得产物可能不是鸟粪石, 由于衍射特征峰不明显, 所以无法推断其物相, 但是根据部分衍射峰和其它学者的理论分析可以推断出产物中含的某些非鸟粪石晶体可能是Mg(OH)2、MgHPO4、Mg3(PO4)2或Na2SO4等的混合沉淀物(沈颖等, 2013).
4 结论(Conclusions)1) 利用6%硫酸进行海绵铁改性可以提升海绵铁磷吸附容量, 改性海绵铁理论最大吸附容量相比改性前提高了335%;改性海绵铁磷吸附饱和后, 可以通过解吸和再活化恢复其除磷能力, 活化率可以达到98.2%.
2) 海绵铁渗滤床具有良好的动态除磷性能, 累积磷吸附量达到6.95 kg·m-3, 载体活化再生方便, 可有效从含磷水体中回收磷.
3) 影响碱再生废液鸟粪石回收的主要因素是pH, 对含磷解吸液通过调节pH和投加氮镁进行磷回收制取鸟粪石的最优条件为:初始pH=10, n(Mg2+):n(PO43-):n(NH4+)=1.3:1:1.1.最优条件下, 磷回收率可以达到97.8%.
Almeelbi T, Bezbaruah A. 2012. Aqueous phosphate removal using nanoscale zero-valent iron[J]. Journal of Nanoparticle Research, 14. |
北京市生态环境局. 2019. 2018北京市水生态环境状况公报[R]. 20190509, 北京: 北京市生态环境局, 1-30
|
Du X, Han Q, Li J, et al. 2017. The behavior of phosphate adsorption and its reactions on the surfaces of Fe-Mn oxide adsorbent[J]. Journal of the Taiwan Institute of Chemical Engineers, 76: 167-175. |
范军辉, 郝瑞霞, 李萌, 等. 2016. 基于反硝化脱氮的硫铁复合填料除磷机制[J]. 环境科学, 37: 4275-4281. |
Lai L, Xie Q, Chi L N, et al. 2016. Adsorption of phosphate from water by easily separable Fe3O4@SiO2 core/shell magnetic nanoparticles functionalized with hydrous lanthanum oxide[J]. Journal of Colloid and Interface Science, 465: 76-82. |
Lee S I, Weon S Y, Lee C W, et al. 2003. Removal of nitrogen and phosphate from wastewater by addition of bittern[J]. Chemosphere, 51: 265-271. |
李杰, 李文譞, 魏志勇, 等. 2013. 海绵铁/微生物协同互促除磷研究[J]. 中国给水排水, 29: 124-127. |
Lu H Y, Feng Y F, Wu Y H, et al. 2016. Phototrophic periphyton techniques combine phosphorous removal and recovery for sustainable salt-soil zone[J]. Science of the Total Environment, 568: 838-844. |
马鸿文, 刘昶江, 苏双青, 等. 2017. 中国磷资源与磷化工可持续发展[J]. 地学前缘, 24: 133-141. |
Matsubae K, Yamasue E, Inazumi T, et al. 2016. Innovations in steelmaking technology and hidden phosphorus flows[J]. Science of the Total Environment, 542: 1162-1168. |
Mayer B K, Baker L A, Boyer T H, et al. 2016. Total value of phosphorus recovery[J]. Environmental Science & Technology, 50: 6606-6620. |
Mehta C M, Khunjar W O, Nguyen V, et al. 2015. Technologies to recover nutrients from waste streams: A critical review[J]. Critical Reviews in Environmental Science and Technology, 45: 385-427. |
沈颖, 叶志隆, 叶欣, 等. 2013. 鸟粪石法回收养猪废水中氮磷时产物的组分与性质研究[J]. 环境科学学报, 33: 92-97. |
Tansel B, Lunn G, Monje O. 2018. Struvite formation and decomposition characteristics for ammonia and phosphorus recovery: A review of magnesium-ammonia-phosphate interactions[J]. Chemosphere, 194: 504-514. |
仝武刚, 王继徽. 2002. 磷酸铵镁除磷脱氮技术[J]. 工业用水与废水: 4-6. |
Wang W J, Zhou J, Wei D, et al. 2013. ZrO2-functionalized magnetic mesoporous SiO2 as effective phosphate adsorbent[J]. Journal of Colloid and Interface Science, 407: 442-449. |
Wen Z P, Zhang Y L, Dai C M. 2014. Removal of phosphate from aqueous solution using nanoscale zerovalent iron (nZVI)[J]. Colloids and Surfaces a-Physicochemical and Engineering Aspects, 457: 433-440. |
吴秋月, 陈静, 张伟, 等. 2015. 新型纳米结构铈锰复合氧化物的磷吸附行为与机制研究[J]. 环境科学学报, 35: 1824-1832. |
Xiong W, Tong J, Yang Z, et al. 2017. Adsorption of phosphate from aqueous solution using iron-zirconium modified activated carbon nanofiber: Performance and mechanism[J]. Journal of Colloid and Interface Science, 493: 17-23. |
张颖纯, 王伟. 2015. 纳米零价铁颗粒除磷反应机理[J]. 环境工程学报, 9: 2041-2047. |
钟丽燕, 郝瑞霞, 万京京, 等. 2017. 新型缓释碳源耦合海绵铁同步脱氮除磷的研究[J]. 中国给水排水, 33: 69-72+76. |
Zhou K X, Barjenbruch M, Kabbe C, et al. 2017. Phosphorus recovery from municipal and fertilizer wastewater: China′s potential and perspective[J]. Journal of Environmental Sciences, 52: 151-159. |
 2020, Vol. 40
2020, Vol. 40


