土地整治是指为提高土地利用效率和产出率, 运用工程、生物等技术对闲置、退化和损毁土地进行综合治理的活动(鹿心社, 2002;王军等, 2018).随着社会的发展与城市的扩张, 土地整治这一缓解土地矛盾的重要方式得到了社会各界进一步的重视, 在全世界范围内都得到了广泛的应用(van Dijk, 2007;Haldrup, 2015;Du et al., 2018).从微观的角度看, 土地整治过程是一个土体有机重构的过程, 是对土壤的重构和改良, 其中不可避免地会对土壤产生影响, 而这种影响不仅仅体现在土壤理化性质的变化上, 也会体现在微生物群落多样性和结构的变化上(Djanibekov et al., 2018).
近年来随着工业化进程的加快, 采矿、冶炼等活动的规模不断扩大, 使得土壤的重金属污染问题日趋严重(Chen et al., 2014).学者们已经意识到重金属污染对土壤生态具有严重影响, 大量研究表明, 土壤微生物对重金属胁迫相较于动植物更具有敏感性, 这种特性也使得土壤微生物成为最具潜力的土壤重金属污染监测指标(Brookes et al., 1984;Zhang et al., 2010).而关于微生物与重金属污染之间联系的研究, 国内外学者已取得了很大的进展, 发现重金属污染会影响土壤微生物的群落丰度、多样性、结构组成及功能性乃至土壤微生物酶活性等生态特征(Harris-Hellal et al., 2009;Hamed et al., 2015;邓代莉等, 2018).而关系到粮食安全的农业土壤重金属污染这一领域更是受到了学者们的广泛关注, 已有学者指出农业土壤中重金属积累将会对人类健康造成风险(Yang et al., 2019), 同时有研究分别对工业区周边的稻田土壤进行了大面积、长周期的监测, 发现Cd、Pb、As重金属污染已经超过安全界限, 威胁着人类健康(Yang et al., 2018; He et al., 2019).面对日益严峻的重金属污染形势, 对污染治理的研究成为重中之重, 有学者分别对植物修复、海泡石、生物质碳等土壤重金属污染治理途径进行了探索(Abad-Valle et al., 2016;徐继敏等, 2018;Ashraf et al., 2019), 但目前针对土地整治应对土壤重金属污染的研究尚未展开.基于此, 本文通过对某县工业区周边土地整治区中土壤理化性质及土壤微生物群落多样性和组成的分析, 研究土地整治和相关土壤环境因子对土壤微生物的影响.
2 材料与方法(Materials and methods) 2.1 研究区及样品采集与处理本文选取浙江省某县某工业区周边水田作为研究区域, 选定工业区主要从事有色金属冶炼铸造.该县位于中国东部沿海地区、长江三角洲中心位置, 具有良好的环境条件和悠久的农业历史.然而目前该地区的农业发展面临着诸多难题:一方面, 耕地破碎化和土壤贫瘠严重制约着当地农业的可持续发展;另一方面, 大量“低、小、弱、散”工业区的存在也不可避免地影响着周边土壤质量及农业产出.而土地整治则成为了当地改善土壤质量、保障农业发展的主要手段.在土地整治区, 采取的土地整治措施主要包括地块合并、土地平整、兴修农田水利、改进农耕技术、生态环境保持工程等.
2018年9月在该地区选定工业区旁大致距离为2、1、0.5 km处的样地, 分别标记为A1、A2、A3, 均在土地整治区内(土地整治3 a以上), 并分别在每个样地周边范围内选取未整治样地(耕作10 a以上)作为对照组(标记为B1、B2、B3).所选样地均为水田, 作物为水稻, 并且土壤质地近似, 均为紫色粘性土壤.每个样地采样时均采用五点法采集0~10 cm的表层土, 筛除其中石头、动植物残留及其他杂物后, 将多点土样混匀成一个样品, 低温保存运输至实验室(Yu et al., 2018).
之后每个土样取20 g样本储存于-80 ℃冰箱用于DNA提取, 另取用于测定土壤理化性质的500 g土样根据不同实验需求分别以鲜土和风干土方式保存.土壤经均质化处理后, 对每个土壤样本进行重复3次的土壤理化分析和DNA提取(沈冰洁等, 2015).
2.2 土壤理化性质测定土壤理化性质测定主要包括土壤pH、含水量、重金属、总氮、有效磷、速效钾等指标.其中, 土壤pH以V(土壤) : V(水)=1 : 2.5的体积比通过pH计测定, 土壤含水量通过电热恒温烘箱在105 ℃的条件下烘干6 h后测定.土壤中的铜、锌、镉等重金属含量由电感耦合等离子体质谱仪(Agilent 7800, California, USA)测定, 总氮由自动凯氏定氮仪(K9860)测定, 有效磷由紫外分光光度计测定, 速效钾由火焰光度计(F-100)测定(Chen et al., 2015).
2.3 DNA提取及高通量测序根据Fast DNA SPIN试剂盒(MP Biomedicals, USA)的使用说明, 从0.5 g土壤样品(一式3份)中提取用于PCR扩增的土壤基因组DNA.通过Nano-drop 2000分光光度计(Thermo Scientific, USA)测定提取的DNA的质量和浓度, 并将提取的DNA储存在-20 ℃条件下等待进一步使用.16S rDNA引物为338F和806R(Noah et al., 2005).细菌PCR扩增采用20 μL反应体系, 包括4 μL 5×Pyrobest Buffer、2 μL 2.5 mmol·L-1 dNTPs、0.8 μL 5 μmol·L-1 338F/806R、0.4 μL FastPfu聚合酶、0.2 μL BSA、10 ng DNA模板.整个过程在PCR仪(ABI Gene Amp 9700)中进行, 程序如下:95 ℃下预变性3 min;95 ℃下变性30 s, 60 ℃下退火30 s, 72℃下延伸45 s, 10个循环;72 ℃下延伸10 min.然后, 在Illumina HiSeq4000平台上进行测序, 使用软件FLASH、Trimmomatic进行数据去杂和优化, 以fastq格式保存原始DNA测序结果.
2.4 分析工具与方法原始DNA测序数据在Usearch平台(version 7.0)上处理, 采用RDP classifier贝叶斯算法对97%相似水平的OTU代表序列进行分类学分析, 统计各分类学水平上各样品的群落组成(Tipayno et al., 2018);根据OTU分析结果, 利用R语言工具作图并分析样品稀释性曲线, 并计算Sobs、Shannon、Simpson、ACE、Chao、Coverage微生物α多样性指数;运用内梅罗指数法评估重金属污染程度, 这也是目前在国内外应用最为普遍的综合污染指数评估方法之一(Li et al., 2017;闫华等, 2018), 计算公式如下:
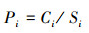
|
(1) |
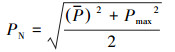
|
(2) |
式中, Pi为重金属i的污染指数;Ci为重金属含量的实测值;Si为土壤环境质量标准值(国家二级标准值)(Si来源于我国《土壤环境质量标准》(GB15618- 2018)中的农用地土壤污染风险筛选值);PN为综合污染指数;P为各污染物种污染指数的平均值;Pmax为各污染物中污染指数最大值.
在此基础上进行数据分析, 使用Wilcox秩和检验方法进行不同组之间差异的显著性分析;使用PICRUSt软件进行细菌功能预测;通过R语言进行PCoA统计分析和作图, 研究样本群落组成的相似性或差异性, 并使用R pheatmap package通过Spearman相关性分析研究环境因素与微生物群落结构的关系(申丽等, 2018;Zhang et al., 2010).
本研究中16S rRNA基因序列上传至GenBank, 项目登记号为PRJNA548089, 序列登记号为SAMN12001121-SAMN12001130.
3 结果与分析(Results and analysis) 3.1 土壤环境因子表 1展示了6个样地的土壤理化性质测定结果, 含水量经测定均在35%以上, 其余指标包括酸碱度(pH)、有效磷(AP)、速效钾(AK)和总氮(TN), 重金属指标包括铜(Cu)、镉(Cd)、铅(Pb)、铬(Cr)、汞(Hg)、锌(Zn).同时运用内梅罗指数法评估重金属污染程度, 根据内梅罗综合污染指数, 可将土壤重金属污染分为5个等级(表 2)(宋伟等, 2013;葛晓颖等, 2019).
| 表 1 土壤理化性质和综合污染指数 Table 1 Physical and chemical properties of the soil and pollution appraisal indexes |
| 表 2 内梅罗综合污染指数评价标准 Table 2 Evaluation criterion of Nemerow index |
从表 1结果中可以发现, 远离工业区的A1、B1样地pH均在7左右, 接近于中性土壤, 而随着与工业区距离的缩短, 对照组之间的pH差异逐渐增加.在土壤理化性质方面, 土地整治区域的TN、AK、AP稍优于未整治区域, 表明土地整治可能有助于改善土壤质量状况;而与工业区的距离则对重金属指标产生了明显的影响, 其中表现出值得注意的两个特征:一是代表土地整治区域的A组重金属指标大多低于未经土地整治的B组相应对照组;二是样地越靠近工业区, 重金属含量越高.从重金属污染程度来看, 样地A1、B1、A2、B2、A3的综合污染指数PN均在2.0~3.0之间, 属于中度污染, 而B3的污染指数PN超过3.0, 为重污染, 其中主要超出土壤环境质量标准值的指标为Cd, 其次为Hg, 具体综合污染程度为:A1 < B1 < A2 < B2 < A3 < A3;与工业区距离越远, 污染程度越轻, 并且在距离相当的条件下, 土地整治区的污染程度也低于未整治区.
3.2 测序结果6组土壤样品共检测出个8383个OTU, 共53个门、134个纲、272个目、502个科、947个属和2172个种.6个组别的Sobs稀释曲线均趋于平坦, 表明测序数据量合理, 序列信息可以充分反映样本总体信息.
以门作为分类学水平分析6组样品的微生物群落结构, 将平均丰度小于1%的门归入others, 如图 1所示, 剩余部分中共有10门细菌, 大致占据门水平分类微生物的90%.总体来看, 6组样品相对丰度最多的分别为变形菌门(Proteobacteria)(30.57%)、绿弯菌门(Chloroflexi)(22.35%)、酸杆菌门(Acidobacteria)(12.86%)、放线菌门(Actinobacteria)(6.91%)、硝化螺旋菌门(Nitrospirae)(4.97%), 共占据75%以上的OTU.从分组样品来看, 相对丰度最高的门是变形菌门, 其相对丰度的分布为A2(26.44%) < A1(29.45%) < B2(28.78%) < B1(31.24%) < A3(32.71%) < B3(32.80%);而绿弯菌门的相对丰度分布为A3(19.25%) < B1(19.77%) < B3(20.91%) < A1(24.30%) < B2(24.01%) < A2(25.84%);酸杆菌门的相对丰度分布为B1(10.90%) < B3(11.11%) < B2(12.79%) < A3(12.96%) < A2(15.27%) < A1(16.14%).总体来看, 在土地整治背景下A组样地中变形菌门的相对丰度均小于未经整治的B组样地, A组绿弯菌门和酸杆菌门的相对丰度则大于未整治土地B组;并且随着与工业区距离的缩短, 污染程度加深, 变形菌门的相对丰度逐渐增加, 绿弯菌门的相对丰度先增后减, 酸杆菌门的相对丰度逐渐降低.此外还可以发现, 随着重金属污染程度的加深, 3种主要菌门在土地整治对照组之间的相对丰度差距明显缩小.
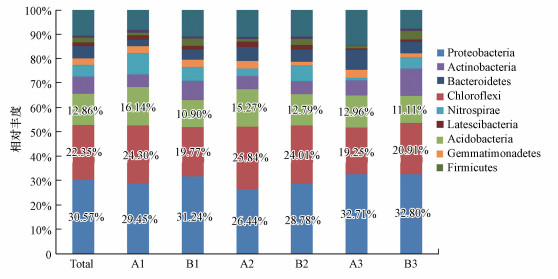 |
| 图 1 门水平上土壤细菌组成 Fig. 1 Composition of soil bacterial community at phylum level |
以属作为分类学水平进行分析, 将平均丰度小于1%的菌属归入others, 如图 2所示, 剩余18个菌属可对应至属水平.其中, 硝化螺旋菌属(Nitrospira)是主要的菌属, 其总相对丰度明显高于其他菌属, 相对丰度分布为A3(2.78%) < B2(14.30%) < B3(14.61%) < B1(17.65%) < A2(18.81%) < A1(28.72%).其余H16、鞘脂单胞菌属(Sphingomonas)、玫瑰弯菌属(Roseiflexus)、硫杆菌属(Thiobacillus)、地杆菌属(Geobacter)的相对丰度较高, 均在2%以上.从土地整治视角观察, 发现在土地整治区A组样地中鞘脂单胞菌属、地杆菌属等的相对丰度大于未整治B组样地, Gaiella、Defluviicoccus、Desulfobacca则在未进行土地整治样地中丰度较高.以污染程度为视角, 发现硝化螺旋菌属、H16、硫杆菌属等相对丰度属表现出随污染程度增加而减少的趋势, 而鞘脂单胞菌属、Gaiella等则相反.同时, 重金属污染程度越高, 在土地整治视角下观察到的属水平差异越不明显.
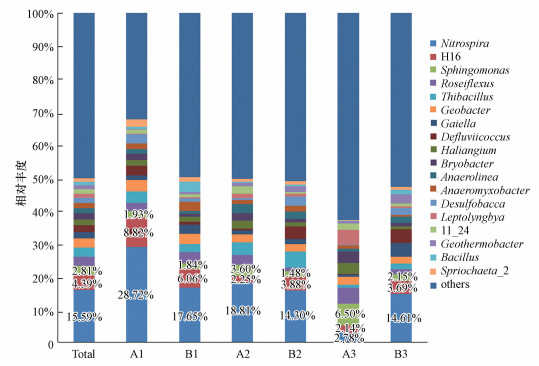 |
| 图 2 属水平上土壤细菌组成 Fig. 2 Composition of soil bacterial community at genus level |
微生物α多样性指数如表 3所示, Sobs为实测OTU数目, Chao 1、ACE指数为群落丰富度指数, Shannon、Simpson指数为群落多样性指数.数据显示:一方面, 在群落丰富度与多样性指数方面A组均大于B组, 但在靠近工业区重金属污染较严重的A3、B3区域, 多样性指数与对照组间的差距明显缩减;另一方面, 随着重金属污染程度的加重, 土壤微生物的多样性指数有着明显的下降, 这在土地整治区尤为明显(A1>A2>A3), 而对比非整治区, 由于可能存在其他因素干扰, 这种趋势不甚明显.
| 表 3 土壤微生物α多样性指数 Table 3 α-diversity indexes of soil bacteria |
运用R语言进行PCoA统计分析及作图(图 3), PCoA分析即通过各土壤细菌样品序列间的进化信息来测算样品间距离, 从而将不同样品间的细菌群落进行区分以观察群体之间的相似性与差异性.而本次样品检测中, PC1、PC2分别代表对于两组样本基因表达模式的可能影响因素, 其中, PC1和PC2分别解释了样品细菌群落结构差异的54.22%和16.92%.分别以土地整治和工业区距离作为分组要素, 都可以区分细菌群落结构在PC1轴和PC2轴方向上的差异性, 同时这两种组别的差异也具有各自的相似性.表明土地整治和工业区距离两种要素都在一定程度上影响着细菌群落的结构组成.
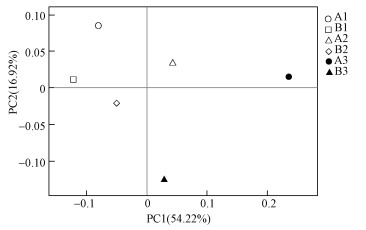 |
| 图 3 基于PCoA的细菌群落β多样性分析 Fig. 3 β-diversity analysis of bacterial communities based on PcoA |
从土地整治的角度出发, 具体来看, 在门水平上, 土地整治区和非整治区细菌群落组成类似, 均以变形菌门、绿弯菌门、酸杆菌门和放线菌门为主, 但在两组中不同物种的平均相对丰度存在着明显的差异.通过Wilcox秩和检验方法(Wilcoxon rank-sum test), 在门水平相对平均丰度大于1%的物种进行组间差异显著性检验, 结果如图 4所示.由图可知, A组(整治区)中酸杆菌门的相对丰度显著高于B组(未整治区)(p < 0.05), 拟杆菌门的相对丰度显著低于B组(p < 0.01), 表明土地整治会使得土壤中酸杆菌门的相对丰度增加, 拟杆菌门的相对丰度降低.
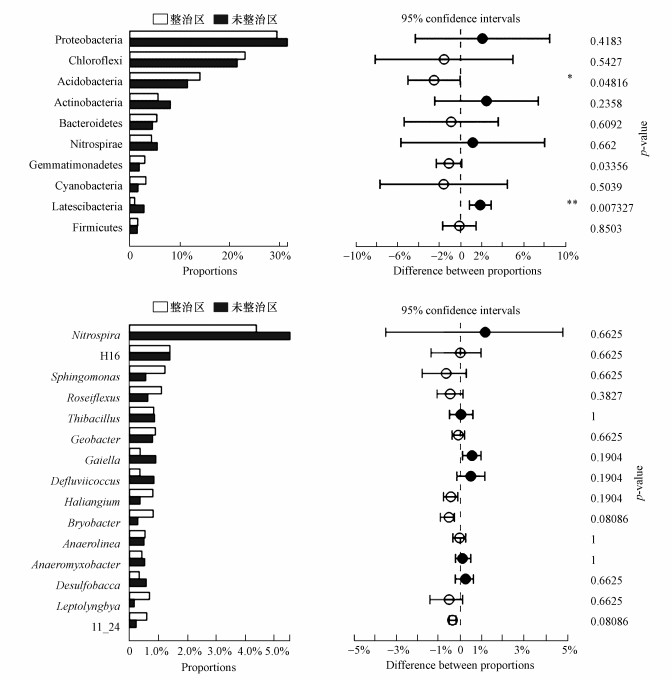 |
| 图 4 土地整治组间差异显著性检验 Fig. 4 Examined significant differences between the land consolidation groups |
而在属水平上, 包括硝化螺旋菌属、鞘脂单胞菌属、玫瑰弯菌属等在内的770个属细菌在两个组别中被一同检测到, 而气丝藻属(Aerosakkonema)、Dyadobacter、地发菌属(Geothrix)、Silanimonas、宽球藻属(Pleurocapsa)等仅在A组中被检测到, Angustibacter、脱硫球菌属(Desulfococcus)、Skermanella、Sulfuriferula、Umezawaea等仅在B组中被检测到;同时, 在平均相对丰度大于1%的属水平差异显著性检验中(图 4), 鞘脂单胞菌属、地杆菌属、玫瑰弯菌属、细鞘丝藻属、Haliangium等在A组中的相对丰度高于B组, 而硝化螺旋菌属、Gaiella、Defluviicoccus等则低于B组.
通过16S功能预测可以分析土地整治对细菌群落功能差异的影响.运用PICRUSt对OTU丰度表进行标准化, 然后通过每个OTU对应的Greengene ID, 比对到COG和KEGG库, 获得OTU对应的COG家族信息和KO信息, 最终分别得到功能丰度谱和各功能类别的丰度(Langille et al., 2013).根据两组土壤样品的功能预测结果, 发现能源生产和转换、氨基酸转运和代谢、细胞壁/膜生物发生、信号转导机制是其中最主要的功能.同时, A组和B组细菌功能之间存在着显著差异(p < 0.05), A组细菌各功能类别的丰度均要大于B组, 反映出土地整治对细菌群落功能结构的影响.
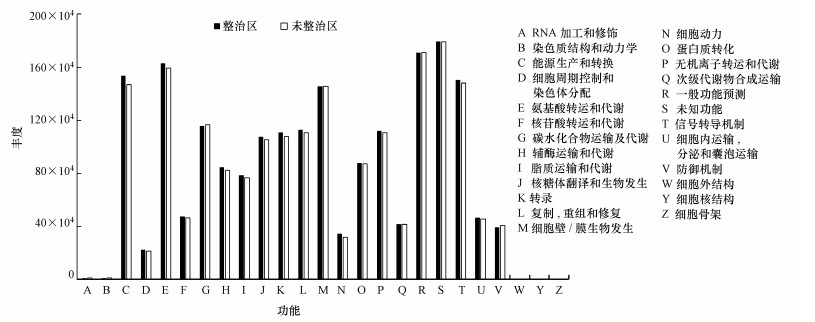 |
| 图 5 土地整治区(A组)与未整治区(B组)土壤样品中PICRUSt推断的功能丰度 Fig. 5 Abundance of functions inferred by PICRUSt in the soil samples under land consolidation(Group A) or not(Group B) |
为细化细菌群落及明确环境因素的影响, 本研究选取相对丰度大于0.05%的405个OTU, 运用Spearman统计方法分析环境因素与细菌群落的相关性, 其中, 环境因素包括6种重金属元素(Cu、Cd、Pb、Cr、Zn、Hg)、3种营养元素(TN、AP、AK)及土壤酸碱度pH, 发现共有234个显著相关的联系, 其中, 正相关127个, 负相关107个.表 4数据显示, 与重金属Cu、Cd、Pb、Cr、Zn、Hg显著相关的OTU个数分别为14、35、25、20、13、32个, 说明Cd、Hg、Pb是影响细菌群落的主要重金属元素;pH对细菌群落的影响最为明显;在3种营养元素中, AP则对细菌群落产生主要影响, 而AK、TN的影响较为轻微.
| 表 4 OTU水平的环境因子显著相关统计 Table 4 Significant correlation statistics of environmental factors at OTU level |
将这些与环境因素显著相关的OTU序列比对至属水平, 发现有35个OTU能比对至属水平, 分属6个门、22个属(表 5).其中, 硝化螺旋菌属、H16、RB41、Desulfobacca、Pseudolabrys、Defluviicoccus与多种重金属表现出显著的负相关关系, 说明这些菌属对重金属污染较为敏感;地杆菌属、芽孢杆菌属、假单胞菌属则表现出与多种重金属的显著正相关关系, 表明这几类菌属对重金属的耐受能力较强.同时, 有相当多的OTU表现出对pH显著的敏感性, 尤其是硝化螺旋菌属, 表现出显著的负相关关系(p < 0.01), 而变形菌门/α-变形菌纲下大多表现出正相关关系.在营养元素中, AP则是影响细菌群落组成的最主要因素, 并且其与pH因素所表现出的相关关系截然相反.
| 表 5 OTU水平的Spearman相关性分析 Table 5 Spearman′s correlation at OTU level |
在门水平上, 所有样地土壤的优势菌门相同, 均为变形菌门、绿弯菌门、酸杆菌门, 表明这些菌门是工业区周边稻田土壤的优势菌落, 对重金属污染的耐受性较强, 并且随着重金属污染程度的加深, 变形菌门的相对丰度逐渐增加, 绿弯菌门的相对丰度先增后减, 酸杆菌门的相对丰度逐渐降低.在其他相关研究中, 有学者同样基于Illumina高通量测序技术发现在重金属污染环境下稻田土壤平均相对丰度最高的门依次是变形菌门、绿弯菌门、酸杆菌门(申丽等, 2018;Luo et al., 2019), 表明不同地理环境中的水田土壤, 在重金属污染影响下具有着相似的微生物群落结构.
4.2 土地整治对微生物群落组成的影响土地整治对土壤微生物多样性和群落结构具有较大影响.从研究中发现, 在土壤理化性质方面, 土地整治能够影响土壤中营养元素比重, 减少土壤重金属含量, 进而改善土壤污染状况, 提高土壤微生物群落的丰度与多样性水平, 同时也能显著提高土壤微生物功能多样性(p < 0.05)(Zhang et al., 2012;Chartin et al., 2013), 而这种现象在重金属污染程度较低的样地中尤为明显.分析原因, 土地整治所采取的部分整治措施可能直接改变了土壤结构及性质, 例如, 筑造沟渠可改善农田水分涵养状况(Zhao et al., 2019), 而含水量对土壤中各种微生物群落都存在着直接的影响;土地平整会改变表土分布, 而工程期间对不同深度土壤层之间的混合会显著影响土壤pH水平(Wu et al., 2019), 进而影响对pH敏感的微生物群落组成;此外, 土地平整会改变土壤粘粒含量和粒径水平, 这将会影响土壤中营养元素如TN等的异质性分布(Bai et al., 2012);改用有机肥有助于提高土壤微生物的功能多样性, 一方面有机肥能够显著增加土壤中细菌、真菌、放线菌的数量, 提高土壤微生物的多样性, 另一方面有机肥中含有大量功能性微生物, 进入土壤后可有效活化被土壤固定的磷、钾养分, 改善微生物的营养条件, 保持土壤微生物具有较高活性(Guo et al., 2017;侯会静等, 2019);改善土壤中生物生活环境(真菌、蚯蚓等)从而使其与土壤关系发生变化, 而这些生物活动是影响土壤孔隙度的重要因素(Palese et al., 2014), 土壤孔隙度则与土壤理化性质密切相关, 也是影响微生物群落组成的重要因素之一.
对具体微生物进行讨论, 发现土地整治区A组中酸杆菌门的相对丰度显著高于未整治区B组(p < 0.05), 拟杆菌门的相对丰度显著低于B组(p < 0.01), 表明土地整治会使得土壤中酸杆菌门的相对丰度增加, 拟杆菌门的相对丰度降低.而在属水平上, 则表现为鞘脂单胞菌属、地杆菌属、玫瑰弯菌属、Haliangium在土地整治区中的相对丰度高于未整治区, 而硝化螺旋菌属、Gaiella、Defluviicoccus则相反, 这与之前研究的结论类似(林耀奔等, 2019).值得一提的是, 已经有研究表明鞘脂单胞菌属、地杆菌属具有修复有机物及重金属污染的潜力, 增加其丰度对农业经营具有积极意义(Wu et al., 2006;Zhou et al., 2016;Xu et al., 2018).
需要注意的是, 虽然土地整治影响了微生物群落组成, 但这种影响可能是有限的, 随着重金属污染程度的加深, 所观察到的土地整治对照组之间微生物群落的差异越不明显, 需要对土地整治和环境因素如何影响微生物群落进行更加合理的对照组实验.
4.3 环境因子对微生物群落组成的影响重金属污染会降低微生物群落的多样性, 但重金属污染与群落多样性之间并不表现出严格的负相关关系(表 2), 在重金属污染程度最重的B3样点多样性有所回升.根据相关研究, 在某些情况下重金属污染与群落多样性之间会出现复杂的关系(Xiao et al., 2017), 这可能是因为当微生物短期内无法适应重金属污染时会进入休眠状态使得群落多样性下降, 而在长期过程中随着微生物群落对重金属污染的逐渐适应, 对重金属敏感的菌群被具有更高耐受性的菌群取代(Tipayno et al., 2018), 使得多样性出现回升(Sheik et al., 2012;Berg et al., 2012), 这可以在一定程度上解释本文中α多样性指数的波动.
有足够的实验证明, 重金属会对土壤中微生物群落组成造成影响(Sun et al., 2013;Wu et al., 2018), 而本研究将样地以工业区距离为标准进行划分, 同样发现土壤中的重金属含量是影响微生物群落组成的重要因素, 尤其是Cd、Pb、Hg.在本研究中, Cd、Hg均与变形菌门下的α-变形菌纲显著正相关(p < 0.05), 与β变形菌纲负相关, 而与δ-变形菌纲和γ-变形菌纲无明显相关关系, 其中的差异可能是由于变形菌门中的不同菌属能够利用的有机物质不同, 因而会对重金属做出不同的应激反应以获得更好的环境适应性(Bouskill et al., 2010;Li et al., 2017).同时, Cd、Hg也与硝化螺旋菌门显著负相关, 硝化螺旋菌属的总体丰度随着Cd、Hg含量的增加而减少, 并且硝化螺旋菌属对Hg更为敏感(p < 0.01).Pb则与硫杆菌属、芽孢杆菌属显著正相关(p < 0.01), 其中需要注意的是, 属水平上的相对丰度分布显示芽孢杆菌与土壤重金属含量呈正相关(图 2), 而已有许多研究证实了芽孢杆菌对多种重金属的耐受性, 甚至在自然界As循环代谢中也发挥着重要作用(Kelly et al., 2000;Ruta, 2011).
变形菌门是土壤样本中丰度最高的门, 同时其丰度随着重金属污染程度的上升而略微上升(Liu et al., 2014;Li et al., 2017), 而对应到属水平的OTU分析表明鞘脂单胞菌属是变形菌门中主要的菌群, 并且与多种重金属表现出正相关关系.Guo等(2017)发现陕西省某县4个受重金属污染的农田中鞘脂单胞菌属的相对丰度高于变形菌门中其他菌属, 这与本文研究结论类似, 鞘脂单胞菌属对重金属污染具有较强的耐受性;此外, 也已有学者证实了鞘脂单胞菌属对重金属及有机物具有一定的吸附能力(Tangaromsuk et al., 2002), 表明鞘脂单胞菌属在重金属污染治理方面存在着较大的潜力.
除了重金属因素以外, 其他环境因子如土壤其他理化性质也影响着微生物群落组成, 其中, 许多菌群对pH极为敏感(Tang et al., 2019).有研究表明, pH会影响土壤中重金属的浸出和土壤营养物质的调节, 同时会改变重金属对土壤微生物所参与生态活动的影响, 进一步导致微生物群落结构的变化(Wang et al., 2012;刘沙沙等, 2018).与之相似, 在本研究中也发现pH影响着微生物群落组成, 其中, 硝化螺旋菌属表现出对pH的敏感性, 而鞘脂单胞菌属则表现出对碱性环境的耐受性(Menon et al., 2019).同时在本研究中AP与pH表现出了显著的负相关关系(p < 0.01), 根据之前研究, 这是由于有效磷在酸性条件下会有更高的效率水平(展晓莹等, 2015), 其对土壤微生物群落的影响也更为剧烈.
5 结论(Conclusions)本文以工业区周边土地整治区及非整治区为研究区, 通过对其中土壤理化性质及土壤微生物群落结构和多样性的对比分析, 发现土地整治对土壤理化性质及微生物群落组成具有重要影响.研究结果表明, 土地整治有助于改善土壤理化性质及重金属污染状况, 同时对土壤微生物群落组成具有显著影响, 但随着重金属污染程度的升高, 这种影响会逐渐减弱.在本研究中, 土壤酸碱度是对微生物群落影响最为明显的环境因子, 镉、汞、铅则是影响微生物群落的主要重金属元素, 此外, 还发现了部分微生物对重金属污染表现出较高的耐受性, 在治理环境污染方面存在较大的潜力.总而言之, 本研究探索了土地整治对土壤质量的重要意义, 研究结果表明土地整治有助于改善土壤微生物群落组成及土壤理化性质.而在未来为了更深入地研究土地整治影响土壤微生物及理化性质的机理, 需要设计更具有完备性和针对性的实验.
Abad-Valle P, álvarez-Ayuso E, Murciego A, et al. 2016. Assessment of the use of sepiolite amendment to restore heavy metal polluted mine soil[J]. Geoderma, 280: 57-66. |
Ashraf S, Ali Q, Zahir Z A, et al. 2019. Phytoremediation:Environmentally sustainable way for reclamation of heavy metal polluted soils[J]. Ecotoxicology and Environmental Safety, 174: 714-727. |
Bai J, Deng W, Wang Q, et al. 2012. Spatial and seasonal distribution of nitrogen in marsh soils of a typical floodplain wetland in Northeast China[J]. Environmental Monitoring and Assessment, 184(3): 1253-1263. |
Berg J, Brandt K K, Al-Soud W A, et al. 2012. Selection for Cu-Tolerant bacterial communities with altered composition, but Unaltered Richness, via Long-Term Cu exposure[J]. Applied and Environmental Microbiology, 78(20): 7438-7446. |
Bouskill N J, Barker-Finkel J, Galloway T S, et al. 2010. Temporal bacterial diversity associated with metal-contaminated river sediments[J]. Ecotoxicology, 19(2): 317-328. |
Brookes P C, Mcgrath S P. 1984. Effect of metal toxicity on the size of the soil microbial biomass[J]. Journal of Soil Science, 35(2): 341-346. |
Chartin C, Evrard O, Salvador-Blanes S, et al. 2013. Quantifying and modelling the impact of land consolidation and field borders on soil redistribution in agricultural landscapes (1954-2009)[J]. CATENA, 110: 184-195. |
Chen H, Teng Y, Lu S, et al. 2015. Contamination features and health risk of soil heavy metals in China[J]. Science of the Total Environment, 512-513: 143-153. |
Chen J H, He F, Zhang X H, et al. 2014. Heavy metal pollution decreases microbial abundance, diversity and activity within particle-size fractions of a paddy soil[J]. FEMS Microbiology Ecology, 87(1): 164-181. |
Djanibekov U, Finger R. 2018. Agricultural risks and farm land consolidation process in transition countries:The case of cotton production in Uzbekistan[J]. Agricultural Systems, 164: 223-235. |
Du X, Zhang X, Jin X. 2018. Assessing the effectiveness of land consolidation for improving agricultural productivity in China[J]. Land Use Policy, 70: 360-367. |
邓代莉, 石清清, 薛圣炀, 等. 2018. 外源铅污染对紫色土中微生物酶活性的影响研究[J]. 环境污染与防治, 40(10): 1095-1100. |
Guo H, Nasir M, Lv J, et al. 2017. Understanding the variation of microbial community in heavy metals contaminated soil using high throughput sequencing[J]. Ecotoxicology and Environmental Safety, 144: 300-306. |
葛晓颖, 欧阳竹, 杨林生, 等. 2019. 环渤海地区土壤重金属富集状况及来源分析[J]. 环境科学学报, 39(6): 1979-1988. |
Haldrup N O. 2015. Agreement based land consolidation-In perspective of new modes of governance[J]. Land Use Policy, 46: 163-177. |
Hamed A, Maria N, Ryszard L, et al. 2015. Microbial community composition and functions are resilient to metal pollution along two forest soil gradients[J]. FEMS Microbiology Ecology, 91(1): 1-11. |
Harris-Hellal J, Vallaeys T, Garnier-Zarli E, et al. 2009. Effects of mercury on soil microbial communities in tropical soils of French Guyana[J]. Applied Soil Ecology, 41(1): 59-68. |
He M, Shen H, Li Z, et al. 2019. Ten-year regional monitoring of soil-rice grain contamination by heavy metals with implications for target remediation and food safety[J]. Environmental Pollution, 244: 431-439. |
侯会静, 韩正砥, 杨雅琴, 等. 2019. 生物有机肥的应用及其农田环境效应研究进展[J]. 中国农学通报, 35(14): 82-88. |
Kelly D P, Wood A P. 2000. Reclassification of some species of Thiobacillus to the newly designated genera Acidithiobacillus gen.nov., Halothiobacillus gen.nov.and Thermithiobacillus gen.nov[J]. International journal of Systematic and Evolutionary Microbiology, 50(2): 511. |
Langille M G I, Zaneveld J, Caporaso J G, et al. 2013. Predictive functional profiling of microbial communities using 16S rRNA marker gene sequences[J]. Nature Biotechnology, 31(9): 814-821. |
Li X, Meng D, Li J, et al. 2017. Response of soil microbial communities and microbial interactions to long-term heavy metal contamination[J]. Environmental Pollution, 231: 908-917. |
Liu Y, Wang J, Zheng Y, et al. 2014. Patterns of bacterial diversity along a long-term mercury-contaminated gradient in the paddy soils[J]. Microbial Ecology, 68(3): 575-583. |
Luo L Y, Xie L L, Jin D C, et al. 2019. Bacterial community response to cadmium contamination of agricultural paddy soil[J]. Applied Soil Ecology, 139: 100-106. |
林耀奔, 叶艳妹, 杨建辉, 等. 2019. 土地整治对土壤微生物多样性的影响分析[J]. 环境科学学报, 39(8): 2644-2653. |
刘沙沙, 付建平, 蔡信德, 等. 2018. 重金属污染对土壤微生物生态特征的影响研究进展[J]. 生态环境学报, 27(6): 1173-1178. |
鹿心社. 2002. 论中国土地整理的总体方略[J]. 农业工程学报, (1): 1-5. |
Menon R R, Kumari S, Kumar P, et al. 2019. Sphingomonas pokkalii sp.nov., a novel plant associated rhizobacterium isolated from a saline tolerant pokkali rice and its draft genome analysis[J]. Systematic and Applied Microbiology, 42(3): 334-342. |
Noah F, Jason A J, Rytas V, et al. 2005. Assessment of soil microbial community structure by use of taxon-specific quantitative PCR assays[J]. Applied and Environmental Microbiology, 71(7): 4117-4120. |
Palese A M, Vignozzi N, Celano G, et al. 2014. Influence of soil management on soil physical characteristics and water storage in a mature rainfed olive orchard[J]. Soil and Tillage Research, 144: 96-109. |
Ruta M. 2011. As(Ⅴ)-reduction to As(Ⅲ) by arsenic-resistant Bacillus spp.bacterial strains isolated from low-contaminated sediments of the Oliveri-Tindari Lagoon, Italy[J]. Chemistry in Ecology, 27(3): 207-219. |
Sheik C S, Mitchell T W, Rizvi F Z, et al. 2012. Exposure of soil microbial communities to chromium and arsenic alters their diversity and structure[J]. PLoS One, 7(6): e40059. |
Sun Y, Sun G, Xu Y, et al. 2013. Assessment of natural sepiolite on cadmium stabilization, microbial communities, and enzyme activities in acidic soil[J]. Environmental Science and Pollution Research, 20(5): 3290-3299. |
申丽, 李振桦, 曾伟民, 等. 2018. 株洲清水塘工业区周边土壤微生物群落特征[J]. 环境科学, 39(11): 5151-5162. |
沈冰洁, 祝贞科, 袁红朝, 等. 2015. 不同种植方式对亚热带红壤微生物多样性的影响[J]. 环境科学, 36(10): 3839-3844. |
宋伟, 陈百明, 刘琳. 2013. 中国耕地土壤重金属污染概况[J]. 水土保持研究, 20(2): 293-298. |
Tang J, Zhang J, Ren L, et al. 2019. Diagnosis of soil contamination using microbiological indices:A review on heavy metal pollution[J]. Journal of Environmental Management, 242: 121-130. |
Tangaromsuk J, Pokethitiyook P, Kruatrachue M, et al. 2002. Cadmium biosorption by Sphingomonas paucimobilis biomass[J]. Bioresource Technology, 85(1): 103-105. |
Tipayno S C, Truu J, Samaddar S, et al. 2018. The bacterial community structure and functional profile in the heavy metal contaminated paddy soils, surrounding a nonferrous smelter in South Korea[J]. Ecology and Evolution, 8(12): 6157-6168. |
van Dijk T. 2007. Complications for traditional land consolidation in Central Europe[J]. Geoforum, 38(3): 505-511. |
Wang X, Hu M, Xia Y, et al. 2012. Pyrosequencing analysis of bacterial diversity in 14 wastewater treatment systems in China[J]. Applied and Environmental Microbiology, 78(19): 7042-7047. |
Wu B, Hou S, Peng D, et al. 2018. Response of soil micro-ecology to different levels of cadmium in alkaline soil[J]. Ecotoxicology and Environmental Safety, 166: 116-122. |
Wu C, Huang J, Zhu H, et al. 2019. Spatial changes in soil chemical properties in an agricultural zone in southeastern China due to land consolidation[J]. Soil and Tillage Research, 187: 152-160. |
Wu Q, Sanford R, Löffler F. 2006. Uranium(Ⅵ) reduction by Anaeromyxobacter dehalogenans strain 2CP-C[J]. Applied and Environmental Microbiology, 72(5): 3608-3614. |
王军, 钟莉娜, 应凌霄. 2018. 土地整治对生态系统服务影响研究综述[J]. 生态与农村环境学报, 34(9): 803-812. |
Xiao X, Wang M, Zhu H, et al. 2017. Response of soil microbial activities and microbial community structure to vanadium stress[J]. Ecotoxicology and Environmental Safety, 142: 200-206. |
Xu Y, Niu L, Qiu J, et al. 2018. Stereoselective accumulations of hexachlorocyclohexanes (HCHs) are correlated with Sphingomonas spp.in agricultural soils across China[J]. Environmental Pollution, 240: 27-33. |
徐继敏, 张平, 廖柏寒, 等. 2018. 生物质炭对湘南矿区轻度Pb污染土壤性质及Pb的累积转运影响[J]. 农业环境科学学报, 37(2): 259-267. |
Yang Q, Li Z, Lu X, et al. 2018. A review of soil heavy metal pollution from industrial and agricultural regions in China:Pollution and risk assessment[J]. Science of The Total Environment, 642: 690-700. |
Yang S, Zhao J, Chang S X, et al. 2019. Status assessment and probabilistic health risk modeling of metals accumulation in agriculture soils across China:A synthesis[J]. Environment International, 128: 165-174. |
闫华, 欧阳明, 张旭辉, 等. 2018. 不同程度重金属污染对稻田土壤真菌群落结构的影响[J]. 土壤, 50(3): 513-521. |
Yu X, Yang L, Fei S, et al. 2018. Effect of soil layer and plant-soil interaction on soil microbial diversity and function after canopy gap disturbance[J]. Forests, 9(11): 680. |
Zhang F, Li C, Tong L, et al. 2010. Response of microbial characteristics to heavy metal pollution of mining soils in central Tibet, China[J]. Applied Soil Ecology, 45(3): 144-151. |
Zhang Q, Luo H, Yan J. 2012. Integrating biodiversity conservation into land consolidation in hilly areas-A case study in southwest China[J]. Acta Ecologica Sinica, 32(6): 274-278. |
Zhao Y, Wang Y, Wang L, et al. 2019. Exploring the role of land restoration in the spatial patterns of deep soil water at watershed scales[J]. CATENA, 172: 387-396. |
Zhou L, Li H, Zhang Y, et al. 2016. Sphingomonas from petroleum-contancinated soils in shenfu, China and their PAHs degradation abilities[J]. Brazilian Journal of Microbiology, 47(2): 271-278. |
展晓莹, 任意, 张淑香, 等. 2015. 中国主要土壤有效磷演变及其与磷平衡的响应关系[J]. 中国农业科学, 48(23): 4728-4737. |
 2020, Vol. 40
2020, Vol. 40


