离子液体(Ionic liquids, ILs)是由有机阳离子与有机或无机阴离子组成的、在室温下呈液态的有机盐, 是一种性质稳定、溶点低、不易挥发的新型绿色溶剂(Baker et al., 2005), 因而被广泛用于化学合成(Shultz et al., 2019)、电化学与催化(Yuan et al., 2019)、萃取和分离(Wang et al., 2019)、生物材料制备(Marr et al., 2016; Wasilewski et al., 2017)等多个领域.
近年来, 随着对ILs研究的深入, 人们发现ILs并非完全绿色, 某些ILs甚至是有毒的.一些研究资料表明, ILs对多种生物均有毒性, 如小麦幼苗(Xu et al., 2018)、三角褐藻(Deng et al., 2017)、斑马鱼(Zhang et al., 2017)、大肠杆菌(Borkowski et al., 2016)和HepG2细胞(Wan et al., 2018)等.进一步研究发现, 影响ILs毒性的因素主要有:阳离子骨架(Bubalo et al., 2014)、阴离子基团(Frade et al., 2013)和烷基侧链的长度(Shao et al., 2018).此外, ILs的浓度(Chen et al., 2018)、特殊离子基团的相互组合(Frade et al., 2013)等可以增强ILs的毒性.
本课题组前期开展了咪唑基ILs([Cn mim]Br)对小鼠的急性毒性研究, 发现当烷基侧链长度为14时, [Cn mim]Br的毒性最强(徐红梅等, 2013); 进一步研究发现, [C14mim]Br对小鼠的肝脏损伤最为严重.由于目前的研究多集中在对ILs的急性毒性方面, 而对ILs的亚慢性毒性研究鲜见报道.因此, 本实验通过观察大鼠体重变化、血清生化指标、脏体系数及组织病理学改变等指标, 考察[C14mim]Br亚慢性染毒对SD大鼠的毒性作用, 以期为更全面地评价ILs的毒性作用提供实验参考依据.
2 材料与方法(Materials and methods) 2.1 离子液体[C14mim]Br购自中科院兰州化学物理研究所, 纯度≥99%, 结构如图 1所示.
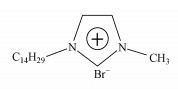 |
| 图 1 [C14mim]Br的结构式 Fig. 1 Structure of [C14mim]Br |
健康SD大鼠60只(6周龄), 雌、雄各半, 体重约为90~120 g, 由安徽医科大学动物养殖中心提供, 生产许可证为SCXK(皖)2017-001.大鼠饲养于标准动物房内(温度20~22 ℃, 湿度65%~75%), 自然光照, 动物自由饮水、饮食.
2.3 试剂生理盐水(0.9%氯化钠注射液)购自丰原药业有限公司, 批号为160701131;甲醛溶液(37.0%~40.0%)购自烟台双双有限公司, 批号为20180301;无水乙醇购自上海中试化工总公司, 批号为20181010.
2.4 实验仪器实验仪器包括DHG-9071A电热恒温干燥箱(上海精宏实验设备有限公司)、JA2004N电子天平(上海精密科学仪器有限公司)、CT14RD高速离心机(Thermo公司)、PUZS-300全自动生化分析仪(普朗医疗器械公司)、RM2245Leica切片机(德国莱卡公司)、IX71显微镜(OLYMPUS公司)、微量移液器(北京东南仪诚实验室设备有限公司).
2.5 [C14mim]Br溶液的配制实验前, 分别精密称取100、50及25 mg的[C14mim]Br, 各自溶于100 mL蒸馏水中, 依次得到浓度为1、0.5和0.25 mg · mL-1的[C14mim]Br溶液.
2.6 动物染毒及指标检测 2.6.1 [C14mim]Br对大鼠的亚慢性染毒60只SD大鼠适应性饲养一周后, 随机均分成5组, 雌雄各半.根据前期测得的[C14mim]Br的LD50值(49.7 mg · kg-1), 设置3个染毒组、1个对照组和1个染毒恢复组(表 1), 对大鼠进行灌胃染毒(1 mL/100 g体重), 每天1次, 连续3个月, 对照组大鼠灌胃等容积的蒸馏水.染毒后逐日观察, 记录各组大鼠的中毒反应, 包括毛发光泽、活动状态、粪便颜色、死亡数等.每周称量并记录大鼠体重, 计算其体重变化率.染毒恢复组在停止染毒后, 继续观察1个月.
| 表 1 大鼠分组与染毒剂量 Table 1 Group of rats and contamination dose |
末次染毒后, 将大鼠麻醉, 腹主动脉取血, 静置30 min, 3500 r · min-1离心10 min, 取血清, 在全自动生化仪上检测丙氨酸氨基转移酶(Alanin eaminotransferase, ALT)、天门冬氨酸转氨酶(Aspartate aminotransferase, AST)、直接胆红素(Direct bilirubin, DBIL)、总胆红素(Total bilirubin, TBIL)等生化指标.
2.6.3 脏器指数大鼠取血后, 立即解剖并分离其肝、肾、脾、胃、小肠和大肠, 用预冷的生理盐水清洗血污, 滤纸吸干水分, 称重.根据测得的各器官的质量, 计算脏器指数.
2.6.4 组织病理学检查将分离得到的各组大鼠的脏器组织用10%甲醛溶液固定, 采用不同浓度梯度的乙醇逐级脱水, 石蜡包埋, 切片, 脱蜡, HE染色, 在Olympus显微镜下观察大鼠脏器组织的病理学变化.
2.7 数据统计与分析采用SPSS 17.0统计分析软件, 组间差异采用单因素方差(ANOVE)结合最小显著性差异法LSD-t检验比较, p < 0.05表示差异具有统计学意义, 并用Origin 8.0软件绘图.
3 结果(Results) 3.1 大鼠中毒体征观察在染毒过程中, 随着染毒时间的增加, 大鼠的毒性反应增强, 表现为被毛凌乱竖立, 呼吸急促, 身体颤抖、蜷缩, 不断嗝气, 腹泻或粪便颜色变深.1/5 LD50组大鼠除出现上述现象外, 还出现精神萎靡不振、行走不稳等中毒症状.雌、雄大鼠的毒性反应相似.
3.2 [C14mim]Br对大鼠体重的影响由图 2可以看出大鼠体重的变化趋势:与对照组相比, 早期染毒组大鼠(雌性2~9周, 雄性2~6周)体重的增长量随着剂量的升高而降低; 中期大鼠(雌性10~11周, 雄性7~10周)的体重增长量与正常组大鼠基本一致; 而在染毒的后期, 大鼠(雌性12~16周, 雄性11~16周)体重增长量随着染毒剂量的增加而增大.究其原因, 可能是染毒初期ILs的毒性对大鼠生长具有抑制作用, 而后期体重增加的部分原因可能是由于毒性引起组织水肿及增生所致.
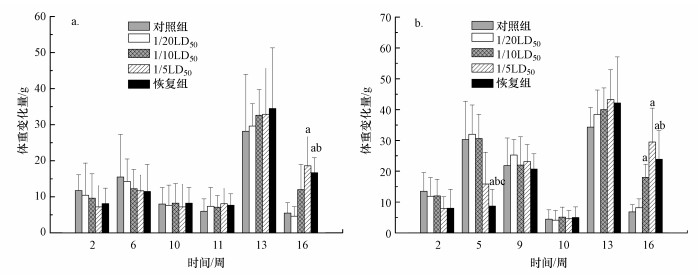 |
| 图 2 [C14mim]Br亚慢性染毒对大鼠体重的影响(x±S, n=6) (a.雌性大鼠; b.雄性大鼠; 图中a、b、c分别表示与对照组、1/20 LD50和1/10 LD50相比, 差异显著, p < 0.05) Fig. 2 Effects of [C14mim]Br subchronic exposure on body weight of rats(x±S, n=6)(a.male rats; b.female rats) |
表 2、表 3数据显示, 与对照组相比, [C14mim]Br对染毒组雌、雄大鼠的心、脾脏器指数几乎无影响, 而使其肝、肾、肺的脏器指数略有升高; 与1/5 LD50组相比, 恢复组大鼠肝、肾、肺的脏器指数略有下降; 各组脏器指数间无统计学差异.
| 表 2 [C14mim]Br亚慢性染毒对雌性大鼠脏器指数的影响(n=6) Table 2 Effect of [C14mim]Br subchronic exposure on the ratio of viscera in female rats |
| 表 3 [C14mim]Br亚慢性染毒对雄性大鼠脏器指数的影响(n=6) Table 3 Effect of [C14mim]Br subchronic exposure of on the ratio of viscera in male rats |
从表 4、表 5中可以看出, 与对照组相比, 随着剂量的增加, 各染毒组雌、雄大鼠的ALP、ALT、AST、TBIL、GLB和DBIL水平显著升高(p < 0.05);ALB、TP及A/G值明显降低(p < 0.05);与1/5 LD50组相比, 恢复组大鼠的各项指标均有一定程度的改善, 其中, 雌、雄大鼠血清中ALP、ALT和AST得到明显改善(p < 0.05).上述结果显示, [C14mim]Br对大鼠肝脏的损伤与剂量相关, 停止染毒后, 肝损伤有一定程度的恢复.
| 表 4 [C14mim]Br亚慢性染毒对雄性大鼠生化指标的影响(n=6) Table 4 Effect of [C14mim]Br subchronic exposure on biochemical parameters of male rats |
| 表 5 [C14mim]Br亚慢性染毒对雌性大鼠生化指标的影响(n=6) Table 5 Effect of [C14mim]Br subchronic exposure on biochemical parameters of female rats |
组织病理学检查显示, 对照组大鼠的肝细胞形态正常, 肝细胞索排列整齐, 肝小叶结构清晰(图 3a).大鼠染毒后, 随着剂量的增加, 肝脏依次出现汇管区少量炎细胞浸润(图 3b)、肝细胞点状坏死及少量灶性坏死(图 3c)、大量炎细胞浸润、肝实质出现多个梗死灶等病变(图 3d).停止染毒一个月后, 大鼠肝组织可见大量脂肪空泡(图 3e).上述结果表明, 随着染毒剂量的增加, 大鼠肝脏受损程度增强, 且停止染毒后难以完全恢复.
 |
| 图 3 大鼠肝组织病理切片(HE染色, 100×; a.正常大鼠; b~d分别为1/20 LD50、1/10 LD50和1/5 LD50组大鼠; e.恢复组大鼠) Fig. 3 Histological sections of livers in rats(HE staining, 100×; a.normal rat; b~d.groups of rats treated with [C14 mim]Br at dosages of 1/20 LD50, 1/10 LD50 and 1/5 LD50 respectively; e. recovery group of rat) |
从光镜下可以看出, 对照组大鼠肾脏的皮质、髓质界限清楚, 肾小球、肾小管结构正常(图 4a).随着染毒剂量的增加, 染毒组大鼠的肾脏依次出现肾小管上皮细胞脱落、肾小球变性萎缩(图 4b、4c)、肾间质淋巴细胞浸润(图 4c、4d)、肾实质消失(图 4d)等病变.停止染毒一个月后, 大鼠肾皮、髓质界限尚清楚, 肾小球变性萎缩(图 4e).上述结果表明, 随着染毒剂量的增加, 肾脏受损程度增强, 停止染毒后, 肾损伤有一定程度的恢复.
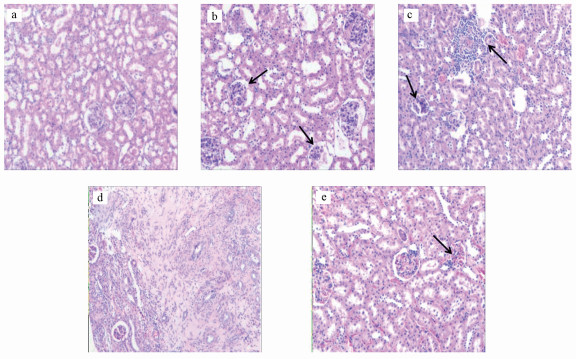 |
| 图 4 大鼠肾组织病理切片(HE染色, 100×; a.正常大鼠; b~d分别为1/20 LD50、1/10 LD50和1/5 LD50组大鼠; e.恢复组大鼠) Fig. 4 Histological sections of kidneys in rats(HE staining, 100×; a. normal rat; b~d. groups of rats treated with [C14 mim]Br at dosages of 1/20 LD50, 1/10 LD50 and 1/5 LD50 respectively; e. recovery group of rat) |
HE染色结果显示, 对照组大鼠的肺组织结构清晰、完整(图 5a).[C14mim]Br染毒后, 各组大鼠肺组织依次出现炎性渗出、水肿(图 5b)、个别支气管管腔坏死(图 5c)、肺泡间距增大、肺淤血(图 5d)等病变, 而恢复组大鼠仅见肺泡间距增大(图 5e).上述结果表明, [C14mim]Br对大鼠肺部的损伤随着剂量的增加而增强.
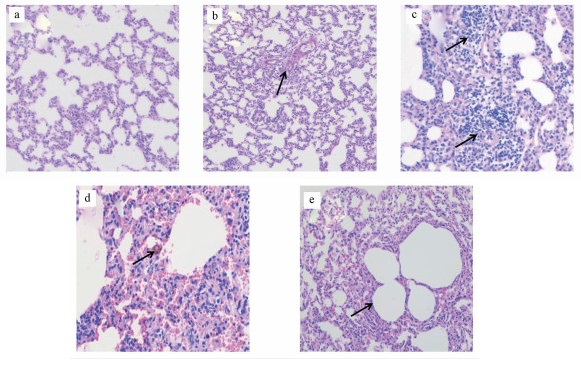 |
| 图 5 大鼠肺组织病理切片(HE染色, 100×; a.正常大鼠; b~d分别为1/20 LD50、1/10 LD50和1/5 LD50组大鼠; e.恢复组大鼠) Fig. 5 Histological sections of lungs in rats(HE staining, 100×; a. normal rat; b~d. groups of rats treated with [C14 mim]Br at dosages of 1/20 LD50, 1/10 LD50 and 1/5 LD50 respectively; e. recovery group of rat) |
镜检结果显示, 1/5 LD50染毒组大鼠的心、脾、胃及肠结构完整, 与对照组比较, 未出现明显异常和病变(图 6b、6d、6f、6h).上述结果表明, [C14mim]Br对大鼠的心、脾、胃及肠没有明显的损伤.
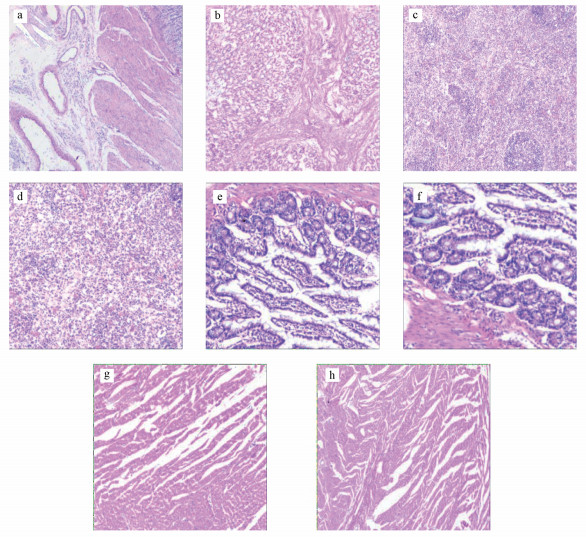 |
| 图 6 大鼠其他组织病理切片(HE染色, 100×, a、c、e、g.正常大鼠胃、脾、肠、心组织; b、d、f、h. 1/5 LD50组大鼠胃、脾、肠、心组织) Fig. 6 Other histopathological sections of rats (HE staining, 100×; a, c, e, g. normal rats of stomach, spleen, intestinal, cardiac tissue; b, d, f, h. 1/5 LD50 rats of stomach, spleen, intestinal, cardiac tissue) |
肝脏是机体内最重要的代谢和解毒器官, 它可通过一系列代谢酶的作用, 将进入体内的有毒物质转化为低毒或无毒物排出体外.转氨酶在体内代谢过程中起着重要的作用, 尤以ALT、AST最为重要.当肝细胞发生变性、细胞膜通透性增大时, 位于胞浆中的ALT可进入血液; 而当肝细胞发生严重病变或坏死时, 位于线粒体内的AST也逸出细胞.因此, 血清中ALT、AST能敏感地反映肝细胞的损伤及程度.血清中碱性磷酸酶(Alkaline phosphatase, ALP)主要来自于肝脏、骨骼和肠道, 当胆道梗阻严重时, ALP水平显著升高(Li et al., 2015).胆红素由肝脏产生, 经胆道排泄, 胆红素的测定包括DBIL和TBIL, 当肝脏排泄功能受损、出现胆汁淤积时, 可引起DBIL和TBIL的异常升高(Wang et al., 2019).白蛋白(Albumin, ALB)和球蛋白(Globulin, GLB)是血清总蛋白(Total Protein, TP)的组成成分, 在炎症反应中起重要作用.TP和A/G(ALB水平下降, GLB水平升高)降低, 反映肝脏合成功能下降和慢性炎症的发生(Li et al., 2018).已有的研究资料表明, 具有较长烷基链的ILs可破坏细胞膜的结构(Gal et al., 2012; Sónia et al., 2013), 使小鼠血清中ALT、AST数值升高(Xu et al., 2013).本实验中, 大鼠染毒90 d后, 其血清中AST、ALT、ALP、DBIL和TBIL均显著升高, 表明[C14mim]Br可能通过破坏肝细胞膜结构, 使血清中代谢酶数值升高, 产生毒性反应.而肝细胞变性或坏死, 导致肝脏分泌与排泄功能受损, 从而引起胆道梗阻和胆汁淤积.此外, 染毒组大鼠血清中TP减少, ALB水平降低, GLB数值升高, A/G下降, 提示[C14mim]Br对大鼠肝脏合成功能也产生了影响.病理检查结果显示, 染毒组大鼠的肝细胞出现水肿、坏死、胆汁淤积、炎细胞浸润等病变, 进一步提示[C14mim]Br染毒对大鼠肝脏的损伤作用.与1/5 LD50组相比, 恢复组大鼠血清中AST、ALT、ALP等都有明显降低, 表明停止染毒后, 大鼠肝脏的损伤有一定程度的恢复.实验中还发现, [C14mim]Br不仅对大鼠肝脏具有严重损害作用, 对大鼠的肾、肺也有一定程度的损伤, 可导致肾小球萎缩、肺水肿等病变, 且随着染毒剂量的增加, 其损害作用有增强的趋势.由此可见, 不仅肝脏是[C14mim]Br毒性作用的靶器官, 肾和肺也有可能是[C14mim]Br攻击的主要器官.
5 结论(Conclusions)离子液体[C14mim]Br亚慢性染毒, 对大鼠的肝脏及其功能具有显著毒性, 且其毒性呈剂量依赖性; 停止染毒后, 大鼠受损的肝功能有一定程度的恢复; 肾和肺也有可能是[C14mim]Br毒性作用的重要靶器官.
Baker G A, Baker S N, Pandey S, et al. 2005. An analytical view of ionic liquids[J]. The Royal Society of Chemistry, 130: 800-808. |
Borkowski A, Lawniczak L, Clapa T, et al. 2016. Different antibacterial activity of novel theophylline-based ionic liquids-Growth kinetic and cytotoxicity studies[J]. Ecotoxicology and Environmental Safety, 13: 54-64. |
Bubalo M C, Hanousek K, Radošević K, et al. 2014. Imidiazolium based ionic liquids:Effects of different anions and alkyl chains lengths on the barley seedlings[J]. Ecotoxicology and Environmental Safety, 101: 116-123. DOI:10.1016/j.ecoenv.2013.12.022 |
Chen Z L, Zhou Q, Guan W, et al. 2018. Effects of imidazolium-based ionic liquids with different anions on wheat seedlings[J]. Chemosphere, 194: 20-27. DOI:10.1016/j.chemosphere.2017.11.145 |
Deng X Y, Li D, Wang L, et al. 2017. Potential toxicity of ionic liquid([C12 mim]BF4) on the growth and biochemical characteristics of a marine diatom Phaeodactylum tricornutum[J]. Science of the Total Environment, 586: 675-684. DOI:10.1016/j.scitotenv.2017.02.043 |
Gal N, Malferarri D, Kolusheva S, et al. 2012. Membrane interactions of ionic liquids:Possible determinants for biological activity and toxicity[J]. Biochimica et Biophysica Acta, 1818(12): 2967-2974. DOI:10.1016/j.bbamem.2012.07.025 |
Li R J, Zhang M, Wang Y, et al. 2018. Effects of sub-chronic exposure to atmospheric PM2.5 on fibrosis, inflammation, endoplasmic reticulum stress and apoptosis in the livers of rats[J]. The Royal Society of Chemistry, 7: 271-282. |
李飞, 陆伦根. 2015. 肝功能异常的评估及临床意义[J]. 临床肝胆病杂志, 31(9): 1543-1546. DOI:10.3969/j.issn.1001-5256.2015.09.046 |
Marr P C, Marr A C. 2016. Ionic liquid gel materials:applications in green and sustainable chemistry[J]. Green Chemistry, 18(1): 105-128. DOI:10.1039/C5GC02277K |
Frade R F M, Simeonov S, Rosatella A A, et al. 2013. Toxicological evaluation of magnetic ionic liquids in human cell lines[J]. Chemosphere, 92: 100-105. DOI:10.1016/j.chemosphere.2013.02.047 |
Shao Y T, Wang J, Du Z K, et al. 2018. Toxicity of 1-alkyl-3-methyl imidazolium nitrate ionic liquids to earthworms:The effects of carbon chains of different lengths[J]. Chemosphere, 206: 302-309. DOI:10.1016/j.chemosphere.2018.04.114 |
Shultz Z, Gaitor J C, Burton R D, et al. Phosphorodithioate-functionalized ionic liquids: Synthesis and physicochemical properties characterization[J].Journal of Molecular Liquids, 276: 334-337
|
Sónia P M V, Ana M M G, Tánia S, et al. 2013. Designing ionic liquids:The chemical structure role in the toxicity[J]. Ecotoxicology, 22(1): 1-12. |
Wasilewski T, Gębicki J, Kamysz W. 2017. Prospects of ionic liquids application in electronic and bioelectronic nose instruments[J]. Trends in Analytical Chemistry, 93: 23-36. DOI:10.1016/j.trac.2017.05.010 |
Wang G W, Zhang X L, Wu Q H, et al. 2019. The hepatoprotective effects of Sedum sarmentosum extract and its isolated major constituent through Nrf2 activation and NF-κB inhibition[J]. Phytomedicine, 53: 263-273. DOI:10.1016/j.phymed.2018.09.023 |
Wang L Y, Guo Q J, Lee M S. 2019. Recent advances in metal extraction improvement:Mixture systems consisting of ionic liquid and molecular extractant[J]. Separation and Purification Technology, 210: 292-303. DOI:10.1016/j.seppur.2018.08.016 |
Wan R Y, Xia X H, Wang P J, et al. 2018. Toxicity of imidazoles ionic liquid[J]. Toxicology in Vitro, 52: 1-7. DOI:10.1016/j.tiv.2018.05.013 |
Xu Y Q, Wang J, Zhu L S, et al. 2018. Physiological and biochemical responses of wheat (Triticum aestivum L.) seedlings to three imidazolium-based ionic liquids in soil[J]. Chemosphere, 191: 81-88. DOI:10.1016/j.chemosphere.2017.09.108 |
徐红梅, 任娜, 宣怡红, 等. 2013. 四氟硼酸化1-烷基-3-甲基咪唑基离子液体对小鼠的急性经口毒性[J]. 环境科学学报, 33(1): 298-303. |
徐红梅, 宣怡红, 江云, 等. 2013. 溴化1-十四烷基-3-甲基咪唑对小鼠的肝脏毒性及其作用机制[J]. 生态毒理学报, 8(5): 791-798. |
Yuan F, Chi S, Dong S. 2019. Ionic liquid crystal with fast ion-conductive tunnels for potential application in solvent-free Li-ion batteries[J]. Electrochimica Acta, 294: 249-259. DOI:10.1016/j.electacta.2018.10.079 |
Zhang C, Zhu L S, Wang J H, et al. 2017. The acute toxic effects of imidazolium-based ionic liquids with different alkyl-chain lengths and anions on zebrafish (Danio rerio)[J]. Ecotoxicology and Environmental Safety, 140: 235-240. DOI:10.1016/j.ecoenv.2017.02.054 |
 2020, Vol. 40
2020, Vol. 40


