对硝基苯酚(p-nitrophenol, PNP)作为重要的工业品或原材料, 广泛的应用于各种合成工业, 同时也可以由杀虫剂降解产生, 因此被美国环保属(EPA)列为控制优先污染物名单(Wu et al., 2015).因其在环境中难以被降解, 因而对人类的健康存在巨大的危害(Tao et al., 2013).近几年来, 在河水、土壤、污水和地下水中都检测到了PNP的存在.由于PNP的毒性而导致的环境污染问题已经引起全球的关注.因此含PNP废水在排放前必须进行处理, 以保护环境和人类的健康.
生物电化学系统(bioelectrochemical system, BES)能利用微生物产生不同的化学物质或者能量(Wang and Ren, 2013), 由于这项技术具有高效污染物去除能力、易于控制且环境友好的优点, 因此受到了广泛的关注(Chen et al., 2016).BES耦合其他常规水处理技术已被用于PNP降解的研究(Shen et al., 2012;2014).生物阴极BES已被用来降解PNP.本实验室开展了以碳酸氢钠和葡萄糖作为底物降解PNP的研究, 发现产物均为对氨基苯酚, 都能获得较好的降解效果(Wang et al., 2016; 2018).碳是生命必须的元素之一, 生物阴极微生物生长需要碳源, 因此碳源对微生物的种类影响很大(Toshifumi et al., 2008).BES降解PNP的研究主要集中在PNP浓度、电流密度、底物浓度、水力停留时间和外电阻等的影响(Jiang et al., 2016; Shen et al., 2015).碳酸盐在生物阴极中是一种低成本的碳源, 在实验室中葡萄糖也是常用的碳源之一.此外在不同底物的反应器中, 碳源转换和电压转换对PNP去除率的影响目前研究很少.
因此本研究探讨了碳酸氢钠和葡萄糖为底物的反应器对PNP的降解效能.利用双室生物阴极电化学反应器, 研究有机碳源(葡萄糖)和无机碳源(碳酸氢钠)对PNP降解效能和阴极微生物群落结构的影响, 碳源转换和电压转换对PNP去除的影响, 为BES应用于PNP废水处理工程奠定理论基础.
2 材料和方法(Materials and methods) 2.1 反应器的构型本研究中采用H型双室玻璃反应器构建有机碳源(葡萄糖, RGlucose)和无机碳源(碳酸氢钠, RNaHCO3)生物阴极BES反应器.以阳离子交换膜(CMI7000, Membranes International Inc., USA)分隔为阴极室和阳极室, 每室有效体积为300 mL.以碳刷作为电极, 外电阻为10 Ω, 外加电压0.5 V, Ag/AgCl电极作为参比电极(0.247 V VS SHE, 上海雷磁, 中国)固定于阴极室(Wang et al., 2016).
2.2 反应器的启动及运行以哈尔滨文昌污水处理厂生活污水接种反应器的阴极和阳极.阳极液为1.67 g · L-1乙酸钠, 维生素母液(Lu et al., 2012)和微量元素母液(Lovley and Phillips, 1988)溶于50 mmol · L-1磷酸盐缓冲液(KCL 0.13 g · L-1, NH4CL 0.31 g · L-1, Na2HPO4 4.58 g · L-1, NaH2PO4 2.45 g · L-1)中;阴极液采用人工配水, 分别以碳酸氢钠和葡萄糖作为碳源, 50 mmol · L-1磷酸盐缓冲液, 加入维生素母液和微量元素母液, 加入20 mg · L-1 PNP作为目标污染物, 培养温度为(25±2) ℃.每个反应重复测定3次.完成1次碳源转换和电压转换后, 反应器恢复7 d, 再进行试验.
2.3 分析和计算在浓度测试前, 所有样品均通过0.45 μm滤膜过滤.电压和阴极电势记录由Keithley2700数据记录仪(Keithley Co., Ltd., USA)自动采集和保存, 时间间隔为10 min.电流根据欧姆定律进行计算.
PNP浓度测定采用高效液相色谱法(model-e2695, Waters Co., USA)(Wang et al., 2018).PNP去除率根据进水和出水PNP浓度差值进行计算.出水pH值使用pH计(PHS-2F, 上海雷磁)测定.
2.4 生物阴极微生物群落结构分析取反应器阴极碳刷上生物膜提取总DNA.利用DNA试剂盒(PowerSoil, Mo-BIO, USA)提取样品总DNA, 所得的DNA进行454-焦磷酸高通量测序分析(美吉生物), 测序结果通过软件(QIIME)进行样品生物信息学分析(Wang et al., 2016; 2018).
3 结果和讨论(Results and discussion) 3.1 BES反应器启动及底物对反应器性能的影响反应器阴极电势用来评估反应器启动情况.当反应器电流保持稳定, 且阴极中黄色消失, 此时表明BES反应器生物阴极启动成功.碳源对BES反应器电压和电流密度的影响如图 1所示.碳源对阴极电势影响很小, RGlucose和RNaHCO3具有几乎相同的阴极电位且变化趋势基本相同, 在达到稳定时都可达到-1.0 V, 这表明碳源对反应器的性能变化影响不大.而反应器中电流具有比较明显的改变.0~20 h, 电流都出现了波动, 在20 h后都基本稳定在0.38 mA左右, 但对于RGlucose从2 h到16 h存在一个较高的电流峰值, 此时间段内RGlucose的电流要远高于RNaHCO3, 最高达到2.3 mA.这表明在2 h到16 h这段时间内RGlucose中具有更多的电子的产生, 因而会有更多的电子用于PNP的还原反应, 因此RGlucose具有高的电化学活性.
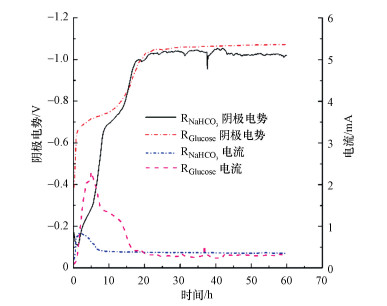 |
| 图 1 不同碳源类型下阴极电势和电流 Fig. 1 The effect of carbon source on the cathode potential and current |
检测电流和阴极电势的同时, 对反应器生物阴极出水的pH值也进行了检测.尽管阴极进液都使用了50 mmol · L-1 PBS, 阴极出水的pH出现了完全相反的变化(图 2).在RNaHCO3中的阴极出水pH呈碱性, 在60 h时达到7.4.而RGlucose阴极出水的pH则呈酸性, 60 h时为6.3.产生的主要原因是在RGlucose中葡萄糖被阴极微生物代谢产生了小分子挥发性有机酸(VFAs)而使pH降低.而pH在24 h后会有缓慢的上升, 这表明24 h葡萄糖已完全被微生物代谢掉, 随后阴极内的微生物以产物VFAs为底物因而使VFAs浓度减少, pH出现上升的趋势.
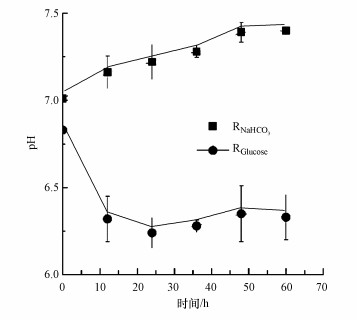 |
| 图 2 反应器生物阴极出水pH值 Fig. 2 The pH of the biocathode effluent |
对生物阴极降解PNP的效果也进行了检测.降解产物检测结果表明, 不论以葡萄糖为碳源还是以碳酸氢钠为碳源, PNP都被还原成对氨基苯酚(Wang et al., 2016; 2018).RGlucose和RNaHCO3都具有去除PNP的能力(图 3).在进水PNP浓度为40 mg · L-1时, 1 g · L-1碳源的条件下, RGlucose的PNP去除效果要明显高于RNaHCO3.其中, 在12 h和24 h时RGlucose中PNP去除率分别为47.6%和82.0%, 而在RNaHCO3中PNP去除率分别为10.2%和43.6%.在0~24 h中RGlucose中电流明显高于RNaHCO3, 这也说明了RGlucose具有更高的电化学活性, 因而具有更高的PNP去除效果.此外, 碳酸氢钠在生物阴极中降解PNP过程中只是作为生物阴极碳源而存在, 电极为PNP还原提供所需的电子, 而葡萄糖不仅可作为碳源, 还能作为电子供体提供更多的电子用作PNP还原反应, 因此, 葡萄糖作为碳源可以提供更多的电子以供PNP还原反应并且能够获得更高的生物量.葡萄糖作为生物阴极碳源时BES表现出更加突出的PNP去除能力.
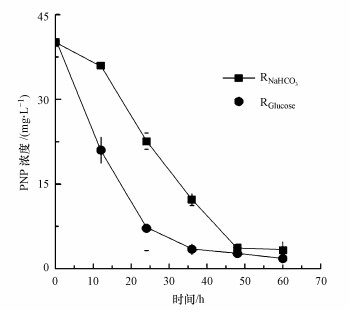 |
| 图 3 不同碳源对PNP去除的影响 Fig. 3 The effect of carbon source on PNP degradation |
实际工业废水处理面对的问题很多, 例如水质不稳定, 因此, 处理含PNP废水过程中生物阴极耐受碳源改变十分重要.RNaHCO3的阴极外加碳源由碳酸氢钠转换为葡萄糖, 再转换为碳酸氢钠时, 阴极电势曲线几乎不变, 而RGlucose阴极外加碳源由葡萄糖转换为碳酸氢钠, 在转换为葡萄糖时, 阴极电势略有升高(图 4A).而RNaHCO3和RGlucose中电流在碳源转换过程中均呈下降的趋势(图 4B).这说明碳源转换对阴极生物膜的冲击很大.
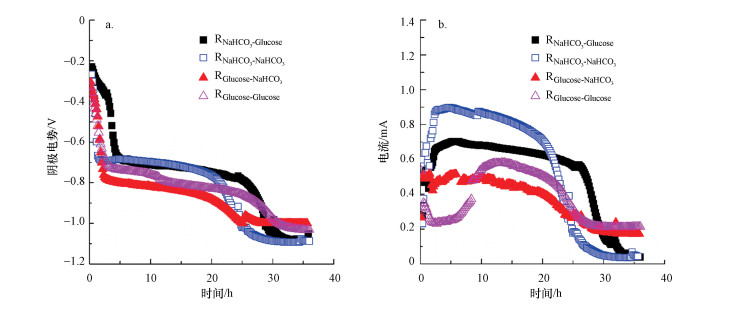 |
| 图 4 碳源转换时PNP降解过程中阴极电势(a)和电流(b) Fig. 4 The cathode potential (a) and current (b) of carbon source switchover of PNP degradation |
RNaHCO3和RGlucose的PNP去除速率常数随碳源转换分别从(0.022±0.002) h-1和(0.059±0.009) h-1减小到(0.018±0.001) h-1和(0.042±0.002) h-1, PNP去除率分别下降了36%和6.9%(表 1).碳源转换对于生物膜来说是营养含量不足, 不利于微生物的生长, 因此生物阴极无法充分发挥PNP降解的能力.合适的碳源对阴极微生物生长代谢提供足够的能量, 因而增强了PNP的去除.生物阴极BES系统在碳源转换后仍具有对PNP的降解能力, 这也证明外加电压对PNP降解的重要作用.生物阴极中碳源转换能够改变微生物群落结构及功能基因密度(Liang et al., 2014), 充分说明生物阴极在不同碳源条件下具有良好的适应能力和PNP降解能力.
| 表 1 碳源转换对PNP降解的影响 Table 1 The effect of carbon source switchover on PNP degradation |
外加电压能够改变BES中电流和离子迁移速率, 对PNP去除效率产生影响较大.外加电压转换下阴极电势和电流如图 5所示.阴极电势随着外加电压降低而升高.当外加电压为0 V时, RNaHCO3和RGlucose 36 h时阴极电势都由-1.0 V升高到-0.45 V, 外加电压转换为0.5 V时, RNaHCO3阴极电势下降到-1.0 V, 而RGlucose阴极电势下降到-0.82 V.电流变化随外加电压而改变, 当外加电压为0 V时, 电流几乎为0, 而外加电压为0.5 V时, 系统中电流也随着升高.这表明电压转换对RGlucose的阴极生物膜有影响.以往的研究表明外加电压在BES降解体系中起着重要的作用, 电场的存在为BES系统提供一个更简化的微环境, 为电子供体在还原过程中提供驱动力, 这是提高反应器降解PNP性能的关键(Wang et al., 2017).
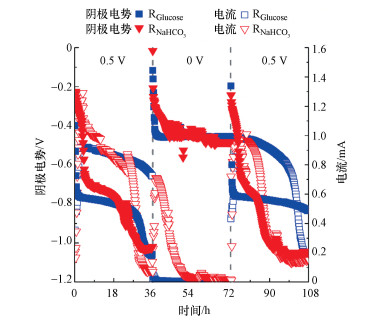 |
| 图 5 电压转换PNP降解过程中阴极电势和电流的变化 Fig. 5 The effect of applied voltage switchover on cathode potential and current during PNP degradation |
当外加电压从0.5 V转换为0 V时, RNaHCO3和RGlucose的PNP降解速率常数k分别下降到(0.004±0.00061) h-1和(0.007±0.0006) h-1, 再次转换为0.5 V时RNaHCO3和RGlucose的PNP降解速率常数k分别升高到0.022±0.002 h-1和0.062±0.004 h-1.外加电压为0 V时, RNaHCO3和RGlucose的PNP去除率(36 h)分别下降到17.1%±1.7%和26.7%±2.4%(图 6).表明单独存在的阴极生物膜对PNP也具有降解功能.当电压再次升高到0.5 V时, RNaHCO3和RGlucose的PNP去除率升高到79.4%±3.7%和89.2%±6.4%.而这表明外加电压在生物阴极BES降解PNP中起到了重要的作用.阴极电位降低表明阴极生物膜活性受到了影响.BES的外加电压对PNP降解是必要的, 外加电压提高了系统中电流, 使PNP在阴极更快速的被还原.外加电压为0 V时, 此时系统中没有电流, 这些结果表明外加电压能够促进PNP的降解.
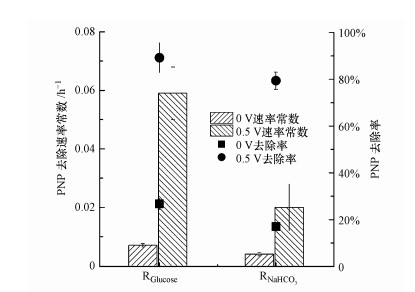 |
| 图 6 电压为0 V时及再转换为0.5 V时PNP去除速率常数及PNP去除率 Fig. 6 The PNP degradation constant rate and PNP degradation efficiency at applied voltage of 0 V and convert to 0.5 V |
当外加电压为0 V时, (图 6), 36 h时RNaHCO3和RGlucose PNP去除率为17.1%±1.75%和26.7%±2.4%, 而此时电流密度很低, 接近于0(图 6).这表明此时PNP的还原由阴极中的微生物完成的.由此可知, 外加电压的存在能够促进电子转移, 促进阴极生物膜的催化功能.对比0.5 V电压时PNP去除率, 可推测在低电压下对阴极生物膜的损害作用小于高电压, 因此, 在生物阴极实际应用中应该更加重视外加电压的调节和控制.
3.5 碳源类型对微生物群落结构的影响生物阴极可以被定义为由廉价的材料制成, 微生物作为催化剂来催化阴极的反应.目前大量的研究表明微生物群落结构决定了阴极的效能, 因此测定阴极微生物群落结构能更好的理解电流及PNP去除率的差异.测序结果表明在不同碳源存在下, 阴极微生物群落结构和相对丰度存在显著差异.在门水平上(图 7), 在RNaHCO3中优势门为Proteobacteria(85.6%), 而在RGlucose中优势门为Firmicutes(60.4%)和Bacteroidetes(31.9%).
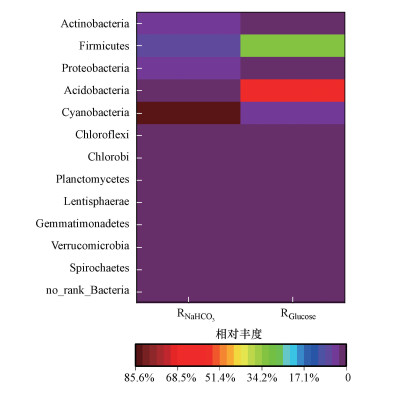 |
| 图 7 门水平热图 Fig. 7 The heatmap at the genus level |
在属水平上对阴极微生物群落结构进行比较, 有助于更好的理解碳源的作用.在RNaHCO3和RGlucose中存在32个相同的属(图 8), 相对于RGlucose的72个属, 在RNaHCO3中获得了更多的属(136个).这表明RNaHCO3中具有更复杂的群落结构.表 2在RNaHCO3和RGlucose生物阴极中相对丰度大于5%的8个属, RNaHCO3中富集到优势菌属为Delftia、Diaphorobacter、Aquamicrobium和Raoultella, 相对丰度总和为56%, 而这4个属在RGlucose中的相对丰度和仅为0.5%.在RGlucose中富集到的优势菌属为Streptococcus、Lactococcus、Dysgonomonas和Bacteroides, 相对丰度总和为84.6%, 相对应在RNaHCO3中这4个属的相对丰度总和是0.05%.这表明生物阴极微生物群落结构和类型受到碳源类型的影响.Delftia和Diaphorobacter菌属具有细胞外电子转移能力(Yamini et al., 2016).在RGlucose中优势属Dysgonomonas的能发酵葡萄糖(Lu et al., 2012), 并与电流产生相关(Watanabe et al., 2011).
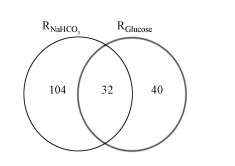 |
| 图 8 属水平venn图 Fig. 8 The venn of genus |
| 表 2 属水平生物阴极微生物群落结构分析(相对丰度大于5%) Table 2 The analysis of microbial communities of different carbon source at genus level (the relative abundance over 5%) |
已有研究表明, 在产生氢气的生物阴极MEC中, 阴极群落结构受很多因素的影响(如构型、营养分布和流动路径等, 碳源也是其中一个因素(Croese et al., 2014).本研究中, 由于反应器构型和接种物相同, 因而碳源种类成为了形成完全不同的阴极微生物群落的主要因素, 不同的阴极微生物群落导致了生物阴极对PNP降解能力的差异和反应器效能的差异.因此, 碳源也是影响生物阴极群落结构和效能的重要因素之一.
RNaHCO3中生物阴极生物膜的碳源来自于碳酸氢钠, 而能量只能来源于电极, 因此PNP还原所需的电子只能从阴极获得, 因此反应器RNaHCO3生物阴极生物膜在PNP还原过程中起到将电子从电极传递给PNP的作用.而在RGlucose中生物阴极功能除将电子从电极转移到PNP外, 溶液中游离的微生物还能利用葡萄糖产生额外电子供PNP还原作用, 因此RGlucose获得了远高于RNaHCO3的PNP降解效率.PNP对微生物具有抑制作用(Carrera et al., 2011), 以葡萄糖作为碳源获得了更大的阴极生物量且电极不是唯一的电子供体(Wang et al., 2018), 因而在面对碳源转换和电压转换时具有更快的适应能力和更好的效能.
4 结论(Conclusions)1) 碳源类型对反应器性能影响很大, 葡萄糖作为碳源获得更高的反应器效能.
2) 碳源类型影响PNP去除率, 在以葡萄糖为碳源时获得了更高的PNP去除效率, 在12 h和24 h时是以碳酸氢钠为碳源时的4倍和2倍.
3) PNP降解速率随着碳源改变而改变, 碳源由碳酸氢钠变成葡萄糖时, PNP降解率下降.外加电压在PNP降解过程中起重要作用.以葡萄糖为底物的生物阴极BES能够更好的耐受碳源和电压的转换.
4) 在相同的接种物和反应器运行条件下, 碳源类型对生物阴极微生物群落结构有显著影响.在门水平上, 以碳酸氢钠为底物的生物阴极主要为Proteobacteria, 而以葡萄糖为底物的生物阴极主要为Firmicutes和Bacteroidetes.
Carrera J, Martin-Hernanded M, Suarez-Ojeda M E, et al. 2011. Modelling the pH dependence of the kinetics of aerobic p-nitrophenol biodegradation[J]. Journal of Hazardous Materials, 186: 1947-1953. DOI:10.1016/j.jhazmat.2010.12.096 |
Chen D, Wang H Y, Yang K. 2016. Effective biodegradation of nitrate, Cr(VI) and p-fluoronitrobenzene by a novel three dimensional bioelectrochemical system[J]. Bioresource Technology, 203: 370-373. DOI:10.1016/j.biortech.2015.12.059 |
Croese E, Jeremiasse A W, Marshall I, et al. 2014. Influence of setup and carbon source on the bacterial community of biocathodes in microbial electrolysis cells[J]. Enzyme and Microbial Technology, 61-62: 67-75. DOI:10.1016/j.enzmictec.2014.04.019 |
Jiang X B, Shen J Y, Lou S, et al. 2016. Comprehensive comparison of bacterial communities in a membrane-free bioelectrochemical system for removing different mononitrophenols from wastewater[J]. Bioresource Technology, 216: 645-652. DOI:10.1016/j.biortech.2016.06.005 |
Liang B, Cheng H Y, Nostrand J D V, et al. 2014. Microbial community structure and function of Nitrobenzene reduction biocathode in response to carbon source switchover[J]. Water Research, 54: 137-148. DOI:10.1016/j.watres.2014.01.052 |
Lovley D R, Phillips E J P. 1988. Novel mode of microbial energy-metabolism-organic-carbon oxidation coupled to dissimilatory reduction of iron or manganese[J]. Applied and Environmental Microbiology, 54(6): 1472-1480. DOI:10.1128/AEM.54.6.1472-1480.1988 |
Lu L, Xing D F, Ren N Q, et al. 2012. Syntrophic interactions drive the hydrogen production from glucose at low temperature in microbial electrolysis cells[J]. Bioresource Technology, 124: 68-76. DOI:10.1016/j.biortech.2012.08.040 |
Shen J Y, Feng C C, Zhang Y Y, et al. 2012. Bioelectrochemical system for recalcitrant p-nitrophenol removal[J]. Journal of Hazardous Materials, 209-210: 516-519. DOI:10.1016/j.jhazmat.2011.12.065 |
Shen J Y, Zhang Y Y, Xu X P, et al. 2013. Role of molecular structure on bioelectrochemical reduction of mononitrophenols from wastewater[J]. Water Research, 47: 5511-5519. DOI:10.1016/j.watres.2013.06.025 |
Shen J Y, Xu X P, Jiang X B, et al. 2014. Coupling of a bioelectrochemical system for p-nitrophenol removal in an upflow anaerobic sludge blanket reactor[J]. Water Research, 67: 11-18. DOI:10.1016/j.watres.2014.09.003 |
Tao H C, Wei X Y, Zhang L J, et al. 2013. Degradation of p-nitrophenol in a BES-Fenton system based on limonite[J]. Journal of Hazardous Materials, 254-255: 236-241. DOI:10.1016/j.jhazmat.2013.03.061 |
Toshifumi O, Kosuke S, Sachiko Y, et al. 2008. Effects of carbon source on denitrification efficiency and microbial community structure in a saline wastewater treatment structure[J]. Water Research, 42: 3709-3718. DOI:10.1016/j.watres.2008.06.007 |
Wang D X, Hang H J, Han Y X, et al. 2017. Enhanced treatment of Fischer-Tropsch (F-T) wastewater using the up-flow anaerobic sludge blanket coupled with bioelectrochemical system:Effect of electric field[J]. Bioresource Technology, 232: 18-26. DOI:10.1016/j.biortech.2017.02.010 |
Wang H M, Ren Z J. 2013. A comprehensive review of microbial electrochemical systems as a platform technology[J]. Biotechnology Advances, 31: 1796-1807. DOI:10.1016/j.biotechadv.2013.10.001 |
Wang X Y, Xing D F, Mei X X, et al. 2018. Glucose and applied voltage accelerated p-nitrophenol reduction in biocathode of bioelectrochemical systems[J]. Frontiers in Microbiology, 9: 580. DOI:10.3389/fmicb.2018.00580 |
Wang X Y, Xing D F, Ren N Q. 2016. p-Nitrophenol degradation and microbial community structure in a biocathode bioelectrochemical system[J]. RSC Advances, 6: 89821-89826. DOI:10.1039/C6RA17446A |
Watanabe K, Miyahara M, Shimoyama T, et al. 2011. Population dynamics and current-generation mechanisms in cassette-electrode microbial fuel cells[J]. Applied Microbiology and Biotechnology, 92(6): 1307-14. DOI:10.1007/s00253-011-3598-3 |
Wu Z B, Yuan X Z, Zhong H, et al. 2016. Enhanced adsorptive removal of p-nitrophenol from water by aluminum metal-organic framework/reduced graphene oxide composite[J]. Scientific Reports, 6(1): 25638. DOI:10.1038/srep25638 |
Yamini J, Sarah F, Momper L M, et al. 2016. Isolation and characterization of electrochemically active subsurface delftia and azonexus species[J]. Frontiers in Microbiology, 7: 756. |
Zhang L B, Shen J Y, Xu K C, et al. 2016. Enhanced bioelectrochemical reduction of p-nitrophenols in the cathode of self-driven microbial fuel cells[J]. RSC advances, 6: 29072-29079. DOI:10.1039/C6RA04293G |
 2020, Vol. 40
2020, Vol. 40


