我国已成为抗生素生产和使用的大国(Cai et al., 2019), 目前抗生素被广泛应用于临床、畜牧、水产等行业.与此同时, 大量的残留抗生素持续不断地进入到水体当中, 据报道, 自然水环境和污水处理厂的抗生素残留已经非常普遍(Zheng et al., 2019).在污水处理厂的生物处理过程中, 污水中抗生素去除的主要机制是污泥吸附(Zhang et al., 2018).研究表明, 被污泥吸附富集的抗生素70%以上未被降解, 使得污泥成为一个重要的抗生素储存库.因此, 在污泥的处理处置过程中关注抗生素的归趋至关重要.此外, 污泥中抗生素的持久存在是导致抗性基因(ARGs)诱发和传播的重要因素, 并严重威胁到人类的健康.而污泥具有较高的微生物量, 也为ARGs的水平转移提供了潜在的传播环境.可移动基因原件(MEGs)如整合子已经被证明是人类致病菌获得抗性的重要途经之一(Zhu et al., 2013).因此, 应重点关注污泥处理处置的安全性, 尤其是对抗生素和ARGs消减的影响.
厌氧消化技术可以降解易腐有机质、消减抗生素和病原菌, 是国内外污泥稳定化处理的主流技术, 然而较低的生物转化效率和不充分的无害化效果限制了该技术的发展.有报道表明, 厌氧消化可以有效地消减ARGs, 但仍然存在厌氧消化会富集ARGs的现象(Ghosh et al., 2009;Guo et al., 2017).这可能是由于不同ARGs存在特定的宿主偏好, ARGs消减或富集与厌氧消化的生物群落有关.水热预处理不仅能够加速污泥基质结构的破坏和胞外聚合物的解体, 提高后续生物转化效率, 还能通过高温高压的作用, 实现污泥的消毒, 消减抗生素、ARGs和病原微生物, 是污泥实现无害化与资源化安全处置的重要手段.然而, 目前此类研究多集中于较低含固率(TS小于10%)的污泥, 对高含固率的脱水污泥研究较少.在高含固体系下, 水热预处理对抗生素、ARGs、病原微生物的消减效能及对污泥资源属性的影响尚未见报道.
因此, 本文以高含固污泥(TS为15%~20%)为研究对象, 考察不同水热温度对污泥无害化效能和资源化属性的影响.同时, 选取污泥中4种具有代表性的氟喹诺酮(FQs)抗生素、相关ARGs和MGEs及几种常见的病毒来表征水热处理的无害化效果, 并研究高含固污泥在水热处理后有机质的释放规律.
2 实验(Experiment) 2.1 材料与试剂试验所用的污泥样品为上海市某污水处理厂的机械脱水污泥, 其基本性质如表 1所示.本文选取4种污水中含量高的氟喹诺酮抗生素(Fluoroquinolones, FQs), 分别为氧氟沙星(Ofloxacin, OFL)、诺氟沙星(Norfloxacin, NOR)、环丙沙星(Ciprofloxacin, CIP)、洛美沙星(Lomefloxacin, LOM), 4种抗生素标准品及固相萃取小柱分别购自德国CNW公司和美国Waters公司, 甲醇、乙腈等色谱纯试剂分别购自上海安谱公司和上海国药公司, 试验用水为去离子水和Millipore水.
| 表 1 高含固污泥的理化性质 Table 1 Characteristics of the high solid sludge |
将70 g污泥加入到100 mL聚四氟乙烯内胆中, 然后将内胆放入反应釜中, 加盖旋转至紧.将数字式温度计的热电偶贴于反应釜的外表面, 在线检测外表面的温度, 接近于罐体内部污泥的温度.将反应罐放入设定目标温度(80、120、160、180 ℃)的烘箱内, 升温至目标温度后, 计时反应60 min, 取出罐体, 冷却到室温后打开罐体取样.
2.3 抗生素的检测原污泥和水热处理后污泥中抗生素的检测方法参考文献(戴晓虎等, 2016).具体操作如下, 污泥样品的预处理:向0.2 g冷干研磨后的污泥样品中加入20 mL碱式萃取液(三乙胺/甲醇/水以5/25/75比例混合的溶液), 振荡5 min充分混匀, 放入细胞破碎机中梯度增加功率破碎, 萃取5 min, 5000 r · min-1离心10 min, 收集上清液.重复上述步骤, 合并两次上清液.甲酸调节pH到3.0, 过0.45 μm膜, 滤液适当稀释后, 采用固相萃取柱萃取.萃取小柱用10 mL甲醇和10 mL超纯水活化, 液体样品以5 mL · min-1流速通过HLB柱, 采用5 mL 5%甲醇溶液淋洗, 负压真空抽10 min, 最后用6 mL 6%的氨水/甲醇洗脱剂洗脱.洗脱液在35 ℃水浴氮吹尽干, 用初始流动相定容到1 mL, 过0.45 μm的针孔滤膜, 保存于色谱小瓶, 待测.
色谱检测条件:采用Agilent Technologies1260高效液相色谱配备荧光检测器, 流动相及比例为磷酸-三乙胺溶液(pH=3.0)(A)80%和甲醇(B)20%, 采用Agilent XDB-C18柱(150 mm×4.6 mm, 5.0 μm), 进样体积为20 μL, 流量为1 mL · min-1, 柱温箱控温为30 ℃, 每个样品运行时间为18 min.采用梯度扫描波长, 0~9.5 min内激发波长为295 nm, 发射波长为500 nm;9.5~14 min内激发波长为278 nm, 发射波长为445 nm;14~18 min内激发波长为285 nm, 发射波长为470 nm.
2.4 抗性基因和病毒的检测抗性基因的检测:每个均质样品约10 g(原污泥或水热产物), 放置于-80 ℃超低温冰箱中冷冻干燥48 h;然后使用Fast® DNASpin试剂盒(MP Biomedicals, 美国)按照制造商的说明步骤提取冻干样品(0.25 g).DNA浓度检测采用QuantiFluor dsDNA系统(Promega, 美国), 使用ViiATM7实时PCR系统进行定量PCR(qPCR)反应(启因生物, 上海, 中国).本试验选择2种FQs抗性基因(qnrS和qnrA)、1种整合酶基因intl1及16S rRNA基因.
病毒的提取与检测:将10 g污泥与50 mL洗脱液(10%牛肉膏液, pH=7.2)混合, 于室温下以500 r · min-1搅拌30 min, 混合物在4 ℃、10000 g离心力下离心30 min, 收集上清液, 调整pH至7.2, 并通过0.22 μm滤膜过滤, 以去除残留细菌破碎物等.得到的滤液中添加8%聚乙二醇, 剧烈混合后于4 ℃下放置过夜, 在4 ℃、12000 g离心力下离心30 min, 收集沉淀, 直接进行DNA和RNA的提取与检测.DNA采用DNA快速提取试剂盒(TIANNAMP Soil DNA Kit, TIANGEN, 中国)进行提取, 使用StepOnePlutTM时荧光定量PCR(启因生物,上海,中国)进行检测;RNA采用Trizol法进行提取, 半进行逆转录PCR反应(启因生物,上海,中国).基因引物见表 2, PCR/RT-PCR反应参数参考文献(Cai et al., 2019).
| 表 2 抗性基因和病毒的引物序列表 Table 2 Sequences of primers for antibiotic resistance genes and viruses |
样品的总固体(TS)、挥发性有机质(VS)采用称重法测定.泥样用超纯水按质量比稀释, 稀释后的样品在10000 r · min-1下离心15 min, 经0.45 μm膜过滤后, 测定滤液中的SCOD、多糖、蛋白质、挥发性脂肪酸(VFA).碳水化合物采用蒽铜比色法测定, 蛋白质采用福林酚法测定, VFA测定时先将滤液用甲酸调节pH为2.0左右, 然后涡旋振荡, 采用气相色谱(Shimadzu GC 2010 Plus Column 30 m 0.25 mm ID)测定, 检测器为氢火焰离子检测器(FID).
3 结果与讨论(Results and discussion) 3.1 水热处理无害化效能 3.1.1 抗生素的降解水热处理高含固污泥的无害化效能如图 1所示.针对FQs抗生素的消减, 不同水热温度会显著影响高含固污泥中4类FQs抗生素总量的去除(图 1a).尽管在80 ℃处理条件下污泥中FQs总量并没有显著降低, 但随着温度的进一步升高, 抗生素的去除效果也越来越好.在160 ℃处理60 min的情况下, 总FQs去除率达到42.5%, 温度进一步升高至180 ℃时, 去除率达到59.5%.与此同时, 在高温处理条件下, CIP和LOM在污泥中并未检出, 表明水热处理可以有效去除CIP和LOM.然而, 在水热处理后的污泥中仍有一定量的抗生素残留, 如OFL和NOR在160 ℃水热处理后残留量分别为4.6 mg · kg-1和1.3 mg · kg-1(以干污泥计, 下同), 表明OFL和NOR在污泥中具有较高的稳定性.此结果与文献(Sun et al., 2019)报道的结果一致, 水热处理可以显著降低大部分种类抗生素的含量, 如热不稳定的β内酰胺抗生素(Cai et al., 2017), 但OFL和NOR的去除率相对较差.水热处理后残留的FQs可以通过后续的厌氧消化等生物过程实现进一步的去除, 从而满足污泥的无害化需求(Li et al., 2017).另一方面, 原污泥中较高含量的OFL和NOR也给水热处理彻底去除抗生素带来了难度.据报道, 我国剩余污泥中的FQs含量普遍高于国外, 如瑞士某水厂原剩余污泥中NOR和CIP的含量分别为1.96和2.03 mg · kg-1(Golet et al., 2002), 奥地利和瑞典某污水厂剩余污泥中FQs总含量分别低于1 mg · kg-1和5 mg · kg-1(Ferdig et al., 2005, Lindberg et al., 2005).因此, 有效规范我国抗生素的生产和使用对降低污水厂污泥无害化处理成本、消减环境安全风险至关重要.
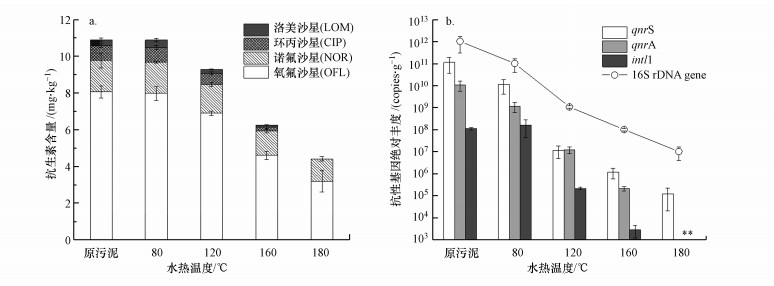 |
| 图 1 不同水热温度处理高含固污泥的无害化效果 (a.氟喹诺酮抗生素的降解;b.喹诺酮类抗生素抗性基因和16S rDNA基因的绝对丰度变化(星号代表未检出)) Fig. 1 Harmless performance of different HT treatments of high solid sludge (a.Changes in fluoroquinolones concentration; b.Changes in absolute abundance of ARGs, MGE and 16S rDNA gene(Asterisks indicate undetectable levels)) |
本研究考察了2种FQs抗性基因及1个整合酶基因的消减情况, 结果如图 1b所示.由图可知, 水热处理显著地消减了污泥中FQs抗性基因和整合酶基因, 在80 ℃水热处理后, 污泥中抗性基因qurS和qnrA的绝对丰度降低了约1个数量级, 表明该温度下微生物的DNA可以被破坏.qnr基因是由质粒介导的FQs抗性基因, 可表达细菌DNA解旋酶保护蛋白, 从而起到拮抗喹诺酮的作用(Robicsek et al., 2006).据报道, 当温度高于70 ℃时即可导致细菌基因的破坏(Zhang et al., 2005).当水热温度继续升高至180 ℃时, qnrS基因的绝对丰度从原污泥的1.4×1011 copies · g-1下降到1.2×105 copies · g-1(以干污泥计, 下同), 消减了6个数量级(6 logs).在此条件下, qnrA基因和intl1基因未检出, 表明高温水热条件下可以高效消减ARGs和水平转移因子, 从而降低水热产物可能带来的ARGs污染及其水平转移的风险.除此以外, 16S rDNA基因的绝对丰度也出现了大幅消减, 当水热温度为180 ℃时, 其拷贝数降低了5个数量级(5 logs), 表明微生物细胞数量也显著降低.在高温高压情况下, 水热处理可以破坏细胞壁, 释放胞内物质到液相当中, 从而导致细胞的破坏.由于大量细胞破坏, 使体系中的潜在细胞宿主死亡, 从而进一步降低了ARGs的传播风险, 有利于水热产物的进一步安全利用.
3.1.3 病毒的灭活本研究考察了污泥中4种DNA病毒(人腺病毒ADENO、疱疹病毒HSV1、多瘤病毒JCV1、痘病毒OPV)和2种RNA病毒(肠道病毒ENTERO、人冠病毒HKU1)的检出及水热处理的去除效果.在未处理污泥中, 6种病毒均被检出, 其中, 痘病毒OPV和人冠病毒HKU1具有包膜结构.包膜病毒由于其脂质包膜结构易被有机溶剂(如乙醇等)破坏, 被认为在环境中更易失活(O′Donnell et al., 2020;Wigginton et al., 2015), 而未处理污泥中痘病毒OPV和人冠病毒HKU1两种包膜病毒的检出表明包膜病毒在环境中具有一定的持久性.研究发现, 许多包膜病毒(如禽流感病毒、SARS-CoV等)可随粪便进入城市污水系统, 并在几天到几个月内仍保持感染性(Wigginton et al., 2015).
水热处理结果表明(表 3), 80 ℃及以上的温度作用60 min即可实现污泥中大部分病毒的削减, 然而人腺病毒在80 ℃处理后仍可检出, 可能与其高耐热性相关(Gerba et al., 2002).高温可通过蛋白质变性、核酸损伤等机制实现病毒的削减与灭活, Monpoeho等(2004)发现热处理(195 ℃、21 bar, 100 min)后污泥中肠道病毒感染性和基因组滴度均达到检测限以下, 被认为是中温厌氧消化、堆肥、石灰稳定、热处理4种工艺中最有效的消毒方法.此外, 污泥含固率等因素可对水热处理病原菌的削减效果造成一定影响, 未来仍需对该方向继续进行深入研究.
| 表 3 水热处理对高含固污泥中常见病毒PCR检出的影响 Table 3 PCR detection of viruses in the sludge with/without hydrothermal treatment |
水热处理能够促进聚合物的溶解和细胞结构的破裂, 水热处理温度是导致污泥结构破坏的重要因素之一.图 2a所示为不同水热温度对溶解性有机物浓度SCOD的影响.从图中可以看出, 随着水热处理温度的提高, COD的溶出率不断提高, 当水热温度达到160 ℃时, COD溶出率由原污泥的4.5%提高至34.4%.继续提高处理温度至180 ℃, COD溶出率提升至36.8%.可以发现, 温度升高至一定程度后(160 ℃), COD的溶出效率变低, 考虑到经济效率因素, 最佳的水热处理温度为160 ℃, 在此温度下, COD的溶出率较原污泥增长了7.6倍.
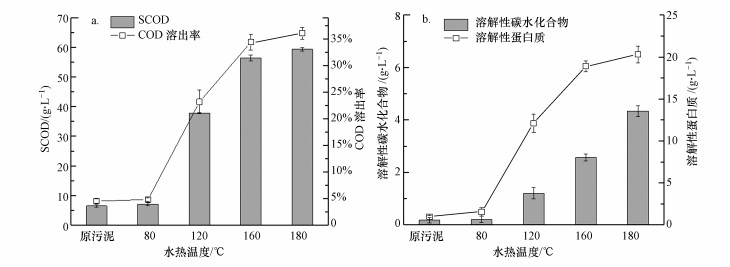 |
| 图 2 不同水热处理温度对COD溶出(a)及溶解性多糖和溶解性蛋白质(b)的影响 Fig. 2 Effects of different hydrothermal temperatures on COD solubilization (a) and soluble carbohydrate and protein contents(b) |
高含固污泥中的微生物细胞内蛋白质和多糖占到细菌干重的70%以上, 是主要的有机物质.因此, 蛋白质和多糖的溶出可能会成为SCOD增加的主要原因.本文同时考察了不同水热温度对溶解性多糖和蛋白质的影响, 结果如图 2b所示.由图可知, 水热处理温度的提高有助于蛋白质和多糖的溶出, 而且, 蛋白质的溶出量要明显高于多糖, 160 ℃水热处理60 min后, 蛋白质浓度为18.9 g · L-1, 多糖浓度为2.6 g · L-1;水热温度提升至180 ℃时, 蛋白质浓度为20.3 g · L-1, 多糖浓度为4.3 g · L-1.多糖的理论分子式C6H9.95O5P0.05, 转换为COD值为1.191 g · g-1(多糖), 蛋白质的理论分子式C4H6.1O1.2N, 转换为COD值为1.439 g · g-1(蛋白质)(Donoso-Bravo et al., 2011).经过160 ℃到180 ℃水热处理后, 蛋白质对SCOD的贡献率由21.9%分别提高到48.2%和49.2%, 多糖对SCOD的贡献率由3.3%分别提高到5.5%和8.6%.这些结果表明, 水热处理可以释放污泥基质中的蛋白质和多糖等营养物质, 营养物质的释放有助于后续的微生物利用, 提高生物转化效率(Xue et al., 2015).
3.2.2 挥发性脂肪酸的释放图 3显示了不同水热温度处理后, 污泥液相中的VFA浓度变化.热水解前后, 乙酸和丙酸都是VFA的主要成分, 两者加起来占到VFA总量的71.9%~81.5%.当水热温度在80 ℃和120 ℃时, VFA浓度略微降低, 从原污泥的1010 mg · L-1分别下降到844 mg · L-1和830 mg · L-1, 其中, 乙酸和丙酸有一定程度的消耗.这是因为相比于原污泥, 温度压力升高后, 小分子VFA更容易被水解.当水热温度提升至160 ℃和180 ℃后, 正戊酸的含量显著提高, 浓度约为原污泥的4倍.乙酸浓度在180 ℃条件下增加至1280 mg · L-1, 使总VFA浓度提高至1520 mg · L-1, 较原污泥提高了50%.
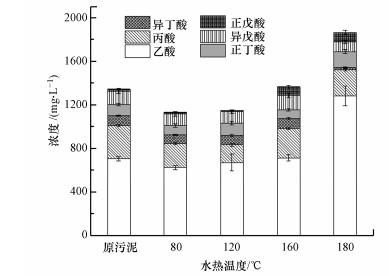 |
| 图 3 不同水热处理温度对挥发性脂肪酸浓度的影响 Fig. 3 Effects of different hydrothermal temperatures on VFA contents |
综上, 可发现在80~160 ℃水热处理条件下, VFA浓度有一定的消减, 说明在该温度范围内, 热水解消耗的VFA速度要大于污泥基质中溶出并释放的VFA速度.相对于低温热水解, 180 ℃水热处理后, VFA的增加主要是高温高压下污泥中细胞内脂肪酸物质或氨基酸的水解导致乙酸等小分子VFA的释放作用.Wilson等(2009)发现, 在高于160 ℃的工况下, 氨基酸转化为VFA的速率会提高.
4 结论(Conclusions)1) 水热处理对于高含固污泥具有较好的无害化效果.在160 ℃和180 ℃处理60 min的情况下, 总FQs去除率分别达到了42.5%和59.5%, 而低温条件下FQs的去除效果不明显, 表明FQs具有一定的热稳定性.
2) 水热处理可以显著消减ARGs.当水热温度为180 ℃时, qnrS基因的绝对丰度从原污泥的1.4×1011 copies · g-1下降到1.2×105 copies · g-1, 消减了6个数量级(6 logs).在此条件下, qnrA基因和intl1基因未检出, 表明高温水热条件下可以高效消减ARGs和水平转移因子, 从而降低水热产物可能带来的ARGs污染及其水平转移的风险.
3) 尽管高含固污泥中可以检出病毒基因如人腺病毒等, 但污泥中病毒对水热温度非常敏感, 在120 ℃的水热条件下即可消减病毒基因.
4) 当水热温度达到160 ℃时, 即可实现污泥营养物质的大量释放和溶出, COD溶出率由原污泥的4.5%提高至34.4%, 蛋白质和多糖的浓度分别达到18.9 g · L-1和2.6 g · L-1, 有助于提高和改善后续的微生物转化效率.
Cai C, Liu H, Dai X, et al. 2019. Multiple selection of resistance genes in arable soil amended with cephalosporin fermentation residue[J]. Soil Biology and Biochemistry, 136: 107538. DOI:10.1016/j.soilbio.2019.107538 |
Cai C, Liu H, Wang B. 2017. Performance of microwave treatment for disintegration of cephalosporin mycelial dreg (CMD) and degradation of residual cephalosporin antibiotics[J]. Journal of Hazardous Materials, 331: 265-272. DOI:10.1016/j.jhazmat.2017.02.034 |
Donoso-Bravo A, Pérez-Elvira S, Aymerich E, et al. 2011. Assessment of the influence of thermal pre-treatment time on the macromolecular composition and anaerobic biodegradability of sewage sludge[J]. Bioresource technology, 102(2): 660-666. DOI:10.1016/j.biortech.2010.08.035 |
戴晓虎, 薛勇刚, 刘华杰, 等. 2016. 基于固相萃取及高效液相色谱-荧光检测分析的污泥中氟喹诺酮类抗生素研究方法的开发[J]. 环境科学, 37(4): 1553-1561. |
Ferdig M, Kaleta A, Buchberger W. 2005. Improved liquid chromatographic determination of nine currently used (fluoro) quinolones with fluorescence and mass spectrometric detection for environmental samples[J]. Journal of Separation Science, 28(13): 1448-1456. DOI:10.1002/jssc.200400065 |
Gerba C P, Gramos D M, Nwachuku N. 2002. Comparative inactivation of enteroviruses and adenovirus 2 by UV light[J]. Applied and Environmental Microbiology, 68(10): 5167-5169. DOI:10.1128/AEM.68.10.5167-5169.2002 |
Ghosh S, Ramsden S J, LaPara T M. 2009. The role of anaerobic digestion in controlling the release of tetracycline resistance genes and class 1 integrons from municipal wastewater treatment plants[J]. Applied Microbiology and Biotechnology, 84(4): 791-796. |
Golet E M, Strehler A, Alder A C, et al. 2002. Determination of fluoroquinolone antibacterial agents in sewage sludge and sludge-treated soil using accelerated solvent extraction followed by solid-phase extraction[J]. Analytical Chemistry, 74(21): 5455-5462. DOI:10.1021/ac025762m |
Guo J, Li J, Chen H, et al. 2017. Metagenomic analysis reveals wastewater treatment plants as hotspots of antibiotic resistance genes and mobile genetic elements[J]. Water Research, 123: 468-478. DOI:10.1016/j.watres.2017.07.002 |
Li N, Liu H, Xue Y, et al. 2017. Partition and fate analysis of fluoroquinolones in sewage sludge during anaerobic digestion with thermal hydrolysis pretreatment[J]. Science of The Total Environment, 581-582: 715-721. DOI:10.1016/j.scitotenv.2016.12.188 |
Lindberg R H, Wennberg P, Johansson M I, et al. 2005. Screening of human antibiotic substances and determination of weekly mass flows in five sewage treatment plants in Sweden[J]. Environmental Science & Technology, 39(10): 3421-3429. |
Monpoeho S, Maul A, Bonnin C, et al. 2004. Clearance of human-pathogenic viruses from sludge:Study of four stabilization processes by real-time reverse transcription-PCR and cell culture[J]. Applied and Environmental Microbiology, 70: 5434-5440. DOI:10.1128/AEM.70.9.5434-5440.2004 |
O'Donnell V B, Thomas D, Stanton R, et al. 2020. Potential role of oral rinses targeting the viral lipid envelope in SARS-CoV-2 infection[J]. Function, 1(1). DOI:10.1093/function/zqaa002 |
Robicsek A, Strahilevitz J, Jacoby G A, et al. 2006. Fluoroquinolone-modifying enzyme:a new adaptation of a common aminoglycoside acetyltransferase[J]. Nature Medicine, 12(1): 83-88. DOI:10.1038/nm1347 |
Sun C, Li W, Chen Z, et al. 2019. Responses of antibiotics, antibiotic resistance genes, and mobile genetic elements in sewage sludge to thermal hydrolysis pre-treatment and various anaerobic digestion conditions[J]. Environment International, 133: 105156. DOI:10.1016/j.envint.2019.105156 |
Wigginton K R, Ye Y, Ellenberg R M. 2015. Emerging investigators series:the source and fate of pandemic viruses in the urban water cycle[J]. Environmental Science:Water Research & Technology, 1(6): 735-746. |
Wilson C A, Novak J T. 2009. Hydrolysis of macromolecular components of primary and secondary wastewater sludge by thermal hydrolytic pretreatment[J]. Water Research, 43(18): 4489-4498. DOI:10.1016/j.watres.2009.07.022 |
Xue Y, Liu H, Chen S, et al. 2015. Effects of thermal hydrolysis on organic matter solubilization and anaerobic digestion of high solid sludge[J]. Chemical Engineering Journal, 264: 174-180. DOI:10.1016/j.cej.2014.11.005 |
Zhang L, Wu Q. 2005. Single gene retrieval from thermally degraded DNA[J]. Journal of Biosciences, 30(5): 599-604. DOI:10.1007/BF02703559 |
Zhang X, Li R. 2018. Variation of antibiotics in sludge pretreatment and anaerobic digestion processes:Degradation and solid-liquid distribution[J]. Bioresource Technology, 255: 266-272. DOI:10.1016/j.biortech.2018.01.100 |
Zheng W, Wen X, Zhang B, et al. 2019. Selective effect and elimination of antibiotics in membrane bioreactor of urban wastewater treatment plant[J]. Science of The Total Environment, 646: 1293-1303. DOI:10.1016/j.scitotenv.2018.07.400 |
Zhu Y G, Johnson T A, Su J Q, et al. 2013. Diverse and abundant antibiotic resistance genes in Chinese swine farms[J]. Proceedings of the National Academy of Sciences of the United States of America, 110(9): 3435-3440. DOI:10.1073/pnas.1222743110 |
 2020, Vol. 40
2020, Vol. 40


