氮是微生物及植物生长的必需元素, 但是过量氮的存在则会引起水体富营养化污染.反硝化是生物脱氮过程中的重要一环, 传统反硝化过程利用有机物提供电子供体将硝态氮或亚硝态氮还原为氮气, 从而将氮素从污水中去除.然而作为污水脱氮的关键步骤, 需要足够的有机碳作为电子供体才能保证脱氮效率.这不仅增加了运营成本, 造成碳排放升高, 而且极大地降低未来可持续污水处理面向能源回收的价值.
甲烷作为一种强温室气体, 其所导致的温室效应是等物质的量的二氧化碳的28倍, 占据整个温室气体贡献量的15%, 是全球仅次于二氧化碳的第二大温室气体(Alvarez et al., 2018).反硝化厌氧甲烷氧化(Denitrifying anaerobic methane oxidation, DAMO)是厌氧条件下以甲烷为电子供体还原硝态氮/亚硝态氮的反硝化过程, 在全球碳氮循环过程中起着关键作用, 是全球温室气体减排中的重要生物反应.现有文献表明, DAMO过程包括两大类功能微生物,分别是DAMO细菌和DAMO古菌.Ettwig等发现DAMO细菌可以将亚硝酸盐转化成一氧化氮, 经一氧化氮歧化酶催化在细胞内产生氧, 利用产生的氧在细胞内将甲烷氧化(Ettwig et al., 2009; 2010).DAMO古菌(如ANME-2d)通过反向产甲烷过程氧化甲烷, 获得的电子将硝酸盐还原为亚硝酸盐(Haroon et al., 2013; Welte et al., 2016).利用了甲烷作为唯一碳源和电子供体进行硝态氮/亚硝态氮的还原可以实现甲烷的高效利用和温室气体减排(孙巍等, 2019).
反硝化厌氧甲烷菌群倍增速度缓慢, 一般为7~18个月(钱祝胜等, 2014), 难以在短时间内成功富集并且对目标污染物硝酸盐、亚硝酸盐的去除效率低(王劲松等, 2017).加之甲烷溶解度低(22.4 mg·L-1, 常温常压)(杨永良等, 2013))也阻碍了其有效利用.基于以上问题, 本研究分别以硝酸盐和亚硝酸盐分别作为电子受体进行反硝化厌氧甲烷氧化的功能菌群富集, 构建以甲烷为唯一电子供体的中空纤维膜生物膜反应器, 提高甲烷气液传质效率及微生物附着率, 探究不同电子受体下硝酸盐/亚硝酸盐还原速率, 分析富集的功能微生物群落结构.
2 材料与方法(Materials and methods) 2.1 实验装置本研究构建两个中空纤维膜生物膜反应器(图 1), 分别命名为W1和W2.反应器总体积为163 mL, 其中有效体积为100 mL, 根据前期研究结果, 中空纤维膜丝采用Teijin(Teijin Limited. Japan)膜丝, 具体参数如表 1所示.本研究中反应器共使用膜丝200根, 膜丝长30 cm, 由此获得膜丝表面积与反应器工作体积比(A/V)为6.594 cm-1.膜丝束一端通过减压阀与甲烷高压气瓶(95% CH4和5% CO2)相连, 另一端由树脂胶密封, 膜丝内压力控制为1.27×105 Pa.如图 1所示, 回流瓶通过蠕动泵管与膜反应器相连, 通过时间继电器对进水及循环时间的控制, 提高反应器内气液传质效率的同时避免微生物流失.同时回流瓶上设有pH探头及气相和液相取样口, 每天测定反应器内pH及取样用于后续测定, 回流瓶另一端与液封瓶相连.进水瓶与氩气袋相连, 以保证反应器内厌氧状态.
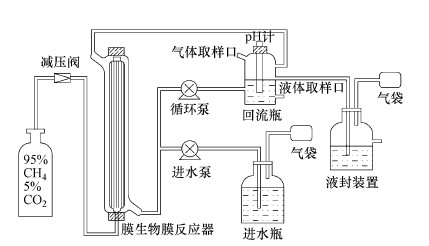 |
| 图 1 甲烷基质膜生物膜反应器示意图 Fig. 1 Schematic diagram of methane-based hollow-fiber membrane biofilm reactor |
| 表 1 本研究所用中空纤维膜丝参数 Table 1 Parameters of hollow fiber used in this study |
实验开始前, 已经获得由农田排水沟渠底泥、厌氧消化池污泥、文昌污水处理厂(哈尔滨)回用污泥混合污泥驯化获得的厌氧硝化污泥, 接种污泥的硝酸盐还原速率为28.6 mg·L-1·d-1.在两个反应器中分别接种50 mL培养成功的厌氧硝化污泥, 剩余部分填充配制好的富集培养基, 其具体组成如下(g·L-1):KH2PO4 0.075、CaCl2 2H2O 0.3、MgSO4 7H2O 0.2、NH4Cl 0.347, 酸性微量元素0.5 mL和碱性微量元素0.2 mL的配置参照Ettwig等(2009)的研究.此外, W1和W2反应器分别加入NaNO3 1.214 g(200 mg·L-1)和NaNO2 0.986 g(200 mg·L-1).
2.2.2 运行条件甲烷基质膜生物膜反应器W1和W2内分别以硝酸盐和亚硝酸盐作为电子受体闭合循环进行微生物的富集.循环泵流速设置为65 mL·min-1.每天检测反应器内剩余硝酸盐及亚硝酸盐的浓度, 待消耗殆尽手动补充20 g·L-1的硝酸盐浓缩液, 使两个反应器内硝酸盐及亚硝酸盐浓度均保持在200 mg·L-1.同时每天用2 mol·L-1 NaOH调节反应器内pH使其维持在7.0~7.5范围内.
待反应器内微生物富集成功后, 将两个反应器调整为序批式生物反应器(SBR)运行模式, 进水培养基中硝酸盐和亚硝酸盐浓度调整为100 mg·L-1, 进水泵流速设置为5 mL· min-1, 每天进水2次, 每次进水5 min, 因此反应器的水力停留时间(HRT)为2 d.其余条件如上.
2.3 分析方法每2 d取水样后过0.22 μm滤膜后在0 ℃保存, 硝酸盐氮和亚硝酸盐氮测定采用离子色谱法(ICS-3000, Dionex, USA)(Zhang et al., 2019), 其中离子色谱柱选择IonPac AS11-HC分析柱与IonPac AG11-HC保护柱(Dionex, USA)进行串联, 淋洗液为1.5 mmol·L-1的NaOH溶液, 流速设置为1 cm3·min-1.挥发性脂肪酸采用配备火焰离子化检测器(FID)和毛细管柱DB-FFAP(30 m×50 μm, 0.25 μm)的气相色谱(GC, Agilent 7890A, USA)进行测定(Zhang et al., 2018).氮气、二氧化碳及甲烷气体含量同样由气相色谱检测, 检测器搭配热导检测器(TCD)(Luo et al., 2018b).
将接种物, 微生物富集过程中反应器的不同运行阶段的微生物样品送至派森诺公司进行DNA提取, PCR扩增以及16S rRNA高通量测序.提取后的DNA针对V6~V8区域进行PCR扩增, 之后采用引物926F (5′-AAACTYAAAKGAATTGACGG-3′)及1392R (5′-ACGGGCGGTGTGTRC-3′)进行16S rRNA高通量测序, 分析微生物在不同阶段群落结构的变化.
3 结果与分析(Results and discussion) 3.1 反硝化厌氧甲烷氧化功能菌群的富集 3.1.1 硝酸盐型厌氧甲烷氧化功能菌群的富集甲烷基质膜生物膜反应器W1内加入200 mg·L-1的硝酸盐氮闭合自循环进行功能微生物富集, 反应器运行76 d内的出水硝酸盐氮浓度如图 2所示, 与现有研究中微生物富集时间长, 硝酸盐去除率低不同的是, 在反应器接入接种物的8 d内, 200 mg·L-1的硝酸盐氮就可以被完全还原, 随后的60余天内, 硝酸盐氮一直稳定在2~3 d可以被完全去除, 最高去除效率达到100 mg·L-1, 运行期间, 可以观察到反应器内膜丝上微生物逐渐富集成功.
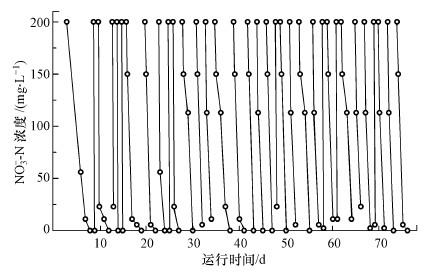 |
| 图 2 反应器W1富集期出水硝酸盐氮浓度 Fig. 2 The concentration of nitrate in effluent during the enrichment period of W1 |
在微生物富集成功后, 将反应器W1改为SBR模式继续运行.在HRT为2 d条件下, 图 3a显示了反应器在SBR模式运行的48 d内反应器进水硝酸盐氮、出水硝酸盐氮以及出水亚硝酸盐氮的浓度.图 3b显示了反应器中硝酸盐氮的进水负荷以及硝酸盐氮的去除速率.由图可知, 进入SBR运行模式后, 硝酸盐氮一直可以被稳定还原, 在进水负荷为50 mg·L-1·d-1的情况下, 去除速率一直保持在49.2~50 mg·L-1·d-1的范围内.在反应器W1运行的第77~110 d内, 出水中一直有0~2 mg·L-1的亚硝酸盐氮被检出, 推测可能是硝酸盐还原中间产物的残余, 而在111~124 d的运行期内, 硝酸盐可以被完全还原, 没有再检测出中间产物亚硝酸盐.反应器回流瓶的设计与SBR模式的结合最大限度杜绝了微生物的流失, 在微生物挂膜运行期内, 反应器内硝酸盐去除速率稳定, 可以观察到微生物挂膜成功.
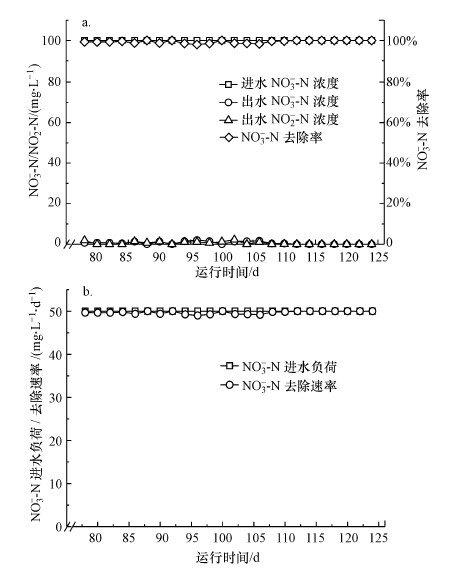 |
| 图 3 反应器W1挂膜期进出水硝酸盐氮及出水亚硝酸盐氮浓度(a)及反应器W1挂膜期硝酸盐氮进水负荷及去除速率(b) Fig. 3 Nitrate reduction performance during biofilm culturingstage of W1(a) and nitrate loading rate and removal rate during biofilm culturing stage of W1 (b) |
同时, 每隔2 d取样测定反应器内甲烷分压, 根据甲烷分压随时间变化图 4可知, 在微生物挂膜阶段, 反应器中甲烷分压始终保持在1.33×105Pa以上, 表明有足够的电子供体支持反硝化过程.该膜生物膜反应器在提供高效甲烷气液传质的同时, 可以最大限度将富集的功能微生物截留在反应器内, 表明反应器可以用于甲烷氧化耦合溴酸盐还原效能的强化研究.
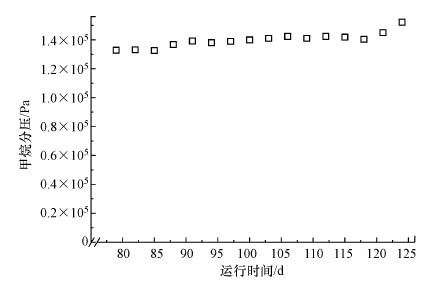 |
| 图 4 反应器W1挂膜期甲烷分压 Fig. 4 The pressure of methane during biofilm culturing stage of W1 |
以甲烷为电子供体, 200 mg·L-1的亚硝酸盐为电子受体的反应器W2同样也闭合自循环运行进行功能微生物的富集, 出水亚硝酸盐氮的浓度如图 5所示.
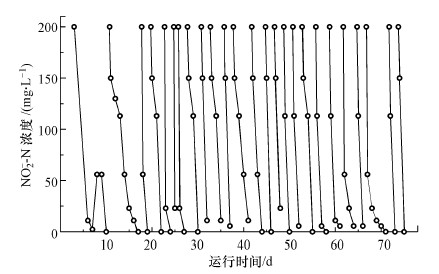 |
| 图 5 反应器W2富集期出水亚硝酸盐氮浓度 Fig. 5 The concentration of nitrite in effluent during the enrichment period of W2 |
其前期运行与反应器W1相似, 在运行10 d内, 200 mg·L-1的亚硝酸盐氮即可以被完全还原.在接下来的富集期内, 亚硝酸盐氮可以稳定在3~4 d内被完全去除.其还原效率略慢于硝酸盐型厌氧甲烷化功能菌群的富集, 这与高浓度亚硝酸盐对微生物有一定抑制作用有关.
在富集76 d后, 反应器W2调整为SBR模式继续运行.如图 6所示, HRT为2 d条件下, 在以100 mg·L-1的亚硝酸盐氮为电子受体的反应器W2中, 反应一开始, 亚硝酸盐氮即可被有效还原, 出水亚硝酸盐氮浓度稳定在0~3 mg·L-1.在亚硝酸盐氮可被完全去除后, 在此水平上继续运行10 d, 表明功能微生物挂膜稳定.而反应器中0~2 mg·L-1硝酸盐氮的检出, 可能是由于反应器中亚硝酸盐被反应过程中产生的微量氧气所氧化产生.
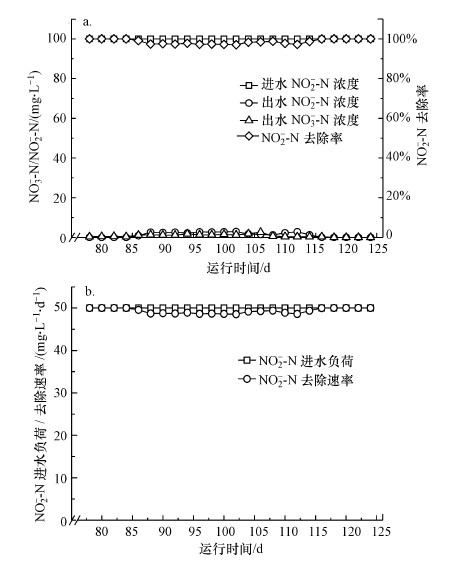 |
| 图 6 反应器W2挂膜期进出水亚硝酸盐氮及出水硝酸盐氮浓度(a)及亚硝酸盐氮进水负荷及去除速率(b) Fig. 6 Nitrite reduction performance during biofilm culturing stage of W2(a) and nitrite loading rate and removal rate during biofilm culturing stage of W2(b) |
本研究中, 以硝酸盐为电子受体的反硝化甲烷厌氧氧化过程效率略高于亚硝酸盐, 这与Cai等(2015)之前的研究相似.同时令人惊讶的是, 两个反应器中的反硝化甲烷厌氧氧化微生物富集周期较之前的几个月到几年相比大大缩短, 硝酸盐/亚硝酸盐的去除效率也有显著提高.
同时反应器W2此阶段的顶空甲烷分压如图 7所示, 在运行的第109 d, 甲烷分压为整个运行阶段的最低值仍为1.27×105 Pa, 表明在微生物挂膜阶段, 系统中电子供体甲烷供应充足.
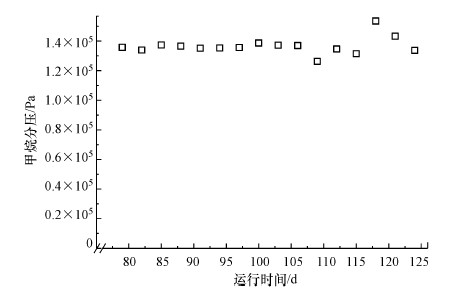 |
| 图 7 反应器W2挂膜期甲烷分压 Fig. 7 The pressure of methane during biofilm culturing stage of W2 |
现有研究中, 富集成功的反硝化型厌氧甲烷氧化微生物无法达到对硝酸盐/亚硝酸盐的高效还原, 电子受体的还原速率一直低于50 mg·L-1·d-1(王劲松等, 2017; Luo et al., 2018).然而, 本研究对硝酸盐/亚硝酸盐氮达到了最高100 mg·L-1·d-1的还原效率.由于每天反应器内部的pH值呈下降趋势, 推测在功能微生物的富集阶段很可能伴随酸性中间产物的生成.通过对出水中物质进行分析比较发现, 两个反应器中始终可以检测到大量挥发性脂肪酸(VFAs)的剩余.由于甲烷是本研究中唯一的碳源, 因此推测VFAs来自于甲烷氧化, 作为反应体系的中间产物为反硝化过程提供了有机碳源, 从而大大提高了反硝化速率.
由于前期闭合自循环导致中间产物的积累, 反应器W1在SBR模式的初始运行阶段, 即可在出水中检测到215 mg·L-1的VFAs, 如图 8a所示, 在运行第94 d时, 出水中挥发酸浓度可以达到485 mg·L-1, 而在此后的32 d内, 出水挥发酸浓度再次下降至253 mg·L-1, 随着反应器中硝酸盐氮的还原速率逐步稳定, 出水挥发酸浓度逐渐增高, 在第124 d时达到948 mg·L-1的峰值.出水中所检出的VFAs中, 乙酸占绝大多数, 平均含量达到了70.7%, 丙酸则占据VFAs总含量的29.3%.
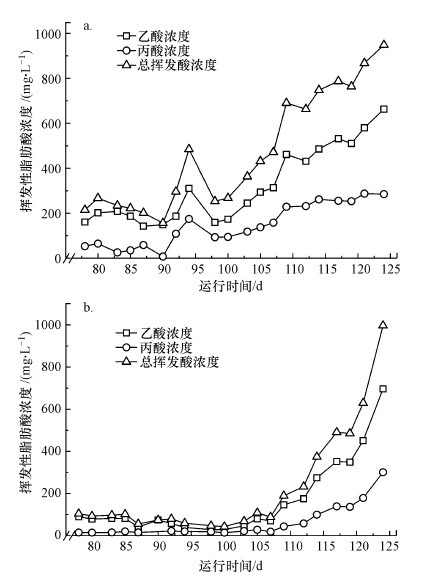 |
| 图 8 反应器W1(a)及W2(b)挂膜期出水中挥发性脂肪酸浓度 Fig. 8 Residual volatile fatty acids (VFAs) concentration in the MBfR W1(a) and W2(b) |
反应器W2在SBR运行期产生的挥发酸含量变化如图 8b所示, 前期反应器内的挥发酸浓度低于反应器W1, 初始出水中只检测到104 mg·L-1的挥发酸, 较反应器W1低109 mg· L-1.在运行的第100 d时, 反应器出水挥发酸浓度继续降至42.5 mg·L-1, 期间丙酸含量一直低于乙酸浓度, 甚至在运行的第90 d时, 丙酸在出水中没有检测到.出水中挥发酸浓度在达到42.5 mg·L-1的低点后逐步增高, 后期呈现了与反应器W1相似的变化趋势, 在运行的124 d时浓度达到了997 mg·L-1.乙酸作为电子供体和碳源已被证实可以被多种反硝化微生物用于硝酸盐/亚硝酸盐的去除.因此, 挥发性脂肪酸的产生, 应是本研究以甲烷为电子供体驱动的反硝化过程快速进行的主要原因.同时, 出水中的大量挥发性脂肪酸的剩余说明可以通过进一步对反应器的运行调控来提高甲烷驱动反硝化的效率, 比如进一步缩短反应的HRT, 使得甲烷转化生成的VFAs可以被异养反硝化菌利用, 提高反硝化速率的同时避免出水中VFAs的残余造成的二次污染.
3.3 反硝化厌氧甲烷氧化功能菌群生物群落结构分析 3.3.1 硝酸盐型厌氧甲烷氧化功能菌群生物群落结构分析反应器W1在整个运行阶段中, 接种物(Day 0)、闭合循环富集期(Day 76)以及SBR模式挂膜期(Day 124)3个阶段的微生物群落结构分析如图 9所示.图 9a比较了门水平上3个阶段的微生物群落结构的异同.相比于接种物中主要存在的7个菌门, 微生物开始富集后只剩余3个菌门可以被检测到.反应器运行的第76 d时的优势菌门为变形菌门, 丰度占据了总体丰度的96.3%之多, 厚壁菌门和拟杆菌门则分别占据了总体丰度的0.9%和2.1%.
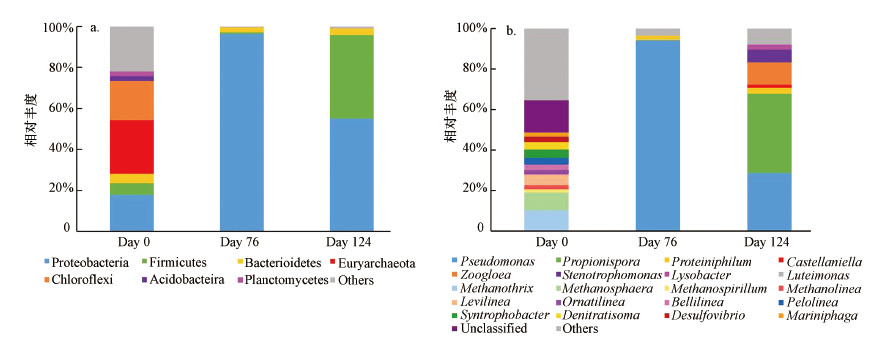 |
| 图 9 反应器W1不同阶段在门(a)和属分类水平(b)上的微生物相对丰度 Fig. 9 Relative abundances of microbial communities at different stages in the MBfR W1 (a.phylum level, b. genus level) |
Methanothrix和Methanosphaera是存在于接种物中的优势菌属, 所占丰度分别为10.1%和9.2%.然而, 在反应器开始运行后, 两个菌属均未检测到.在反应器运行的第76 d, Pseudomonas丰度从0增至94.5%, 成为了反应器中的优势菌属, 继续运行48 d后, 丰度又降为28.7%.Propionispora在接种物中和运行76 d时均未被检测到, 在124 d时增至39.1%, 成为SBR运行阶段的最优菌属.同样未在前两阶段检出的Zoogloea、Stenotrophomonas和Lysobacter在第124 d时丰度分别为10.90%、6.30%和2.30%.Pseudomonas是一种常见于反硝化系统中的菌属, 在废水生物处理的反硝化阶段多有检出(Xu et al., 2020; Pan et al., 2020).Castellaniella、Zoogloea、Stenotrophomonas和Lysobacter也都是反硝化系统中常见的反硝化细菌(Jia et al., 2019; Wang et al., 2019; Zhou et al., 2020; Obermeier et al., 2020), 根据目前已有报道, 这些反硝化细菌多以有机物为电子供体, 未见以甲烷为电子供体驱动的反硝化过程的相关报道.产酸菌Propionispora和Proteiniphilum是两种均在厌氧体系中以有机物为底物的产酸菌(Chen et al., 2018; Ao et al., 2020), 其是否与甲烷氧化过程有关仍有待研究.
3.3.2 亚硝酸盐型厌氧甲烷氧化功能菌群生物群落结构分析反应器W2在门水平上和属水平上的微生物群落结构分析如图 10所示.反应器W2在门水平上的微生物群落结构与W1有所相似, 功能微生物开始富集后同样只有3个菌门被检测到.在第76 d时, 变形菌门、厚壁菌门和拟杆菌门的丰度分别为93.9%、1.3%和2.7%.略有不同的是, 在第124 d时, W2中的最优势菌门变为丰度为85%的厚壁菌门.
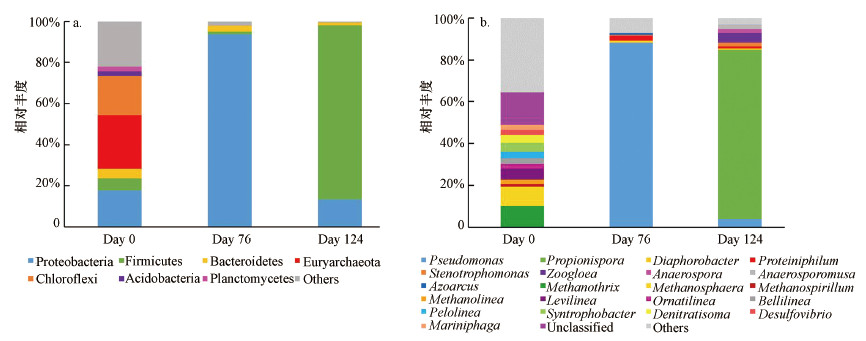 |
| 图 10 反应器W2不同阶段在门(a)和属分类水平(b)上的微生物相对丰度 Fig. 10 Relative abundances of microbial communities at different stages in the MBfR W2(a) phylum level and (b) genus level |
接种物中的优势菌属Methanothrix和Methanosphaera等在反应器W2中同样也没有检测到, 反应器W2运行第76 d时的最优势菌属是反硝化菌Pseudomonas, 与W1同阶段的最优菌属相同, 占据了总体丰度的88.1%, 在第124 d时也呈现了相同的下降趋势, 丰度降为3.9%.同样在接种物中和运行76 d时未被检测到的产酸菌Propionispora在第124 d时丰度达到了80.9%, 成为了该阶段的最优势菌属.在该阶段, 反应器W2中的产酸菌相比于W1占据了更高丰度, 可能是导致其在SBR运行模式下VFAs快速积累的原因.在反应器W2的整个富集期间, 反硝化菌与产酸菌共同介导了系统内部亚硝酸盐的去除, 成功富集了大量功能微生物.
以上研究结果表明, 挥发酸很可能作为甲烷氧化的中间产物后被反硝化菌群加以利用.由于甲烷气体是反应体系中唯一的电子供体和碳源, 出水中的挥发酸很可能是甲烷氧化过程的产物, 尽管体系中目前并不能确定是否有介导该反应的微生物检出, 但是挥发酸的大量产生确实有效作用于硝酸盐/亚硝酸盐的去除, 大幅度提高了电子受体的还原速率.反应体系中大量发酵微生物的产生佐证了这一观点, 产酸菌始终是富集过程的优势菌属, 只是产酸菌是否可以直接作用于甲烷氧化过程亦或甲烷的氧化是否还存在其它微生物介导的不同途径有待进一步研究确定.
4 结论(Conclusions)1) 以甲烷为唯一电子供体和碳源, 在本实验所示MBfR中, 可以实现分别以硝酸盐和亚硝酸盐为电子受体进行的目标功能微生物的快速富集.
2) 在前期闭合自循环的76 d内, W1可以稳定在2 d内将200 mg·L-1 NO3--N完全还原, W2也可在3 d内将200 mg·L-1 NO2--N全部去除.在稳定挂膜的SBR运行阶段, 在进水负荷为50 mg·L-1·d-1的条件下, 两个反应器均可实现100%的反硝化.
3) 在两组微生物富集的整个运行阶段, 均可检测到挥发性脂肪酸的积累.其中VFAs在整个SBR挂膜运行阶段总体皆呈上升趋势, 反应器W1出水中挥发酸最高浓度为948 mg·L-1, W2则为997 mg·L-1.
4) 高通量测序结果表明, 在W1和W2两个反应器中检测到了较大量产酸菌Propionispora, 其丰度分别为39.1%和80.9%.异养反硝化菌Pseudomonas是反应器内的主要脱氮微生物.由此推测在本研究中甲烷为唯一电子供体驱动的硝酸盐/亚硝酸盐生物还原过程通过甲烷氧化为VFAs, 再由异养反硝化菌完成.而甲烷通过何种微生物由何种途径转化为挥发酸仍需后续进一步研究.此外, 反应器中大量的剩余挥发酸也意味着可以通过反应器运行过程调控来进一步提高甲烷驱动反硝化效率.
Alvarez R A, Zavala-Araiza D, Lyon D R, et al. 2018. Assessment of methane emissions from the US oil and gas supply chain[J]. Science, 361(6398): 186-188. |
Ao T, Ran Y, Chen Y, et al. 2020. Effect of viscosity on process stability and microbial community composition during anaerobic mesophilic digestion of Maotai-flavored distiller's grains[J]. Bioresource Technology, 297(122460). |
Cai C, Hu S, Guo J, et al. 2015. Nitrate reduction by denitrifying anaerobic methane oxidizing microorganisms can reach a practically useful rate[J]. Water Research, 87: 211-217. DOI:10.1016/j.watres.2015.09.026 |
Chen H, Zhao L, Hu S, et al. 2018. High-rate production of short-chain fatty acids from methane in a mixed-culture membrane biofilm reactor[J]. Environmental Science & Technology Letters, 5(11): 662-667. |
Ettwig K F, van Alen T, van de Pas-Schoonen K T, et al. 2009. Enrichment and molecular detection of denitrifying methanotrophic bacteria of the NC10 phylum[J]. Applied and Environmental Microbiology, 75(11): 3656-3662. DOI:10.1128/AEM.00067-09 |
Haroon M F, Hu S, Shi Y, et al. 2013. Erratum:Anaerobic oxidation of methane coupled to nitrate reduction in a novel archaeal lineage[J]. Nature, 500(7464): 567-570. DOI:10.1038/nature12375 |
Jia Y, Zhou M, Chen Y, et al. 2019. Carbon selection for nitrogen degradation pathway by Stenotrophomonas maltophilia:Based on the balances of nitrogen, carbon and electron[J]. Bioresource Technology, 294(122114). |
Luo J, Chen H, Yuan Z, et al. 2018. Methane-supported nitrate removal from groundwater in a membrane biofilm reactor[J]. Water Research, 132: 71-78. DOI:10.1016/j.watres.2017.12.064 |
Obermeier M M, Gnaedinger F, Raj A C D, et al. 2020. Under temperate climate, the conversion of grassland to arable land affects soil nutrient stocks and bacteria in a short term[J]. Science of the Total Environment, 703(135494). |
Pan Z, Zhou J, Lin Z, et al. 2020. Effects of COD/TN ratio on nitrogen removal efficiency, microbial community for high saline wastewater treatment based on heterotrophic nitrification-aerobic denitrification process[J]. Bioresource Technology, 301(122726). |
钱祝胜, 付亮, 丁静, 等. 2014. 中空纤维膜生物反应器富集反硝化厌氧甲烷氧化菌群的研究[J]. 中国科学技术大学学报, 44(11): 887-892. |
孙巍, 丁燕玲, 张丽娟, 等. 2019. 亚硝酸盐型厌氧甲烷氧化过程与应用研究进展[J]. 生态环境学报, 28(5): 1064-1070. |
王劲松, 张召基, 王晓君, 等. 2017. 反硝化型甲烷厌氧氧化微生物人工富集与应用研究进展[J]. 水处理技术, 43(12): 8-13. |
Wang S, Zhao J, Ding X, et al. 2019. Effect of starvation time on NO and N2O production during heterotrophic denitrification with nitrite and glucose shock loading[J]. Process Biochemistry, 86: 108-116. DOI:10.1016/j.procbio.2019.07.023 |
Welte C U, Rasigraf O, Vaksmaa A, et al. 2016. Nitrate- and nitrite-dependent anaerobic oxidation of methane[J]. Environmental Microbiology Reports. |
Xu W, Wang L, Peng F, et al. 2020. Spatiotemporal distribution and interaction of denitrifying functional genes in a novel DAS-NUA biofilter used for groundwater nitrate treatment[J]. Science of the Total Environment, 712(136595). |
杨永良, 李增华, 侯世松, 等. 2013. 甲烷在表面活性剂水溶液中溶解度的实验研究[J]. 采矿与安全工程学报, 30(2): 302-306. |
Zhang R, Xu X, Chen C, et al. 2019. Bioreactor performance and microbial community analysis of autotrophic denitrification under micro-aerobic condition[J]. Science of the Total Environment, 647: 914-922. DOI:10.1016/j.scitotenv.2018.07.389 |
Zhang R, Xu X, Chen C, et al. 2018. Interactions of functional bacteria and their contributions to the performance in integrated autotrophic and heterotrophic denitrification[J]. Water Research, 143: 355-366. DOI:10.1016/j.watres.2018.06.053 |
Zhou H, Xu G. 2020. Biofilm characteristics, microbial community structure and function of an up-flow anaerobic filter-biological aerated filter (UAF-BAF) driven by COD/N ratio[J]. Science of the Total Environment, 708(134422). |
 2020, Vol. 40
2020, Vol. 40


