2. 城市水资源与水环境国家重点实验室, 哈尔滨 150090;
3. 哈尔滨工业大学(深圳)及深圳市微藻生物能源工程实验室, 深圳 518055
2. State Key Laboratory of Urban Water Resource and Environment, Harbin 150090;
3. Shenzhen Engineering Laboratory of Microalgal Bioenergy, Harbin Institute of Technology(Shenzhen), Shenzhen 518055
随着社会经济的发展和人类生产及生活活动的日益频繁, 大量的含氮有机物质排放到水体中, 使水体受到了越来越严重的氮素污染, 并对生态环境和人类身体健康都造成了严重的危害(Wang et al., 2016).据生态环境部《2018中国生态环境状况公报》显示, 全国流域总体水质状况呈现好的发展态势, 但黄河、松花江和淮河流域为轻度污染, 海河和辽河流域为中度污染, 其中, 黄河、松花江、辽河流域的主要污染指标之一为氨氮, 并且氨氮也是全国地级及以上城市集中式生活饮用水水源的主要超标指标, 水中氮元素的污染已经成为世界性的环境和公共健康问题.污水在进入污水处理厂前, 氮元素主要以氨态氮的形式存在, 因此, 高效去除氨氮等氮素的技术越来越受到人们的关注.
氮素循环是地球生物化学循环中的一部分, 也是无机氮单质与含氮化合物之间进行转化的重要途径.去除水体中氮元素的污染, 常用的治理方法有3种, 分别为化学法、物理法、生物法.化学法包括化学沉淀法(Rahman et al., 2014)、折点氯化法(杨洪新等, 2018)、离子交换法(银瑰等, 2018)等, 但投放的化学药剂成本较高, 有时操作较为繁琐, 可行性不高(Ryu et al., 2008).物理法包括吹脱法(曾青云等, 2018)、吸附法(李丹等, 2018)等, 但受其他条件影响较大, 氨氮脱除效率会随之下降, 气体氨氮也可能导致二次污染.
生物法主要包含传统生物脱氮和新型生物脱氮, 其中, 传统生物脱氮技术包括氨化、硝化和反硝化阶段.据报道, 具有氨化作用的细菌包括Bacillus sp.(Streminska et al., 2012)、Lysinibacillus fusiformis(Gong et al., 2019)、Bacillus vireti(Mania et al., 2016)等, 进行硝化反应的是氨氧化菌(AOB)和亚硝酸盐氧化菌(NOB)(杨垒, 2016), 进行反硝化作用的反硝化菌有Pseudomonas brassicacearum LZ-4(Yu et al., 2016)、Agrobacterium sp LAD9 (Chen et al., 2012)、Marinobacter sp. NNA5(Liu et al., 2016)等, 其可将一部分氮素还原成氮气, 另一部分被同化生成有机氮.相较于物理化学法, 生物脱氮具有高效经济、无二次污染等优点, 目前已成为污水处理厂常用的方法并得到了广泛的推广(Yang et al., 2017).
Papen等(1998)定义异养硝化作用为在好氧条件下, 氨氮或有机氮被异养微生物氧化成羟胺、亚硝酸盐及硝酸盐的过程.异养硝化菌能够耐受较高的有机负荷, 可以同步去氨氮COD(张彤等, 2006; Shi et al., 2014). 1983年, Robertson等首次发现异养硝化-好氧反硝化菌Paracoccus pantotrophus, 并提出相应概念(乔森等, 2014), 其主要分属包括不动杆菌(Acinetobacter)(Yao et al., 2013; Huang et al., 2013)、假单胞菌(Pseudomonas)(Zhang et al., 2018)、芽孢杆菌(Bacillus)(Kim et al., 2005)等.异养硝化-好氧反硝化菌的优势是可同步降解COD和氨氮, 生长代谢快, 易保存于处理系统中.由于菌株的基质和产物的多样性, 使其易与其他菌株共存, 扩大了其应用范围.
基于此, 本文从活性污泥反应器中分离出一株异养硝化-好氧反硝化菌株, 对其进行形态学观察、生理生化测定及16S rRNA基因序列分析, 并利用MEGA7.0软件建立相应的系统发育树.同时, 在分别以NH4+-N、NO2--N或NO3--N为唯一氮源的条件下, 研究菌株的生长情况, 探究其对COD和氨氮的去除情况.
2 材料与方法(Materials and methods) 2.1 主要试剂酚二磺酸、氨水、酒石酸钾钠、纳氏试剂、显色剂等.驯化活性污泥培养基(g·L-1):无水乙酸钠2.73, NH4Cl 0.31, KNO3 1, KH2PO4 0.15, MgSO4·7H2O 0.1, FeSO4·7H2O 0.006;微量元素(g·L-1):EDTA 50, ZnSO4 2.2, CaCl2 5.5, MnCl2·4H2O 5.06, FeSO4·7H2O 5.0, (NH4)6Mo7O2·4H2O 1.1, CuSO4·5H2O 1.57, CoCl2·6H2O 1.61;富集筛选培养基(g·L-1):丁二酸钠4.7, NH4Cl 0.9, KH2PO4 1.5, Na2HPO4 7.9, MgSO4·7H2O 0.5.
2.2 实验方法 2.2.1 活性污泥驯化及细菌分离纯化以哈尔滨市某污水处理厂二沉池中的活性污泥为种泥, 启动一组SBR反应器, 实验用水为人工配水, 采用驯化活性污泥的培养基, pH值调至7.5~8.0, 污泥驯化采取梯度驯化的方式, 初始氨氮浓度为50 mg·L-1, 每24 h为一个周期, 在每个周期内反应器的氨氮全部降解后, 再依次提高氨氮浓度到100、150、200、300、400 mg·L-1.当反应器内的活性污泥驯化成熟后, 再从中进行氨氮降解菌的富集筛选, 具体操作为:在250 mL锥形瓶内加入100 mL富集培养基(氨氮浓度为200 mg·L-1), 从反应器内吸取驯化成熟的泥水混合物, 按10%的接种量加入到锥形瓶中, 摇瓶培养24 h后, 富集出大量的氨氮降解菌.
在超净工作台上, 通过移液枪吸取1 mL上述富集液, 接种至100 mL筛选培养基中, 待菌体生长好后转接至新鲜培养基中, 重复实验3次后进行平板划线分离.使用移液枪吸取1 mL培养液注入到盛有9 mL去离子水的10 mL离心管中, 充分混合摇匀, 按照10-1~10-8的梯度逐级稀释, 再分别从稀释后的溶液中吸取100 μL加到固体培养基(氨氮浓度为100 mg·L-1)进行涂布, 分别编号标记, 放入30 ℃生化培养基倒置培养, 直到培养基上形成肉眼可见的菌落.用酒精灯灭菌的接种环挑取不同形态特征的单菌落, 在固体培养基上进行平板划线分离, 再放入30 ℃生化培养基倒置培养, 经过3次划线分离后, 筛选得到纯菌株.
2.2.2 菌株形态学观察、生理生化鉴定及16S rRNA基因序列分析AFM细菌样品制备:取1 mL菌液至1.5 mL离心管中, 5000 r·min-1离心1 min, 弃掉上清液.加入1 mL PBS, 混匀, 5000 r·min-1离心1 min, 弃掉上清液, 如此反复3~5次.取干净载玻片, 滴一滴无菌水, 将上述沉淀用接种环或注射器取少量, 在无菌水上涂匀风干后, 先置于光学显微镜下观察, 再确定理想观察位置.生理生化测定参照《伯杰氏细菌学鉴定手册》和《常见细菌系统鉴定手册》, 与相关细菌的描述进行比较, 确定菌株所属菌属.
以细菌DNA为模板, 进行16S rDNA序列的PCR扩增, 引物序列为:上游引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和下游引物1492R(5′-GGTTACCTTGTTACGACTT-3′), 将样品送至哈尔滨睿博兴科生物技术有限公司进行测序, 将所测得的序列提交到NCBI网站的GenBank数据库进行比对, 确定菌株所属菌种, 并选出相关序列, 通过MEGA7.0软件确定系统发育树.
2.2.3 菌株降解特性研究菌株X1-L的异养硝化性能:将X1-L菌液培养至对数生长期, 吸取菌液按1%接种量转接至100 mL以丁二酸钠为唯一碳源、NH4Cl为唯一氮源的培养基中, 使培养基中氨氮浓度为100 mg·L-1, 调节碳源量保证碳氮比为11, 保持其他成分不变, 放置在温度为30 ℃、转速为180 r·min-1的摇床中进行培养.按时取样8 mL放到10 mL离心管中, 10000 r·min-1离心5 min后取上清液测定氨氮、亚硝态氮、硝态氮的浓度.
菌株X1-L的好氧反硝化性能:将X1-L菌液培养至对数生长期, 吸取菌液按1%接种量转接至100 mL以丁二酸钠为唯一碳源、分别以NaNO2和KNO3为唯一氮源的培养基中.培养基中氨氮浓度为100 mg·L-1, 调节碳源量保证碳氮比为11, 保持其他成分不变, 放置在温度为30 ℃、转速为180 r·min-1的摇床中进行培养.按时取样8 mL放到10 mL离心管中, 10000 r·min-1离心5min后取上清液测定氨氮、亚硝态氮、硝态氮的浓度, 其中, 氨氮(NH4+-N)采用纳氏试剂光度法测定, 亚硝氮(NO2--N)采用N-(1-萘基)-乙二胺光度法测定, 硝态氮(NO3--N)采用紫外分光光度法测定, 同时采取生物氮测定方法确定同化的氮元素(Feng et al., 2019).
3 结果(Results) 3.1 菌株筛选分离及鉴定活性污泥经过驯化, 富集出具有较强氨氮降解能力的菌株后, 在以氨氮为唯一氮源的固体培养基上进行多次划线分离, 挑选生长形态特征较好的单菌落, 进行原子力显微镜观察.菌株X1-L的形态如图 1所示, 菌落呈圆形, 表面光滑, 淡黄色, 不透明, 菌体的黏性较大, 不易挑取, 培养较长时间后表面转为深黄色.
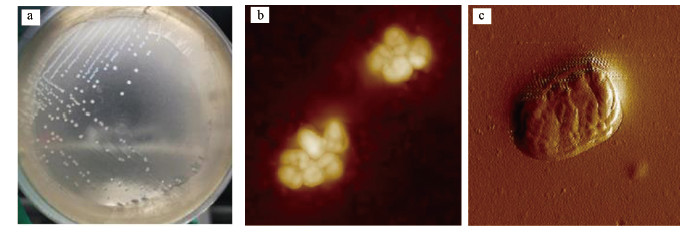 |
| 图 1 细菌X1-L的形态特征(a.在平板培养基上的菌落形态;b, c.在原子力显微镜下的形态) Fig. 1 Colonial morphology of strain X1-L(a.the image of strain X1-L in the plate medium; b, c.the image of strain X1-L under atomic force microscope) |
菌株X1-L的生理生化特征见表 1.由表可知, 该菌能利用葡萄糖, 西蒙氏柠檬酸盐产碱、分解淀粉、V-P试验、明胶液化、过氧化氢酶、溶菌酶、硝酸盐还原等试验均成阳性, 甘露醇和吲哚测试等试验结果则为阴性, 通过参照《常见细菌系统鉴定手册》可确定该菌株为芽孢杆菌属.
| 表 1 菌株X1-L的生理生化特征结果 Table 1 Results of physiological and biochemical characteristics of strain X1-L |
通过菌株X1-L测序结果在NCBI中的在线BLAST找到相似菌株, 再利用MEGA7.0软件(Kumar et al., 2016)Alignment中的CLUSTAL W对菌株X1-L序列和相应的参考序列进行比对, 对菌株16S rRNA基因序列进行分析, 菌株系统发育树见图 2.由图可知, 菌株X1-L与弯曲芽孢杆菌(Bacillus flexus)同源性达到99.86%, 在Genbank登录号为MT457091, 因此, 确定菌株X1-L属于芽孢杆菌属(Bacillus sp.).
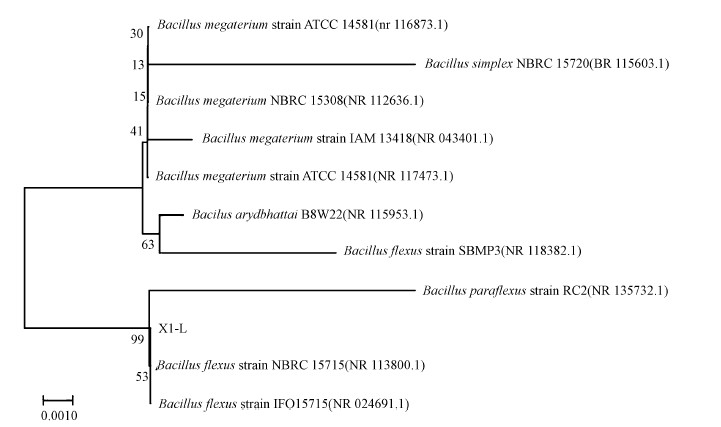 |
| 图 2 菌株X1-L的系统发育树 Fig. 2 Phylogenetic tree of strain X1-L |
异养硝化是指异养硝化微生物利用有机碳作为能源, 同时进行脱氮除碳的一种现象.在好氧条件下, 菌株Bacillus flexus X1-L接种至以90 mg·L-1氨氮为唯一氮源的培养基中, 如图 3所示, 随着菌株在培养基中生长, 氨氮浓度不断下降.在最初培养的6 h, OD660从0.17增加到0.60, 菌株不存在迟滞期, 在接下来的6 h, 菌株快速生长OD660达到1.55, 氨氮浓度迅速降低, 生物氮开始增加;培养12 h后, 最大NH4+-N去除率可达到99.6%, 同时随着OD660的增大, COD下降了96.4%;同时, 经24 h培养后, 生物氮占总氮含量的56.3%, 亚硝酸盐和硝酸盐没有积累, 经硝化作用去除的氮有43.7%.这些实验结果表明, 随着菌株Bacillus flexus X1-L的生长, 有机物和氮均可去除, 证明菌株具有异养硝化能力.
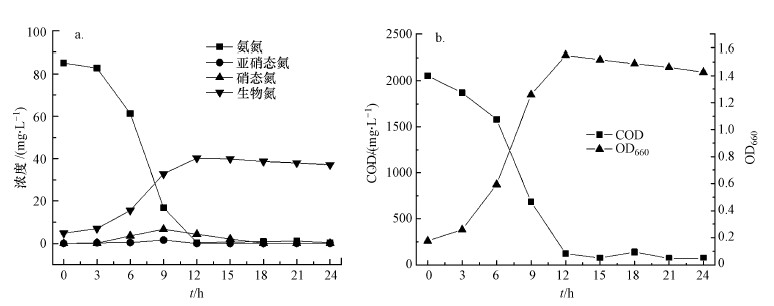 |
| 图 3 菌株X1-L的异养硝化能力(a)和生长及COD去除情况(b) Fig. 3 Heterogeneous nitrification(a) and the growth and COD removal(b) of strain X1-L |
在好氧条件下, 随着培养基内氨氮浓度下降, 亚硝酸盐和硝酸盐几乎没有积累, 与其他学者对菌株O.anthropic LJ81(Lei et al., 2019)和Acinetobacter sp.Y16(Huang et al., 2013)的研究现象一样, 在传统的生物脱氮过程中, 细菌会通过异养硝化作用将氨氮转化为亚硝态氮或硝态氮, 但实验结果表示亚硝态氮和硝态氮都几乎没有积累, 由此可见细菌可能存在好氧反硝化作用.
3.3 菌株好氧反硝化性能在好氧条件下, 菌株Bacillus flexus X1-L接种至以100 mg·L-1 NO2--N为唯一氮源的培养基中, 如图 4所示, 随着菌株在培养基中生长, NO2--N浓度不断下降.在最初培养的6 h, OD660从0.14增加到0.21, 菌株存在短暂的迟滞期;在接下来的6~9 h, 菌株快速生长OD660达到1.28, NO2--N浓度迅速降低;培养15 h后, NO2--N去除率可达到81.8%.在初始培养的6~18 h, NO2--N有一部分转化为NO3--N, NO3--N浓度出现先增加后下降的趋势;在培养24 h后NO2--N去除率达到95.5%, 同时随着OD660的增大, COD下降了95.3%, 经24 h培养后, 生物氮占总氮含量的32.3%, 硝酸盐没有积累, 经反硝化作用去除的氮有67.7%.这些实验结果表明, 随着菌株Bacillus flexus X1-L的生长, 有机物和氮都可去除, 证明菌株具有好氧反硝化能力.
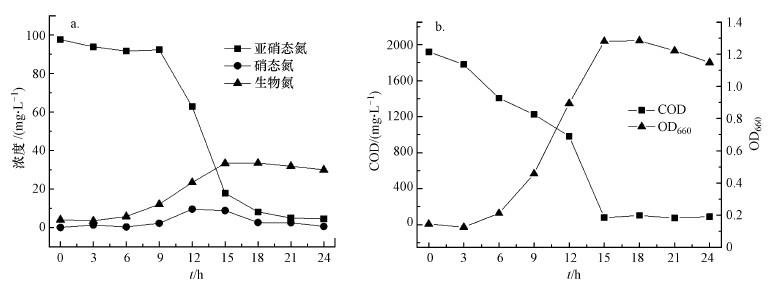 |
| 图 4 菌株X1-L的好氧反硝化能力(a)和生长及COD去除情况(b)(NO2--N为唯一氮源) Fig. 4 Aerobic denitrification(a) and the growth and COD removal(b) of strain X1-L |
在好氧条件下, 菌株Bacillus flexus X1-L接种至以100 mg·L-1 NO3--N为唯一氮源的培养基中, 如图 5所示, 随着菌株在培养基中的生长, NO3--N浓度不断下降.在最初培养的6 h, OD660从0.15增加到0.25, 菌株存在短暂的迟滞期;在接下来的6~9 h, 菌株快速生长OD660达到1.25, NO3--N浓度迅速降低;培养15 h后, NO3--N去除率可达到78.6%.在初始培养的6~15 h, NO3--N有一部分转化为NO2--N, NO3--N出现先增加后下降的趋势;在培养24 h后, NO3--N去除率达到96.5%, 同时随着OD660的增大, COD下降了96.4%;经24 h培养后, 生物氮占总氮含量的31.8%, 硝酸盐没有积累, 经反硝化作用去除的氮有68.2%.这些实验结果表明, 随着菌株Bacillus flexus X1-L的生长, 有机物和氮都可同时去除, 证明菌株具有好氧反硝化能力.
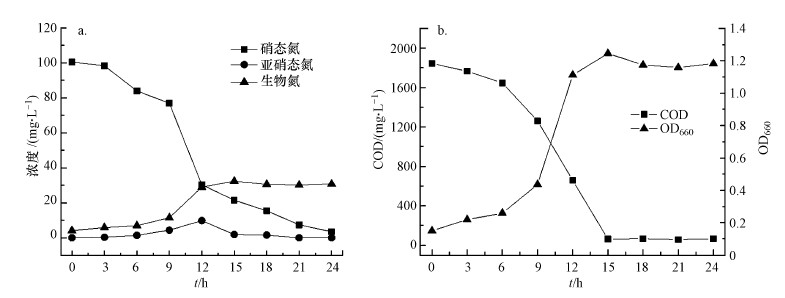 |
| 图 5 菌株X1-L的好氧反硝化能力(a)和生长及COD去除情况(b)(NO3--N为唯一氮源) Fig. 5 Aerobic denitrification(a) and the growth and COD removal(b) of strain X1-L |
综上所述, 在以亚硝态氮和硝态氮为唯一氮源的条件下, 菌株可快速生长并有效去除COD, 表明在菌株X1-L体内亚硝态氮和硝态氮可替代氨氮作为生长代谢的氮源(Sun et al., 2017), 与菌株P. stutzeri YZN-001(Zhang et al., 2011)和K. pneumoniae CF-S9(Padhi et al., 2013)的研究现象一致.有研究表明, 亚硝态氮对生物有毒性, 会抑制菌株的生长, 并且使亚硝酸盐还原酶和硝酸盐还原酶活性受到抑制(Bergaust et al., 2008), 从而影响脱氮效率.在好氧条件下, 异养硝化作用产生的物质可作为反硝化作用的底物, 没有中间产物的积累且pH值比较稳定, 不仅可以避免抑制菌株的生长和硝化反应的进行, 还能促进硝化和反硝化过程(Ji et al., 2015).
4 结论(Conclusion)1) 本实验从哈尔滨某污水处理厂的活性污泥中筛选出一株具有异养硝化-好氧反硝化细菌X1-L, 经16S rRNA基因序列同源性分析, 其与弯曲芽孢杆菌的相似性高达99.86%, 因此, 确定菌株X1-L为芽孢杆菌属(Bacillus sp.), Genbank上的登录号为MT457091.
2) 菌株Bacillus flexus X1-L接种至以90 mg·L-1氨氮为唯一氮源的培养基中, 培养24 h后, NH4+-N去除率可达到99.6%, COD下降了96.4%, 经硝化作用去除的氮有43.7%, 证明菌株具有异养硝化的能力, 并且在脱氮的同时可以有效去除水体中的COD.
3) 菌株Bacillus flexus X1-L接种至以100 mg·L-1 NO2--N为唯一氮源的培养基中, 培养24 h后, NO2--N去除率可达到95.5%, COD下降了95.3%, 经反硝化作用去除的氮有67.7%.同理, 菌株Bacillus flexus X1-L接种至以100 mg·L-1 NO3--N为唯一氮源的培养基中培养24 h后, NO3--N去除率可达到96.5%, COD下降了96.4%, 经反硝化作用去除的氮有68.2%, 证明菌株具有好氧反硝化的能力, 并可同时去除水中的COD.
Bergaust L, Shapleigh J, Frostegard A, et al. 2008. Transcription and activities of NOx reductases in Agrobacterium tumefaciens:The influence of nitrate, nitrite and oxygen availability[J]. Environmental Microbiology, 10(11): 3070-3081. DOI:10.1111/j.1462-2920.2007.01557.x |
Chen Q, Ni J R. 2012. Ammonium removal by Agrobacterium sp LAD9 capable of heterotrophic nitrification-aerobic denitrification[J]. Journal of Bioscience and Bioengineering, 113(5): 619-623. DOI:10.1016/j.jbiosc.2011.12.012 |
Feng L, Yang J X, Ma F, et al. 2019. Characterisation of Pseudomonas stutzeri T13 for aerobic denitrification:Stoichiometry and reaction kinetics[J]. The Science of the Total Environment. DOI:10.1016/j.scitotenv.2019.135181 |
Gong X X, Tian W J, Bai J, et al. 2019. Highly efficient deproteinization with an ammonifying bacteria Lysinibacillus fusiformis isolated from brewery spent diatomite[J]. Journal of Bioscience and Bioengineering, 127(3): 326-332. DOI:10.1016/j.jbiosc.2018.08.004 |
Huang X F, Li W G, Zhang D Y, et al. 2013. Ammonium removal by a novel oligotrophic Acinetobacter sp Y16 capable of heterotrophic nitrification-aerobic denitrification at low temperature[J]. Bioresource Technology, 146: 44-50. DOI:10.1016/j.biortech.2013.07.046 |
Ji B, Yang K, Zhu L, et al. 2015. Aerobic denitrification:A review of important advances of the last 30 years[J]. Biotechnology and Bioprocess Engineering, 20(4): 643-651. DOI:10.1007/s12257-015-0009-0 |
金源, 夏建新, 张紫君. 2013. 工业废水中氨氮处理方法比较分析[J]. 工业水处理, 33(7): 5-10. |
Kim J K, Park K J, Cho K S, et al. 2005. Aerobic nitrification-denitrification by heterotrophic Bacillus strains[J]. Bioresource Technology, 96(17): 1897-1906. DOI:10.1016/j.biortech.2005.01.040 |
Kumar S, Stecher G, Tamura K. 2016. MEGA7:Molecular evolutionary genetics analysis version 7.0 for bigger datasets[J]. Molecular Biology and Evolution, 33(7): 1870-1874. DOI:10.1093/molbev/msw054 |
Lei X, Jia Y T, Chen Y C, et al. 2019. Simultaneous nitrification and denitrification without nitrite accumulation by a novel isolated Ochrobactrum anthropic LJ81[J]. Bioresource Technology, 272: 442-450. DOI:10.1016/j.biortech.2018.10.060 |
Liu Y, Ai G M, Miao L L, et al. 2016. Marinobacter strain NNA5, a newly isolated and highly efficient aerobic denitrifier with zero N2O emission[J]. Bioresource Technology, 206: 9-15. DOI:10.1016/j.biortech.2016.01.066 |
李丹, 沈存花, 刘佛财, 等. 2018. 低浓度氨氮废水处理技术研究进展[J]. 应用化工, 47(6): 1274-1280. |
Mania D, Heylen K, van Spanning R J M, et al. 2016. Regulation of nitrogen metabolism in the nitrate-ammonifying soil bacterium Bacillus vireti and evidence for its ability to grow using N2O as electron acceptor[J]. Environmental Microbiology, 18(9): 2937-2950. DOI:10.1111/1462-2920.13124 |
乔森, 刘雪洁, 周集体. 2014. 异养硝化-好氧反硝化在生物脱氮方面的研究进展[J]. 安全与环境学报, 14(2): 128-135. |
Padhi S K, Tripathy S, Sen R, et al. 2013. Characterisation of heterotrophic nitrifying and aerobic denitrifying Klebsiella pneumoniae CF-S9 strain for bioremediation of wastewater[J]. International Biodeterioration & Biodegradation, 78: 67-73. |
Papen H, Von berg R. 1998. A Most Probable Number method (MPN) for the estimation of cell numbers of heterotrophic nitrifying bacteria in soil[J]. Plant and Soil, 199(1): 123-130. DOI:10.1023/A:1004243810473 |
Rahman M M, Salleh M A M, Rashid U, et al. 2014. Production of slow release crystal fertilizer from wastewaters through struvite crystallization-A review[J]. Arabian Journal of Chemistry, 7(1): 139-155. DOI:10.1016/j.arabjc.2013.10.007 |
Ryu H D, Kim D, Lee S I. 2008. Application of struvite precipitation in treating ammonium nitrogen from semiconductor wastewater[J]. Journal of Hazardous Materials, 156(1/3): 163-169. |
Shi Q Z, Shuo Y, Jin R N. 2014. High-efficient nitrogen removal by coupling enriched autotrophic-nitrification and aerobic-denitrification consortiums at cold temperature[J]. Bioresource Technology, 161: 288-296. DOI:10.1016/j.biortech.2014.03.066 |
Streminska M A, Felgate H, Rowley G, et al. 2012. Nitrous oxide production in soil isolates of nitrate-ammonifying bacteria[J]. Environmental Microbiology Reports, 4(1): 66-71. DOI:10.1111/j.1758-2229.2011.00302.x |
Sun Y L, Feng L, Li A, et al. 2017. Ammonium assimilation:An important accessory during aerobic denitrification of Pseudomonas stutzeri T13[J]. Bioresource Technology, 234: 264-272. DOI:10.1016/j.biortech.2017.03.053 |
Wang T, Dang Q F, Liu C S, et al. 2016. Heterotrophic nitrogen removal by a newly-isolated alkalitolerant microorganism, Serratia marcescens W5[J]. Bioresource Technology, 211: 618-627. DOI:10.1016/j.biortech.2016.03.142 |
Yang Y L, Xie L X, Tao X, et al. 2017. Municipal wastewater treatment by the bioaugmentation of Bacillus sp. K5 within a sequencing batch reactor[J]. Plos One, 12(6): e0178837. DOI:10.1371/journal.pone.0178837 |
Yao S, Ni J R, Ma T, et al. 2013. Heterotrophic nitrification and aerobic denitrification at low temperature by a newly isolated bacterium, Acinetobacter sp HA2[J]. Bioresource Technology, 139: 80-86. DOI:10.1016/j.biortech.2013.03.189 |
杨洪新, 胡金玲, 姜雪松, 等. 2018. 折点加氯技术处理农药废水中氨氮的研究[J]. 现代农药, 17(5): 19-21. |
银瑰, 刘维荣, 楚广. 2018. 氨氮废水处理技术现状分析及新动向[J]. 中国锰业, 36(6): 1-3+17. |
杨垒.2016.高效异养硝化细菌的脱氮特性及其处理高氨氮废水研究[D].西安: 西安建筑科技大学 http://cdmd.cnki.com.cn/Article/CDMD-10703-1016741584.htm
|
Yu X A, Jiang Y M, Huang H Y, et al. 2016. Simultaneous aerobic denitrification and Cr(Ⅵ) reduction by Pseudomonas brassicacearum LZ-4 in wastewater[J]. Bioresource Technology, 221: 121-129. DOI:10.1016/j.biortech.2016.09.037 |
Zhang J B, Wu P X, Hao B, et al. 2011. Heterotrophic nitrification and aerobic denitrification by the bacterium Pseudomonas stutzeri YZN-001[J]. Bioresource Technology, 102(21): 9866-9869. DOI:10.1016/j.biortech.2011.07.118 |
Zhao B, Cheng D Y, Tan P, et al. 2018. Characterization of an aerobic denitrifier Pseudomonas stutzeri strain XL-2 to achieve efficient nitrate removal[J]. Bioresource Technology, 250: 564-573. DOI:10.1016/j.biortech.2017.11.038 |
张彤, 庞金钊, 杨宗政, 等. 2006. 异养硝化菌的脱氮研究[J]. 水科学与工程技术, (6): 41-42. |
曾青云, 薛丽燕, 曾繁钢, 等. 2018. 氨氮废水处理技术的研究现状[J]. 有色金属科学与工程, 9(4): 83-88. |
 2020, Vol. 40
2020, Vol. 40


