2. 哈尔滨工业大学水资源国家工程研究中心有限公司, 哈尔滨 150090
2. Water Resources National Engineering Research Center Co., Ltd, Harbin Institute of Technology, Harbin 150090
生活污水和工业废水的生物脱氮, 以及温室气体的减排, 是实现人类与环境协调和可持续发展的重大战略.研究表明, 甲烷(CH4)作为最主要的温室气体之一, 对全球气候变暖的贡献率高达16.0%(Pachauri et al., 2014).而人类活动导致的含氮城市污水和工业废水排放, 已经造成了水体富营养化(Conley et al., 2009)、生物多样性丧失(Scherer et al., 2016)和水生态系统功能失调(Dodds et al., 2009)等一系列严重环境问题.在污水和废水生物处理过程中, 或多或少都有CH4的产生和释放, 而有机碳源不足造成的生物脱氮困难等问题也普遍存在(Delre et al., 2017).最新发现的亚硝酸盐型甲烷厌氧氧化(Nitrite-dependent anaerobic methane oxidation, N-DAMO), 为解决废水生物脱氮的碳源不足和减排CH4提供了新思路(Fu et al., 2019;孙巍等, 2019).
N-DAMO是某些微生物在厌氧条件下以甲烷为电子供体和唯一碳源还原亚硝酸盐(NO2-)为氮气(N2)的过程(式(1))(Raghoebarsing et al., 2006), 广泛存在于沟渠、湿地、水田、海洋等各种生态系统中(朱群等, 2013;沈李东, 2014;周蓉等, 2015), 被认为是生物圈碳氮循环的一个重要环节(沈李东, 2014).
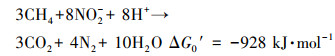
|
(1) |
然而, N-DAMO细菌对环境要求苛刻, 生长代谢缓慢, 倍增时间长达14~25 d(Kampman et al., 2012), 导致其富集培养困难, 很难应用于工程实践(Bhattacharjee et al., 2016).因此, 广泛开展N-DAMO细菌的富集, 并对其生理生态特性进行研究, 不仅有助于加深对自然界碳氮循环的认识, 对相关工程技术的研发亦具有重要意义.尽管已有相关工作开展, 并就N-DAMO细菌与某些共栖菌群的代谢耦合作用进行了探讨(Jiang et al., 2018; Fan et al., 2019), 但资料还非常匮乏.
本文以湿地土壤为菌源, 通过富集获得一个N-DAMO菌群, 并对其主要环境因子和生长因子进行了研究, 以期为N-DAMO菌群的富集培养, 深入了解其生理生态特性提供参考.
2 材料与方法(Materials and methods) 2.1 菌源用于富集N-DAMO菌群的样品, 取自齐齐哈尔扎龙自然保护区的湿地土壤(40~60 cm深处), 其pH为7.6, 氨氮(NH4+)、NO2-和硝酸盐(NO3-)含量分别为121.12、6.06和38.25 mg · kg-1.前期经220 d的培养, 得到N-DAMO菌群的初级富集物, 本文将其作为菌源做进一步强化富集培养.
2.2 培养基及维生素液用于富集培养N-DAMO菌群的基础培养基组成为:KHCO3 0.25 g · L-1、CaCl2 · 2H2O 0.30 g · L-1、KH2PO4 0.05 g · L-1、MgSO4 · 3H2O 0.20 g · L-1、酸性微量元素液0.5 mL · L-1、碱性微量元素液0.2 mL · L-1(Ettwig et al., 2009).其中, 每升酸性微量元素液包含:2.085 g FeSO4 · 3H2O、0.120 g CoCl2 · 6H2O、0.320 g CuSO4、0.014 g H3BO3、0.068 g ZnSO4 · 3H2O、0.500 g MnCl2 · 4H2O、0.095 g NiCl2 · 6H2O、HCl(12 mol · L-1)8.75 mL;每升碱性微量元素液包含:0.063 g SeO2、0.050 g Na2WO4 · 2H2O、0.242 g Na2MoO4、0.400 g NaOH.
研究中, 测试了维生素液对N-DAMO细菌富集物代谢活性的影响.所使用的维生素液的组成为(mg · L-1):2.00生物素、5.00盐酸硫胺素、5.00 D-Ca-泛酸、5.00硫辛酸、2.00叶酸、5.00核黄素、0.10维生素B12、10.00维生素B6、5.00烟酸、5.00对氨基苯甲酸.
2.3 N-DAMO菌群的富集培养对N-DAMO菌群的富集培养, 采用有效容积为1 L的玻璃瓶, 以序批式反应器的运行方式进行, 装置系统如图 1所示.主要操作过程为:向反应器中装载0.6 L的基础培养基, 接种4.00 g · L-1(以混合液悬浮固体MLSS计)的菌源样品, 调节混合液pH为7.0~7.5(图 1a);充入高纯甲烷气体(99.99%)5 min后密封, 置于空气浴振荡器(3BGH—2020, 上海博讯), 在30 ℃、甲烷分压为(P(CH4))98 kPa和140 r · min-1下持续培养, 以NO2-消耗殆尽为反应终点, 检测反应系统中的NO2-残留量和气相中的CH4含量;反应结束并静置沉淀后, 排出0.4 L的反应上清液(图 1b), 输入等体积的新鲜培养基, 调节pH, 充甲烷气体驱氧5 min后密封, 进入下一轮培养.
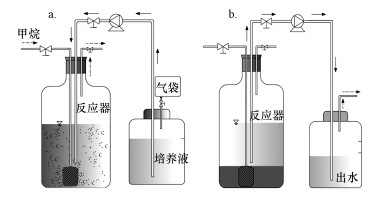 |
| 图 1 实验装置及反应系统构建(a)与排水方式(b)示意图 Fig. 1 Experimental device and reaction system construction (a) and drainage method (b) |
对N-DAMO菌群的强化富集培养时间共计300 d, 分为4个阶段.在第1阶段, NO2-投加量为1.0 mmol · L-1, 培养周期为72 h, 包括培养基输入0.5 h(包括充甲烷15 min), 振荡培养67 h, 静置4 h, 上清液排出0.5 h;第2和第3阶段, 在其他参数不变的情况下, 将振荡培养时间分别减少为43 h和19 h, 即培养周期分别为48和24 h;第4阶段, 维持24 h的培养周期, 将NO2-投加量提高到1.5 mmol · L-1继续强化富集.
2.4 N-DAMO菌群环境因子影响测试在接种量MLSS统一为2.35 g · L-1的条件下, 以有效容积为50 mL的厌氧瓶构建系列反应系统, 采用单因子变量法, 对pH、温度、NO2-、P(CH4)、溶解氧(DO)和NaCl等多种因素对N-DAMO菌群代谢活性的影响进行评估.操作过程为:装载30 mL的培养基和待测成分, 调节pH, 充甲烷5 min, 密封, 在30 ℃和140 r · min-1下振荡培养.培养过程中, 间隔12 h抽提0.5 mL液体用于检测NO2-浓度.
对于pH的测试设置9个梯度, 即培养的初始pH分别为5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5和9.0.温度设置为20、25、30、35、40和45 ℃ 6个梯度, NO2-浓度设置为0.5、1.0、1.5、2.0、3.0、4.0和6.0 mmol · L-1 7个梯度, P(CH4)设置为0、25、49、74和98 kPa 5个梯度, DO浓度设置为为0、0.3、0.6、0.8和1.0 mg · L-1 5个梯度, NaCl浓度设置为0、1.0、2.5、5.0、10.0和15.0 g · L-1 6个梯度.在以上各组测试中, 除了测试因子为变量外, 其他因子强度均保持一致, 即:初始pH 7.0, NO2-浓度为1.0 mmol · L-1, 温度为30 ℃, P(CH4) 98 kPa, 不投加NaCl, 厌氧.
2.5 N-DAMO菌群生长因子测试维生素、血红素和甜菜碱等生长因子对N-DMAO菌群代谢活性的影响实验, 均采用与N-DAMO菌群环境因子影响测试同样的方法.其中, 维生素液的剂量梯度设置为0、0.01、0.02、0.03、0.05、0.07和0.10 mL · L-1, 血红素的剂量梯度设置为0、2、4、6、10、15、20和30 μg · L-1, 甜菜碱的剂量梯度设置为0、0.1、0.2、0.3、0.5、0.7和1.0 mg · L-1.各培养系统的初始pH、NO2-浓度、温度和P(CH4)相同, 分别为7.0、1.0 mmol · L-1、30 ℃和98 kPa, 且不投加NaCl.
2.6 分析方法MLSS和NO2-依照《水和废水监测分析方法》(国家环境保护总局, 2002)进行测定, 其中MLSS采用恒重法, NO2-采用分光光度法. pH采用Delta320酸度计(Mettler-Toledo, 瑞典)测定. DO以Multi3510 iDS溶解氧测定仪(WTW, 德国)检测.气相的甲烷含量(体积百分数)采用SP-6890气相色谱仪测定(Zhu et al., 2008).
2.7 计算方法在N-DAMO菌群环境因子和生长因子实验中, 每个测试均设置3个平行系统, 测试值采用平均值.菌群对NO2-的还原速率, 采用式(2)进行计算.

|
(2) |
式中, V为菌群单位生物量对NO2-的比还原速率(mmol · g-1 · d-1);C0和Ct分别为反应起始和终止时的NO2-浓度(mmol · L-1);M为反应系统的生物量(以MLSS计)(g · L-1).
3 结果与讨论(Results and discussion) 3.1 N-DAMO菌群的富集与代谢活性为获得生长代谢良好的N-DAMO菌群, 在30 ℃、P(CH4) 98 kPa和140 r · min-1等条件下, 对前期得到的初级富集物持续强化培养300 d.如图 2a所示, 在NO2-初始浓度为1.0 mmol · L-1、培养周期为72 h(振荡培养67 h)的第1阶段(第1~60 d), N-DAMO菌群富集物即表现出了良好的N-DAMO代谢活性, 使NO2-在每个运行周期中均得到了较为彻底的去除, NO2-还原速率平均为0.05 mmol · g-1 · d-1.在第2(第61~120 d)和第3(第121~178 d)阶段, 尽管振荡培养时间分别缩短到了43 h和19 h, 富集物仍能在各运行周期内将NO2-消耗殆尽, 还原速率分别稳定在0.08和0.18 mmol · g-1 · d-1左右.进入第4阶段(第179~300 d)后, NO2-投加剂量从第3阶段的1.0 mmol · L-1提高到了1.5 mmol · L-1. NO2-浓度的提高, 对富集物产生了显著的胁迫作用, 使其对NO2-的还原能力明显下降.在第186 d, 其NO2-的残留量高达0.59 mmol · L-1, 对NO2-的还原速率低达0.16 mmol · g-1 · d-1.在较高NO2-浓度的胁迫下, 富集培养物的N-DAMO代谢活性随着培养的延续持续提高, 并在第242 d后达到相对稳定, 对NO2-的平均还原速率大幅提高到了0.27 mmol · g-1 · d-1.
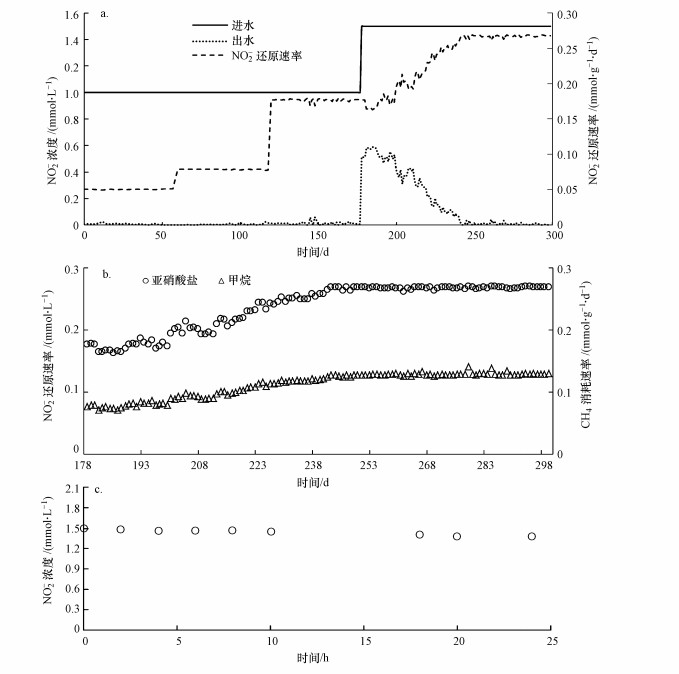 |
| 图 2 气相为CH4 (a和b)和N2 (c)条件下的N-DAMO菌群代谢特征 Fig. 2 Metabolic characteristics of the N-DAMO flora with CH4 (a and b) and N2 (c) as the gas phase |
如图 2b所示, 在富集培养的第4阶段, 富集菌群的NO2-还原速率与CH4消耗速率保持了同步, 在第242~300 d的持续培养过程中, NO2-还原与CH4消耗的物质的量的比平均为2.09, 接近理论值的2.67 (式(1)).这一结果说明, 富集培养物中的NO2-去除是由N-DAMO代谢实现的.检测发现, 在第300 d富集培养结束时, 系统内的MLSS已从接种时的4.00 g · L-1大幅提升到了7.05 g · L-1.分析认为, 作为富集培养系统中的唯一氮源, 部分NO2-势必会被N-DAMO菌群同化用于生长, 因此, 造成了NO2-还原与CH4消耗物质的量的比和理论值的差别(Raghoebarsing et al., 2006).
为进一步确证富集培养物的N-DAMO代谢特征, 在富集培养300 d后, 以N2替代CH4继续培养24 h.如图 2c所示, 在无CH4存在的条件下, 富集菌群的N-DAMO代谢活性几乎消失殆尽, 在24 h的培养过程中, NO2-极少被消耗, 再次证明了富集物的N-DAMO属性.
3.2 环境因子对N-DAMO菌群代谢活性的影响在不同pH、温度、NO2-浓度、P(CH4)、DO和NaCl浓度条件下, 对强化富集获得的N-DAMO菌群进行环境因子和生长因子的测试, 以了解其生理生态特性.
结果表明, 随着pH(图 3a)、温度(图 3b)和NO2-浓度(图 3c)的提高, N-DAMO菌群的N-DAMO代谢活性, 均表现出了先上升后下降的趋势, 最佳值分别为7.5、35 ℃和2.0 mmol · L-1, 对应的NO2-还原速率分别为0.17、0.20和0.18 mmol · g-1 · d-1.可见, 该N-DAMO菌群适宜在中性偏碱和中温条件下生存, 在NO2-浓度高达6.0 mmol · L-1时仍能保持一定的代谢活性.其中, 温度对N-DAMO菌群代谢活性的影响更为显著(He et al., 2015).已有的大多数研究, 均将培养N-DAMO细菌的pH设置在7.0左右(Ettwig et al., 2009; Kampman et al., 2012; Bhattacharjee et al., 2016;楼菊青, 2016), 而本文的研究结果显示(图 3a), 将其设置在7.5左右更为适宜. NO2-虽然是N-DAMO菌群生长代谢的主要底物之一, 但浓度过高亦会对细菌产生强烈的抑制作用(Luesken et al., 2011).何崭飞等(2012)利用Monod方程研究了初始NO2-浓度的影响, 指出其最佳浓度为1.92 mmol · L-1, 这一结果与本研究获得的2.0 mmol · L-1基本一致.
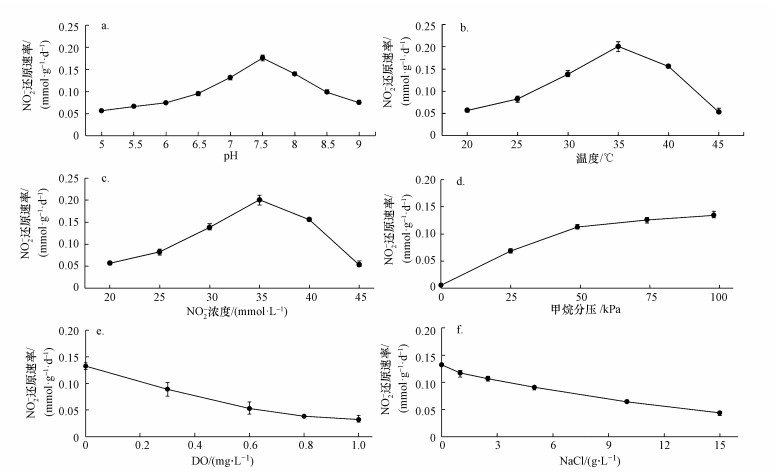 |
| 图 3 pH (a)、温度(b)、NO2- (c)、P(CH4) (d)、DO (e)和NaCl (f)对N-DAMO菌群代谢活性的影响 Fig. 3 Effect of pH (a), temperature (b), NO2- (c), P(CH4) (d), DO (e) and NaCl (f) on metabolic activity of the N-DAMO flora |
环境中的P(CH4)和DO对N-DAMO菌群的代谢活性亦有显著的影响.如图 3d所示, 在较低的P(CH4)条件下, N-DAMO菌群的NO2-还原速率随着P(CH4)的升高迅速提高, 在49 kPa时达到了0.11 mmol · g-1 · d-1.进一步升高P(CH4), N-DAMO菌群的代谢活性虽有提高但不再明显.在大气压力下, 接近100%的甲烷气相条件(P(CH4) 98 kPa)也只能使其NO2-还原速率达到0.13 mmol · g-1 · d-1. N-DAMO被认为是某些微生物在厌氧条件下的代谢特征(Raghoebarsing et al., 2006), 但DO对这一代谢的影响至今并不明确.如图 3e所示, 随着DO的升高, N-DAMO菌群的代谢活性受到了越来越严重的抑制, 但在DO 1.0 mg · L-1的条件下仍能保持0.03 mmol · g-1 · d-1的NO2-还原速率.
作为微生物的重要环境因子之一, 较高的盐度将导致细胞周质中的多种代谢酶受损, 包括与N-DAMO直接相关的甲醇脱氨酶、亚硝酸盐还原酶等(Wu et al., 2012; Zhao et al., 2013).高盐度还能降低CH4的溶解度, 亦会影响N-DAMO菌群的代谢活性(He et al., 2015).以NaCl调节培养系统盐度的实验结果显示(图 3f), N-DAMO菌群对盐度有良好的耐受能力, 但高盐度会对其代谢产生严重的抑制作用.随着NaCl浓度从0逐渐升高到15.0 g · L-1, N-DAMO菌群的NO2-还原速率亦从0.13大幅降低到了0.04 mmol · g-1 · d-1, 但在NaCl浓度为5.0 g · L-1时仍能保持0.09 mmol · g-1 · d-1的NO2-还原速率.
以上研究表明, N-DAMO菌群对pH、温度、NO2-、P(CH4)、DO和盐度均有一定的耐受和适应能力, 是其在自然环境中得以广泛分布的重要原因之一(Ettwig et al., 2008; Luesken et al., 2011).
3.3 生长因子对N-DAMO菌群代谢的促进作用像大多数微生物一样, N-DAMO菌群亦需必要的生长因子以维持其生长代谢.其中, 血红素是细胞色素cd1亚硝酸还原酶(Cytochrome cd1-containing nitrite reductase)的辅基, 是N-DAMO菌群还原NO2-为N2不可或缺的生长因子(Wu et al., 2011).甜菜碱是有效的甲基供体, 1 mol可提供3 mol的活性亚甲基, 对N-DAMO菌群的生长代谢亦有促进作用(Lever et al., 2010).就维生素液、血红素和甜菜碱等3类生长因子的测试结果表明(图 4), 这3类生长因子对N-DAMO菌群的代谢活性均有一定的促进作用, 但过量的添加并不能获得更好的效果.如图 4所示, 维生素液(图 4a)、血红素(图 4b)和甜菜碱(图 4c), 有效提高N-DAMO菌群代谢活性的最高浓度分别为0.02 mL · L-1、6 μg · L-1和0.5 mg · L-1, 对应的NO2-还原速率分别为0.18、0.17和0.28 mmol · g-1 · d-1, 分别是不添加生长因子的对照组的1.32、1.22和1.96倍.
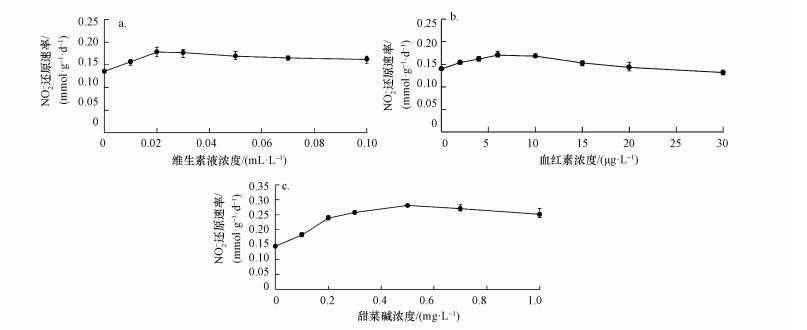 |
| 图 4 生长因子对N-DAMO菌群代谢活性的影响 Fig. 4 Effect of growth factors on metabolic activity of the N-DAMO flora |
1) 以湿地土壤为初始样品, 通过初级富集和强化培养, 获得了具有较高NO2-还原能力的N-DAMO菌群, 在NO2-浓度为1.5 mmol · L-1、30 ℃、P(CH4) 98 kPa和140 r · min-1等条件下振荡培养19 h, 其NO2-还原速率可达0.27 mmol · g-1 · d-1.
2) N-DAMO菌群适宜的pH、温度和NO2-浓度分别为7.5、35 ℃和2.0 mmol · L-1, P(CH4)的提高可提升其N-DAMO代谢活性;DO对菌群的N-DAMO活性有显著的抑制作用, 但在1.0 mg · L-1的条件下仍能保持0.03 mmol · g-1 · d-1的NO2-还原速率;较高的NaCl浓度对菌群的N-DAMO活性的抑制作用虽然明显, 但在浓度高达15.0 g · L-1时, 仍能表现出0.04 mmol · g-1 · d-1的NO2-还原代谢活性.
3) 维生素液、血红素和甜菜碱等对N-DAMO菌群的代谢活性均有一定的促进作用, 但过量添加并不能获得更好的效果, 其适宜剂量分别为0.02 mL · L-1、6 μg · L-1和0.5 mg · L-1, 对应的NO2-还原速率为0.18、0.17和0.28 mmol · g-1 · d-1, 分别是不添加生长因子时的1.32、1.22和1.96倍.
4) N-DAMO菌群对环境条件具有较强的适应性和耐受能力, 是其在自然环境中得以广泛分布的重要原因.
Bhattacharjee A S, Motlagh A M, Jetten M S M, et al. 2016. Methane dependent denitrification-from ecosystem to laboratory-scale enrichment for engineering applications[J]. Water Research, 99: 244-252. DOI:10.1016/j.watres.2016.04.070 |
Conley D J, Paerl H W, Howarth R W, et al. 2009. Ecology controlling eutrophication:Nitrogen and phosphorus[J]. Science, 323(5917): 1014-1015. DOI:10.1126/science.1167755 |
Delre A, Monster J, Scheutz C. 2017. Greenhouse gas emission quantification from wastewater treatment plants, using a tracer gas dispersion method[J]. Science of the Total Environment, 605: 258-268. |
Dodds W K, Bouska W W, Eitzmann J L, et al. 2009. Eutrophication of US freshwaters:Analysis of potential economic damages[J]. Environmental Science & Technology, 43(1): 12-19. |
Ettwig K F, van Alen T, van de Pas-Schoonen K T, et al. 2009. Enrichment and molecular detection of denitrifying methanotrophic bacteria of the NC10 phylum[J]. Applied and Environmental Microbiology, 75(11): 3656-3662. DOI:10.1128/AEM.00067-09 |
Fan S, Xie G, Lu Y, et al. 2019. Granular sludge coupling Nitrate/Nitrite dependent anaerobic methane oxidation with anammox:From Proof-of-Concept to high rate nitrogen removal[J]. Environmental Science & Technology. |
Fu L, Zhang F, Bai Y, et al. 2019. Mass transfer affects reactor performance, microbial morphology, and community succession in the methane-dependent denitrification and anaerobic ammonium oxidation co-culture[J]. Science of the Total Environment, 651(1): 291-297. |
国家环境保护总局. 2002. 水和废水监测分析方法[M]. 第4版. 北京: 中国环境科学出版社.
|
何崭飞, 蔡琛, 沈李东, 等. 2012. DAMO过程中甲烷传质模型的建立与验证[J]. 化工学报, 63(6): 1836-1841. |
He Z, Geng S, Shen L, et al. 2015. The short- and long-term effects of environmental conditions on anaerobic methane oxidation coupled to nitrite reduction[J]. Water Research, 68: 554-562. DOI:10.1016/j.watres.2014.09.055 |
Jiang L, Hu Z, Wang Y, et al. 2018. Effect of trace elements on the development of co-cultured nitrite-dependent anaerobic methane oxidation and methanogenic bacteria consortium[J]. Bioresource Technology, 268: 190-196. DOI:10.1016/j.biortech.2018.07.139 |
Kampman C, Hendrickx T L G, Luesken F A, et al. 2012. Enrichment of denitrifying methanotrophic bacteria for application after direct low-temperature anaerobic sewage treatment[J]. Journal of Hazardous Materials, 227: 164-171. |
Lever M, Slow S. 2010. The clinical significance of betaine, an osmolyte with a key role in methyl group metabolism[J]. Clinical Biochemistry, 43(9): 732-744. DOI:10.1016/j.clinbiochem.2010.03.009 |
楼菊青, 王析镭, 杨东叶, 等. 2016. 不同接种物对富集反硝化型甲烷厌氧氧化微生物的影响[J]. 环境科学学报, 36(11): 4087-4095. |
Luesken F A, van Alen T A, van der Biezen E, et al. 2011. Diversity and enrichment of nitrite-dependent anaerobic methane oxidizing bacteria from wastewater sludge[J]. Applied Microbiology and Biotechnology, 92(4): 845-854. DOI:10.1007/s00253-011-3361-9 |
Pachauri R, Allen V, Barros J, et al. 2014. Climate change 2014:Synthesis Report. Contribution of working groups I, Ⅱ and Ⅲ to the fifth assessment report of the intergovernmental panel on climate change[J]. Journal of Romance Studies, 4(2): 85-88. |
Raghoebarsing A A, Pol A, van de Pas-Schoonen K T, et al. 2006. A microbial consortium couples anaerobic methane oxidation to denitrification[J]. Nature, 440(7086): 918-921. DOI:10.1038/nature04617 |
Scherer L, Pfister S. 2016. Global biodiversity loss by freshwater consumption and eutrophication from swiss food consumption[J]. Environmental Science & Technology, 50(13SI): 7019-7028. |
沈李东. 2014.湿地亚硝酸盐型厌氧氨氧化和厌氧甲烷氧化微生物生态学研究[D].杭州: 浙江大学. 83-111
|
孙巍, 丁燕玲, 张丽娟, 等. 2019. 亚硝酸盐型厌氧甲烷氧化过程与应用研究进展[J]. 生态环境学报, 28(5): 1064-1070. |
Wu M L, Ettwig K F, Jetten M S M, et al. 2011. A new intra-aerobic metabolism in the nitrite-dependent anaerobic methane-oxidizing bacterium Candidatus 'Methylomirabilis oxyfera'[J]. Biochemical Society Transactions, 39(1): 243-248. |
Wu M L, van Alen T A, van Donselaar E G, et al. 2012. Co-localization of particulate methane monooxygenase and cd(1) nitrite reductase in the denitrifying methanotroph 'Candidatus Methylomirabilis oxyfera'[J]. Fems Microbiology Letters, 334(1): 49-56. DOI:10.1111/j.1574-6968.2012.02615.x |
Zhao W, Wang Y, Liu S, et al. 2013. Denitrification activities and N2O production under salt stress with varying COD/N ratios and terminal electron acceptors[J]. Chemical Engineering Journal, 215: 252-260. |
周蓉, 祝贵兵, 周磊榴, 等. 2015. 稻田土壤反硝化厌氧甲烷氧化菌的时空分布与群落结构分析[J]. 环境科学学报, 35(3): 729-737. |
Zhu G, Li J, Wu P, et al. 2008. The performance and phase separated characteristics of an anaerobic baffled reactor treating soybean protein processing wastewater[J]. Bioresource Technology, 99(17): 8027-8033. DOI:10.1016/j.biortech.2008.03.046 |
朱群, 沈李东, 胡宝兰, 等. 2013. 西湖底泥中的反硝化型甲烷厌氧氧化菌的分子生物学检测[J]. 环境科学学报, 33(5): 1321-1325. |
 2020, Vol. 40
2020, Vol. 40


