随着经济的增长和生活水平的提高, 餐厨垃圾产量日益增加, 对经济和环境都造成了不利影响(Xu et al., 2017).餐厨垃圾有机含量高、含水率高、营养丰富、易腐败, 如果不加以妥善处理将会滋生有害微生物, 释放刺鼻气体, 对环境造成二次污染, 并对人体健康产生威胁.目前餐厨垃圾无害化、减量化、资源化的处理处置方式已成为全球关注的问题(Capson-Tojo et al., 2017).相比卫生填埋、焚烧及好氧堆肥带来的环境污染和能源浪费, 厌氧消化被认为是一种污染小、效益高的餐厨垃圾处理技术(Braguglia et al., 2017).但餐厨垃圾因其高有机物、盐、油和蛋白质含量的特性, 容易产生氨抑制和长链脂肪酸抑制等问题(Banks et al., 2012; Dai et al., 2013; Gao et al., 2015; Li et al., 2015), 使产甲烷过程受到抑制, 造成反应器的崩溃.因此, 通过人为改变反应条件以强化水解产酸, 以获得富含挥发性脂肪酸(VFAs)发酵液的过程愈发受到关注.产生的VFAs可作为合成聚羟基脂肪酸酯(PHA)的底物.聚羟基脂肪酸酯(PHA) (车雪梅等, 2018; Nielsen et al., 2017)是原核微生物在碳氮营养失衡的情况下自身合成的一类热塑性聚酯的统称, 具有与传统化工塑料相似的物化性质和可生物降解性, 是传统塑料的理想替代(Chen, 2009).餐厨垃圾发酵液富含VFAs, 是生产PHA的理想底物并可降低生产成本.PHA产品的物理性能取决于PHB和PHV的比例.PHB具有热塑性、耐水性, 而PHV决定了产品的弹性与柔韧性(Suriyamongkol et al., 2007).偶数碳VFAs(乙酸、丁酸)主要合成PHB, 而奇数碳VFAs(丙酸、戊酸)主要合成PHV.因此调控底物VFAs的组成可以调控PHA产品物理性质, 从而满足PHA的不同用途的需求.
粗甘油是餐厨垃圾生产生物柴油过程的主要副产物(Rivero et al., 2014).近年来, 粗甘油的产量不断增加.纯度较高的甘油可以用在食品、药品及化妆品等各个行业中, 但由于粗甘油的提纯成本较高, 使得大量的粗甘油无法有效的回收利用, 而是作为废弃物排放(Slinn et al., 2008).粗甘油有机质含量高、可生物降解, 可以通过厌氧消化的方式经济有效的实现资源化利用, 其主要成分甘油可以为厌氧微生物提供丰富碳源.目前有研究将甘油投加到有机废弃物如生活垃圾(Fountoulakis et al., 2010)、市政污水污泥(Razaviarani et al., 2015;张颖等, 2018)、餐厨垃圾(Silva et al., 2017; Silva et al., 2018)、猪粪(Astals et al., 2012)等厌氧消化的过程中, 通过调整发酵底物的碳氮比, 改变VFAs的产量及组成, 调控厌氧消化的过程.为获得性能多样的PHA产品, 本研究将甘油投加到餐厨垃圾厌氧发酵产酸的体系中, 通过改变发酵液VFAs的产量和组成比例实现对PHA合成底物成分的优化, 对推动PHA产品化发展具有重要参考意义.
2 材料与方法(Material and methods) 2.1 餐厨垃圾与接种污泥实验所用的餐厨垃圾主要来自于哈尔滨工业大学天香餐厅, 主要成分为米饭、面食、蔬菜、肉类、豆制品和水果等.将取回的实验室的餐厨垃圾倒在网格上, 适当翻动, 人工分选出其中的骨头、鱼刺、纸巾、塑料袋等, 再用食品搅拌机(荣事达RS-JR20F, 中国大陆)打成浆状, 使餐厨垃圾的粒径减小, 增大与微生物接触的比表面积, 利于后续发酵更好的进行.将浆状餐厨垃圾分装在封口袋, 放在-20 ℃的冰箱中冷冻保存, 用料时将其放在4 ℃的冰箱中冷藏储存待用.
实验所用的接种污泥来自实验室正在稳定运行的中温单相厌氧发酵罐中的厌氧污泥, 厌氧泥取用之后静沉待用, 污泥外观呈黑色.
实验所用的餐厨垃圾和污泥的性质见表 1.
| 表 1 餐厨垃圾和接种污泥的性质 Table 1 Characteristics of food waste and mixed sludge |
试验所用的半连续流厌氧发酵产酸反应器示意图如图 1所示.反应器由有机玻璃制成, 总体积5.5 L(直径8 cm, 高28 cm), 有效容积4 L, 采用加热垫包裹加热, 控制温度在(35±1) ℃, 中温发酵.反应器采用pH自控装置通过向反应器中投加1 mol·L-1的NaOH溶液以保证实验时该反应器中的pH保持在5.9~6.1之间.反应器上部设置进料口, 底部设置出料口, 进出料由蠕动泵(兰格蠕动泵BT100-2J, 中国大陆)完成.顶部设置机械搅拌装置, 搅拌桨深入到反应器底部, 确保发酵混合物充分混合.反应器封盖中心设置水封, 封盖上连接气袋, 用于收集气体、平衡气压.
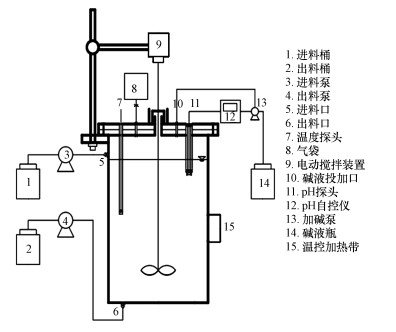 |
| 图 1 半连续流厌氧发酵反应器示意图 Fig. 1 Schematic diagram of semi-continuous reactor of anaerobic fermentation |
将总体积1 L, 有效体积800 mL的反应瓶放入恒温磁力水浴锅中构建成恒温水浴磁力批次反应装置.批次厌氧发酵反应器的示意图见图 2.
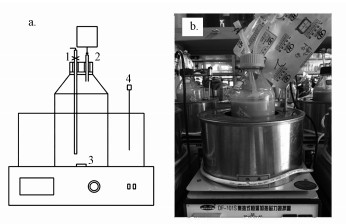 |
| 图 2 批次实验反应装置示意图a)和实物图b) (1.取料口; 2.气体收集口; 3.磁转子搅拌; 4.温度探头) Fig. 2 Schematic diagram a) and physical picture of batch reactor (1. Effluent bucket, 2. Gas collection, 3. Magnetic rotor stirring, 4. Thermometer) |
餐厨垃圾半连续流厌氧发酵反应器启动阶段采用逐渐提高负荷的方式启动.反应器初始种泥3 L, 接种前先经过脱气处理, 将反应器进行3 min左右氮吹, 每天投加餐厨垃圾200 mL, 5 d后达到反应器有效容积, 启动阶段反应器中餐厨垃圾(VS)与接种污泥(VS)的比值为1.74.提高负荷阶段只进料不出料.达到有效容积之后, 每隔24 h进出料1次(各500 mL), 并进行取样分析.反应器运行负荷OLR (VS)为3 g·L-1·d-1, 运行期间HRT为8 d.
2.3.2 甘油对餐厨垃圾厌氧消化影响的批次实验采用批次反应装置进行甘油对餐厨垃圾厌氧消化影响的实验, 将不同比例的餐厨垃圾和甘油混合, 配制成不同碳氮比(C/N)的反应底物.共设置两组平行试验, 每组4个水平, C/N分别为10.69/1(空白)、15/1、20/1、25/1, 水浴温度控制在(35±1) ℃, pH值不调控.共设8个反应器, 编号为0-1, 0-2, 1-1, 1-2, 2-1, 2-2, 3-1, 3-2, 其中0-1和0-2是未投加甘油的空白对照组(C/N=10.69).1-1和1-2为投加5.66 g甘油的一组, 2-1和2-2中投加甘油12.22 g, 3-1和3-2中投加甘油18.78 g, 此3组C/N分别为15/1、20/1和25/1.批次实验所用接种物为半连续流反应器中驯化所得的餐厨垃圾厌氧消化污泥.所用餐厨垃圾和接种污泥的性质如表 2所示.反应器进料、氮吹之后, 密闭中温发酵5 d, 间隔取样, 测试分析.
| 表 2 批次实验所用的餐厨垃圾和接种污泥的性质 Table 2 Properties of kitchen waste and inoculating sludge used in the batch experiment |
将样品在10000 r·min-1下离心15 min, 上清液过0.45 μm滤膜后进行各项指标测定及分析.挥发性脂肪酸采用气相色谱法测试(GC7890N/FID, 美国安捷伦).氨氮、溶解性COD按照国家标准方法(国家环境保护总局, 2002)测量.溶解性蛋白质浓度采用Lowery试剂盒测试法, 溶解性多糖浓度采用苯酚-硫酸法测试.COD与其他部分指标之间有一定的换算系数(Chen et al., 2017):1.07 g COD/g乙酸, 1.51 gCOD/g丙酸, 1.81 g COD/g丁酸, 2.04 g COD/g戊酸, 1.19 g COD/g多糖, 1.42 g COD/g蛋白.
3 结果与讨论(Results and discussion) 3.1 半连续流反应器启动和运行发酵液sCOD可以表征发酵体系中有机物的总量(周爱娟, 2014), 主要包括VFAs、溶解性多糖、溶解性蛋白、乙醇及其他, VFAs主要由乙酸、丙酸、异丁酸、正丁酸、异戊酸、正戊酸等组成.餐厨垃圾厌氧发酵过程的底物水解程度可以由sCOD的变化情况表示, 底物的水解程度对后续VFAs的产生有很大的影响.半连续流反应器发酵液sCOD各组分含量随发酵时间的变化由图 3a所示.随着发酵天数的增加, sCOD的值先有一定增加, 之后保持在一定范围内上下波动, 反应器逐渐达到稳定运行状态, 稳定运行期sCOD为(29419.50±3739.64) mg·L-1.sCOD中VFAs所占的比例逐渐增加, 反应器酸化程度逐渐升高.发酵液的酸化率(VFAs/sCOD)随发酵时间的增长, 由50.22%提高到92.64%, 且从第16 d开始逐渐稳定在92.63%±4.46%.图 3b显示了发酵液VFAs总产量及各组分含量随发酵时间的变化.可以看出正戊酸和正丁酸在VFAs中所占比例较高, 且随发酵时间有先增高后降低的变化, 乙酸和丙酸的比例也有所增加.在发酵第13到第19 d中, 正戊酸44.41%±0.84%和正丁酸42.82%±1.64%的比例较高, 在发酵第20 d之后二者所占比例分别降至36.00%±2.63%和24.35%±2.18%.与此同时, 乙酸和丙酸的比例在发酵前20 d内逐渐增高, 之后稳定在17.51%±1.95%和20.09%±1.35%.
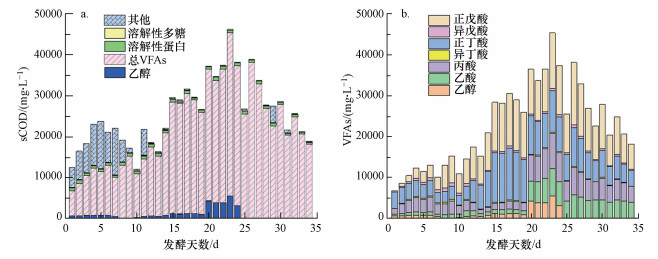 |
| 图 3 半连续流反应器发酵液a) sCOD及b) VFAs各组分含量随发酵时间的变化 Fig. 3 The changes of a) sCOD content and b) VFAs components in semi-continuous reactor with fermentation time |
半连续流反应器发酵液氨氮浓度随发酵时间的变化如图 4a所示, 氨氮浓度在提升负荷阶段迅速下降, 5 d后反应器运行负荷稳定, 随着发酵时间增加, 发酵液氨氮含量在一定范围内波动, 反应器达到稳定运行的状态, 发酵液氨氮浓度基本稳定在(29.32±5.41) mg·L-1.发酵体系中的氨氮主要来源于蛋白质和氨基酸的降解, 初始氨氮浓度较高可能是由于初期反应器中接种污泥所占混合发酵物的比例较高且发酵底物中的蛋白质水解程度还较低的原因.随发酵天数增加, 体系中餐厨垃圾及其溶出物占比不断增加, 氨氮浓度降至一个较低的水平, 并在一定范围内浮动, 发酵体系趋于稳定.
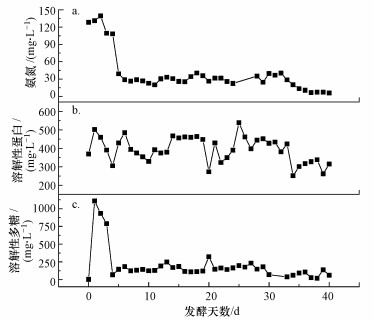 |
| 图 4 半连续流反应器a)氨氮、b)蛋白及c)多糖浓度随发酵时间的变化 Fig. 4 The changes of a) ammonia nitrogen b) protein and c) polysaccharide concentration in semi-continuous reactor with fermentation time |
蛋白质和多糖是餐厨垃圾的主要成分, 其浓度的变化可指示餐厨垃圾的水解程度.有研究(Yin et al., 2014)证实餐厨垃圾中碳水化合物和多糖的水解酸化与产生的VFAs的组成有关.发酵液溶解性蛋白浓度随发酵时间的变化如图 4b所示, 溶解性蛋白浓度随发酵时间的增加变化幅度不大, 基本稳定在(393.31±69.00) mg·L-1.发酵液溶解性多糖浓度(图 4 c)在提升负荷阶段变化较大, 5 d后反应器运行负荷稳定, 随着发酵时间增加, 溶解性多糖浓度变化幅度不大, 基本稳定在(158.22±36.79) mg·L-1.
3.2 甘油对餐厨垃圾厌氧产酸的影响在餐厨垃圾厌氧发酵半连续流反应器运行逐渐达到稳定之后, 反应器内成功驯化出了适用于餐厨垃圾中温发酵的污泥, 将其作为接种污泥用于批次实验, 探究甘油投加对餐厨垃圾厌氧发酵产酸过程的影响.
3.2.1 甘油对餐厨垃圾厌氧发酵体系pH的影响厌氧发酵产酸过程中VFAs的不断积累使得发酵体系的pH不断下降, 对厌氧消化过程的各个阶段都会产生影响.图 5a表示了各组反应器内pH值随发酵时间的变化情况.由图 5a可以看出, 发酵时间在0~20 h之间, 各反应器发酵体系pH不断下降, pH平均值由5.62±0.02 (0 h)降至5.13±0.03 (22 h), 这可能是反应器VFAs不断积累造成的.此后空白组的两个反应器pH逐渐回升, 0-1的pH在22 h至43 h之间上升至5.69, 并在43~75.5 h之内维持在5.71±0.02的水平, 75.5 h之后由5.70小幅下降至5.57.0-2的pH的变化与0-1有相似的趋势, 22~75.5 h内回升至5.72, 之后的47.5 h内下降至5.58.pH的回升是因为含氮有机物水解产生的氨氮为反应体系提供了碱度.整体来看, 在发酵22 h之后空白组的pH明显高于其他组.且随着甘油投加量的增加, 发酵体系pH的下降程度也增加, 甘油投加量较大(12.22 g和18.78 g)的4个反应器的发酵体系pH在发酵过程中持续下降, 最终pH降至4.98 (2-1)、4.89 (2-2)、4.76 (3-1)、4.82 (3-2).由此可见, 甘油投加对反应器产酸有促进作用.有研究报道(吴清莲, 2015)厌氧反应器pH低于5.0时, 可能会对发酵过程有机物的水解产生抑制.因此在甘油投加时既要考虑其对产酸效果的影响也要考虑对发酵环境的影响, 避免因pH过低而对微生物活性和相关酶活性产生抑制.
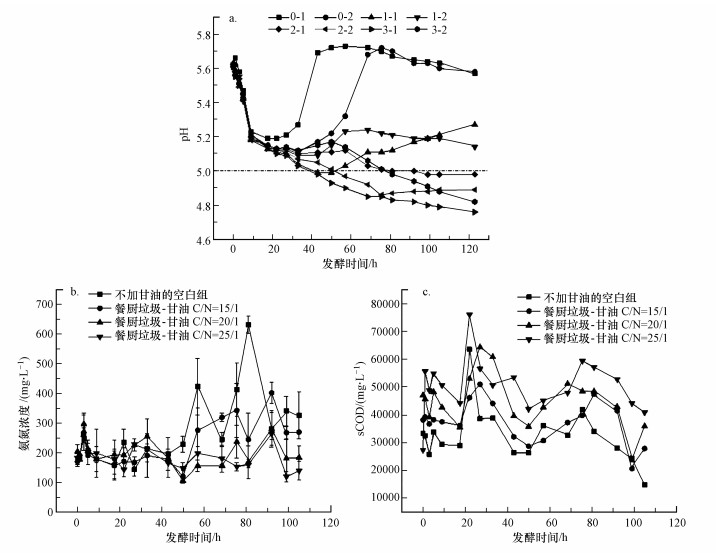 |
| 图 5 厌氧发酵过程中a) pH、b)氨氮浓度及c) sCOD随发酵时间的变化 Fig. 5 Changes in a) pH, b) ammonia nitrogen concentration and c) sCOD concentration during anaerobic fermentation |
图 5b所示为不同C/N时发酵液氨氮浓度随发酵时间的变化.在发酵初期, 0~50 h内, 各组氨氮浓度在一定范围内波动, 变化幅度不大, 各组之间的差异性不明显.在第50 h之后, 未投加甘油的空白组氨氮浓度有大幅度的增加, 这是由于发酵体系中的蛋白质和氨基酸等含氮有机物质水解产生了氨氮.氨氮的释放为反应器提供了碱度, 中和了反应器的酸性环境, 这也是空白组的两个反应器在发酵中后期pH升高明显且维持在较高水平的原因.从图 5b可以看出, 厌氧发酵反应器甘油投加量越高, 发酵中后期(50 h之后)在同一时间下发酵液的氨氮浓度越低.因为在厌氧消化系统中投加甘油, 有效的提高了发酵底物的C/N, 丰富的碳源和氮源促进了产酸菌的增殖.有研究(Drennan et al., 2014; Akindele et al., 2017)指出, 以餐厨垃圾这种C/N较低的底物进行厌氧消化过程会产生过多的氨氮, 容易造成系统失败, 对微生物的种类也有影响(Julie et al., 2013).本研究实现了在不进行人工调控pH的情况下, 通过投加甘油调节C/N的手段改善对厌氧发酵过程中氨氮抑制的问题.
3.2.2 甘油对餐厨垃圾水解效果的影响研究用发酵液sCOD、溶解性蛋白和溶解性多糖这3个指标随发酵时间的变化表征餐厨垃圾厌氧消化水解的效果.图 5c表示在不同C/N时发酵液sCOD随发酵时间的变化.可以看出, 随着发酵时间的增加, 各组反应器发酵液sCOD整体呈现先升高后降低的趋势.未加甘油的空白组发酵液sCOD在发酵22 h时提高至最大值63484.80 mg·L-1.随着甘油投加量的增加, 各个组的sCOD的最高值及相对应的发酵时间分别为50898.00 mg·L-1 (27 h), 64260.00 mg·L-1 (27h), 75990.00 mg·L-1 (22h).在发酵时间为0~22 h之内, 空白组的sCOD在各组中最低, 随C/N升高, 发酵液sCOD升高.这是因为投加甘油提高了底物的C/N, 充足的碳源和适宜的C/N有效提高了水解酶的合成与分泌, 促进底物中固相的有机物质快速水解.从整体趋势来看, 甘油的投加可以提高发酵液sCOD, 且随C/N升高而升高.图 6表示在不同C/N时发酵液溶解性蛋白和溶解性多糖浓度随发酵时间的变化.由图 6a可以看出, 发酵液溶解性蛋白浓度整体呈下降趋势, 原因可能是被水解为氨基酸等小分子物质或被氨化细菌等微生物分解产生氨, 作为微生物生长增殖的氮源被利用.由图 6b可以看出, 随着发酵时间的增加, 发酵液溶解性多糖的浓度先增加后降低.在发酵初期, 发酵底物中固相的含碳有机物在水解酶的作用下迅速水解产生大量溶解性多糖, 在发酵9 h时浓度达到最高.未投加甘油的空白组发酵液多糖浓度的最大值为997.86 mg·L-1, 比发酵前提高14.04%, C/N为15/1、20/1和25/1的3组溶剂性多糖浓度最大值较发酵前分别增加了14.45%、16.72%和20.66%.表明甘油的投加加速了发酵底物的水解过程.发酵9 h之后各组溶解性多糖浓度有逐渐下降的趋势, 表明溶解性多糖被微生物利用转化成VFAs等小分子物质.溶解性蛋白和溶解性多糖同步降低的现象也说明了蛋白质降解和碳水化合物降解之间存在协同作用, 这一说法已有相关研究印证(周爱娟, 2014; Feng et al., 2009).
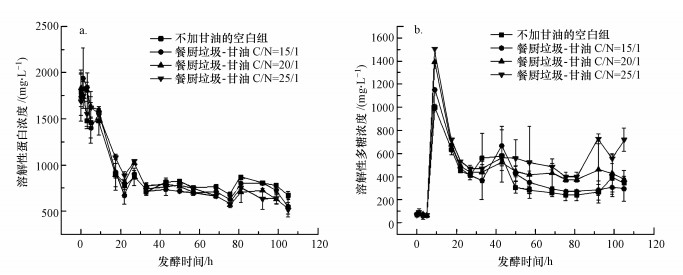 |
| 图 6 不同C/N时发酵液溶解性蛋白(a)及多糖(b)浓度随发酵时间的变化 Fig. 6 Changes in the concentration of soluble proteins a) and soluble polysaccharides b) at different C/N |
在不同的甘油投加量下, 发酵液VFAs的产量和组成也不同.图 7a )是不同C/N条件下餐厨垃圾厌氧发酵VFAs的产量随发酵时间的变化情况.由图可知, 随着发酵时间的增加, 发酵液VFAs的浓度呈上升趋势.未投加甘油的组反应器中发酵液VFAs在发酵99 h时达最大33503.14 mg·L-1, 随着甘油投加量的增加, C/N为15/1, 20/1和25/1的组反应器中发酵液VFAs的最大产量分别为33093.78 mg·L-1(发酵99 h), 36110.91 mg·L-1(发酵75.5 h)和36952.21 mg·L-1(发酵81 h), 说明甘油的投加对提高VFAs产量有促进作用.VFAs产量最大在C/N为25/1, 相比空白组提高了10.3%.结合对其他指标的观察结果, 可知甘油的投加有效的促进了发酵底物中有机物的水解过程, 也促进VFAs的产生.
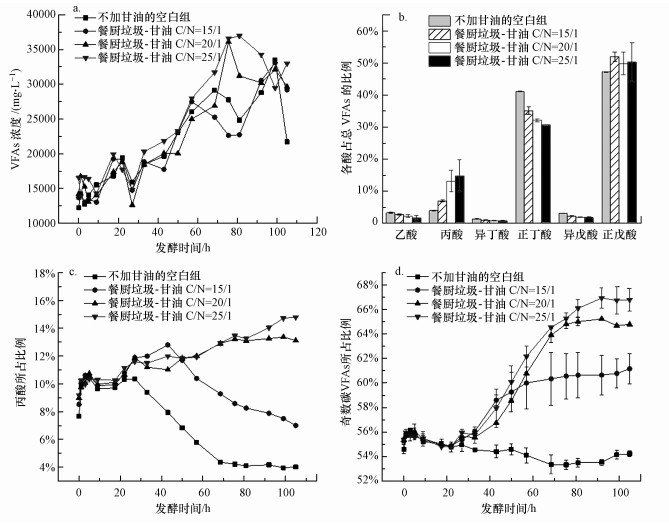 |
| 图 7 不同C/N时发酵液VFAs产量及组成随发酵时间的变化 Fig. 7 Changes in VFAs concentration and composition at different C/N |
投加甘油改变了餐厨垃圾厌氧发酵原有的发酵环境, 产生的发酵液中的VFAs的组分也发生了变化.图 7b表示了投加甘油对餐厨垃圾厌氧发酵得到的末端发酵液VFAs组分的影响.末端发酵液中VFAs的成分主要以正戊酸、正丁酸和丙酸为主.发酵底物C/N较高的组末端发酵液丙酸所占的比例较高.不加甘油的空白组发酵液丙酸占VFAs总量的3.96%, C/N为15/1、20/1和25/1的发酵体系末端发酵液丙酸所占VFAs比例分别为7.50%、13.22%和13.25%.由此可知, 投加甘油能使末端发酵液丙酸所占VFAs的比例有所增加.从图 7c又可以看出, 不加甘油的发酵体系发酵液丙酸占VFAs的比例随发酵时间先增加后降低, 而甘油投加量较高的组(C/N=20/1, 25/1)发酵液丙酸所占比例随发酵时间持续呈上升趋势, 进一步说明甘油投加在整个发酵过程中对丙酸的产生都有一定促进作用.
奇数碳VFAs占总VFAs的比例的提升是本研究的一个重要目标.从图 7b可以看出, 投加甘油的发酵体系末端发酵液奇数碳VFAs所占的比例比对照组高.空白组发酵液奇数碳VFAs占VFAs总量的54.23%, C/N为15/1、20/1和25/1的发酵体系末端发酵液奇数碳VFAs所占VFAs比例分别为61.16%、64.78%和66.79%.可见甘油的投加能使末端发酵液中奇数碳VFAs占总VFAs的比例增加.图 7d是不同C/N时发酵液奇数碳VFAs所占比例随发酵时间的变化.在空白组, 发酵液奇数碳VFAs所占的比例随发酵时间呈下降趋势, 在5 d的发酵时间里, 从发酵前的54.60%小幅降低至54.23%.随着甘油投加量增加, 发酵液奇数碳VFAs所占的比例随发酵时间的增长越高.可见在餐厨垃圾厌氧发酵体系中投加甘油改变底物C/N可以发酵液VFAs中奇数碳VFAs和偶数碳VFAs的比例起到调控作用, 并且对奇数碳VFAs的合成比较有利.
4 结论(Conclusions)1) 发酵5 d之后, 发酵底物水解过程达到稳定, 发酵液氨氮、溶解性蛋白和溶解性多糖浓度分别为(29.32±5.41) mg·L-1, (393.31±69.00) mg·L-1和(158.22±36.79) mg·L-1.反应器运行15 d之后, sCOD逐渐稳定在(29419.50±3739.64) mg·L-1, 其中VFAs所占比例逐渐升高, 发酵液酸化率稳定在92.63%±4.46%, 发酵体系趋于稳定.
2) 通过投加甘油的方式改变餐厨垃圾厌氧发酵过程底物的C/N, 探究在不同C/N条件下餐厨垃圾厌氧发酵的产酸性能.研究表明, 投加甘油加速了有机物的水解过程, 使发酵体系pH迅速降低, 提高了反应器酸化程度, VFAs产量最大在C/N为25/1, 相比空白组提高了10.3%;投加甘油在提高餐厨垃圾厌氧发酵VFAs的产量的同时对VFAs组成也产生影响, 使得丙酸、戊酸等奇数碳VFAs在总VFAs中所占的比例显著提升, 为PHA产品的合成和应用提供了参考.
Akindele A A, Sartaj M. 2018. The toxicity effects of ammonia on anaerobic digestion of organic fraction of municipal solid waste[J]. Waste Management, 71(1): 757-766. |
Astals S, Nolla-Ardèvol V, Mata-Alvarez J. 2012. Anaerobic co-digestion of pig manure and crude glycerol at mesophilic conditions:Biogas and digestate[J]. Bioresource Technology, 110: 63-70. |
Banks C J, Zhang Y, Jiang Y, et al. 2012. Trace element requirements for stable food waste digestion at elevated ammonia concentrations[J]. Bioresource Technology, 104(none): 127-135. |
Braguglia C M, Gallipoli A, Gianico A, et al. 2017. Anaerobic bioconversion of food waste into energy: A critical review[J]. Bioresource Technology: S486281446
|
Capson-Tojo G, Trably E, Rouez M, et al. 2017. Dry anaerobic digestion of food waste and cardboard at different substrate loads, solid contents and co-digestion proportions[J]. Bioresource Technology, 233(Complete): 166-175. |
Chen G Q. 2009. A microbial polyhydroxyalkanoates (PHA) based bio- and materials industry[J]. Chemical Society Reviews, 38(8): 2434-2446. |
Chen Y, Jiang X, Xiao K, et al. 2017. Enhanced volatile fatty acids (VFAs) production in a thermophilic fermenter with stepwise pH increase-Investigation on dissolved organic matter transformation and microbial community shift[J]. Water Research, 112: 261-268. |
Dai X, Duan N, Dong B, et al. 2013. High-solids anaerobic co-digestion of sewage sludge and food waste in comparison with mono digestions:Stability and performance[J]. Waste Management, 33(2): 308-316. |
Drennan M F, Distefano T D. 2014. High solids co-digestion of food and landscape waste and the potential for ammonia toxicity[J]. Waste Management, 34(7): 1289-1298. |
Feng L, Chen Y, Zheng X. 2009. Enhancement of waste activated sludge protein conversion and volatile fatty acids accumulation during waste activated sludge anaerobic fermentation by carbohydrate substrate addition:The effect of pH[J]. Environmental Science & Technology, 43(12): 4373-4380. |
Fountoulakis M S, Petousi I, Manios T. 2010. Co-digestion of sewage sludge with glycerol to boost biogas production[J]. Waste Management, 30(10): 1849-1853. |
Gao S, Zhao M, Chen Y, et al. 2015. Tolerance response to in situ ammonia stress in a pilot-scale anaerobic digestion reactor for alleviating ammonia inhibition[J]. Bioresource Technology, 198: S488578784. |
Julie, Williams, And, et al. 2013. Monitoring methanogenic population dynamics in a full-scale anaerobic digester to facilitate operational management[J]. Bioresource Technology, 140: 234-242
|
Li L, He Q, Ma Y, et al. 2015. Dynamics of microbial community in a mesophilic anaerobic digester treating food waste:Relationship between community structure and process stability[J]. Bioresource Technology, 189: 113-120. |
Nielsen C, Rahman A, Rehman A U, et al. 2017. Food waste conversion to microbial polyhydroxyalkanoates[J]. Microbial Biotechnology, 10(6): 1338-1352. |
Razaviarani V, Buchanan I D. 2015. Anaerobic co-digestion of biodiesel waste glycerin with municipal wastewater sludge:Microbial community structure dynamics and reactor performance[J]. Bioresource Technology, 182: 8-17. |
Rivero M, Solera R, Perez M. 2014. Anaerobic mesophilic co-digestion of sewage sludge with glycerol:Enhanced biohydrogen production[J]. International Journal of Hydrogen Energy, 39(6): 2481-2488. |
Silva F M S, Mahler C F, Oliveira L B, et al. 2018. Hydrogen and methane production in a two-stage anaerobic digestion system by co-digestion of food waste, sewage sludge and glycerol[J]. Waste Management, 76(6): 339-349. |
Silva F M S, Oliveira L B, Mahler C F, et al. 2017. Hydrogen production through anaerobic co-digestion of food waste and crude glycerol at mesophilic conditions[J]. International Journal of Hydrogen Energy: S2069000668
|
Slinn M, Kendall K, Mallon C, et al. 2008. Steam reforming of biodiesel by-product to make renewable hydrogen[J]. Bioresource Technology, 99(13): 5851-5858. |
Suriyamongkol P, Weselake R, Narine S, et al. 2007. Biotechnological approaches for the production of polyhydroxyalkanoates in microorganisms and plants-A review[J]. Biotechnology Advances, 25(2): 148-175. |
Xu F, Li Y, Ge X, et al. 2017. Anaerobic digestion of food waste-challenges and opportunities[J]. Bioresource Technology: S486276249
|
Yin J, Wang K, Yang Y, et al. 2014. Improving production of volatile fatty acids from food waste fermentation by hydrothermal pretreatment[J]. Bioresource Technology, 171: 323-329. |
车雪梅, 司徒卫, 余柳松, 等. 2018. 聚羟基脂肪酸酯的应用展望[J]. 生物工程学报, 34(10): 6-17. |
国家环境保护总局. 2002.水和废水监测分析方法[M].北京: 中国环境科学出版社
|
吴清莲. 2015.餐厨垃圾厌氧发酵产挥发性脂肪酸的研究[D].哈尔滨: 哈尔滨工业大学 10.7666/d.D754821
|
张颖, 王怡, 柴宝华. 2018. 制取生物柴油产生的粗甘油对污泥厌氧消化的影响[J]. 中国给水排水, 34(17): 15-19. |
周爱娟. 2014.预处理促进剩余污泥发酵制取短链脂肪酸的效能及机制研究[D].哈尔滨: 哈尔滨工业大学 10.7666/d.D594037
|
 2020, Vol. 40
2020, Vol. 40


