我国污水排放量近年来逐年增加, 排放总量已超过700亿吨.水中污染物的转化途径包括物理法、化学法和生物法等, 物理法包括混凝沉淀、沉淀分离、气浮、过滤、反渗透和膜分离等(Sonune & Ghate, 2004), 主要是将水相中的颗粒、悬浮物及大分子等污染物转移到其它相中.化学法包括中和法、化学沉淀法、氧化法、还原法、吸附法、离子交换法等, 其中高级氧化技术, 如UV/O3、UV/H2O2、UV/Fenton、O3/H2O2、氯氧化、硫酸盐氧化和电化学催化等(Andreozzi et al., 1999; Lin & Chen, 1997), 可有效的将废水中各种有机物进行转化.生物法有好氧法和厌氧法等(Cakir & Stenstrom, 2005; Chan et al., 2009).好氧法包括活性污泥法、接触氧化法、水解酸化法、膜生物反应器法等, 可有效去除水中的碳和氮;厌氧法包括厌氧消化池、厌氧生物滤池、UASB、EGSB等, 主要用于处理高浓度污水并回收能源(Leitao et al., 2006);随着人们对脱氮除磷要求的提高, 陆续开发出耦合好氧和厌氧的AAO、AO、SBR、氧化沟、短程硝化反硝化和厌氧氨氧化等工艺, 实现废水中氮磷的高效去除(Peng & Zhu, 2006).
自活性污泥法1914年在英国被应用以来, 废水生物处理技术已经过100多年的发展, 是目前水处理行业的主流技术, 被广泛应用(朱乐辉等, 1997).然而, 该技术存在厌氧转化效率低、速度慢, 好氧污泥产生量大、能耗高等不足.
本文基于微生物氧化的基本原理, 从介体材料强化、光电磁强化及微生物电化学界面强化等角度, 归纳总结了目前微生物胞外电子传递过程强化的研究进展, 并展望了该技术的发展趋势及存在的挑战.
2 介体材料强化微生物电子传递(Strengthening microbial electron transfer with mediator materials)针对难降解废水厌氧处理效率低、毒性大等问题, 向厌氧消化系统中加入介体材料, 不仅能使毒性物质脱毒, 而且可促进种间电子传递及强化甲烷产生.目前, 铁基和碳基材料是研究最广泛的用于改进厌氧系统的运行效能和微生物活性的导电介体.
我国在铁基方向的研究处在世界前列.以铁和厌氧消化为关键词, 在Web of science中, 可检索到686篇文献, 其中大连理工大学、中国科学院、哈尔滨工业大学、清华大学和昆士兰大学排在前5位.强化厌氧系统的铁基材料有零价铁(ZVI)、磁铁矿、氧化铁、铁粉及刨花铁等.所采用铁基材料粒径一般小于200 nm, 用量一般介于几到几百mg · L-1之间, 厌氧发酵底物包括废水、剩余污泥、城市废弃物、牛粪等(Ajay et al., 2020; Ugwu et al., 2020).对甲烷产生量的强化效果介于4%~105%之间, 主要与介体的类型、投加量、底物种类以及厌氧消化条件等有关(Zhang et al., 2020; Zhen et al., 2015).作为还原剂, ZVI能帮助构建厌氧环境, 能改进厌氧工艺的运行效果并改变厌氧系统的主要群落结构.Zhang等构建的ZVI-UASB系统能提升染料废水的处理效能, 且温度降低(35到25 ℃)对ZVI-UASB的影响要比UASB小一些, 同时ZVI-UASB系统在HRT为12 h时对COD和色度的去除率要比UASB在HRT为24 h时的去除率更高一些(Zhang et al., 2011).我们前期研究表明GAC/NZVI能使COD和TOC的去除提高12.1%和10.3%, 而对四环素去除和硫化物产生没有明显影响, 使生物气产生和甲烷含量分别提高21.2%和26.9%.加入的GAC/NZVI与污泥形成紧密的聚集体, 增加了污泥的电导率和污泥EPS含量(Zhang et al., 2018d).
铁介体强化甲烷产生机制(图 1)主要体现在以下几方面:(1)ZVI的导电特性可以用作互营养菌群(如产氢产乙酸菌和产甲烷菌等)之间的电子传输通道(Kato et al., 2012);(2)Fe3+/Fe2+和NZVI氧化还原作用能够加速电子流从乙酸氧化到氢营养型产甲烷菌的传递(Jiang et al., 2013);(3)主要产甲烷菌Methanosaeta能够与系统中的铁还原菌进行种间直接电子传递.Rotaru等报道混合菌群中CO2还原为CH4时Metallireducens能够与Methanosaeta harundinacea进行种间直接电子传递(Rotaru et al., 2014);(4)ZVI与产生的H2可以作为自养甲烷菌在还原CO2为CH4时作为电子供体, 从而导致甲烷的产生(Zhen et al., 2015).
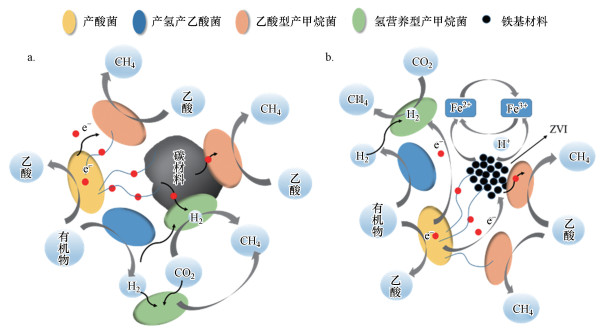 |
| 图 1 介体强化胞外电子传递过程示意(a.碳基材料;b.铁基材料) Fig. 1 Schematic diagram of extracellular electron transfer process enhanced by carbon-based and iron-based material |
用于强化厌氧系统的碳基材料主要有颗粒活性炭(GAC)、粉末活性炭(PAC)、碳布、碳纳米管、生物炭、石墨及石墨烯等.所采用碳基材料的粒径多介于几μm到几十mm之间, 投加量介于几mg · L-1到10 g · L-1, 强化甲烷产生的效果介于11.7%~70.6%之间(Lu et al., 2020; Zhang et al., 2018a).一般认为, 碳基材料的强化作用主要是通过强化不同菌群之间的电子传递效率产生的(图 1).例如, Liu等发现GAC可提升废物向甲烷的转化, 而高导电性的GAC能强化细菌和产甲烷菌之间的直接种间电子传递, 促进乙醇的代谢和甲烷的产生, 并通过基因敲除菌实验证实含有GAC的系统存在种间直接电子传递(Liu et al., 2012).将导电碳基材料加入到连续流系统时, 能提升乙酸/乙醇向甲烷的转化和系统的负荷率, 同时介体还有助于复杂有机化合物的降解.1 g · L-1的生物炭可使硝基苯的准一级降解速率常数提高4倍(Zhao et al., 2018).
介体强化厌氧过程虽然取得重要进展, 仍存在许多问题有待研究.主要包括:纳米介体的流失问题;强化系统长期运行时的稳定性;强化系统中难降解污染物的强化转化机制;介体强化污染物去除及促进甲烷产生的机制;多种介体之间的协同作用机制等.
3 光、电、磁强化微生物电子传递(Strengthening microbial electron transfer with photo, electric and magnetism) 3.1 电场强化微生物电子传递过程电-生物耦合技术是将“电场”引入生物反应器中, 通过对电压、电流等电化学参数的调控来增强污染物的降解效果, 如图 2所示.
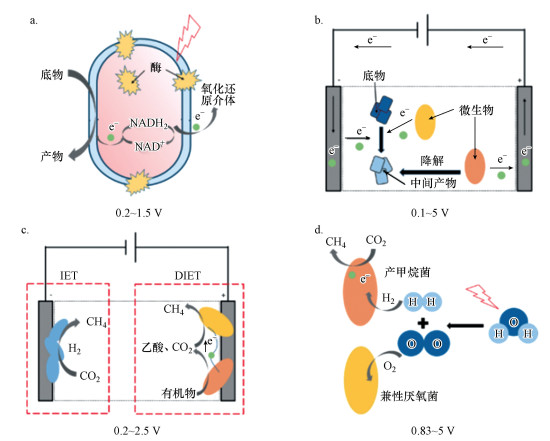 |
| 图 2 电场强化胞外电子传递过程示意图 Fig. 2 Schematic diagram of extracellular electron transfer process enhanced by electric field |
外加电场能够提高微生物中生物酶的活性并促进微生物的代谢与生长(Chang et al., 1995; 钟方丽等, 2001), 促进微生物的氧化还原过程, 强化有机物的降解效果(周生学, 2009).Guiot等在上升流反应器中添加电解电压处理四氯乙烯(PCE)废水, 在电场刺激诱导作用下, 甲烷加氢酶的产生和活性提高, 产生的甲烷与PCE转化过程中的氯化中间体形成共代谢效应共同被氧化, 实现污染物的高效去除(Guiot et al., 2008).此外, 电极可作为电子源, 在微生物和电极之间进行直接胞外电子传递(DIET)或间接胞外电子传递(IET)过程(Kracke et al., 2015).电场可通过促进微生物在电极上的富集以达到强化电子传递过程的目的(Beese-Vasbender et al., 2015; De Vrieze et al., 2014; Koch et al., 2015).向厌氧反应器中添加0.8 V的电压时, Methanosaeta和Geobacter在阳极富集并发生DIET过程, 阴极表面富集了氢营养型产甲烷菌Methanospirillum和Methanobacterium, DIET及IET过程均得到强化使得产甲烷率和菲的去除率分别增加30.5%和83.5%(Lin et al., 2019).当向反应器添加电解电压时, 水被电解所产生的H2作为电子中介体强化间接电子传递过程.Tartakovsky等在升流式厌氧污泥床(UASB)反应器中施加了2.8~3.5 V直流电压, 电解水产生的H2作为电子中间传递体促进了IET过程, 使得甲烷产量提高了10%~25% (Tartakovsky et al., 2011).除此之外, 添加电场可以影响微生物的种群结构(Moscoviz et al., 2016).向处理苯酚废水的UASB反应器中添加0.3 V电压时, 具有DIET能力的Methanobacterium和Syntrophorhabdus分别增长了15%和33%, 使得产甲烷效率增加了68%(Mostafa et al., 2020).
综上, 当向反应器中添加电场时, 电场可通过刺激微生物生长代谢或参与微生物之间的电子传递过程来强化生物降解过程.该强化手段利用较低的成本提高了微生物的活性, 富集优势菌群, 促进污染物降解过程中的DIET和IET过程, 并在特定电压范围内生产H2, 为废水处理及能源再生工艺提供了新思路.
3.2 光强化微生物电子传递过程受到自然界中半导体矿物与微生物相互作用的启发, 利用光能来强化微生物的胞外电子传递过程, 近年来引起了人们的关注.半导体矿物在光照下会产生光生电子和空穴对, 进而影响微生物的胞外电子传递过程.
非光合微生物除了通过氧化环境中还原性物质得到电子, 也能利用半导体矿物吸收光能所产生的光生电子, 光生电子通过半导体矿物导带传至微生物的外膜蛋白, 从而促进微生物的代谢与生长, 转移过程机制图如图 3a所示.Lu等在国际上首次证实了金属氧化物和金属硫化物等半导体矿物在可见光激发下产生的光生电子促进了化能自养与异养微生物的生长(Lu et al., 2012).此外, 一些细菌被证明能够利用光能合成半导体矿物, 同时完成CO2的固定来获得能量促进其自身生长.如Yang等证明CO2还原菌Moorella thermoacetica可以将体系中的镉离子和半胱氨酸转换为CdS纳米粒子, 并析出在细胞表面上.在光照下, CdS产生的光生电子会将CO2还原成乙酸, 而乙酸又可以为菌提供能量促进其生长(Sakimoto et al., 2016).微生物产生的电子还能够与半导体矿物产生的光生空穴复合, 从而提高半导体矿物光生电子和空穴的分离, 光生电子则传递到外电路, 从而增强电子在半导体和微生物之间的转移, 其电子传递和转移过程机制图如图 3b所示.Ren等以水钠锰矿和铜绿假单胞菌(PAO1)的混合系统作为光阳极构建了生物电化学系统(Ren et al., 2018).在可见光下, 该系统的光电流密度为279.57 μA · cm-2, 比没有铜绿假单胞菌对照组高出322%.He等研究发现, 对于Shewanella oneidensis MR-1和赤铁矿混合的体系来说, 无论是野生型的Shewanella oneidensis MR-1还是基因重组的Shewanella oneidensis MR-1, 在光照下输出的光电流要明显高于黑暗条件下的输出电流(Zhu et al., 2017).此外, 微生物产生的电子也可从微生物直接转移到半导体矿物.Yu等研究发现Geobacter sulfurreducens可以在光激发的a-Fe2O3上存活, 并且在光照以及没有可溶性电子穿梭体的情况下观察到了电子从G. sulfurreducens到a-Fe2O3的直接转移(Li et al., 2014).
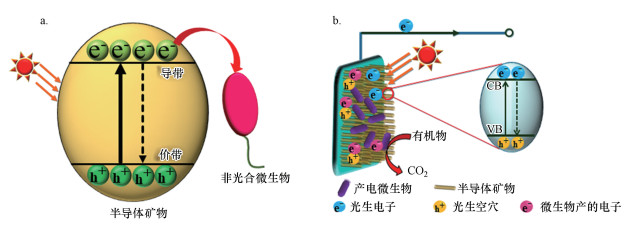 |
| 图 3 半导体矿物产生的光生电子传递到微生物的外膜蛋白过程机制图(a)光照下电子在半导体矿物和微生物之间的传递和转移过程机制图(b) Fig. 3 Mechanism diagram of the transfer of photogenerated electrons from semiconductor minerals to the outer membrane proteins of microorganisms (a) Mechanism diagram of electron transfer between semiconductor minerals and microorganisms under light irradiation (b) |
以上研究均证实了光能和具有光响应的半导体矿物的引入能够有效提高微生物胞外电子的传递过程.尽管目前光能对微生物胞外电子传递的促进机制研究已经取得了一定的进展, 但目前仍有很多科学问题亟待解决.将其应用到实际的污水处理, 构建高效去除污染物和生物电回收的系统仍需进一步深入研究.
3.3 磁场强化微生物电子传递过程任何活性生命体都具有磁性, 外加磁场、环境磁场和生物体内的磁场均会对微生物产生力的作用, 影响微生物的生长和代谢活性, 称为生物磁效应(Li et al., 2012; 许喜林等, 2006).近年来国内外有关研究证实了将微生物磁效应作用于污废水的生物处理中具有较好的强化效果(牛川等, 2018).
磁强化污水生化处理的机制主要有3种.第一, 磁场能够直接影响活性污泥微生物的细胞膜的通透性, 从而增大物质传递扩散, 影响生物体内的代谢作用(孙秀兰等, 2011).在极交变磁场条件下, 两极交变磁场使微生物细胞壁损坏、细胞内物质的外流及DNA结构改变(王洪朔等, 2007).其次, 磁场能够通过影响酶的活性间接影响微生物与污染物之间物质和能量的传递, 间接强化废水处理能力(汪涛等, 2017).过渡金属原子作为生物酶的成分, 许多情况下表现出顺磁特性, 磁场通过影响生物体的顺磁原子进而影响酶的活性(Ghodbane et al., 2013).研究还表明, 磁场能够提高低温废水的生物处理效果, 这可能是磁场通过影响脂质双层的取向重排和酶的活性中心位点来弥补低温限制的不足(Niu et al., 2013).有研究表明磁介体能够影响微生物电化学中微生物胞外电子转移(EET)过程及阳极微生物的富集, 进而提高MFCs的产电能力(Zhou et al., 2017; Zhou et al., 2019)
4 微生物电化学强化界面电子传递(Strengthening the interfacial electron transfer with microbial electrochemical system)介体材料和光、电、磁场强化了微生物代谢过程产生的电子跨细胞膜运输及种间电子传递, 实现了电子在同一空间内的种间传递.而微生物电化学系统(Microbial Electrochemical System, MES)通过外电路将电子输出和输入分离, 在两个空间内实现电子“传递”.微生物胞外电子传递(Extracellular Electron Transport, EET)主要包含两个过程:阳极电活性微生物通过胞外电子传递将电子导入阳极, 实现底物的氧化及电子输出至外电路;阴极功能微生物将电子从阴极以胞外电子传递的途径摄取进入细胞内, 参与阴极的还原过程.电极材料既是微生物的附着地, 也是微生物胞外电子传递的必经通道.图 4以反硝化生物阴极为例, 给出了微生物电化学系统的基本原理和电子输出/输入机制.
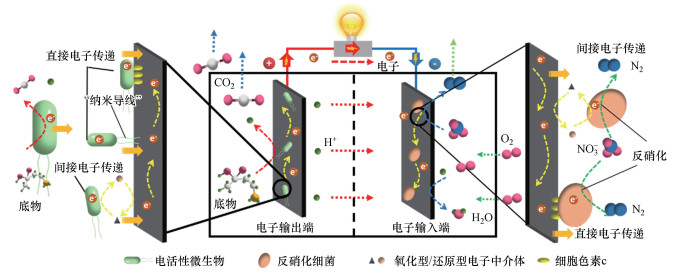 |
| 图 4 微生物电化学系统的基本原理和电子输出/输入端机制(反硝化生物阴极为例) Fig. 4 Schematic illustration in basic principle of microbial electrochemical system and the mechanism of electronic input and output(Denitrification biocathode as an example) |
阐明微生物的电子传递机制是MES技术全面推广应用的前提(Logan et al., 2019), 也是强化微生物胞外电子传递效率的难点.目前, MES系统中微生物胞外电子传递的机制尚未形成统一的结论, 但一致认同存在两种胞外电子传递机制:直接电子传递(DIET)和间接电子传递(IET).
直接电子传递(DIET):电活性微生物可以通过细胞外膜的细胞色素c将胞内电子直接转移到胞外电子受体表面/阳极(Bond & Lovely, 2003), 远离电极的微生物无法通过这一方式实现电子传递, 极大限制了电子传递的效率.Lovely等首次并证实了微生物有类似金属导电的纳米导线存在, 是微生物胞外电子长距离传输至电极的可能通道(Malvankar et al., 2011; Reguera et al., 2005).
间接电子传递(IET):微生物能够利用在代谢过程中产生小分子和小分子有机物(核黄素)作为微生物和电极之间的电子中介体, 通过电子中介体氧化还原状态的转变, 实现了电子在微生物与电极界面之间的传递(Yong et al., 2013).
4.2 微生物电化学系统胞外电子传递强化过程在微生物电化学系统(MES)中, 电子的跨膜传输, 跨生物膜的电子传递以及微生物与电极界面的电子传递是影响电子传递效率的关键过程, 如图 5所示.
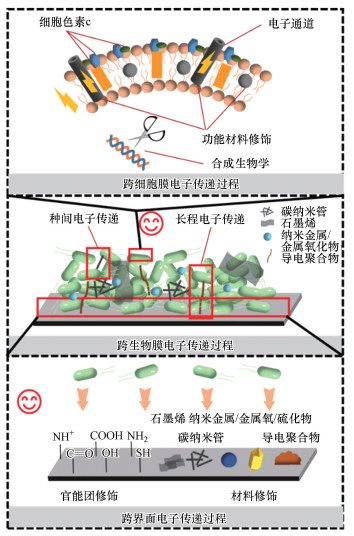 |
| 图 5 界面电子传递强化的关键过程与方法 Fig. 5 The key process and method of interface electron transfer enhancement |
(1) 电子跨膜传输的强化手段:在MES厌氧过程中, 微生物代谢有机物产生的胞内电子导出到胞外依赖于细胞膜上功能结构如细胞色素c(Liu et al., 2015a)和纳米导线(Zhou et al., 2018), 因而提高功能结构的表达和构筑跨膜电子通道是提高电子跨膜传递的有效手段.Yang等将碳点加入希瓦氏菌中, 在细胞膜内构筑电子通道, 增强了希瓦氏菌的代谢, 提高了希瓦氏菌的电子传递能力(Yang et al., 2020).
(2) 电子跨生物膜传递强化手段:电子从生物膜传递到电极表面主要包含两个部分:电子在生物膜内部种间的电子传递及远离电极的微生物与电极之间的胞外电子传递.为了提高电子的跨生物膜传递, 研究人员利用铁氧化物(Sharma et al., 2016)、碳纳米管(Zhang et al., 2017)等纳米材料在生物膜内部建立了快速电子通道, 实现了电子在微生物种间的高效传递, 极大的提高了微生物长距离胞外电子传递的效率.
(3) 微生物与电极之间的界面电子强化手段:电极界面特性是影响微生物电子传递效率的本质因素之一.使用功能材料进行界面修饰可以有效提高电子传递效率(Zhang et al., 2018b).碳纳米管(Yazdi et al., 2016)、石墨烯(Gangadharan et al., 2016)、纳米金属/金属氧/硫化物(Sun et al., 2010)、导电聚合物等(Liu et al., 2015b)材料常常被人们用于界面修饰, 改善了微生物在界面的粘附生长(Li et al., 2020), 增强电极与微生物外膜蛋白的结合, 提高界面电子传递效率.除了功能材料的修饰方法外, 含氧官能团(Ding et al., 2015)、含氮官能团(Guo et al., 2013)、含硫官能团(Liu et al., 2014)常常被用于电极界面的官能团修饰, 能够显著降低界面电子转移阻力, 促进了微生物的附着和生物膜的形成及界面电子传递.用于界面修饰的官能团普遍具有杂原子、共轭结构、芳香结构等富电子的结构, 说明具有富电子结构的官能团有利于界面电子传递, 与纳米导线上的电子传递模型相类似(Blumberger, 2015).
4.3 多种强化过程耦合提高MES效能在微生物电化学系统构建中, 通过采用电场强化、介体材料强化、光强化、电极修饰、植物耦合强化等手段实现功能微生物富集、强化微生物胞外电子传递、进而影响污染物降解效率, 提升系统性能.施加电场可促进功能微生物在电极表面的富集并可达到强化电子传递的目的, 如图 6a.电流的强化作用可以有效促进微生物种间电子转移以产生更多的甲烷(Sun et al., 2020).向配备生物电化学系统的废水污泥处理厌氧消化反应器中添加0.8 V的电压时, 功能微生物分别在系统阳极与阴极得到有效富集, 电流的强化作用促使胞外电子传递过程得到有效加强, 系统产甲烷率和菲去除率分别提升30.5%和83.5%(Lin et al., 2019).
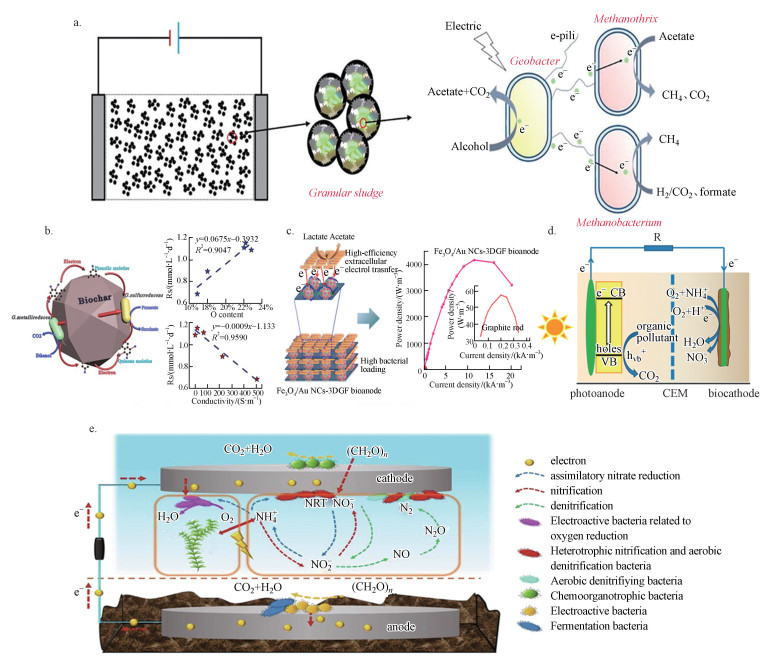 |
| 图 6 微生物电化学系统构建强化手段(a.电场强化(Sun et al., 2020);b.介体材料强化(Zhang et al., 2018c);c.磁性材料强化(Song et al., 2020);d.光强化(Du et al., 2014);e.植物耦合强化(Qiu et al., 2020)) Fig. 6 Enhancement methods for the construction of microbial electrochemical systems (a.electric field enhancement; b.mediator material enhancement; c.magnetic material enhancement; d.light enhancement; e.plant coupling enhancement) |
功能材料与电化学生物膜混合, 可提高生物膜活性, 如图 6b和6c所示.碳点加入到产电模式菌(Shewanella oneidensis)可以加速细胞自身细胞外电子转移和代谢速率, 同时伴随着细胞内电荷增加、三磷酸腺苷水平升高、底物消耗更快和更加丰富胞外分泌物(Yang et al., 2020).介体强化材料生物炭可有效促进微生物种间直接电子转移过程(Zhang et al., 2018c).磁性粒子Fe3O4修饰的电极界面可有效促进功能微生物在阳极表面的富集量并强化微生物的胞外电子传递过程(Song et al., 2020).
生物阳极耦合光电阳极(图 6d), 可以构建混合光电化学和微生物电化学系统(HPMFC)以同时利用太阳能和生物能源, 光电耦合系统的功率输出得到提高(Du et al., 2017).通过将可见光作为生物阴极反应活化能量来源, 可有效降低阴极反应壁垒, 生物阴极通过阳极与阴极之间的电压差促进了光生空穴/电子对的分离同时生物阴极室中发生了有效的硝化作用, 与贵金属催化剂相比, 系统具有更优异的功能(Du et al., 2014).
植物阴极能为系统提供更多的电子受体(O2), 同时根部产生根状沉积物和渗出物可被用作碳源用于微生物氧化, 植物生物质还可通过吸收溶解的养分和重金属以提高系统处理过程中的污染物去除效率(Kabutey et al., 2019).通过开发具有功能性生物阴极的植物耦合管状生物电化学系统(BES)可有效去除地表水和沉积物中的污染物(图 6e).
相对于传统的微生物氧化与还原在一个空间内完成的生物转化系统, 微生物电化学实现了电荷在两个极室的分离(电荷立体分离), 这种分离导致微生物同化效率降低进而可以有效减少污泥产量.哈工大冯玉杰团队构建了总体积为1.5 m3的微生物电化学系统(MES), 并在市政污水处理厂实地进行了场地实验.进水采用初沉池出水, COD去除率91%±3%, 总氮去除率64%±2%, 氨氮去除率91%±3%, 达到一级A排放标准, 运行成本是典型活性污泥工艺的12%(He et al., 2019).该系统的成功运行为城市污水、集中式分散水源的低能耗处理提供了一种新思路.
5 总结(Conclusions)本文针对现有生物处理系统存在的问题, 从强化微生物胞外电子传递效率出发, 从介体强化、光电磁强化及微生物电化学系统界面强化等角度, 系统总结了微生物胞外电子传递过程强化机制的研究进展.本文认为目前该领域的研究重点包括, 1)在强化机制方面:如何原位表征强化微生物胞外电子传递过程;是否存在多种强化方式的协同作用;如何从生物学方面解析其机制等;2)在强化系统构建方面:系统的构型优化与强化措施之间的内在联系;强化系统放大策略及关键问题;强化系统的运行及调控策略;3)在强化系统的应用方面:强化系统应用的模式及领域, 解决应用过程中的工程问题等.
Ajay C M, Mohan S, Dinesha P, et al. 2020. Review of impact of nanoparticle additives on anaerobic digestion and methane generation[J]. Fuel, 277: 118234. DOI:10.1016/j.fuel.2020.118234 |
Andreozzi R, Caprio V, Insola A, et al. 1999. Advanced oxidation processes (AOP) for water purification and recovery[J]. Catalysis Today, 53(1): 51-59. |
Beese-Vasbender P F, Grote J P, Garrelfs J, et al. 2015. Selective microbial electrosynthesis of methane by a pure culture of a marine lithoautotrophic archaeon[J]. Bioelectrochemistry, 102: 50-55. DOI:10.1016/j.bioelechem.2014.11.004 |
Blumberger J. 2015. Recent Advances in the Theory and Molecular Simulation of Biological Electron Transfer Reactions[J]. Chem Rev, 115(20): 11191-11238. DOI:10.1021/acs.chemrev.5b00298 |
Bond D R, Lovely D R. 2003. Electricity production by Geobacter sulfurreducens attached to electrodes[J]. Appl Environ Microbiol, 69: 1548-1555. DOI:10.1128/AEM.69.3.1548-1555.2003 |
Cakir F Y, Stenstrom M K. 2005. Greenhouse gas production:A comparison between aerobic and anaerobic wastewater treatment technology[J]. Water Research, 39(17): 4197-4203. DOI:10.1016/j.watres.2005.07.042 |
Chan Y J, Chong M F, Law C L, et al. 2009. A review on anaerobic-aerobic treatment of industrial and municipal wastewater[J]. Chemical Engineering Journal, 155(1/2): 1-18. |
Chang Y H D, Grodzinsky A J, Wang D I C. 1995. Augmentation of mass transfer through electrical means for hydrogel-entrapped Escherichia coli cultivation[J]. Biotechnology and Bioengineering, 48(2): 149-157. |
De Vrieze J, Gildemyn S, Arends J B, et al. 2014. Biomass retention on electrodes rather than electrical current enhances stability in anaerobic digestion[J]. Water Res, 54: 211-221. DOI:10.1016/j.watres.2014.01.044 |
Ding C M, Lv M l, Zhu Y, et al. 2015. Wettability-regulated extracellular electron transfer from the living organism of Shewanella loihica PV-4[J]. Angewandte Chemie International Edition, 54(5): 1446-1451. DOI:10.1002/anie.201409163 |
Du Y, Feng Y J, Qu Y P, et al. 2014. Electricity generation and pollutant degradation using a novel biocathode coupled photoelectrochemical cell[J]. Environmental Science & Technology, 48(13): 7634-7641. |
Du Y, Zhou X T, Qu Y P, et al. 2017. Enhanced electricity generation and pollutant degradation by hybrid photoelectrochemical and microbial fuel cells[J]. Energy Technology, 5(3): 402-405. DOI:10.1002/ente.201600339 |
Gangadharan P, Nambi I M, Senthilnathan J, et al. 2016. Heterocyclic aminopyrazine-reduced graphene oxide coated carbon cloth electrode as an active bio-electrocatalyst for extracellular electron transfer in microbial fuel cells[J]. RSC Advances, 6(73): 68827-68834. DOI:10.1039/C6RA13911F |
Ghodbane S, Lahbib A, Sakly M, et al. 2013. Bioeffects of Static Magnetic Fields:Oxidative Stress, Genotoxic Effects, and Cancer Studies[J]. Biomed Research International, 2013: 602987. |
Guiot S R, Cimpoia R, Kuhn R, et al. 2008. Electrolytic methanogenic-methanotrophic coupling for tetrachloroethylene bioremediation:Proof of concept[J]. Environmental Science & Technology, 42(8): 3011-3017. |
Guo K, Freguia S, Dennis P G, et al. 2013. Effects of surface charge and hydrophobicity on anodic biofilm formation, community composition, and current generation in bioelectrochemical systems[J]. Environmental Science & Technology, 47(13): 7563-7570. |
He W H, Dong Y, Li C, et al. 2019. Field tests of cubic-meter scale microbial electrochemical system in a municipal wastewater treatment plant[J]. Water Research, 155: 372-380. DOI:10.1016/j.watres.2019.01.062 |
Jiang S H, Park S, Yoon Y, et al. 2013. Methanogenesis facilitated by geobiochemical iron cycle in a novel syntrophic methanogenic microbial community[J]. Environmental Science & Technology, 47(17): 10078-10084. |
Kabutey F T, Zhao Q, Wei L, et al. 2019. An overview of plant microbial fuel cells (PMFCs):Configurations and applications[J]. Renewable & Sustainable Energy Reviews, 110: 402-414. |
Kato S, Hashimoto K, Watanabe K. 2012. Methanogenesis facilitated by electric syntrophy via (semi)conductive iron-oxide minerals[J]. Environmental Microbiology, 14(7): 1646-1654. DOI:10.1111/j.1462-2920.2011.02611.x |
Koch C, Kuchenbuch A, Kretzschmar J, et al. 2015. Coupling electric energy and biogas production in anaerobic digesters-impacts on the microbiome[J]. RSC Advances, 5(40): 31329-31340. DOI:10.1039/C5RA03496E |
Kracke F, Vassilev I, Krömer J O. 2015. Microbial electron transport and energy conservation-the foundation for optimizing bioelectrochemical systems[J]. Frontiers in Microbiology, 6: 575. |
Leitao R C, van Haandel A C, Zeeman G, et al. 2006. The effects of operational and environmental variations on anaerobic wastewater treatment systems:A review[J]. Bioresource Technology, 97(9): 1105-1118. DOI:10.1016/j.biortech.2004.12.007 |
Li D B, Cheng Y Y, Li L L, et al. 2014. Light-driven microbial dissimilatory electron transfer to hematite[J]. Phys Chem Chem Phys, 16(42): 23003-23011. DOI:10.1039/C4CP04065A |
Li Y, Chen Z, Gu N. 2012. In vitro biological effects of magnetic nanoparticles[J]. Chinese Science Bulletin, 57(31): 3972-3978. DOI:10.1007/s11434-012-5295-8 |
Li Y, Liu J, Chen X, et al. 2020. Enhanced electricity generation and extracellular electron transfer by polydopamine-reduced graphene oxide (PDA-rGO) modification for high-performance anode in microbial fuel cell[J]. Chemical Engineering Journal, 387: 123408. DOI:10.1016/j.cej.2019.123408 |
Lin C, Wu P, Liu Y, et al. 2019. Enhanced biogas production and biodegradation of phenanthrene in wastewater sludge treated anaerobic digestion reactors fitted with a bioelectrode system[J]. Chemical Engineering Journal, 365: 1-9. DOI:10.1016/j.cej.2019.02.027 |
Lin S H, Chen M L. 1997. Treatment of textile wastewater by chemical methods for reuse[J]. Water Research, 31(4): 868-876. DOI:10.1016/S0043-1354(96)00318-1 |
Liu F, Rotaru A E, Shrestha P M, et al. 2015a. Magnetite compensates for the lack of a pilin-associated c-type cytochrome in extracellular electron exchange[J]. Environmental Microbiology, 17(3): 648-655. DOI:10.1111/1462-2920.12485 |
Liu F H, Rotaru A E, Shrestha P M, et al. 2012. Promoting direct interspecies electron transfer with activated carbon[J]. Energy & Environmental Science, 5(10): 8982-8989. |
Liu X W, Huang Y X, Sun X F, et al. 2014. Conductive carbon nanotube hydrogel as a bioanode for enhanced microbial electrocatalysis[J]. ACS Applied Materials & Interfaces, 6(11): 8158-8164. |
Liu X, Wu W, Gu Z. 2015b. Poly (3, 4-ethylenedioxythiophene) promotes direct electron transfer at the interface between Shewanella loihica and the anode in a microbial fuel cell[J]. Journal of Power Sources, 277: 110-115. DOI:10.1016/j.jpowsour.2014.11.129 |
Logan B E, Rossi R, Ragab A A, et al. 2019. Electroactive microorganisms in bioelectrochemical systems[J]. Nature Reviews Microbiology, 17(5): 307-319. DOI:10.1038/s41579-019-0173-x |
Lu A, Li Y, Jin S, et al. 2012. Growth of non-phototrophic microorganisms using solar energy through mineral photocatalysis[J]. Nat Commun, 3: 768. DOI:10.1038/ncomms1768 |
Lu J S, Chang J S, Lee D J. 2020. Adding carbon-based materials on anaerobic digestion performance:A mini-review[J]. Bioresource Technology, 300: 122696. DOI:10.1016/j.biortech.2019.122696 |
Malvankar N S, Vargas M, Nevin K P, et al. 2011. Tunable metallic-like conductivity in microbial nanowire networks[J]. Nat Nanotechnol, 6(9): 573-579. DOI:10.1038/nnano.2011.119 |
Moscoviz R, Toledo-Alarcón J, Trably E, et al. 2016. Electro-fermentation:How to drive fermentation using electrochemical systems[J]. Trends in Biotechnology, 34(11): 856-865. DOI:10.1016/j.tibtech.2016.04.009 |
Mostafa A, Im S, Lee M K, et al. 2020. Enhanced anaerobic digestion of phenol via electrical energy input[J]. Chemical Engineering Journal, 389: 124501. DOI:10.1016/j.cej.2020.124501 |
Niu C, Geng J, Ren H, et al. 2013. The strengthening effect of a static magnetic field on activated sludge activity at low temperature[J]. Bioresource Technology, 150: 156-162. DOI:10.1016/j.biortech.2013.08.139 |
牛川, 凌虹, 王连军. 2018. 快速降温下磁场强化SBR处理低温废水研究[J]. 安徽农学通报, 24(08): 75-78. |
Peng Y Z, Zhu G B. 2006. Biological nitrogen removal with nitrification and denitrification via nitrite pathway[J]. Applied Microbiology and Biotechnology, 73(1): 15-26. |
Qiu Y, Yu Y, Li H, et al. 2020. Enhancing carbon and nitrogen removals by a novel tubular bio-electrochemical system with functional biocathode coupling with oxygen-producing submerged plants[J]. Chemical Engineering Journal, 402: 125400. DOI:10.1016/j.cej.2020.125400 |
Reguera G, McCarthy K D, Mehta T, et al. 2005. Extracellular electron transfer via microbial nanowires[J]. Nature, 435(7045): 1098-1101. DOI:10.1038/nature03661 |
Ren G, Sun Y, Ding Y, et al. 2018. Enhancing extracellular electron transfer between Pseudomonas aeruginosa PAO1 and light driven semiconducting birnessite[J]. Bioelectrochemistry, 123: 233-240. DOI:10.1016/j.bioelechem.2018.06.003 |
Rotaru A E, Shrestha P M, Liu F, et al. 2014. Direct interspecies electron transfer between Geobacter metallireducens and Methanosarcina barkeri[J]. Applied and Environmental Microbiology, 80(15): 4599-4605. DOI:10.1128/AEM.00895-14 |
Sakimoto K K, Wong A B, Yang P. 2016. Self-photosensitization of nonphotosynthetic bacteria for solar-to-chemical production[J]. Science, 351(6268): 74. DOI:10.1126/science.aad3317 |
Sharma S C D, Sun Q, Li J, et al. 2016. Decolorization of azo dye methyl red by suspended and co-immobilized bacterial cells with mediators anthraquinone-2, 6-disulfonate and Fe3O4 nanoparticles[J]. International Biodeterioration & Biodegradation, 112: 88-97. |
Song R B, Zhou S, Guo D, et al. 2020. Core/satellite structured Fe3O4/Au nanocomposites incorporated with three-dimensional macroporous graphene foam as a high-performance anode for microbial fuel cells[J]. Acs Sustainable Chemistry & Engineering, 8(2): 1311-1318. |
Sonune A, Ghate R. 2004. Developments in wastewater treatment methods[J]. Desalination, 167(1/3): 55-63. |
Sun M, Zhang F, Tong Z H, et al. 2010. A gold-sputtered carbon paper as an anode for improved electricity generation from a microbial fuel cell inoculated with Shewanella oneidensis MR-1[J]. Biosensors and Bioelectronics, 26(2): 338-343. DOI:10.1016/j.bios.2010.08.010 |
Sun M C, Zhang Z H, Lv M, et al. 2020. Enhancing anaerobic digestion performance of synthetic brewery wastewater with direct voltage[J]. Bioresource Technology, 315: 123764. DOI:10.1016/j.biortech.2020.123764 |
孙秀兰, 刘伟伟, 张银志, 等. 2011. 趋磁细菌研究进展[J]. 中国微生态学杂志, 23(06): 570-573. |
Tartakovsky B, Mehta P, Bourque J S, et al. 2011. Electrolysis-enhanced anaerobic digestion of wastewater[J]. Bioresour Technol, 102(10): 5685-5691. DOI:10.1016/j.biortech.2011.02.097 |
Ugwu S N, Biscoff R K, Enweremadu C C. 2020. A meta-analysis of iron-based additives on enhancements of biogas yields during anaerobic digestion of organic wastes[J]. Journal of Cleaner Production, 269: 122449. DOI:10.1016/j.jclepro.2020.122449 |
汪涛, 张典典, 王志强, 等. 2017. 磁场强化技术在污水处理中的研究进展[J]. 现代化工, 37(07): 29-31+33. |
王洪朔, 叶盛英, 宋贤良, 等. 2007. 从微观层面研究两极交变磁场对微生物的影响[J]. 农业工程学报, 08: 253-256. |
许喜林, 郭祀远, 李琳. 2006. 动态磁场对微生物的作用[J]. 华南理工大学学报(自然科学版), 12: 47-50. |
Yang C, Aslan H, Zhang P, et al. 2020. Carbon dots-fed Shewanella oneidensis MR-1 for bioelectricity enhancement[J]. Nature Communications, 11(1): 1379. DOI:10.1038/s41467-020-14866-0 |
Yazdi A A, D'Angelo L, Omer N, et al. 2016. Carbon nanotube modification of microbial fuel cell electrodes[J]. Biosensors and Bioelectronics, 85: 536-552. DOI:10.1016/j.bios.2016.05.033 |
Yong Y C, Cai Z, Yu Y Y, et al. 2013. Increase of riboflavin biosynthesis underlies enhancement of extracellular electron transfer of Shewanella in alkaline microbial fuel cells[J]. Bioresour Technol, 130: 763-768. DOI:10.1016/j.biortech.2012.11.145 |
Zhang G Y, Shi Y H, Zhao Z S, et al. 2020. Enhanced two-phase anaerobic digestion of waste-activated sludge by combining magnetite and zero-valent iron[J]. Bioresource Technology, 306: 123122. DOI:10.1016/j.biortech.2020.123122 |
Zhang J S, Zhao W Q, Zhang H W, et al. 2018a. Recent achievements in enhancing anaerobic digestion with carbon-based functional materials[J]. Bioresource Technology, 266: 555-567. DOI:10.1016/j.biortech.2018.07.076 |
Zhang P, Liu J, Qu Y, et al. 2018b. Nanomaterials for facilitating microbial extracellular electron transfer:Recent progress and challenges[J]. Bioelectrochemistry, 123: 190-200. DOI:10.1016/j.bioelechem.2018.05.005 |
Zhang P, Liu J, Qu Y, et al. 2017. Enhanced performance of microbial fuel cell with a bacteria/multi-walled carbon nanotube hybrid biofilm[J]. Journal of Power Sources, 361: 318-325. DOI:10.1016/j.jpowsour.2017.06.069 |
Zhang P, Zheng S L, Liu J, et al. 2018c. Surface properties of activated sludge-derived biochar determine the facilitating effects on Geobacter co-cultures[J]. Water Research, 142: 441-451. DOI:10.1016/j.watres.2018.05.058 |
Zhang Y B, Jing Y W, Zhang J X, et al. 2011. Performance of a ZVI-UASB reactor for azo dye wastewater treatment[J]. Journal of Chemical Technology and Biotechnology, 86(2): 199-204. DOI:10.1002/jctb.2485 |
Zhang Z H, Gao P, Cheng J Q, et al. 2018d. Enhancing anaerobic digestion and methane production of tetracycline wastewater in EGSB reactor with GAC/NZVI mediator[J]. Water Research, 136: 54-63. DOI:10.1016/j.watres.2018.02.025 |
Zhao H Q, Liu Q, Wang Y X, et al. 2018. Biochar enhanced biological nitrobenzene reduction with a mixed culture in anaerobic systems:Short-term and long-term assessments[J]. Chemical Engineering Journal, 351: 912-921. DOI:10.1016/j.cej.2018.06.154 |
Zhen G Y, Lu X Q, Li Y Y, et al. 2015. Influence of zero valent scrap iron (ZVSI) supply on methane production from waste activated sludge[J]. Chemical Engineering Journal, 263: 461-470. DOI:10.1016/j.cej.2014.11.003 |
钟方丽, 曹宏斌, 李鑫钢. 2001. 电场对细胞影响的研究进展[J]. 微生物学通报, 04: 77-81. |
Zhou H, Liu B, Wang Q, et al. 2017. Pulse electromagnetic fields enhance extracellular electron transfer in magnetic bioelectrochemical systems[J]. Biotechnology for Biofuels, 10: 238. DOI:10.1186/s13068-017-0929-3 |
Zhou H, Mei X, Liu B, et al. 2019. Magnet anode enhances extracellular electron transfer and enrichment of exoelectrogenic bacteria in bioelectrochemical systems[J]. Biotechnology for Biofuels, 12: 133. DOI:10.1186/s13068-019-1477-9 |
Zhou S, Tang J, Yuan Y, et al. 2018. TiO2 nanoparticle-induced nanowire formation facilitates extracellular electron transfer[J]. Environmental Science & Technology Letters, 5(9): 564-570. |
周生学. 2009.直流电刺激对细菌生长动态过程的作用研究[D].北京: 首都师范大学
|
Zhu G, Yang Y, Liu J, et al. 2017. Enhanced photocurrent production by the synergy of hematite nanowire-arrayed photoanode and bioengineered Shewanella oneidensis MR-1[J]. Biosens Bioelectron, 94: 227-234. DOI:10.1016/j.bios.2017.03.006 |
朱乐辉, 朱衷榜. 1997. 活性污泥法的现状及发展[J]. 环境与开发, 1: 11-14. |
 2020, Vol. 40
2020, Vol. 40


