随着我国城市化速度加快, 氮、磷等污染物通过生活污水、大气沉降、降雨径流等多种方式进入河道, 同时河道底泥中氮、磷的二次释放、河道内生物代谢等原因导致河道中的有机物浓度增高, 氮、磷浓度增大, 藻类大量繁殖, 产生过量的厌氧气体如H2S、NH3等, 影响了水生植物的生长, 导致河道生态系统持续下降, 重污染河道数量日益增多(陈玲等, 2012;王旭等, 2016;Ma et al., 2018).尽管我国已开展大量河道治理和水体修复工程, 水质恶化的趋势初步得到有效遏制, 但重污染河道的水环境问题依然对居民的生产生活产生严重影响(景创新等, 2017;Ma et al., 2020).在重污染河道水体中氮、磷主要以NH3-N和PO43--P的形式存在(Mo et al., 2016;Ma et al., 2018;Yin et al., 2019).因此, 如何去除水体中的NH3-N和PO43--P是必须要回答的重污染河道水体净化的关键问题.
生态浮床主要通过水生植物直接吸收(Sang et al., 2017)、微生物的吸收和转化(Sun et al., 2019)、基质的吸附(Li et al., 2018)等作用来实现水体中氮、磷等污染物的去除.因该方法具有操作简单、运行费用低、景观美化、不产生二次污染且效果显著等优点, 目前已成为水体中氮、磷污染物控制的重要方法之一(Samal et al., 2019).但生态浮床仍存在生物量有限及对氮、磷等营养物去除深度不足等缺点.为提高生态浮床对氮、磷等污染物的去除效果, 多数研究人员从浮床水生植物优化筛选(Lu et al., 2018;Sun et al., 2019)、高效吸附浮床基质选择(Cao et al., 2014;Cao et al., 2016;Lin et al., 2019)及与不同人工生物膜填料、曝气设施等组成组合型生态浮床(Shi et al., 2018;Song et al., 2020)等方面来优化改良生态浮床.而在重污染河道中, 水生植物会受到H2S、NH3的毒害而死亡(Anthonisen et al., 1976;金相灿等, 2008;陈国元等, 2014), 从而影响生态浮床的氮、磷去除效果;另外, 在低温季节生态浮床的氮、磷去除效果较弱(Duan et al., 2016);同时, 大面积的生态浮床容易造成水体中溶解氧(Dissolved Oxygen, DO)不足(唐丹等, 2011).综上可知, 非常有必要探索提高生态浮床去除重污染水体氮、磷效果的新技术.
因此, 本试验以模拟的重污染河道水为研究对象, 通过在以生物质炭为基质的生态浮床中添加以镁铝合金棒为阳极、石墨棒为阴极的电解反应系统作为氮、磷去除的强化措施, 并在该浮床底部添加曝气设备, 构建曝气-电解生态浮床(Aeration-Electrolysis Ecological Floating Bed, A-EEFB), 考察电流密度、曝气量和处理时间对A-EEFB处理含氮、磷重污染水的净化效果, 通过比较氮、磷去除效率、浮床植物生理状况和基质微生物群落结构的变化, 探究A-EEFB对重污染河道水中氮、磷的净化效率和机理, 实现氮、磷去除的原位强化调控, 强化水体自净能力, 以期为重污染河道水体中氮、磷的削减提供新的理论依据.
2 材料与方法(Materials and methods) 2.1 试验装置试验装置共设3组, 分别为曝气-电解强化浮床(A-EEFB)、电解-生态浮床(Electrolysis Ecological Floating Bed, EEFB)、生态浮床(Ecological Floating Bed, EFB), 其中, A-EEFB、EEFB和EFB试验装置示意图如图 1所示.在相同试验条件下, 对比分析A-EEFB、EEFB和EFB对水体中氮、磷营养盐的净化效果.分析比较在EFB系统中添加电解和曝气单元后, 水环境、浮床植物生理状况和基质微生物群落结构的变化, 探究曝气和电解的联合作用对传统生态浮床脱氮除磷能力的强化效果.试验装置由有机玻璃制成, 大小为50 cm×40 cm×50 cm, 容积为100 L, 有效水深为30 cm.每个装置均放一个浮床.每个浮床中间的种植框里放置一个种植袋, 种植袋用1.2 kg生物质炭(竹炭, 粒径1~3 mm)填料填充, 使用前用1 mol·L-1盐酸浸泡2 h, 之后用清水冲洗至中性.每个浮床内种植种苗大小、长势相近的挺水植物黄菖蒲(Iris pseudacorus)4株.在A-EEFB和EEFB的填料中分别插入一根镁铝合金棒(广东鸿褀金属材料有限公司)作阳极, 一根石墨棒(浙江乐清石墨碳棒厂)作阴极, 电极间距为12 cm.电极直径均为15 mm, 长度均为250 mm, 使用前采用5%的盐酸活化15 min, 用清水冲洗至中性后于废水中浸泡一段时间使其吸附饱和.利用直流稳压电源(安泰信APS3005D)连续供给直流电, 电源输出电压为0~60 V, 输出电流为0~2 A, 可通过调节电压来改变电解反应电流密度.另在A-EEFB底部放置2个曝气头(气柄, 直径4 cm), 利用小型曝气机(SOBO/松宝-SB-988)连续进行曝气.模拟河道重污染水通过蠕动泵由进水槽中注入试验装置, 并从另一侧出水口溢出, 水力停留时间(Hydraulic Retention Time, HRT)为3 d.
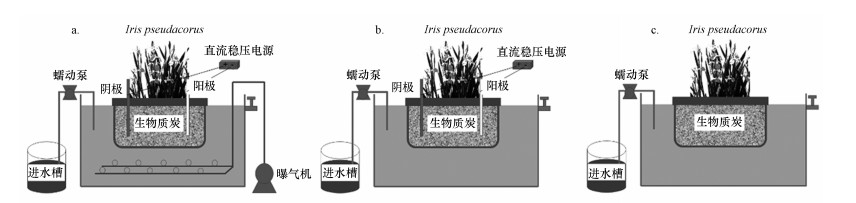 |
| 图 1 曝气-电解生态浮床(A-EEFB)(a)、电解生态浮床(EEFB)(b)和对照组生态浮床(EFB)(c)试验装置示意图 Fig. 1 Schematic diagram of aeration enhanced electrolysis-ecological floating bed (A-EEFB)(a), electrolysis-ecological floating bed (EEFB)(b) and the ecological floating bed (EFB)(c) test device |
通过对苏南城区河道水体中氮、磷浓度调研发现, 重污染河道水体中氮、磷的主要成分为NH3-N和PO43--P.根据调查的氮、磷浓度, 将NH3-N浓度设定为10 mg·L-1, 使用氯化铵(分析纯)配制, PO43--P浓度设定为0.8 mg·L-1, 使用磷酸二氢钾(分析纯)配制.化学需氧量(COD)设定为50 mg·L-1, 使用无水乙酸钠配制, 初始pH为6.5~7.5, DO为(8.17±0.17) mg·L-1.
2.3 运行条件试验于20~26 ℃室温下进行.通过设定不同的电压来调节电流密度, 通过调节曝气机出气管阀门开启的程度来改变曝气量, 具体试验条件见表 1.
| 表 1 试验水质和运行参数 Table 1 Setting of reaction conditions during the test |
本实验水体中NH3-N、NO2--N、NO3--N、TN、PO43--P等水质指标均采用《水和废水监测分析方法(第四版)(增补版)》(2002)中规定方法进行测定.
2.5 基质中细菌群落结构分析试验结束后, 分别取A-EEFB、EEFB和EFB基质填充袋内生物质炭250 g于样品管中, 加入适量PBS缓冲液(包括9.3 g·L-1 K2HPO4和1.8 g·L-1 KH2PO4), 在50 kHz条件下超声振荡30 min, 使表面菌体能够悬浮于PBS缓冲液中, 取适量悬浮液体在12000 r·min-1条件下离心2 min, 留取的沉淀按照OMEGA试剂盒的E.Z.N.ATM Mag-Bind Soil DNA Kit试剂盒使用说明书要求进行DNA提取.DNA提取之后将样品送至生工生物公司, 进行细菌群落结构组成分析.
2.6 大型水生植物生长指标和生理生化指标的测定测试I. pseudacorus的根长(cm)、鲜重(g)、株高(cm)、根长(cm)、分枝数等指标, 之后计算绝对生长速率(Absolute Growth Rate, AGR)(mg·d-1).指标测定结束后, 取整株I. pseudacorus叶片剪碎于冷冻过的研钵中, 用液氮研磨成粉, 然后保存于-80 ℃冰箱中, 测定时取出冰浴解冻.采用丙二醛(Malondialdehyde, MDA)试剂盒(南京建成, A003-1)测定叶片中MDA含量;采用总超氧化物歧化酶(Superoxide Dismutase, SOD)试剂盒(南京建成, A002-1)测定叶片中SOD酶活;采用总蛋白试剂盒(南京建成, A005-2)考马斯亮蓝法测定其蛋白质含量;采用乙醇浸提法测试叶片叶绿素含量, 称取0.5 g左右I. pseudacorus叶片, 剪碎后放置于37 ℃恒温培养箱中, 利用95%的乙醇避光浸提约24 h, 待到叶片完全变白后, 取浸提液分别在665 nm和649 nm波长下比色, 根据吸光度(Optical Density, OD)值计算得到叶绿素a、b含量(式(1)和(2)), 根据样品鲜重进一步求出叶片组织中叶绿素含量(式(3)).
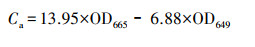
|
(1) |
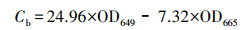
|
(2) |
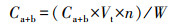
|
(3) |
式中, Ca为叶绿素a的含量(mg·g-1);Cb为叶绿素b的含量(mg·g-1);Vt为提取液体积(mL);n为稀释倍数;W为样品鲜重(g).
2.7 数据处理方法本文中实验数据以均数±标准差(means±SD)表示, 多组样本之间比较采用单因素方差分析, 再进行Tukey检验, p < 0.05为显著性差异.采用OriginPro 2016软件进行做图.
3 结果与讨论(Results and discussion) 3.1 A-EEFB去除重污染水体氮磷潜力从不同试验条件下A-EEFB、EEFB和EFB对模拟重污染水体中NH3-N去除效果分析可知, 曝气和电解的联合作用有利于水体中NH3-N的转化和去除, 不同处理组之间对于NH3-N的净化效率具有显著差异(p < 0.0001), 将曝气、电解反应应用于EFB后, 可大幅提高生态浮床去除水体中NH3-N效率.在A-EEFB组中, 在条件1和条件2下, 由于添加了曝气系统(曝气量4 L·min-1), NH3-N去除率大幅提升, 其去除率均值分别达到41.57%和43.84%, 而在条件3和条件4中将曝气量提高1倍后(曝气量8 L·min-1), NH3-N去除率分别提高至85.36%和90.47%.EEFB浮床对NH3-N的去除效率分别为20.24%、22.76%、26.26%和28.8%, 相比较其对照组的传统浮床EFB各阶段对NH3-N的去除率分别为10.62%、10.91%、11.48%和16.1%.可见曝气和电解的联合作用有利于提升态浮床对NH3-N的强化去除, 曝气可以增加试验水体中DO的含量, 导致好氧菌大量繁殖, 增强了浮床硝化效果, 有效提高了浮床净化NH3-N的能力(图 2 a).
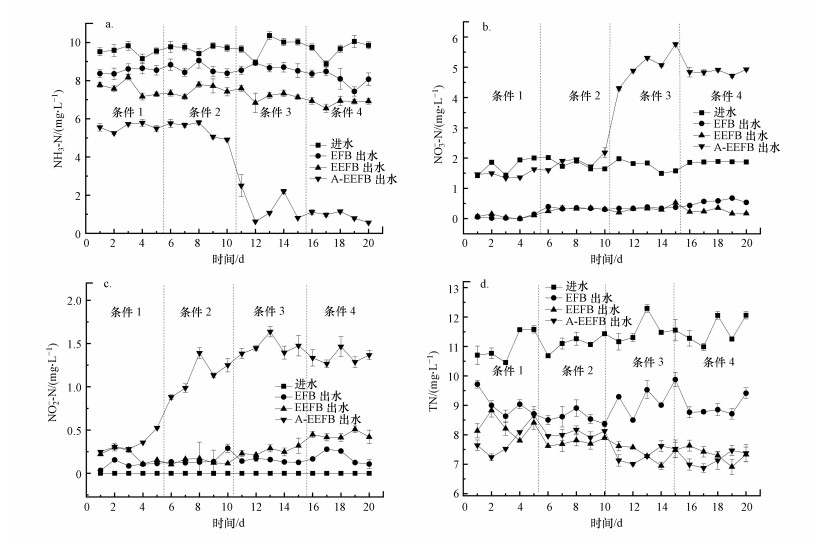 |
| 图 2 模拟净化重污染水体试验出水中NH3-N(a)、NO3--N(b)、NO2--N(c)和TN(d)浓度的变化 Fig. 2 The main water quality variables of NH3-N (a), NO3--N (b), NO2--N (c) and TN (d) concentration in the A-EEFB, EEFB and EFB during the purification of the simulated eutrophic water |
在EEFB组中, 选用镁铝合金棒作阳极, 通电时阳极溶出Mg2+和少量Al3+, NH3-N的去除可能是由于NH3-N与PO43--P和Mg2+结合生成了磷酸铵镁沉淀, 在EEFB的生物质炭基质中, 发现大量白色块状的沉淀, 推测其成分可能为磷酸铵镁或和磷酸镁的混合物;另一方面, NH3-N被经过Mg2+改性的生物质炭吸附进行去除, 生物质炭Zeta电位会随着体系pH升高而变得更负, 导致生物质炭表面官能团—COOH和—OH离解, 表面负电荷数量增加, 其吸附NH3-N的能力增强(袁金华等, 2011).在本实验中, 电解过程引起EEFB组中试验水体pH升高进而增加了填料表面负电荷数量, 强化了其吸附NH3-N的能力.此外, 实验水体的pH值变化对于NH3-N也是一个较为重要的影响因素, 在EFB组中, 实验水体的pH始终处于6.8~8.0之间, 理论上推测不存在氨挥发现象.由于整体HRT较短且电流密度相对较小, 电解作用除去NH3-N的效果并不明显, EEFB组中NH3-N各阶段去除率分别较EFB组提高了9.62%、11.85%、14.48%和12.7%.
在试验中后期, EFB、EEFB和A-EEFB浮床的水体中均出现NO2--N、NO3--N浓度逐步升高的情况, 主要是由于在浮床运行过程中生物质炭表面生物膜不断形成, 微生物的硝化作用不断加强, 导致出水中NO3--N和NO2--N浓度升高(图 2b和2c).同时, 从第10 d起, 相比EEFB和EFB组, A-EEFB在曝气量为8 L·min-1的运行条件下, 出水中NH3-N浓度降低至1 mg·L-1以下, 但NO3--N平均浓度达到4.96 mg·L-1, 这主要是由于在曝气作用下, 硝化螺旋菌属(Nitrospira)和亚硝酸菌属(Nitrosomonas)细菌含量大幅增加, 快速将NH3-N转化为NO2--N和NO3--N;另一方面, 由于水体中DO始终处于较高水平, 影响了反硝化菌生长, 反硝化进程减慢, 导致少量NO3--N积累在系统中.而EEFB组的NH3-N去除效率低于A-EEFB组, NH3-N转化为NO3--N的量较少, 同时由于EEFB组中阴极在电解过程中产生的氢气, 增强了氢自养反硝化脱氮微生物的活性(图 4), 有利于NO3--N的去除.EEFB处理后出水中NO3--N浓度低至0.33 mg·L-1.
传统浮床EFB对于水体中TN具有一定的去除能力.在本试验中, 进水TN平均浓度为11.30 mg·L-1, 而EFB和EEFB组中出水TN平均浓度分别为8.94 mg·L-1和7.68 mg·L-1, TN去除率分别为24.87%和32.04%, 无显著性差异(p>0.05).EFB对于水体中TN的去除主要依赖于浮床填料及反硝化菌的作用, 在缺氧条件下, 反硝化菌以NO2--N和NO3--N为电子受体, 将NO3--N转化为N2等含氮气体物质扩散至大气中, 达到脱氮的目的.而在EFB和EEFB中, 由于DO含量始终处于较低的水平(不足0.3 mg·L-1), 导致硝化菌和亚硝化菌数量较少, 将NH3-N转化为NO3--N的能力较弱, 因此, 反硝化菌可利用的NO3--N数量较少, 导致其TN的去除率较低.
从图 3可以看出, 生态浮床中添加电解单元后, PO43--P去除率与传统生态浮床EFB相比大幅提升.可见, 电解反应有利于提高生态浮床对水体中PO43--P的强化去除, 这主要是由于水体中磷酸盐的存在形态主要为H2PO4-和HPO42-, 极易与阳极电解出的Mg2+和Al3+进行化学反应直接形成沉淀;另外, 阳极电解出的Mg2+、Al3+会与水体中OH-结合形成Mg(OH)2和Al(OH)3絮凝剂, 将水体中的PO43--P进行絮凝沉淀去除, 从而实现强化去除PO43--P的目的(Abdel-Shafy et al., 2020).在试验进行1~5 d时, EEFB和A-EEFB组中PO43--P的去除率分别为12%和14%, 在6~15 d, 将电流密度适当调高至0.58 mA·cm-2后, 去除率分别为34%和36%, 而在第16~20 d再次将电流密度调高(0.96 mA· cm-2)后, PO43--P去除率进一步提高至40%和45%, 可见, 电流密度的提高有利于去除水体中PO43--P.另有研究表明, 生物质炭吸附了Mg2+和Al3+后, 对于PO43--P的吸附能力也会提高.EEFB和A-EEFB系统除磷能力无显著差异(p>0.05), 总体而言, 在本试验中引入曝气单元未能有效强化EEFB对于PO43--P的去除.
 |
| 图 3 模拟净化重污染水体试验各处理组出水中PO43--P浓度(a)及PO43--P去除率(b)的变化 Fig. 3 The main water quality variables of PO43--P concentration (a) and removal rate (b) in the A-EEFB, EEFB and EFB during thepurification of the simulated eutrophic water |
16S rDNA测序分析结果表明, 与EEFB组相比, 添加了曝气单元的A-EEFB浮床填料中细菌多样性和丰度均较高.由于曝气促进了水体流动, 增强传质效果, 所以在A-EEFB中的细菌代谢活动更强烈, 曝气引起的水环境因子(DO、pH、ORP和水温)变化也会对细菌群落结构演变产生较大影响.
添加了曝气系统后, 浮床填料表面细菌群落发生了较大变化.硝化螺旋菌门(Nitrospirae)在A-EEFB基质中的相对丰度明显高于EEFB和EFB的基质样本, 这也是A-EEFB中氨氮去除率较高(90%)的主要原因.其中, 不动杆菌属(Acinetobacte)数量大幅增加, 约占总数的23.68%, 而另一优势属为芽殖杆菌属(Gemmobacter), 其含量为20.58%.EFB中这两种菌属的含量分别为2.03%和1.78%, 而EEFB中分别为2.6%和3.77%.可以看出, 3个样品之间细菌在门和属水平上差异显著, 而这种差异与试验过程中不同系统内环境因子的差异密切相关, 在不同的填料微环境中, 不同的细菌种属得到了富集.
浮床填料细菌属的分类见图 4, 在EFB基质中检测到的反硝化菌属主要有生丝微菌属(Hyphomicrobium, 1.08%), 该菌属可好氧生长或利用硝酸盐进行厌氧生长, 嗜甲基菌属(Mehtylophilus)可以以NH3-N或NO3--N作为氮源.在EEFB组中检测到的第一优势群落为噬氢菌属(Hydrogenophaga), 占比38.56%, 但该菌属在A-EEFB中含量略有所下降, 为9.71%, 而在EFB中, 其含量极低, 不足0.5%, 可见, 电解明显改变了细菌群落结构组成(图 5a和5b).在EEFB组细菌群落中, 识别出具有反硝化功能的主要菌属有Hydrogenophaga、Flavobactrium、Pelomonas、Dechloromonas、Thiobacillus、Simplicispira、Zoogloea、Optitutus、Pseudomonas、Methylophilus和Thauera细菌.从上述研究结果发现, 在EFB中添加电解单元后, 可以有效提升浮床生物质炭中Hydrogenophaga(38.56%)和Dechloromonas(1.65%)细菌含量.而已有较多的研究发现这几类菌在氢自养反硝化系统内的富集(Eamrat et al., 2017;Xing et al., 2018;Sposob et al., 2018).Hydrogenophaga作为EEFB中的第一丰度优势菌属, 大多数该属下的细菌都已经被证明具有反硝化能力, 可以利用H2作为电子供体进行反硝化脱氮.氢自养反硝化过程中消耗了水体中大量的H+, 在一定程度上会导致水体pH上升, 在EEFB基质中, 各种菌群间相互协同作用加快了反硝化进程, 实现了对水体中NO3--N的高效去除.Dechloromonas属是一种较为常见的反硝化菌.陈慧萍等(2018)在经过电解强化人工湿地的基质中也检测到了Dechloromonas菌属.该菌属在浮床系统脱氮过程中发挥着重要作用, 其在EEFB中的丰度明显高于EFB组(不足0.1%), 这也说明在电解作用下, 某些反硝化脱氮细菌在EEFB组中发生了富集.
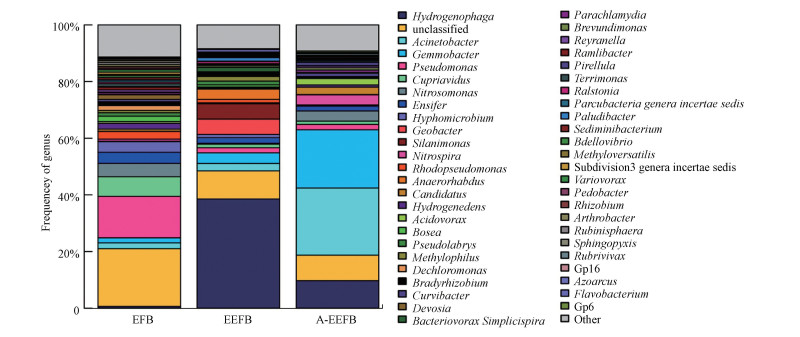 |
| 图 4 浮床填料细菌属水平组成 Fig. 4 The bacteria genus level composition of substrate of EFB, EEFB and A-EEFB |
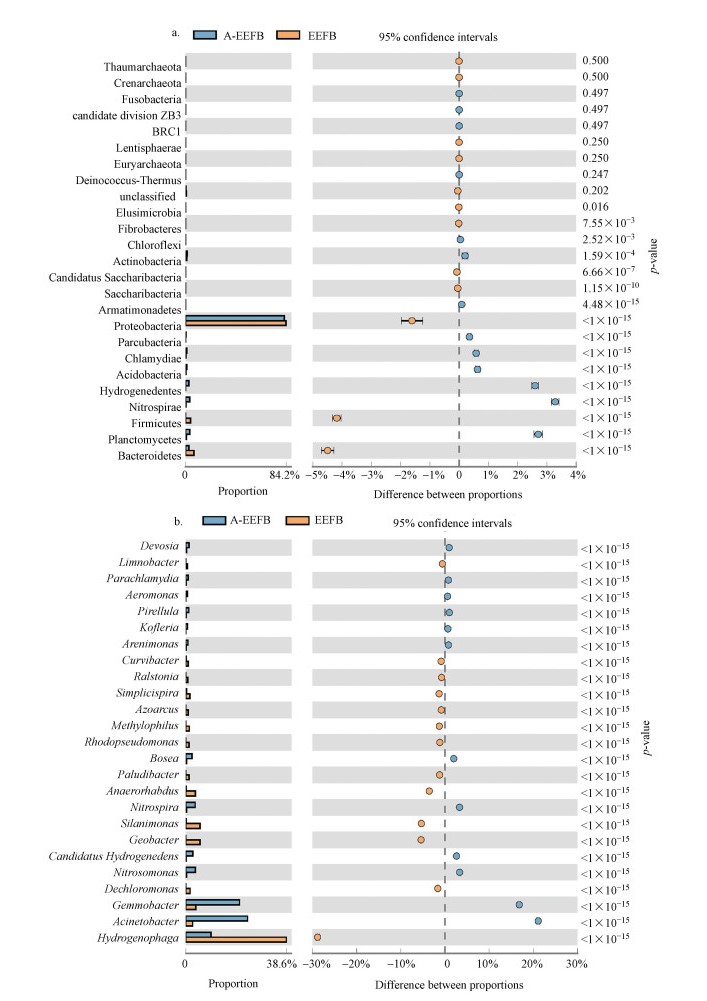 |
| 图 5 A-EEFB和EEFB生物炭基质上细菌在门(a)和属(b)水平上的丰度 (可信度95%, p < 0.05) Fig. 5 The abundance proportion of phyla (a) and genera (b) on the biochar substrate of A-EEFB and EEFB (the confidence between proportions was 95%, p < 0.05) |
在A-EEFB浮床基质细菌群落结构组成中, 不动杆菌属(Acinetobacter)的相对丰度最大(23.68%), Acinetobacter菌为革兰氏阴性杆菌, 为好氧反硝化菌, 广泛分布于水体和土壤等外界环境中(Li et al., 2019).同时, 填料表面的硝化螺旋菌属(Nitrospira)和亚硝酸菌属(Nitrosomonas)细菌含量也大幅增加, 分别达到3.63%和3.58%.Nitrospira是一类革兰氏阴性细菌, 可将NO2--N氧化成NO3--N.Nitrosomonas也是硝化细菌中的重要属, 该属下的细菌可以将NH3-N氧化成NO2--N和NO3--N, 是主要的硝化细菌属.在本试验中, 曝气使A-EEFB组浮床水体和基质中形成了好氧环境, 有利于硝化菌属生长, 促进了NH3-N快速转化为NO3--N, 使得A-EEFB对NH3-N的去除效率高达90%.在生物质炭表面检测出的具有反硝化功能的菌科包括Xanthomonadaceae、Comamonadaceae和Rhodocyclaceae(Zhang et al., 2015;Wu et al., 2016;Gao et al., 2016), 其在EFB中的含量分别为2.01%、6.6%和2.04%, 而在EEFB中, Comamonadaceae成为第一优势菌科, 其含量高达42.6%, Rhodocyclaceae含量提升至3.33%.在A-EEFB中, 受曝气影响, Xanthomonadaceae和Comamonadaceae两科细菌含量分别为1.23%、11.4%, 相对丰度较小.结合水体中DO浓度的变化可以看出, 曝气量过高时, 会抑制反硝化作用, 导致水体中NO3--N去除率较低.
3.3 曝气和电解对浮床水生植物的影响对模拟重污染水体净化试验中3组浮床水生植物生长指标的分析可以看出(表 2), 受电解影响, EEFB组中水生植物I. pseudacorus的株高和叶长均小于对照组EFB, 但无显著性差异(p>0.05).而A-EEFB组中曝气明显促进了I. pseudacorus的生长, 其鲜重((29.42±12.34) g)、株高((46.67±11.86) cm)、根长((8.20±0.08) cm)和AGR ((0.83±0.53) mg·d-1)都远比EEFB和EFB组中高.可见, A-EEFB促进了植物的生长, 曝气作用有利于削弱电解对I. pseudacorus生长的抑制作用.
| 表 2 浮床植物I. pseudacorus生长指标比较 Table 2 The comparison of growth indicators of I. pseudacorus |
试验结束后不同浮床系统中I. pseudacorus叶片中叶绿素含量大小为:A-EEFB>EFB>EEFB(表 3).这主要是由于进水中高浓度NH3-N对于I. pseudacorus产生了一定的毒害作用.研究表明, 高浓度NH3-N会对I. pseudacorus产生胁迫, 陈国元等(2014)研究发现高浓度NH3-N对I. pseudacorus的毒性较为明显.电解作用也会引起I. pseudacorus叶绿素含量下降, 从I. pseudacorus生长过程中也可以观察到, EEFB中I. pseudacorus生长整体较为缓慢, 部分叶片发黄甚至干枯.而在EEFB中对NH3-N的去除率较高, 减弱了NH3-N对于水生植物I. pseudacorus的毒害作用, 因此, A-EEFB组I. pseudacorus叶绿素含量((1.92±0.88) mg·g-1)明显高于EFB组((0.95±0.22) mg·g-1)和EEFB组((0.82±0.47) mg·g-1).可见, 曝气作用有利于缓解电解对I. pseudacorus的胁迫作用.
| 表 3 浮床植物I. pseudacorus生理生化指标的比较 Table 3 The comparison of physiological and biochemical indexes of I. pseudacorus grown in the substrate of EFB, EEFB and A-EEFB |
MDA被认为是膜脂过氧化的最终分解产物, 其含量与细胞膜系统受伤害的程度密切相关.目前, 不同浓度NH3-N对于水生植物MDA含量的影响已经有部分研究, 金相灿等(2008)研究表明, NH3-N浓度大于2 mg·L-1时, 轮叶黑藻MDA含量会显著增加, 达到8 mg·L-1时, 穗花狐尾藻MDA含量迅速增加.在A-EEFB组中MDA的含量为(2.07±0.94) nmol·mg-1, 与EEFB和EFB组相比较低, 主要是由于电解加曝气处理后水体中污染物浓度减少, 对I. pseudacorus的胁迫作用降低, 减少了膜脂过氧化对植物细胞的损害, 细胞膜结构完整性较好.SOD是水生植物体内清除活性氧自由基最关键的保护酶之一, 它可以清除过多的氧自由基并降低膜脂过氧化程度(Scandalios et al., 1993).在EEFB组中, 由于水体中NH3-N平均浓度仍然较高(7~8 mg·L-1), 加上电解作用, I. pseudacorus体内活性氧代谢平衡受到影响, 造成活性氧(Reactive Oxygen Species, ROS)产生, 而作为生物机体防御系统的重要保护酶, EEFB组中植物体内SOD活性增大可以抵御ROS对细胞膜和核酸产生的影响, 但与EFB组相比, 两者SOD活性值无显著差异(p>0.05).而在A-EEFB组中, 试验中后期水体NH3-N浓度已降低至0.5~1.0 mg·L-1, 是适合I. pseudacorus生长的浓度, 无胁迫作用(陈国元等, 2014), 这也是A-EEFB组中I. pseudacorus在中后期旺盛增长的主要原因.而在EEFB中, 除上述因素和电场作用外, 电解引起的低ORP、高pH环境也会在一定程度上影响I. pseudacorus的生长.可见, 在EEFB中添加曝气单元后, 可以有效削减水体中NH3-N, 减缓电解引起pH升高的趋势, 降低水体浊度的同时营造了好氧环境, 因此, 在EEFB中添加曝气单元有利于缓解富营养水体环境和电解对I. pseudacorus的胁迫.
4 结论(Conclusions)1) 曝气-电解生态浮床可有效强化净化重污染水体中NH3-N和PO43--P, 在曝气量为8 L·min-1, 电解的电流密度为0.87 mA·cm-2的条件下, NH3-N的去除效果明显优于传统生态浮床和电解生态浮床.
2) 生态浮床中电解单元有利于强化去除PO43--P, 通过电解反应过程中镁铝合金阳极产生的Mg2+和Al3+对PO43--P具有很好的去除作用, 而曝气和电解的联合作用并没有显著提高PO43--P的去除.
3) 对浮床填料表面细菌群落结构组成的16S rDNA分析结果可知, 电解增加了氢自养反硝化细菌数量, 提高了反硝化脱氮效率.从水生植物黄菖蒲生长和生理指标分析结果可知, 电解对黄菖蒲的生长产生了一定的不利影响, 但曝气能有效减缓电解对植物的危害, 促进黄菖蒲生长, 有利于曝气-电解生态浮床对水体中氮、磷的净化.
Abdel-Shafy H I, Shoeib M A, El-Khateeb M A, et al. 2020. Electrochemical treatment of industrial cooling tower blowdown water using magnesium-rod electrode[J]. Water Resources and Industry, 23: 100121. DOI:10.1016/j.wri.2019.100121 |
Anthonisen A C, Loehr R C, Prakasam T B S, et al. 1976. Inhibition of nitrification by ammonia and nitrous acid[J]. Journal Water Pollution Control Federation, 48: 835-852. |
Cao W, Wang Y, Sun L, et al. 2016. Removal of nitrogenous compounds from polluted river water by floating constructed wetlands using rice straw and ceramsite as substrates under low temperature conditions[J]. Ecological Engineering, 88: 77-81. DOI:10.1016/j.ecoleng.2015.12.019 |
Cao W, Zhang Y. 2014. Removal of nitrogen (N) from hypereutrophic waters by ecological floating beds (EFBs) with various substrates[J]. Ecological Engineering, 62: 148-152. |
陈国元, 甘丽云. 2014. 不同浓度NH4+对黄菖蒲抗氧化酶系统的影响[J]. 环境科技, (4): 6-9. |
陈慧萍, 路俊玲, 肖琳. 2018. 电解强化人工湿地处理城市污水处理厂尾水中微生物群落分析[J]. 中国园林, 34(6): 49-53. |
陈玲, 张晟, 顾礼明, 等. 2012. 城市滞流河道黑臭发生及控制研究[J]. 环境科学与技术, (8): 175-180. |
Duan J, Feng Y, Yu Y, et al. 2016. Differences in the treatment efficiency of a cold-resistant floating bed plant receiving two types of low-pollution wastewater[J]. Environmental Monitoring and Assessment, 188(5): 283. DOI:10.1007/s10661-016-5286-3 |
Eamrat R, Tsutsumi Y, Kamei T, et al. 2017. Optimization of hydrogenotrophic denitrification behavior using continuous and intermittent hydrogen gas supply[J]. Journal of Water and Environment Technology, 15(2): 65-75. DOI:10.2965/jwet.16-059 |
Gao Y, Xie Y W, Zhang Q, et al. 2016. Intensified nitrate and phosphorus removal in an electrolysis -integrated horizontal subsurface-flow constructed wetland[J]. Water Research, 108: 39-45. |
金相灿, 郭俊秀, 许秋瑾, 等. 2008. 不同质量浓度氨氮对轮叶黑藻和穗花狐尾藻抗氧化酶系统的影响[J]. 生态环境, 17(1): 1-5. |
景创新, 郑乾运.2017.浅析城市河道生态系统修复技术[C].2017中国环境科学学会科学与技术年会.厦门: 2589-2594
|
Li B, Lv R, Xiao Y, et al. 2019. A novel nitrite-base aerobic denitrifying bacterium Acinetobacter sp.YT03 and its transcriptome analysis[J]. Frontiers in Microbiology, 10: 2580. DOI:10.3389/fmicb.2019.02580 |
Li X, Marella T K, Tao L, et al. 2018. The application of ceramsite ecological floating bed in aquaculture:its effects on water quality, phytoplankton, bacteria and fish production[J]. Water Science and Technology, 77(11): 2742-2750. DOI:10.2166/wst.2018.187 |
Lin H, Liu J, Dong Y, et al. 2019. The effect of substrates on the removal of low-level vanadium, chromium and cadmium from polluted river water by ecological floating beds[J]. Ecotoxicology and Environmental Safety, 169: 856-862. DOI:10.1016/j.ecoenv.2018.11.102 |
Lu B, Xu Z, Li J, et al. 2018. Removal of water nutrients by different aquatic plant species:An alternative way to remediate polluted rural rivers[J]. Ecological Engineering, 110: 18-26. DOI:10.1016/j.ecoleng.2017.09.016 |
Ma G X, Peng F, Yang W S, et al. 2020. The valuation of China's environmental degradation from 2004 to 2017[J]. Environmental Science and Ecotechnology. DOI:10.1016/j.ese.2020.100016 |
Ma S N, Wang H J, Wang H Z, et al. 2018. High ammonium loading can increase alkaline phosphatase activity and promote sediment phosphorus release:A two-month mesocosm experiment[J]. Water Research, 145: 388-397. |
Mo Q, Chen N, Zhou X, et al. 2016. Ammonium and phosphate enrichment across the dry-wet transition and their ecological relevance in a subtropical reservoir, China[J]. Environmental Science:Processes & Impacts, 18(7): 882-894. |
Sang R, Zhang J K. 2017. Ecological floating bed water purification effect and the impact on the growth of large aquatic plants[J]. Chemical Engineering Design Communications, 12: 164. |
Samal K, Kar S, Trivedi S. 2019. Ecological floating bed (EFB) for decontamination of polluted water bodies:Design, mechanism and performance[J]. Journal of Environmental Management. DOI:10.1016/j.jenvman.2019.109550 |
Scandalios J G. 1993. Oxygen stress and superoxide dismutases[J]. Plant Physiology, 101(1): 7. |
Shi H, Zhou G, Liu Y, et al.2018.Chemical Oxygen Demand abatement in sewage using Micro-Aeration Enhanced Ecological Floating Bed[C]//IOP Conference Series: Earth and Environmental Science.IOP Publishing, 113(1): 012029
|
Song J, Li Q, Dzakpasu M, et al. 2020. Integrating stereo-elastic packing into ecological floating bed for enhanced denitrification in landscape water[J]. Bioresource Technology. DOI:10.1016/j.biortech.1019.122601 |
Sposob M, Cydzik-Kwiatkowska A, Bakke R, et al. 2018. Temperature-induced changes in a microbial community under autotrophic denitrification with sulfide[J]. Process Biochemistry, 69: 161-168. DOI:10.1016/j.procbio.2018.03.006 |
Sun R, Fan L. 2019. Purification of eutrophic water by five aqua-cultured plants in lake Hongfeng, Guiyang, China[J]. Wuhan University Journal of Natural Sciences, 24(1): 37-44. |
Sun S, Liu J, Zhang M, et al. 2019. Simultaneous improving nitrogen removal and decreasing greenhouse gas emission with biofilm carriers addition in ecological floating bed[J]. Bioresource Technology. DOI:10.1016/j.biortech.2019.121944 |
唐丹, 罗固源, 冉青松. 2011. 溶解氧的平衡方程[J]. 环境影响评价, 33(1): 10-13. |
Wu Y, Han R, Yang X, et al. 2016. Correlating microbial community with physicochemical indices and structures of a full-scale integrated constructed wetland system[J]. Applied Microbiology & Biotechnology, 100(15): 6917-6926. |
王旭, 王永刚, 孙长虹, 等. 2016. 城市黑臭水体形成机理与评价方法研究进展[J]. 应用生态学报, 27(4): 1331-1340. |
Xing W, Li J, Li P, et al. 2018. Effects of residual organics in municipal wastewater on hydrogenotrophic denitrifying microbial communities[J]. Journal of Environmental Sciences, 65: 262-270. DOI:10.1016/j.jes.2017.03.001 |
Yin H, Wang J, Zhang R, et al. 2019. Performance of physical and chemical methods in the co-reduction of internal phosphorus and nitrogen loading from the sediment of a black odorous river[J]. Science of the Total Environment, 663: 68-77. DOI:10.1016/j.scitotenv.2019.01.326 |
袁金华, 徐仁扣. 2011. 生物质炭的性质及其对土壤环境功能影响的研究进展[J]. 生态环境学报, 20(4): 779-785. |
Zhang F, Wu J, Dai Y, et al. 2015. Bacterial community analysis by PCR-DGGE and 454-pyrosequencing of horizontal subsurface flow constructed wetlands with front aeration[J]. Applied Microbiology & Biotechnology, 99(3): 1499-1512. |
 2020, Vol. 40
2020, Vol. 40


