2. 清华-伯克利深圳学院, 深圳环境科学与新能源技术工程实验室, 深圳 518055;
3. 清华大学深圳国际研究生院, 国家环境保护环境微生物利用与安全控制重点实验室, 深圳 518055
2. Shenzhen Environmental Science and New Energy Technology Engineering Laboratory, Tsinghua-Berkley Shenzhen Institute, Tsinghua University, Shenzhen 518055;
3. Key Laboratory of Microorganism Application and Risk Control of Shenzhen, Graduate School at Shenzhen, Tsinghua University, Shenzhen 518055
城市污水再生利用是缓解我国水资源短缺、促进城市水循环的重要措施(Sun et al., 2016).但城市污水经二级生物处理后, 仍含有来源复杂、浓度较高的各类污染物, 从而威胁到再生水的安全利用(胡洪营等, 2010;2011).近年来, 城市污水处理厂二级处理出水(以下简称“二级出水”)中不断检出各种新兴化学污染物, 如内分泌干扰物、抗生素、杀菌剂等药品和个人护理品(Pharmaceuticals and Personal Care Products, PPCPs), 其潜在风险值得关注.
生物二级处理对大部分PPCPs类污染物的去除效率较低(Suárez et al., 2009;Monteiro et al., 2010).已有研究表明, 二级出水中, PPCPs类污染物具有检出频率高、检出浓度较高等特点(Evgenido et al., 2015;Wang et al., 2015), 被认为是地表水和地下水中PPCPs类污染物的主要来源之一.进行二级出水深度处理, 去除难生物降解PPCPs类污染物, 对保障城市污水再生利用和水环境安全具有重要意义.
臭氧氧化是常用的污水深度处理氧化技术, 常用于脱色、消毒和难降解污染物去除.臭氧氧化包括臭氧分子(O3)氧化和·OH自由基氧化(徐新华等, 2003).实际二级出水中组分复杂, 臭氧对污染物的去除效率受水质条件、臭氧投加量、PPCPs结构等影响.有研究认为, 臭氧氧化过程中·OH自由基生成率较低, O3分子氧化是去除PPCPs污染物的主要过程(Gunten et al., 2003;Huber et al., 2005);也有研究认为, 二级出水含有浓度较高的溶解性有机物(DOM), O3和DOM反应可能促进·OH自由基的生成, 从而提高PPCPs去除效率(Ternes et al., 2003;Broséus et al., 2009).在二级出水中, 针对臭氧氧化对典型PPCPs类污染物的去除特性、O3分子氧化和·OH自由基氧化的贡献和机制尚不明确.
臭氧氧化去除PPCPs的同时, 会氧化二级出水中的DOM, 改变其紫外线吸收(UVA)特性(Her et al., 2003).DOM的UVA随着臭氧氧化而逐渐降低, 与PPCPs降解同步发生, 可用于指示臭氧氧化过程中PPCPs类污染物的去除效率.
基于此, 本文以掌握实际二级出水中臭氧对典型PPCPs的去除特性为目标, 考察臭氧对不同化学结构特征的PPCPs去除特性, 研究O3分子氧化和·OH自由基氧化对典型PPCPs的去除贡献, 同时考察臭氧氧化过程中二级出水的紫外吸收变化, 研究UVA去除率对典型PPCPs去除率的指示特性, 以期为再生水安全回用提供科学支持.
2 材料和方法(Materials and methods) 2.1 试验水样二级出水采自北京某城市污水处理厂, 污水厂的二级生物处理工艺为厌氧/缺氧/耗氧(Anaerobic-Anoxic-Oxic, A2O)工艺.将采集的水样迅速运至实验室, 经0.45 μm玻璃纤维膜过滤后, 储存于4 ℃冰箱备用.测得水样的基本水质指标如表 1所示.
| 表 1 某城市污水处理厂二级出水水质 Table 1 Quality of secondary effluent from a sewage treatment plant |
高效液相色谱级甲醇和乙腈购自美国J.T.Baker公司, 甲酸(色谱纯)和氨水(色谱纯)购自上海安谱科学仪器有限公司, 试验用超纯水由Milli-Q (Integral 5, Millipore, 美国)制备, 试验所用其他试剂均为分析纯.
典型PPCPs标准品三氯生、吉非罗齐购自阿拉丁试剂(上海)有限公司, 二氯酚酸钠、红霉素、苯扎贝特、坎地沙坦购自华中海威(北京)基因科技有限公司, 卡马西平购于北京百灵威科技有限公司, 布洛芬购于阿法埃莎(中国)化学有限公司, 克拉霉素购于上海麦克林生化科技有限公司, 美托洛尔购于德国Dr. Ehrenstorfer公司, 苯并三唑购于上海源叶生物科技有限公司, 罗红霉素购于中国食品药品检定研究院, 扑米酮购于上海毕得医药科技有限公司.PPCPs同位素标记物氘代布洛芬(布洛芬-D3)、氘代吉非罗齐(吉非罗齐-D4)、氘代罗红霉素(罗红霉素-D7)、氘代苯并三唑(苯并三唑-D4)、氘代三氯生(三氯生-D3)、氘代苯扎贝特(苯扎贝特-D4), 购自加拿大Toronto Research Chemicals公司.使用色谱级甲醇配制PPCPs标准物和同位素标记物, 质量浓度均为20 mg·L-1, 避光保存于-20 ℃冰箱内.
2.3 PPCPs分析方法及UV254测定方法 2.3.1 PPCPs分析方法使用Agilent Technologies 1290高效液相色谱串联Agilent Technologies 6460三重四级杆质谱(HPLC/MSMS)测定样品中PPCPs污染物浓度.使用Agilent SB-量的升高规律C18色谱柱(2.1 mm×150 mm, 2.7 μm粒径)分离样品中的PPCPs.分别使用正离子和负离子模式检测样品中相应的PPCPs.正离子模式下使用的流动相中有机相为甲醇, 无机相为含0.1%甲酸的超纯水;负离子模式下流动相中有机相为乙腈, 无机相为含0.1%氨水的超纯水.样品进样体积为20 μL.各典型PPCPs的HPLC/MSMS检测条件、臭氧二级反应速率、·OH二级反应速率如表 2所示.
| 表 2 典型PPCPs化学氧化特性和HPLC/MSMS检测条件 Table 2 Chemical oxidation characteristics of typical PPCPs and HPLC / MSMS detection conditions |
使用紫外分光光度计(Agilent 8453, 美国)测定水样在254 nm处的紫外吸光度, 狭缝宽度为1 nm;比色皿为1 cm石英比色皿.
2.4 臭氧氧化试验向二级出水中加入微量PPCPs污染物, 使水样中每种PPCP的浓度均为13 μg·L-1, 用盐酸调节至pH=7.0.将臭氧通入冰浴的纯水1 h, 制得臭氧水, 并使用快速臭氧测定仪(Palintest, 美国)测定臭氧水浓度(约为45 mg·L-1).向15 mL含PPCPs的水样中加入不同体积的超纯水和臭氧水组合, 最终使得反应体积为17.5 mL, 每种PPCPs浓度应为11.1 μg·L-1, 臭氧投加剂量为0~5.5 mg·L-1.投加臭氧后, 样品密闭避光反应24 h, 臭氧完全消耗, 分析样品中各PPCP浓度及254 nm处的紫外吸光度.在120 mmol·L-1叔丁醇条件下, 重复上述实验, 研究O3分子氧化和·OH自由基氧化效率差异.
3 结果与讨论(Results and discussion) 3.1 臭氧对PPCPs污染物的去除特性 3.1.1 臭氧投加量对PPCPs去除效率的影响各PPCP的去除率随臭氧投加量的变化如图 1所示.由图 1可知, PPCPs的去除率随臭氧投加量的增加而升高, 但不同分子结构的PPCPs去除率随臭氧投加量的升高规律显著不同.根据去除率变化规律, PPCPs可分为I、II、III类:①I类为易降解PPCPs, 包括三氯生、磺胺甲恶唑、双氯芬酸钠、吉非罗齐、卡马西平、红霉素、罗红霉素和克拉霉素;②II类为可降解PPCPs, 包括美托洛尔、阿替洛尔、苯扎贝特、坎地沙坦;③III类为难降解PPCPs, 包括苯并三唑、布洛芬、扑米酮.
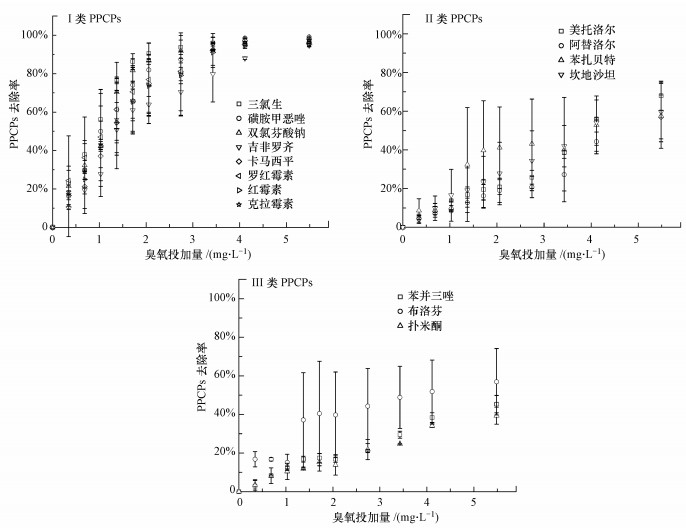 |
| 图 1 臭氧投加量对二级出水中PPCPs去除率的影响 Fig. 1 The removal efficiency of PPCPs in secondary effluent by ozonation at different ozone dosages |
当臭氧投加量由0.7 mg·L-1升高至5.5 mg·L-1时, 易降解PPCPs的去除率由19%~38%升高至95%以上;可降解PPCPs的去除率由7%~10%升高至57%~68%, 需较高的臭氧投加量才能保证60%以上的去除效率;难降解PPCPs的去除率由8%~17%升高至39%~57%, 降解效率较低, 由此可见, 臭氧氧化控制难降解PPCPs的浓度水平较难.
PPCPs去除效率的差异和PPCPs与臭氧的二级反应速率常数(kO3, PPCP)相关, 如易降解PPCPs的kO3, PPCP大于40000 L·mol-1·s-1, 而可降解PPCPs的kO3, PPCP小于2000 L·mol-1·s-1.此外, 难降解PPCPs的臭氧反应活性较低(kO3, PPCP < 250 L·mol-1·s-1), 但其去除率仍达到39%~57%, 表明臭氧氧化过程中, ·OH自由基氧化对污染物去除具有重要贡献.
3.1.2 臭氧对不同PPCPs的去除效果臭氧可优先与化合物的亲核官能团反应(Malik et al., 2020), 如酚基、胺基或双键结构.分析15种PPCPs的化学结构特征发现, 易降解PPCPs中双氯芬酸钠、卡马西平、磺胺甲恶唑含芳香胺和烷基胺结构, 红霉素、罗红霉素和克拉霉素含叔胺结构.芳香环与氮原子相连能增强胺基的亲核特性, 增加物质的臭氧氧化活性(Von et al., 2012;Jin et al., 2014).可降解PPCPs中大多不含芳香胺结构, 但含有烷基胺结构, 如美托洛尔含有叔胺, 阿替洛尔含有伯胺和叔胺, 苯扎贝特含有仲胺结构.难降解PPCPs含羰基或碳氮原子共同构成共轭平面环体系.羰基具有强大的吸电子能力, 降低了相邻原子的电子云密度, 环结构增加了质子化过程难度, 物质亲核特性相对较弱.
在城市污水处理厂常见的臭氧投加量范围内, 不同臭氧投加量(2.7和5.5 mg·L-1)下, 臭氧对不同化学结构特征的PPCPs的去除率如图 2所示.由图可知, 臭氧投加量为2.7 mg·L-1时即可去除70%以上的易降解PPCPs, 其中, 三氯生和双氯芬酸钠的去除率大于90%;但对可降解PPCPs和难降解PPCPs的去除率仅为21%~44%.当臭氧投加量升高至5.5 mg·L-1时, 臭氧氧化对易降解PPCPs的去除率大于95%, 可降解PPCPs的去除率为57%~68%, 难降解PPCPs的去除率为39%~57%.因此, 5.5 mg·L-1的臭氧投加量可有效去除二级出水中的大部分PPCPs污染物, 但对苯并三唑、布洛芬、扑米酮等难降解PPCPs污染物的去除效果较差(Jin et al., 2014).
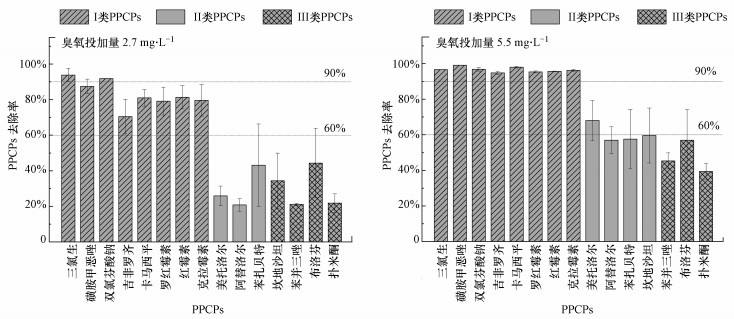 |
| 图 2 典型臭氧投加量下PPCPs的去除率比较 Fig. 2 Comparison of PPCPs removal rate under typical ozone dosage |
基于PPCPs去除率随臭氧投加量的变化曲线, 研究了典型PPCPs去除率为60%和90%时所需的臭氧投加量, 结果如表 3所示.由表可知, 去除率为60%和90%时, 易降解PPCPs所需的臭氧投加量分别为1.7和4.1 mg·L-1.去除率为60%时, 可降解PPCPs所需的臭氧投加量为5.5 mg·L-1;难降解PPCPs在5.5 mg·L-1投加量下不能达到目标去除率.要达到典型PPCPs的目标去除率, 需进一步加大臭氧投加浓度或提高·OH自由基氧化效率.
| 表 3 目标去除率下所需臭氧投加量 Table 3 Required ozone dosage at target removal rate |
利用自由基淬灭剂叔丁醇可掩蔽臭氧氧化中·OH自由基氧化作用, 其对典型PPCPs去除率的影响如图 3所示.首先, 叔丁醇促进了易降解PPCPs的去除效率, 去除率提升了9.3%~23.1%(臭氧投加量1.7 mg·L-1), 并将去除95%的易降解PPCPs所需臭氧投加量由5.5 mg·L-1降低至2.7 mg·L-1.其次, 叔丁醇对可降解PPCPs的影响较为复杂, 臭氧投加量小于1.7 mg·L-1时, 叔丁醇对可降解PPCPs的去除率影响较小, 继续加大臭氧投加量, 叔丁醇促进了可降解PPCPs的去除, 例如, 叔丁醇将阿替洛尔的去除率由57.0%提升至99.2%(臭氧投加量5.5 mg·L-1).再次, 叔丁醇抑制了难降解PPCPs的去除率, 扑米酮的去除率由39.4%降低至5.2%(臭氧投加量5.5 mg·L-1).
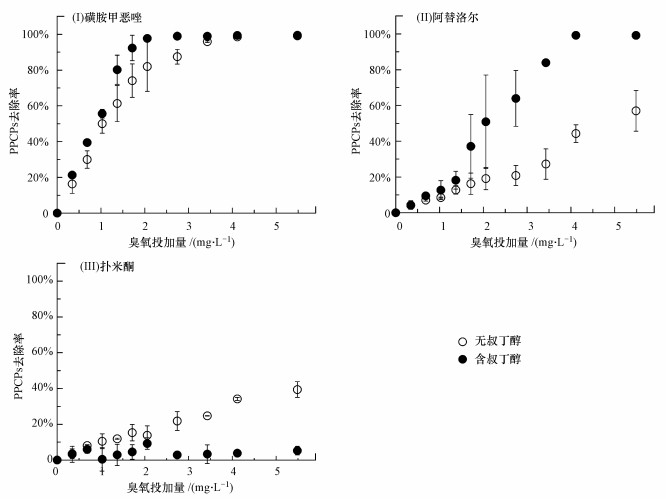 |
| 图 3 叔丁醇对典型PPCPs去除效率的影响 Fig. 3 Different effects of tert-butanol on removal efficiency of typical PPCPs |
上述结果表明, 臭氧氧化去除PPCPs过程中包括O3分子氧化和·OH自由基氧化两个过程, 且其氧化贡献程度与PPCPs的化学结构和反应速率常数相关.二级出水中, 叔丁醇淬灭了·OH自由基, 一方面显著抑制了以·OH自由基氧化为主的难降解PPCPs污染物的去除, 另一方面也抑制了·OH自由基与O3分子的后续反应, 减慢了O3分子衰减和增加了PPCPs污染物的臭氧暴露值(∫[O3]dt), 继而增加了与O3分子氧化较快的PPCPs污染物的去除效率.
3.2.2 O3分子氧化和·OH自由基氧化的去除贡献率以扑米酮为·OH自由基探针, 确定臭氧氧化处理二级出水过程中O3分子氧化和·OH自由基氧化对PPCPs的降解贡献率.PPCPs的降解动力学可由式(1)表示.kO3, 扑米酮 < 10, 臭氧投加量为5.5 mg·L-1时, 扑米酮与O3分子氧化的降解效率可忽略不计, 其降解动力学可简化为式(2).根据文献报道的PPCPs与·OH自由基反应二级速率常数k·OH, PPCP可计算·OH自由基氧化对PPCPs去除的贡献率, 计算过程见式(3), 结果如图 4所示.
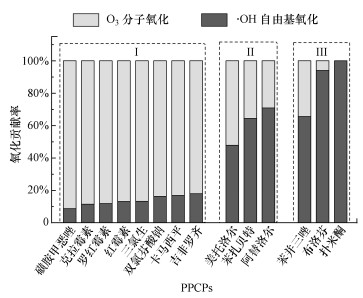 |
| 图 4 二级出水中典型PPCPs的O3分子氧化和·OH自由基氧化贡献率 (臭氧投加量5.5 mg·L-1) Fig. 4 Contributions of O3 molecular oxidation and ·OH radical oxidation of typical PPCPs in secondary effluent |

|
(1) |

|
(2) |
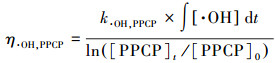
|
(3) |
式中, [PPCP]0和[PPCP]t分别为臭氧氧化前后的PPCP浓度(mol·L-1);∫[O3]dt和∫[·OH]dt分别为O3分子和·OH自由基的浓度时间积分(mol·L-1·s);kO3, PPCP和k·OH, PPCP分别为PPCPs与O3分子和·OH自由基的二级反应速率(L·mol-1·s-1);η·OH, PPCP为·OH自由基氧化对PPCP的氧化贡献率.
臭氧氧化处理二级出水过程中, O3分子氧化和·OH自由基氧化共同作用导致PPCPs污染物去除, 但其对不同降解特性PPCPs的贡献率存在显著差异.臭氧投加量为5.5 mg·L-1时, 易降解PPCPs的O3分子氧化贡献率为82%~91%, ·OH自由基氧化贡献率为9%~18%;可降解PPCPs的O3分子氧化贡献率为29%~52%, ·OH自由基氧化贡献率为48%~71%;难降解PPCPs(kO3, PPCP < 250 L·mol-1·s-1)的O3分子氧化贡献率仅为6%~34%, ·OH自由基氧化贡献率为66%~94%.
上述结果进一步表明, 臭氧氧化深度处理二级出水过程中, 易降解PPCPs污染物的去除以O3分子氧化为主, 而难降解PPCPs污染物的去除以·OH自由基氧化为主, 仅通过提升臭氧投加量难以显著提升难降解PPCPs的强化去除.基于强化O3转化生成·OH自由基控制难降解PPCPs的协同氧化技术研究还有待进一步开展.
3.3 PPCPs去除与水中UVA254变化的关联特性紫外光谱适用于分析具有不饱和结构的化合物, 不饱和基团为生色基团, 共轭结构比单个生色基团的吸收波长更长, 芳香烃和碳碳双键、羧基形成的共轭结构在210~400 nm内对紫外光有强烈的吸收光谱.臭氧氧化是去除生色团物质的重要氧化过程.水中有机物的变化与紫外吸光度UVA254有良好的相关性, 紫外吸光度UVA254的变化可用于评估臭氧化前后各个PPCPs的控制效果(Wert et al., 2009).
二级出水中溶解性有机物的紫外吸收随臭氧氧化而逐渐降低, 臭氧投加量为5.5 mg·L-1时, UVA254的去除率为51.7%.UVA254变化对PPCPs去除效率的指示特征如图 5所示.由图可知, 易降解PPCPs和部分可降解PPCPs的去除率与UVA254去除率呈分段线性相关, 而其他可降解和难降解PPCPs的去除率与UVA254去除率呈单线性相关.
 |
| 图 5 UVA254去除率与PPCPs去除率的相关性 Fig. 5 Correlation between the removal rate of UVA254 and the removal rate of PPCPs |
对易降解PPCPs的去除率与UVA254去除率进行分段线性回归分析, 发现呈现较好的分段线性关系.UVA254去除率为0~26.2%时, 易降解PPCPs处于快速去除阶段;UVA254去除率为26.2%~51.7%时, 该类物质处于低浓度慢速去除阶段.
可降解PPCPs中阿替洛尔、美托洛尔的去除效率与UVA254去除率也呈分段线性相关, 但分段指示特征与易降解PPCPs相反.UVA254去除率为0~51.7%时, 阿替洛尔、美托洛尔先处于慢速去除阶段;随着UVA254进一步被去除, 可降解PPCPs处于快速去除阶段.部分可降解PPCPs和难降解PPCPs的去除效率不变, 呈单线性相关.
UVA254是由水中复杂的生色团决定的, 其与O3分子和·OH自由基的反应速率各不相同.UVA254去除效率与PPCPs去除效率密切相关, 具有指示臭氧对PPCPs去除效率的应用价值.该替代指标具有如下特点:①对大部分PPCPs的指示效果呈多段特征, 这与不同臭氧投加量条件下O3分子氧化和·OH自由基氧化特性相关(Broséus et al., 2009; Benitez et al., 2009);②多段线性指示特征也与臭氧氧化过程中溶解性有机物中存在不同反应活性官能团有关, 如活性生色团和惰性生色团(Abdelmelek et al., 2010; Nanaboina et al., 2010).基于溶解性有机物多活性官能团的非线性指示指标模型还有待进一步研究.在指示实际污水再生处理时, 以较难降解的PPCPs类物质如坎地沙坦和扑米酮去除率等制定技术指标, 对保障再生水水质安全具有较高的参考价值.
4 结论(Conclusions)1) 臭氧氧化对二级出水PPCPs的去除效果与其亲核官能团特征有关, 含胺基等亲核基团的PPCPs与臭氧分子的二级反应速率较快, 去除效率较高.臭氧投加量为5.5 mg·L-1时, 易降解PPCPs的去除率可达95%, 可降解PPCPs去除率为57%~68%, 难降解PPCPs去除率为39%~57%.
2) PPCPs去除率为60%和90%时, 易降解PPCPs所需的臭氧投加量分别为1.7和4.1 mg·L-1;去除率为60%时, 可降解PPCPs所需的臭氧投加量为5.5 mg·L-1.
3) 臭氧氧化过程中包含O3分子氧化和·OH自由基氧化两部分, 其中, 易降解PPCPs的O3分子氧化贡献率为82%~91%, 可降解PPCPs和难降解PPCPs以·OH自由基氧化为主, 贡献率分别为48%~71%和66%~94%.
4) 臭氧氧化可降低二级出水的紫外吸光度.波长为254 nm处的紫外吸光度去除率可指示PPCPs在二级出水中的臭氧氧化效率, 但指示规律既与O3直接氧化和·OH间接氧化作用机制相关, 也与PPCPs的O3氧化活性相关, 具体还有待进一步研究.
Abdelmelek S B, Greaves J, Ishida K P, et al. 2011. Removal of pharmaceutical and personal care products from reverse osmosis retentate using advanced oxidation processes[J]. Environmental Science & Technology, 45(8): 3665-3671. |
Benitez F J, Acero J L, Real F J, et al. 2009. Ozonation of pharmaceutical compounds:Rate constants and elimination in various water matrices[J]. Chemosphere, 77(1): 53-59. |
Benner J, Salhi E, Ternes T, et al. 2008. Ozonation of reverse osmosis concentrate:Kinetics and efficiency of beta blocker oxidation[J]. Water Research, 42(12): 3003-3012. |
Bourgin M, Beck B, Boehler M, et al. 2018. Evaluation of a full-scale wastewater treatment plant upgraded with ozonation and biological post-treatments:Abatement of micropollutants, formation of transformation products and oxidation by-products[J]. Water Research, 129: 486-498. |
Broséus R, Vincent S, Aboulfadl K, et al. 2009. Ozone oxidation of pharmaceuticals, endocrine disruptors and pesticides during drinking water treatment[J]. Water Research, 43(18): 4707-4717. |
Dodd M C, Buffle M O, Von Gunten U. 2006. Oxidation of antibacterial molecules by aqueous ozone:moiety-specific reaction kinetics and application to ozone-based wastewater treatment[J]. Environmental Science & Technology, 40(6): 1969-1977. |
Evgenidou E N, Konstantinou I K, Lambropoulou D A. 2015. Occurrence and removal of transformation products of PPCPs and illicit drugs in wastewaters:A review[J]. Science of the Total Environment, 505: 905-926. |
Gunten U V. 2003. Ozonation of drinking water:Part I.Oxidation kinetics and product formation[J]. Water Research, 37(7): 1443-1467. |
Huber M M, Canonica S, Park G Y, et al. 2003. Oxidation of pharmaceuticals during ozonation and advanced oxidation processes[J]. Environmental Science & Technology, 37(5): 1016-1024. |
Huber M M, GÖbel A, Joss A, et al. 2005. Oxidation of pharmaceuticals during ozonation of municipal wastewater effluents:a pilot study[J]. Environmental Science & Technology, 39(11): 4290-4299. |
Hübner U, Zucker I, Jekel M. 2015. Options and limitations of hydrogen peroxide addition to enhance radical formation during ozonation of secondary effluents[J]. Journal of Water Reuse and Desalination, 5(1): 8-16. |
Her N, Amy G, Mcknight D, et al. 2003. Characterization of DOM as a function of MW by fluorescence EEM and HPLC-SEC using UVA, DOC, and fluorescence detection[J]. Water Research, 37(17): 4295-4303. |
胡洪营, 吴乾元, 黄晶晶, 等. 2011. 再生水水质安全评价与保障原理[M]. 北京: 科学出版社.
|
胡洪营, 吴乾元, 黄晶晶, 等. 2010. 城市污水再生利用安全保障体系与技术需求分析[J]. 中国建设信息(水工业市场), 2010(8): 8-12. |
Jin X, Peldszus S, Sparkes D I. 2014. Modeling ozone reaction rate constants of micropollutants using quantitative structure-property relationships[J]. Ozone:Science & Engineering, 36(4): 289-302. |
Jin X, Peldszus S, Huck P M. 2012. Reaction kinetics of selected micropollutants in ozonation and advanced oxidation processes[J]. Water Research, 46(19): 6519-6530. |
Lee Y, Kovalova L, McArdell C S, et al. 2014. Prediction of micropollutant elimination during ozonation of a hospital wastewater effluent[J]. Water Research, 64: 134-148. |
Malik S N, Ghosh P C, Vaidya A N, et al. 2020. Hybrid ozonation process for industrial wastewater treatment:Principles and applications:A review[J]. Journal of Water Process Engineering, 35: 101193. |
Mathon B, Coquery M, Miege C, et al. 2017. Removal efficiencies and kinetic rate constants of xenobiotics by ozonation in tertiary treatment[J]. Water Science and Technology, 75(12): 2737-2746. |
Monteiro S C, Boxall A. 2010. Occurrence and fate of human pharmaceuticals in the environment[J]. Reviews of environmental contamination and toxicology, 202(1): 53-154. |
Nanaboina V, Korshin G V. 2010. Evolution of absorbance spectra of ozonated wastewater and its relationship with the degradation of trace-level organic species[J]. Environmental Science & Technology, 44(16): 6130-6137. |
Roberts J, Kumar A, Du J, et al. 2015. Pharmaceuticals and personal care products (PPCPs) in Australia's largest inland sewage treatment plant, and its contribution to a major Australian river during high and low flow[J]. Science of The Total Environment, 541: 1625-1637. |
Suárez Sonia, Carballa M, Omil F, et al. 2009. How are pharmaceutical and personal care products (PPCPs) removed from urban wastewaters?[J]. Cheminform, 40(19): 125-138. |
Sun Y, Chen Z, Wu G, et al. 2016. Characteristics of water quality of municipal wastewater treatment plants in China:implications for resources utilization and management[J]. Journal of Cleaner Production, 131(10): 1-9. |
Ternes T A, Stuber J, Herrmann N, et al. 2003. Ozonation:a tool for removal of pharmaceuticals, contrast media and musk fragrances from wastewater?[J]. Water Research, 37(8): 1976-1982. |
Von Sonntag C, Von Gunten U. 2012. Chemistry of Ozone in Water and Wastewater Treatment[M]. London: IWA Publishing.
|
Wang W L, Chen Z, Du Y, et al. 2020. Elimination of isothiazolinone biocides in reverse osmosis concentrate by ozonation:A two-phase kinetics and a non-linear surrogate model[J]. Journal of Hazardous Materials, 389: 121898. |
Wang Z, Zhang X H, Huang Y, et al. 2015. Comprehensive evaluation of pharmaceuticals and personal care products (PPCPs) in typical highly urbanized regions across China[J]. Environmental Pollution, 204(Sep.): 223-232. |
Wert E C, Rosario-Ortiz F L, Snyder S A. 2009. Using ultraviolet absorbance and color to assess pharmaceutical oxidation during ozonation of wastewater[J]. Environmental Science & Technology, 43(13): 4858-4863. |
徐新华, 赵伟荣. 2003. 水与废水的臭氧处理[M]. 北京: 化学工业出版社.
|
 2020, Vol. 40
2020, Vol. 40


