2. 陕西省微生物研究所, 西安 710043;
3. 中国科学院南京土壤研究所, 南京 210008
2. Microbiology Institute of Shaanxi, Xi'an 710043;
3. Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008
园林生物质是园艺管理、农林作业所产生的园艺(花草修剪、枯枝落叶等)、农业(作物秸秆、果蔬瓜蔓等)和林业(枯朽倒木、修剪枝茎等)废弃物, 是地球生物圈储量最为丰富的碳水化合物资源(Mckendry et al., 2002; 田赟等, 2011; Bhange et al., 2019).按照化学组成分类, 其主要是由纤维素、半纤维素和木质素构成的大分子交联体-木质纤维素, 是参与生态系统物质循环的重要有机物.由于植物种类和组织部位的不同, 3种成分所占比例亦有所差异, 其中, 纤维素是由D-葡萄糖以β-1, 4糖苷键组成的大分子多糖, 半纤维素是分散于纤维素微束周围的异质多聚体, 木质素则为苯丙烷醇及其衍生物键合而成的芳香族聚合物(Somerville et al., 2005; Dyk et al., 2012).然而, 自然条件下木质纤维素具有水不溶和生物抵抗性, 难以水解或被微生物直接代谢, 从而阻碍其快速降解和再生利用(Malherbe et al., 2002; Zhu et al., 2012).为实现园林生物质的高效利用, 生物酶解是促进纤维素和半纤维素水解、木质素裂解转化为可利用小分子物质的主要途径, 而适当预处理可有效降低其组分内或组分间的分子聚合力, 减少纤维素结晶度, 破坏木质素结构, 并提高木质纤维素的比表面积, 释放更多酶解位点, 加速催化裂解进程(Kumar et al., 2009; 孙少妮, 2015; 许凤等, 2016).木质纤维素材料的传统溶解或预处理方法包括物理机械破碎、化学酸碱消融和物理-化学组合法等, 并常导致废气、废水、扬尘、噪音等环境污染源产生(李姗等, 2019).因此, 低能耗、无污染、条件温和的处理技术是实现园林生物质快速降解、高效利用的关键手段.
离子液体作为一种新型绿色溶剂, 在室温条件为熔融态的盐, 通过熔融共混模式形成分子内氢键, 以降低纤维素结晶度, 提高半纤维素溶解性, 催化裂解木质素各单体分子内或分子间的醚、碳键, 从而提高对木质纤维素的溶解转化效率(Sang et al., 2009; Sun et al., 2012; Berton et al., 2017).研究发现, 对木质纤维素溶解效果较好的阳离子主要有咪唑(1-烯丙基-3-甲基咪唑[Amim]+、1-丁基-3-甲基咪唑[Bmim]+、1-乙基-3-甲基咪唑[Emim]+)、嘧啶和三乙基季铵3种, 阴离子则主要包括卤素(Cl-、Br-)、有机酸(HCOO-、CH3CH2COO-)、无机酸(H2PO4-、HSO4-、NO3-)及其盐(AICI4-、FeSO4-)、酯(EtSO4-)等(杨勇毅, 2017; 陈茹茹等, 2019).其中, 咪唑型离子液体具有热稳定性好、溶解工艺简单、合成成本低廉、预处理应用广泛等优点, 如农林秸秆经[Emim]Ac处理后, 纤维素结晶度和木质素含量均出现明显下降, 单糖含量得到显著提升, 且可重复利用多次(Ouellet et al., 2011; 张长波等, 2013);[Amim]Cl、[Bmim]MeSO4和[Bmim]MeSO4可溶解木屑中大量的木质素和半纤维素, 并保留纤维素成分(Zavrel et al., 2009; Brandt et al., 2011).基于以上溶解特性, 离子液体已被视为园林生物质再利用的有效溶剂和催化剂, 然而在离子液体对木质纤维素的预处理研究中, 多以高纯纤维素作为溶解底物, 选择液料比为20:1的高温(80~130 ℃)反应体系, 甚至采用高压或“酸+离子液体”的条件.尽管这些预处理举措有助于提高离子液体的催化溶解效率, 但在转化应用中存在反应条件苛刻、成本过高、回收困难等现实问题(Sun et al., 2009; Liu et al., 2011).因此, 有必要结合生物酶解技术开发溶解条件温和、应用成本低廉的复合催化体系.
生物酶解是利用自然界存在的各种细菌、放线菌和真菌, 通过其微生物代谢(好氧或厌氧发酵)所合成的纤维素酶、木质素降解酶等酶系来实现对木质纤维素各组分键合链的裂解(Kristensen et al., 2009).其中, 纤维素酶是实现木质纤维素降解转化最为重要的工业化生物酶, 该酶属于O-糖苷类氧化复合酶, 主要包括葡聚糖内切酶(Endoglucanase, EG)、外切酶(Cellobiohydrolase, CBH)和β-葡萄糖苷酶(β-glucosidase, β-G)(于跃等, 2016; Srivastava et al., 2018), 并协同水解纤维素和半纤维素分子内或分子间糖苷键, 形成小分子多糖甚至单糖(方诩等, 2010; Behera et al., 2016).降解木质素的微生物主要为真菌和丝状放线菌, 通过诱导产生的木质素过氧化物酶、酚氧化物酶、漆酶和脱甲基酶等, 实现对木质素醚键、碳键、甲氧基、芳环等基团的裂解, 最终形成可溶性和酸不溶性木质素(Dashtban et al., 2009; Tian et al., 2012).通常, 纤维素酶是由腐生在富含腐殖质土壤或有机质的微生物代谢表达的产物, 除受产酶体系(碳氮源、温湿度、生境变化)影响外, 微生物物种差异也会导致其类型、剂量和表达水平有所不同(Liu et al., 2013), 而复合型微生物菌剂是实现纤维素酶系多元化的有效途径, 也是进一步协同降解木质纤维素的有效手段(李淼淼等, 2018; 路强强等, 2020).
园林生物质经离子液体预处理后, 木质纤维素的部分结构被解聚, 有助于提高其生物酶解效率(张耿崚等, 2017).文献调研发现, 大多研究集中于合成、筛选功能新颖的离子液体或利用商品纤维素酶来构建“离子液体-生物酶”降解体系(Shoda et al., 2012; 盛捷等, 2015; 孙以新, 2019), 而鲜有将离子液体与复合菌剂进行有效组合, 并以园林生物质作为降解底物进行筛选构建研究.因此, 有必要结合离子液体对木质纤维素的催化溶解特性和复合菌剂的协同酶解效应, 筛选可实现园林生物质高效降解的离子液体-复合菌剂体系.本研究通过比较温和溶解条件下1-丁基-3-甲基咪唑型([Bmim])和1-乙基-3-甲基咪唑型([Emim])两种离子液体氯代物、乙酸盐和三氯化铁盐对园林生物质预处理的适宜性, 并根据酶解率和纤维素酶活力水平筛选可高效酶解纤维素的离子液体水溶液, 最后通过降解失重率和木质素含量动态变化评估所构建体系的应用潜力.
2 实验部分(Experimental) 2.1 实验材料本实验所选用的6种离子液体均对木质纤维素有较好溶解转化性, 合成所需主要试剂包括N-甲基咪唑、氯代正丁烷、氯乙烷、乙酸乙酯、乙酸铅和三氯化铁等, 均为分析纯, 购自国药集团化学试剂有限公司;复合微生物菌剂为本课题组前期筛选所得, 由潮湿纤维单胞菌(Cellulomonas uda)、白色链霉菌(Streptomyces albus)、热带假丝酵母(Candida tropicalis)和白腐菌(Phanerochaetc chrysosporium)经培养发酵、一定比例混合并添加0.5%鼠李糖脂混合而成的菌体, 其中, EG、CBH和β-G酶活力分别为25、14和28 U·mL-1, 培养温度为30~65 ℃, 适宜pH值为5.5~7.5, 所述菌种均保藏于陕西省科学院土壤资源与生物技术应用重点实验室, 培养发酵用培养基、药品等购自天津市科密欧化学试剂有限公司;酶解反应所用阳性对照品纤维素酶为浅棕色粉末, 总酶(滤纸酶)活力为45000 U·mL-1(U·g-1), 最适温度为50~60 ℃, 最适pH值为5.5~6.5, 购自沧州夏盛酶生物技术有限公司;降解分析用园林生物质取自陕西省西安植物园新园区园林修剪凋零物, 主要包括修剪的鼠尾草、山桃枝条及枯萎的芦苇茎干等, 经烘干、粉碎过30目筛, 试验前经湿热灭菌除去杂菌和虫卵, 无菌水浸泡过夜并冲洗可溶性有机物, 105 ℃烘干待用, 其主要结构组成物的含量分别为纤维素39.3%、木质素21.5%、半纤维素17.6%, 基本性质为有机质750 g·kg-1、全碳436 g·kg-1、全氮4.8 g·kg-1、碳氮比91、pH值7.7.
2.2 实验仪器本实验分析测定用主要仪器设备包括:离子液体合成用磁力搅拌反应装置(德国艾卡)、旋转蒸发仪(东京理化)、台式冷冻干燥机(上海力辰);菌剂培养发酵用立式压力蒸汽灭菌器(浙江新丰)、恒温摇床(上海予卓)、低温高速离心机(上海卢湘仪);降解物、酶活力测定分析用电子分析天平(瑞士梅特勒)、台式循环水真空泵(郑州长城)、超声波清洗机(江苏昆山)、超纯水机(成都优普生)、酶标仪(瑞士帝肯).
2.3 实验方法 2.3.1 几种离子液体的有机合成离子液体[Bmim]Cl的合成参照文献(陈明强等, 2014)方法, 以物质的量的比1:1.1将N-甲基咪唑与氯代正丁烷加入三口烧瓶, 70 ℃油浴磁力搅拌24 h得到粘稠粗产物, 用乙酸乙酯洗涤反应物, 减压蒸馏除杂, 50 ℃真空干燥即得类白色产物, 将该中间体与三氯化铁(FeCl3)、乙酸铅(PbAC4)进行室温搅拌反应4 h, 并经低温沉降、抽滤、减压蒸馏除杂处理, 即得浅绿色[Bmim]FeCl4和浅黄色[Bmim]Ac产品;离子液体[Emim]Cl的合成参照文献(范琳, 2015)方法, 以物质的量的比1:1.1将N-甲基咪唑与氯乙烷加入三口烧瓶, 70 ℃油浴磁力搅拌24 h得到粘稠粗产物, 用乙酸乙酯洗涤反应物, 减压蒸馏除杂, 50 ℃真空干燥即得类白色产物, 并进一步与FeCl3、PbAC4进行置换反应, 即可获得相应取代物[Emim]FeCl4和[Emim]Ac.离子液体合成于陕西师范大学生物地球化学循环实验室完成.
2.3.2 园林生物质的溶解与再生称取5 g均质化园林生物质于250 mL锥形瓶, 以20:1液固比添加各离子液体100 g, 补水率为0.05 mL·g-1(离子液体), 并置超声波清洗器辅助超声溶解3 h, 控制水浴温度50 ℃、功率60%(李臻等, 2012).待反应结束、降至室温后, 真空抽滤得到不溶性残渣和滤液, 残渣烘干后计算园林生物质溶解率(式(1));滤液用适量去离子水反复冲洗、沉降, 并经高速离心得到灰色絮状物即再生木质纤维素, 冷冻干燥24 h后计算木质纤维素再生率(式(2)).
2.3.3 木质纤维素的酶解与酶活力根据溶解与再生结果, 选取两类离子液体的乙酸盐([Emim]Ac和[Bmim]Ac)和三氯化铁盐([Emim]FeCl4和[Bmim]FeCl4)开展“离子液体-复合菌剂”体系对木质纤维素的酶解试验.离子液体为含水溶液时, 由于水羟基(—OH)与纤维素分子—OH存在竞争氢键作用, 导致纤维素分子—OH与阴离子的键合作用减弱(刘传富等, 2009), 当采用离子液体质量分数为60%~95%的水溶液时, 对纤维素有较好的溶解性(钟文等, 2019).为进一步研究离子液体水溶液对生物酶解的影响, 本实验选用4个浓度梯度(60%、70%、80%、90%)的上述离子液体水溶液, 用无菌水进行配置, 如[Bmim]Ac60%表示[Bmim]Ac质量分数为60%的无菌水溶液.取15 mL HAc-NaAc/柠檬酸-磷酸氢二钾缓冲溶液于100 mL锥形瓶, 先后加入2 g再生木质纤维素和等质量不同浓度离子液体水溶液, 分别以2 mL复合菌剂培养液、质量分数为0.1%的纤维素酶液和等体积无菌水作为试验、对照和空白组.在50 ℃、120 r·min-1条件下培养24 h后, 低温(5 ℃)高速离心(8000 r·min-1)5~7 min得上清液, 每组试验重复3次.采用3, 5-二硝基水杨酸(DNS)比色法测定上清液中还原糖含量(Kamiya et al., 2008), 进而计算酶解率(式(3))和纤维素酶活力(式(4)), 酶活力单位U·mL-1表示1 mL酶底物反应液每分钟(min)催化纤维素水解产生还原糖(葡萄糖)的量(μmol)(周东兴等, 2018).
2.3.4 离子液体-复合菌剂降解评价基于上述酶解率与酶活力结果, 本研究最终选取[Emim]Ac75%和[Emim]FeCl4·75%两个离子液体水溶液开展园林生物质降解试验, 通过降解失重率和木质素含量变化, 评价离子液体-复合菌剂体系对园林生物质的降解效果.取30 mL 5 mmol·L-1的磷酸缓冲液(pH=7)于250 mL锥形瓶, 先后加入5 g均质化园林生物质和等质量离子液体水溶液, 分别以6 mL复合菌剂培养液和质量分数0.1%的纤维素酶液作为菌剂组与对照组, 并以等体积无菌水作为空白组.在50 ℃、120 r·min-1条件下培养15 d.每组试验做10个平行, 并在第3、6、9、12、15 d分别取每组2个平行试验分析其降解情况, 用去离子水反复洗涤、过滤, 滤渣105 ℃烘干至恒重测定其降解失重率(式(5))(薛志靖, 2015)和木质素含量(式(6)).
2.4 测定与计算在温和预处理条件下, 根据园林生物质在各离子液体中的溶解率(DR)和木质纤维素的再生率(RR), 筛选最优离子液体, 其计算依据如式(1)、(2)所示.
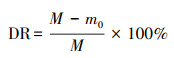
|
(1) |
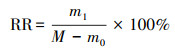
|
(2) |
式中, m0为抽滤不溶性残渣的质量(g);m1为再生木质纤维素的质量(g);M为试验中园林生物质的质量(5 g).
在酶解反应试验中, 各离子液体水溶液具有促进复合菌剂酶解木质纤维素的能力, 可通过比较酶解液还原糖生成量(酶解率ER)和纤维素酶活力(EG、CBH和β-G)水平, 筛选最适离子液体水溶液浓度, 其计算依据如式(3)、(4)所示.
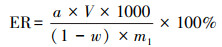
|
(3) |
式中, a为葡萄糖标准曲线查得的还原糖生成量(μg·mL-1);V为酶解液定容体积(mL);m1为再生木质纤维素的质量(g);w为木质纤维素的含水率.
酶活力(EA)测定方法为:取适量稀释倍数的酶解液0.5 mL, 加入1% CMC-Na柠檬酸缓冲液(pH=5.0)1.5 mL, 于50 ℃恒温水浴30 min, 再加入3 mL DNS试剂, 煮沸5 min.利用TECAN InfiniteⓇ 200 PRO酶标仪在540 nm处测定吸光值并根据葡萄糖标准曲线折算内切酶活;外切酶和苷酶测定所加入的反应底物为脱脂棉和脱脂滤条各50 mg, 所用缓冲液为1.5 mL的0.05 mol·L-1柠檬酸(pH=5.0), 酶促反应时间均为60 min, 其它测定条件同上.
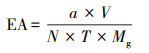
|
(4) |
式中, EA为酶活力(U·mL-1);a为葡萄糖标准曲线查得还原糖生成量(μg·mL-1);V为酶解液稀释定容体积(mL);N为参与反应酶液体积, 取值为0.5 mL;T为酶促反应时间, 内切酶为30 min, 外切酶和苷酶为60 min;Mg为葡萄糖分子质量, 取值为180.
在园林生物质降解试验中, 通过降解失重率(LR)和降解剩余物中木质素含量变化表征“离子液体-复合菌剂”体系的应用效果, 失重率计算依据如式(5)所示.
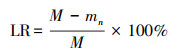
|
(5) |
式中, mn为降解剩余物的质量(g);n为第n天的取样, n=3、6、9、12、15;M为降解前园林生物质的质量(5 g).
木质素含量测定采用木质素酚羟基与乙酰溴发生乙酰化溴代反应, 其衍生物在280 nm处具有特征吸收峰, 且吸光值的高低与其含量呈正相关(Hatfield et al., 2005).称取降解剩余物样品5~10 mg于25 mL具塞玻璃试管中, 先后加入5 mL体积分数为25%的乙酰溴乙酸溶液和0.2 mL 0.7 mol·L-1高氯酸溶液, 于70 ℃恒温反应60 min, 再加入5 mL 2 mol·L-1氢氧化钠溶液终止反应, 并用乙酸定容, 用酶标仪于280 nm处测定其吸光值.以乙酸作为空白对照, 用碱性木质素标准品(日本TCI)做标准工作曲线(R2≥0.995), 折算木质素含量, 其含量变化(C)依据式(6)计算.
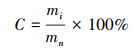
|
(6) |
式中, mi为木质素质量(g);mn为降解剩余物质量(g);i和n为第几天的取样, 取值分别为3、6、9、12、15.
3 结果与讨论(Results and discussion) 3.1 园林生物质在离子液体中的溶解与再生园林生物质在6种离子液体中的溶解与再生结果如图 1所示.由图 1a可知, 园林生物质在[Emim]型离子液体中的平均溶解率(35.3%±5.4%)高于[Bmim]体系(32.0%±1.8%), 总体在30.0%~40.9%之间.各离子液体对应的溶解率大小关系为:[Emim]Ac>[Emim]FeCl4>[Emim]Cl和[Bmim]FeCl4>[Bmim]Ac>[Bmim]Cl.该结果表明, 阳离子烷基链中碳数目越少, 其溶解木质纤维素的能力越强, 同时阴离子为乙酸或三氯化铁盐的离子液体溶解性远高于氯代型.该结果与离子液体促溶解的氢键理论基本一致(Swatloski et al., 2002), 即在咪唑型离子液体中, 阴、阳离子与纤维素的—OH的氢、氧原子相互作用形成氢键, 导致纤维素分子内氢键作用减弱、结晶度降低, 从而有利于纤维素溶解.影响氢键形成的因素包括离子体积大小、阳离子官能团、烷基链长度和阴离子类型等(Moulthrop et al., 2005).因此, 体积相对较小的阳离子1-乙基-3-甲基咪唑([Emim]+)更容易与木质纤维素的—OH发生键合反应, 增加其亲水性, 而金属氯化物(FeCl4-)能提供更多的氢键受体, 同时强极性乙酸根(CH3COO-)具有更强的攻击纤维素分子间和分子内氢键的能力, 从而促其氢键断裂、聚合度下降, 溶解更多纤维素和半纤维素(陶芙蓉等, 2013).从阳离子类型来看(图 1b), 木质纤维素的平均再生率并无显著差异(85.8%±3.7%和84.8%±4.3%), 但存在阴离子类型差异特征, 即FeCl4-盐的再生率最低, [Bmim]FeCl4和[Emim]FeCl4的对应值分别为79.9%±3.5%和82.3%±4.8%.
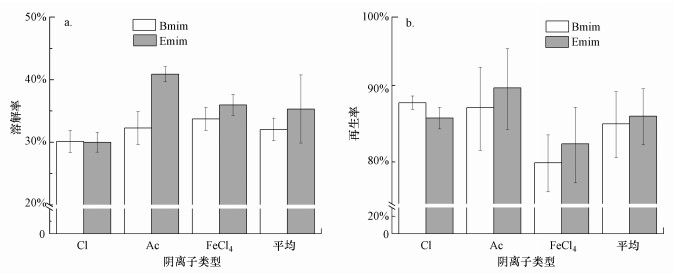 |
| 图 1 园林生物质在离子液体中的溶解率(a)和再生率(b) Fig. 1 The dissolution(a) and regeneration rate(b) of garden biomass in ionic liquid |
在[Bmim]Cl或[Emim]Cl体系中, 有机酸和金属氯化物(Lewis酸)参与的置换反应可形成“离子液体+酸”复合催化体系, 如FeCl4-较优于Cl-与糖苷键的H形成氢键, 从而利于木质素和半纤维素从木质纤维素聚合物中解聚(Zhang et al., 2013).同时, 金属氯化物的熔点较高, 在本试验较为温和的超声辅助溶解条件下, 其粘稠性较大, 不利于木质纤维素的再生与提取.
3.2 木质纤维素在离子液体水溶液中的酶解效率 3.2.1 离子液体水溶液对木质纤维素酶解率的影响再生木质纤维素在离子液体水溶液中的酶解率如表 1所示.由表可知, 菌剂组的酶解率显著高于空白组和对照组, 表明添加复合微生物菌剂的酶解效果最佳.通过比较离子液体类型(图 2a), 发现[Emim]型离子液体水溶液的平均酶解率分别高于对应的[Bmim]型, 即[Emim]Ac 3组试验的酶解率分别为[Bmim]Ac的1.5、1.1和1.2倍, [Emim]FeCl4对应酶解率分别为[Bmim]FeCl4的1.4、1.0和1.4倍;从浓度梯度来看, 空白组和对照组的酶解率随离子液体浓度升高而显著增加, 而菌剂组的变化趋势并不一致, 其中, 阴离子为CH3COO-的体系酶解率与离子液体浓度梯度成正比, 而阴离子为FeCl4-的体系酶解率趋于平缓甚至与浓度梯度成反比.
| 表 1 不同离子液体各浓度体系的酶解率 Table 1 Enzymatic hydrolysis rate in different concentrations of ionic liquid |
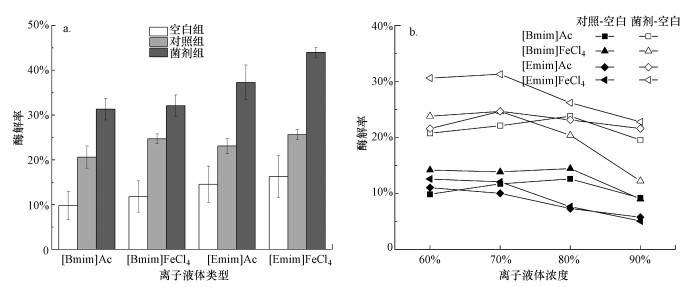 |
| 图 2 木质纤维素在不同离子液体体系中的酶解率(a.不同离子液体类型对应试验组的酶解率, b.扣除空白后各离子液体浓度对应的酶解率) Fig. 2 The enzymatic hydrolysis rate of lignocellulose by different ionic liquid system |
扣除空白, 各离子液体不同浓度对应的酶解率结果如图 2 b所示, 在[Bmim]型离子液体中, [Bmim]Ac质量分数为80%时菌剂组和对照组的酶解率最高, 分别为23.8%和12.5%, [Bmim]FeCl4质量分数为70%时菌剂组酶解率达到最高值24.7%, 而对照组酶解率则在质量分数为60%~80%时保持基本恒定(13.9%~14.5%), 质量分数为90%时酶解率明显下降;[Emim]型离子液体的酶解率则在70%浓度梯度时达到最大, 其中, [Emim]Ac体系菌剂组和对照组的酶解率分别为24.7%和10.0%, [Bmim]FeCl4体系两组试验的酶解率分别为31.3%和12.1%.初步分析表明, [Emim]70%型离子液体水溶液对应的菌剂体系对木质纤维素的降解效果更佳, 这一结果与前人结论(Shi et al., 2014; 钟文等, 2019)基本一致, 即烷基碳链较短的离子液体粘性更小, 有利于酶解体系形成.
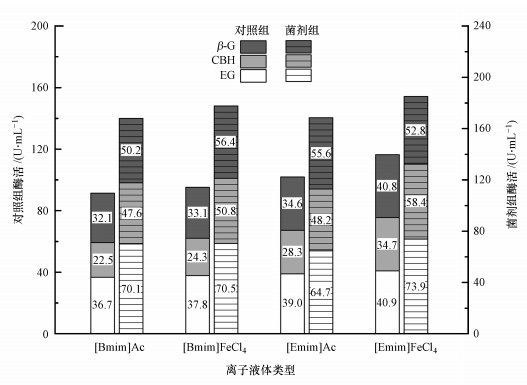
3.2.2 离子液体水溶液对复合菌剂酶活力的影响纤维素在溶解过程中伴随分子链断裂和分子量降低, 从而促使木质纤维素在离子液体中发生部分水解(张加阜, 2017), 这也就解释了空白组在酶解试验时有还原糖产生, 同时空白组有微量酶活力, EG、CBH和β-G的酶活力分别为(1.6±0.2)、(1.3±0.1)和(1.5±0.2) U·mL-1.校正后各离子液体不同浓度体系酶解液的酶活力如表 2所示, 以离子液体类型为依据, 将各浓度梯度酶活力均值化后发现(图 3), 菌剂组各酶活力显著高于对照组, 其中, 阴离子为FeCl4-的体系各酶活力较高;在菌剂组中, [Bmim]FeCl4体系的CBH酶和β-G酶, 以及[Emim]FeCl4体系的EG酶和CBH酶活力明显高于阴离子为CH3COO-型体系对应的酶活力;[Emim]FeCl4体系的β-葡萄糖苷酶活力(52.8 U·mL-1)低于[Emim]Ac体系(55.6 U·mL-1).整体上, [Emim]型离子液体对应的纤维素总酶活力高于[Bmim]型, 且阴离子为FeCl4-的体系较优.
| 表 2 不同离子液体各浓度体系的酶活 Table 2 Enzymatic activity in different concentrations of ionic liquid |
 |
| 图 3 木质纤维素在不同离子液体体系中的酶活 Fig. 3 The enzymatic activity of lignocellulose by different ionic liquid system |
从离子液体水溶液浓度来看(表 2), 在[Bmim]型离子液体中, 酶活力与体系浓度成正比, 浓度为80%时菌剂组的3种酶活力最高, 且[Bmim]FeCl4的酶活力高于[Bmim]Ac, 而浓度为90%时则明显下降;在[Emim]型离子液体中, 各酶活力在两组试验中的变化与[Bmim]型基本一致, 即对照组酶活力随浓度升高而增大, 而菌剂组在浓度为80%时达到最大, 且[Emim]FeCl4酶活力同样高于[Emim]Ac.由以上结果可知, 在木质纤维素酶解体系中, 对照组各酶活力与离子液体浓度成正比, 而对于菌剂组, 较高的离子液体浓度对酶活力具有抑制作用, 且最高酶活力的对应浓度为80%, 这表明高于一定浓度的离子液体对微生物产酶代谢有毒副作用.
3.2.3 离子液体水溶液对复合菌剂的生物毒性前人研究表明, 离子液体均具生物毒性, 并在一定程度上随阳离子烷基侧链长度的增长而毒性增加(张瑾等, 2011).其烷基链效应机理为:碳侧链越长则离子液体的亲脂性越强, 对生物体细胞膜的吸附聚集力越强, 更容易破坏细胞膜、灭活细胞(刘瑞霞等, 2019).该理论与本研究结果基本一致, 即[Emim]侧链为2个碳, 而[Bmim]侧链为4个碳, 因此, 前者体系的微生物毒性相对较低、酶活力更高.而FeCl4-型体系的酶活力高于CH3COO-型, 可能的解释为:在阳离子相同时, 酶解液催化活性与阴离子供电子能力呈正相关, 即金属氯化物的供电子性强于乙酸, 从而利于木质纤维素分子内和分子间氢键的断裂, 同时有机酸阴离子易造成酸性酶解环境, 抑制微生物酶代谢与表达(Li et al., 2014).
3.3 离子液体-复合菌剂体系对园林生物质的降解应用 3.3.1 降解体系对园林生物质降解失重率的影响园林生物质在“离子液体-复合菌剂”体系中的降解失重率结果如图 4所示, 复合菌剂相对空白组和对照组具有更为显著的降解效果.在15 d降解应用过程中, [Emim]Ac75%体系各试验组的降解失重率由降解初期(第3 d)的2.0%、6.1%和10.3%升高至末期(第15 d)的12.1%、30.1%和46.9%(图 4 a), 其中, 试验组与空白组的比较关系为:菌剂组降解失重率是空白组的1.7~5.2倍, 对照组是空白组的1.7~3.1倍, 且菌剂组高于对照组(图 4 c);[Emim]FeCl4·75%体系各试验组的降解失重率由降解初期的4.1%、5.2%和13.7%升高至末期的14.6%、32.4%和52.6%(图 4 b), 菌剂组高于对照组, 其比较关系为:菌剂组降解失重率是空白组的1.4~3.6倍, 对照组是空白组的0.9~2.2倍(图 4 d).同时也发现, 该比例关系均存在先下降后上升的趋势, 且[Emim]FeCl4·75%体系的时间折点早于[Emim]Ac75%体系, 表明[Emim]FeCl4·75%参与的酶解体系较早发挥酶活作用.
 |
| 图 4 园林生物质在两种离子液体体系中的降解失重率(图a、c表示[Emim]Ac75%酶解体系中各试验组对应的园林生物质降解情况, 其中, 图a为降解失重率, 图c为降解失重率的比例关系;图b、d则表示[Emim]FeCl4·75%酶解体系的降解情况) Fig. 4 The degradation weight loss rate of garden biomass by different ionic liquid system |
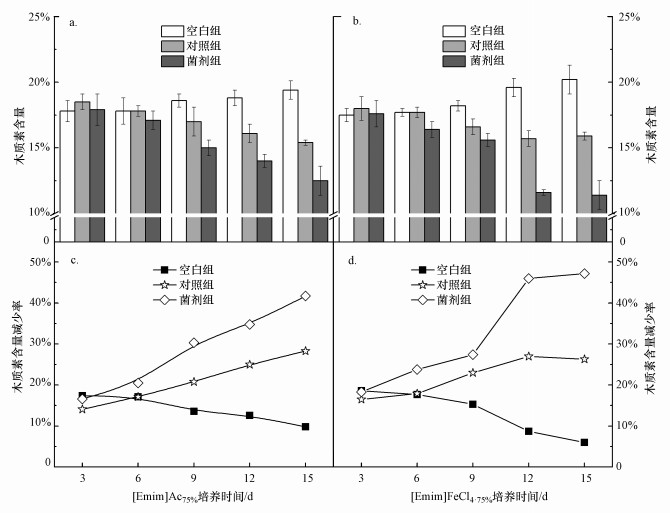
降解剩余物中木质素含量变化如图 5所示, 随着降解时间延长, 纤维素酶或复合菌剂参与的[Emim]Ac75%(图 5a)和[Emim]FeCl4·75%(图 5b)降解体系中, 木质素含量均呈显著下降趋势, 其中, 菌剂组尤为明显, 分别由降解初期的17.9%和17.6%下降至末期的12.5%和11.4%.然而, 两种离子液体体系对应空白组的木质素含量则由降解初期的17.8%和18.5%略增至末期的19.4%和20.2%.该结果与前人研究不一致, 通常认为咪唑类离子液体除有效溶解纤维素外, 也有脱木质素的作用, 如小黑麦、水稻秸秆等经[Emim]Ac离子液体处理后, 其木质素含量和纤维素的结晶度均有不同程度下降(郭立颖等, 2008; Nguyen et al., 2010).究其原因, 本研究采用的是离子液体水溶液而非高纯度离子液体, 且降解条件较为温和(50 ℃)而非高温处理, 这使得降解剩余物中的纤维素和半纤维素被解聚, 而结构复杂的木质素被更多保留, 从而导致其相对含量略有所升高(Fu et al., 2010).
 |
| 图 5 园林生物质降解剩余物中木质素含量的变化(图a、c表示[Emim]Ac75%酶解体系中各试验组对应的木质素含量变化情况, 其中, 图a为木质素含量, 图c为木质素含量减少率;图b、d则表示[Emim]FeCl4·75%酶解体系的木质素含量变化情况) Fig. 5 The changes of lignin content in garden biomass degradation residues |
从降解剩余物中木质素含量的变化趋势来看, 菌剂组中[Emim]Ac75%(图 5 c)和[Emim]FeCl4·75%(图 5 d)体系对应的木质素含量减少率由降解初期的16.6%和18.3%升高至末期的41.7%和47.2%, 且明显高于对照组和空白组.这表明复合菌剂参与的共降解体系具有显著的酶解木质素作用, 该结果与文献报道基本一致(胡晓会等, 2019), 即相对单一的纤维素酶, 复合菌剂体系对木质纤维素的酶解更为全面, 微生物代谢过程产生的非纤维素酶对木质素也有一定的裂解作用(Lee et al., 2009).可能的机理解释为:纤维素在水解过程中为木质素的氧化、脱基、降解反应提供了作用靶点(Tan et al., 2009), 尤其金属氯化物介导的离子液体降解体系有助于木质素多相解聚, 同时, 木质素酚羟基的暴露也为离子液体氢键形成提供了更多的键合位点(李章敏, 2018).
4 结论(Conclusions)为实现园林生物质的高效降解, 筛选了6种常用咪唑型离子液体的溶解再生性, 并结合复合菌剂构建不同质量浓度的“离子液体-复合菌剂”降解体系, 评价其温和条件下对园林生物质的降解效果.结果表明, [Emim]FeCl4·75%-复合菌剂共降解体系具有较为显著的降解应用潜力, 对应纤维素酶最高活力为175 U·mL-1, 15 d时的降解失重率达52%, 木质素含量降至11%.该降解体系具有成本低、毒性小、效率高等优点, 可为园林生物质高附加值产品的开发提供更为环保、高效的技术手段.未来, 75%[Emim]FeCl4离子液体水溶液对复合菌剂和各微生物菌种的生物毒性还有待深入研究, 促木质素降解的酶学机理和单体变化还需进一步探讨.
Behera S S, Ray R C. 2016. Solid state fermentation for production of microbial cellulases:recent advances and improvement strategies[J]. International Journal of Biological Macromolecules, 86: 656-669. DOI:10.1016/j.ijbiomac.2015.10.090 |
Berton P, Bica K, Rogers R D, et al. 2017. Ionic liquids for consumer products:Dissolution, characterization, and controlled release of fragrance compositions[J]. Fluid Phase Equilibria, 450(10): 51-56. |
Bhange V P, Bhivgade U V, Vaidya A N. 2019. Artificial neural network modeling in pretreatment of garden biomass for lignocellulose degradation[J]. Waste & Biomass Valorization, 10(6): 1571-1583. |
Brandt A, Pay M A, To T Q, et al. 2011. Ionic liquid pretreatment of lignocellulosic biomass with ionic liquid-water mixtures[J]. Green Chemistry, 13(9): 2489-2499. DOI:10.1039/c1gc15374a |
陈明强, 杨忠连, 张文涛, 等. 2014. 离子液体[Bmim]Cl的合成与表征[J]. 安徽理工大学学报(自然科学版), 34(2): 1-4. |
陈茹茹, 王雪, 吕兴梅, 等. 2019. 离子液体在生物质转化利用中的应用与研究进展[J]. 轻工学报, 34(3): 1-20. |
Dashtban M, Schraft H, Qin W. 2009. Fungal bioconversion of lignocellulosic residues, opportunities & perspectives[J]. International Journal of Biological Sciences, 5(6): 578-595. |
Dyk J S V, Pletschke B I. 2012. A review of lignocellulose bioconversion using enzymatic hydrolysis and synergistic cooperation between enzymes-Factors affecting enzymes, conversion and synergy[J]. Biotechnology Advances, 30(6): 1458-1480. DOI:10.1016/j.biotechadv.2012.03.002 |
Fu D B, Mazza G, Tamak Y I. 2010. Lignin extraction from straw by ionic liquids and enzymatic hydrolysis of the cellulosic residues[J]. Journal of Agrricultural and Food Chemistry, 58(5): 2915-2922. DOI:10.1021/jf903616y |
范琳.2015.咪唑类离子液体在纤维素酶降解纤维素体系中的作用[D].大连: 大连工业大学.17-18
|
方诩, 秦玉琪, 李雪芝, 等. 2010. 纤维素酶与木质纤维素生物降解转化的研究进展[J]. 生物工程学报, 26(7): 864-869. |
郭立颖, 史铁钧, 李忠, 等. 2008. 两种咪唑类离子液体对杉木屑的溶解性能[J]. 化工学报, 59(5): 1299-1304. |
Hatfield R, Fukushima R S. 2005. Can lignin be accurately measured?[J]. Crop Science, 45(3): 832-839. DOI:10.2135/cropsci2004.0238 |
胡晓会, 程力, 顾正彪, 等. 2019. 离子液体预处理对玉米秸秆酶解效率的影响[J]. 食品与生物技术学报, 38(4): 39-44. |
Kamiya N, Matsushita Y C, Hanaki M. 2008. Enzymatic in situ saccharification of cellulose in aqueous ionic liquid media[J]. Biotechnology Letter, 30(6): 1037-1040. DOI:10.1007/s10529-008-9638-0 |
Kristensen J B, Felby C, Jørgensen H. 2009. Yield-determining factors in high-solids enzymatic hydrolysis of lignocellulose[J]. Biotechnology for Biofuels, 2(11): 1-10. |
Kumar P, Barrett D M, Delwiche M J, et al. 2009. Methods for pretreatment of lignocellulosic biomass for efficient hydrolysis and biofuel production[J]. Industrial & Engineering Chemistry Research, 48(8): 3713-3729. |
Lee S H, Doherty T V, Linhardt J S. 2009. Ionic liquid -mediated selective extraction of lignin from wood leading to enhanced enzymatic cellulose hydrolysis[J]. Biotechnology and Bioengineering, 102(5): 1368-1376. DOI:10.1002/bit.22179 |
李淼淼, 沈飞, 张庆华. 2018. 纤维素酶降解复合菌系的微生物多样性及关键功能菌解析[J]. 环境科学学报, 38(7): 2690-2695. |
李姗, 徐俊丽, 康莹, 等. 2019. 生物可降解离子液体预处理玉米秸秆[J]. 中国科学:化学, 49(7): 1001-1006. |
李臻, 赵应伟, 韩峰, 等. 2012. 功能化离子液体的催化作用及其应用[J]. 中国科学:化学, 42(4): 502-534. |
李章敏.2018.金属基离子液体定向解聚木质素制备高值化学品的研究[D].广州: 华南理工大学.5-26
|
Li Y, Hu S L, Cheng J H, et al. 2014. Acidic ionic liquid-catalyzed esterrification of oleic acid for biodiesel synthesis[J]. Chinese Journal of Catalysis, 35: 394-406. |
Liu G D, Qin Y Q, Li Z H, et al. 2013. Development of highly efficient, low-cost lignocellulolytic enzyme systems in the post-genomic era[J]. Biotechnology Advances, 31(6): 962-975. DOI:10.1016/j.biotechadv.2013.03.001 |
Liu Q P, Hou X D, Li N, et al. 2012. Ionic liquids from renewable biomaterials:synthesis, characterization and application in the pretreatment of biomass[J]. Green Chemistry, 14(2): 304-307. DOI:10.1039/C2GC16128A |
刘传富, 张爱萍, 李维英, 等. 2009. 纤维素在新型离子液体中的溶解及其应用[J]. 化学进展, 21(9): 1800-1806. |
路强强, 赵叶子, 陈智坤, 等. 2020. 城市园林废弃物中纤维素高效降解微生物菌系的构建[J]. 江苏农业科学, 48(6): 272-277. |
Malherbe S, Cloete T E. 2002. Lignocellulose biodegradation:fundamentals and applications[J]. Reviews in Environmental Science and Biotechnology, 1(2): 105-114. |
Mckendry P. 2002. Energy production from biomass (Part 1):overview of biomass[J]. Bioresource Technology, 83(1): 37-46. DOI:10.1016/S0960-8524(01)00118-3 |
Moulthrop J S, Swatloski R P, Moyna G, et al. 2005. High-resolution 13C NMR studies of cellulose and cellulose oligomers in ionic liquid solutions[J]. Chemical Communications, 12: 1557-1559. |
Nguyen T D, Kim K R, Han S J, et al. 2010. Pretreatment of rice straw with ammonia and ionic liquid for lignocellulose conversion to fermentable sugars[J]. Bioresource Technology, 101(19): 7432-7438. DOI:10.1016/j.biortech.2010.04.053 |
Ouellet M, Datta S, Dibble D C, et al. 2011. Impact of ionic liquid pretreated plant biomass on Saccharomyces cerevisiae growth and biofuel production[J]. Green Chemistry, 13(13): 2743-2479. |
Sang H L, Doherty T V, Linhardt R J, et al. 2009. Ionic liquid-mediated selective extraction of lignin from wood leading to enhanced wenzymatic cellulose hydrolysis[J]. Biotechnology & Bioengineering, 102(5): 1368-1376. |
Shi J, Balamurugan K, Parthasarathi R, et al. 2014. Understanding the role of water during ionic liquid pretreatment of lignocellulose:co-solvent or anti-solvent[J]. Green Chemistry, 16(8): 3830-3840. DOI:10.1039/C4GC00373J |
Shoda Y, Nakamoto A, Goto M, et al. 2012. Short time ionic liquids pretreatment on lignocellulosic biomass to enhance enzymatic saccharification[J]. Bioresource Technology, 103(1): 446-452. DOI:10.1016/j.biortech.2011.10.003 |
Somerville C, Bauer S, Brininstool G, et al. 2005. Toward a systems approach to understanding plant cell walls[J]. Science, 306(5705): 2206-2211. |
Srivastava N, Srivastava M, Mishra P K, et al. 2018. Applications of fungal cellulases in biofuel production:Advances and limitations[J]. Renewable and Sustainable Energy Reviews, 82(3): 2379-2386. |
Sun N, Rahman M, Qin Y, et al. 2009. Complete dissolution and partial delignification of wood in the ionic liquid 1-ethyl-3-methylimidazolium acetate[J]. Green Chemistry, 11(11): 646-655. |
Sun S N, Li M F, Yuan T Q, et al. 2012. Effect of ionic liquid pretreatment on the structure of hemicelluloses from corncob[J]. Journal of Agricultural and Food Chemistry, 60(44): 11120-11127. DOI:10.1021/jf3021464 |
Swatloski R P, Spear S K H, Rogers R D. 2002. Dissolution of cellulose with ionic liquids[J]. Journal of the American Chemical Society, 124: 4974-4975. DOI:10.1021/ja025790m |
盛捷, 王少君. 2015. 离子液体介质中纤维素酶降解纤维素的研究进展[J]. 化学研究与应用, 27(5): 553-559. |
孙少妮.2015.协同预处理木质纤维组分结构解析及酶解研究[D].北京: 北京林业大学.13-22
|
孙以新.2019.产纤维素酶菌株的筛选及其降解秸秆的研究[D].哈尔滨: 东北农业大学.8-46
|
Tan S S Y, Macfarlane D R, Upfal J, et al. 2009. Extraction of lignin from lignocellulose at atmospheric pressure using alkylbenzene-sulfonate ionic liquid[J]. Green Chemistry, 11(3): 339-345. DOI:10.1039/b815310h |
Tian X F, Fang Z, Guo F. 2012. Impact and prospective of fungal pre-treatment of lignocellulosic biomass for enzymatic hydrolysis[J]. Biofuels, Bioproducts and Biorefining, 6(3): 335-350. DOI:10.1002/bbb.346 |
田赟, 王海燕, 孙向阳, 等. 2011. 农林废弃物环保型基质再利用研究进展与展望[J]. 土壤通报, 42(2): 497-502. |
陶芙蓉, 崔月芝, 庄辰, 等. 2013. 离子液体对锯末中纤维素的溶解及再生研究[J]. 分子催化, 27(5): 420-428. |
许凤, 张逊, 周霞, 等. 2016. 农林生物质预处理过中细胞壁主要组分溶解机理研究进展[J]. 林业工程学报, 1(4): 1-9. |
薛志靖.2015.黄土丘陵区草地生态系统典型植物枯落物分解特征研究[D].杨凌: 西北农林科技大学.22-27
|
杨勇毅.2017.离子液体在生物质预处理中的应用研究[D].北京: 北京化工大学.4-11
|
于跃, 张剑. 2016. 纤维素酶降解纤维素机理的研究进展[J]. 化学通报, 79(2): 118-122+128. |
Zavrel M, Bross D, Funke M, et al. 2009. Highthroughput screening for ionic liquids dissolving(ligno-)cellulose[J]. Bioresource Technology, 100(9): 2580-2587. DOI:10.1016/j.biortech.2008.11.052 |
Zhang L X, Yu H B, Wang P, et al. 2013. Conversion of xylan, d-xylose and lignocellulosic biomass into furfural using AlCl3 as catalyst in ionic liquid[J]. Bioresource Technology, 130: 110-116. DOI:10.1016/j.biortech.2012.12.018 |
Zhu J Y, Zhuang X S. 2012. Conceptual net energy output for biofuel production from lignocellulosic biomass through biorefining[J]. Progress in Energy and Combustion Science, 38(4): 583-598. DOI:10.1016/j.pecs.2012.03.007 |
张长波, 刘仲齐, 杨双, 等. 2013. 离子液体预处理纤维素及木质纤维素的研究进展[J]. 农业资源与环境学报, 30(6): 20-24. |
张耿崚, 陈细妹, 韩业钜, 等. 2017. 表面活性剂辅助离子液体预处理稻秆的酶解动力学与结构变化分析[J]. 环境科学学报, 37(2): 686-693. |
张加阜.2017.离子液体预处理木质纤维素生物质机理及对厌氧消化性能的影响[D].北京: 北京化工大学.8-13
|
张瑾, 刘树深, 窦容妮, 等. 2011. 30种离子液体对青海弧菌Q67的毒性效应[J]. 环境科学, 32(4): 1108-1113. |
刘瑞霞, 石亚楠, 张瑞锐, 等. 2019. 离子液体的环境行为和安全性探讨[J]. 科学通报, 46(31): 3158-3164. |
钟文, 王琳琳, 马英冲, 等. 2019. 离子液体水溶液中纤维素的温和处理[J]. 大连工业大学学报, 38(4): 259-264. |
周东兴, 王广栋, 吴欣慧, 等. 2018. 腐熟堆肥中维素降解菌筛选鉴定及酶学特性研究[J]. 东北农业大学学报, 49(5): 60-68. |
 2020, Vol. 40
2020, Vol. 40


