2. 深圳市水务(集团)有限公司, 深圳 518031;
3. 广州大学土木工程学院, 广州 510006
2. Shenzhen Water Affairs(Group) Co., Ltd., Shenzhen 518031;
3. School of Civil Engineering, Guangzhou University, Guangzhou 510006
细菌群落在水处理工艺过程中有机污染物去除方面发挥着重要作用, 特别是在生物滤池系统中尤为重要.但一些蓝藻细菌和放线菌可引起嗅味问题(王杨等, 2019), 鸟型分枝杆菌、嗜肺性军团菌、霍乱弧菌等介水传播病原菌的存在更是对人体健康构成严重威胁.据相关报道, 在发展中国家有80%的疾病与不安全的饮用水有关(刘文君等, 2017), 微生物仍是威胁饮用水安全的首要问题(WHO, 2011).因此, 掌握水处理工艺过程中细菌群落多样性与组成及其时空分布变化规律, 特别是条件致病菌的组成, 对控制技术的开发和饮用水安全保障具有重要意义.
随着我国经济的不断发展, 为应对水源微污染问题, O3-BAC深度处理工艺在我国饮用水处理中应用越来越广泛.《江苏省城乡供水十三五规划》更是明确提出, 全省“十三五”期末实现自来水深度处理改造全覆盖.目前虽有一些水处理工艺中细菌群落的研究报道(Lautenschlager et al., 2014), 但对O3-BAC深度处理工艺中细菌群落时空变化、主要影响因素、条件致病菌等鲜有涉及.此外, 作为下一代测序技术, 高通量测序近年来在饮用水微生物群落解析方面得到广泛应用(杨浩等, 2017; Wang et al., 2018; Douterelo et al., 2018), 极大地拓宽了人类对饮用水中微生物的认识.
本文以我国南方某O3-BAC深度处理工艺水厂为研究对象, 利用NovaSeq6000高通量测序技术对工艺过程中水样及滤砂和活性炭生物膜的细菌群落进行研究, 以弄清细菌群落多样性和结构组成的时空分布及动态变化规律, 以及影响细菌群落的工艺单元及水质参数, 掌握工艺过程中条件致病菌的组成与分布, 为饮用水安全保障提供技术支撑.
2 实验材料与方法(Experimental materials and methods) 2.1 水处理工艺该水厂设计规模为60万t·d-1, 基本处于满负荷运行状态, 服务人口约300万人.原水为水库水, 主要处理工艺单元为折板絮凝池、平流沉淀池、砂滤池、臭氧接触池、活性炭滤池和清水池, 工艺流程图如图 1所示.水厂采用聚合氯化铝作为混凝剂, 投加量为1.0~2.0 mg·L-1, 以氧化铝计;臭氧投加量为0.5~1.5 mg·L-1;采用液氯预氧化和消毒, 预氧化投加量为0.5~1.0 mg·L-1, 主消毒投加量为1.5~2.0 mg·L-1, 均以Cl2计.
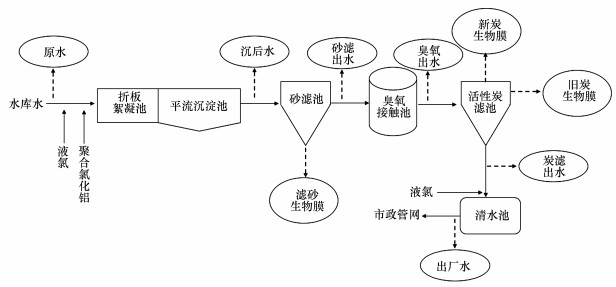 |
| 图 1 O3-BAC深度处理工艺流程图 Fig. 1 Schematic diagram of the O3-BAC advanced treatment process |
水样采自O3-BAC深度处理工艺各单元, 生物膜样品采自砂滤池滤砂和炭滤池活性炭, 其中, 新炭生物膜采自于第一次样品采集5个月前更换的新活性炭滤池, 旧炭生物膜采自于使用约10年的活性炭滤池.各采样点如图 1所示.分别于夏季(7月)和冬季(12月)进行样品采集, 夏季样品编号包括:S.RW(原水)、S.CSE(沉后水)、S.SFE(砂滤出水)、S.OE(臭氧化出水)、S.BACFE(炭滤出水)、S.FW(出厂水)和S.FSB(滤砂生物膜)、S.NBACB(新炭生物膜)、S.OBACB(旧炭生物膜), 冬季样品编号包括:W.RW(原水)、W.CSE(沉后水)、W.SFE(砂滤出水)、W.OE(臭氧化出水)、W.BACFE(炭滤出水)、W.FW(出厂水)和W.FSB(滤砂生物膜)、W.NBACB(新炭生物膜)、W.OBACB(旧炭生物膜).水样采用灭菌处理的塑料桶进行采集, 滤砂样品存放在无菌袋中.每个样品均独立采集3份, 混合后用于后续分析(Zhang et al., 2012).所有样品运送到实验室后立即进行处理, 或保存在4 ℃冰箱中, 24 h内处理完毕.滤砂的处理方式参照文献(郭建宁, 2013), 水样及生物膜处理上清液均用0.22 μm滤膜(直径47 mm, Millipore, USA)过滤, 直到不能通过滤膜为止.过滤后的滤膜置于无菌离心管中, 于-80 ℃冰箱中保存.
2.3 水质指标测定pH值、水温(Temp)和溶解氧(DO)于样品采集后采用HACH HQd多参数水质分析仪立即测定;浊度(Turb)、TOC/DOC、UV254分别采用HACH 2100AN浊度分析仪、GE Sievers 5310C总有机碳测定仪、VARIAN CARY50型紫外-可见分光光度计检测;总磷(TP)、氨氮(AN)、高锰酸盐指数(CODMn)、细菌总数等参考《生活饮用水标准检验方法》(GBT 5750-2006), 生物可降解溶解性有机碳(BDOC)测定方法参考文献(刘文君, 1999), 异养菌平板计数(HPC)参考文献(侯鸾凤, 2018).
2.4 细菌群落测序分析细菌群落测序过程均委托北京诺禾致源科技股份有限公司完成.首先, 采用十六烷基三甲基溴化铵(CTAB)法对样本的基因组DNA进行提取, 之后利用琼脂糖凝胶电泳检测DNA的纯度和浓度.取适量的样品于离心管中, 使用无菌水稀释样品至1 ng·μL-1;以稀释后的基因组DNA为模板, 使用带Barcode的16S V4区引物(515F和806R)、New England Biolabs公司的PhusionⓇ High-Fidelity PCR Master Mix with GC Buffer和高效高保真酶进行PCR, 确保扩增效率和准确性.其次, PCR产物使用2%的琼脂糖凝胶进行电泳检测;根据PCR产物浓度进行等量混样, 充分混匀后使用2%的琼脂糖凝胶电泳检测PCR产物, 对目的条带使用qiagen公司提供的胶回收试剂盒回收产物.最后, 使用TruSeqⓇ DNA PCR-Free Sample Preparation Kit建库试剂盒进行文库构建, 构建好的文库经过Qubit和Q-PCR定量, 文库合格后, 使用NovaSeq6000进行上机测序.
2.5 测序数据分析首先, 对测序获得的数据进行拆分、拼接后得到原始Tags数据(Raw Tags), Raw Tags经过过滤、质控流程后, 与已有数据库(Gold database)进行对比去除嵌合体序列, 得到最终的有效数据(Effective Tags).
其次, 利用Uparse软件在97%的一致性(Identity)水平上将有效数据聚类成为OTUs(Operational Taxonomic Units), 并依据算法原则, 筛选出出现频数最高的序列作为代表序列.用Mothur方法与SILVA的SSUrRNA数据库对OTUs代表序列进行物种注释分析, 在门(phylum)、纲(class)、目(order)、科(family)、属(genus)、种(species)水平上统计各样本的群落组成.并对数据进行均一化处理, 用于后续多样性分析.
最后, 使用Qiime软件(Version 1.9.1)计算Chao1、Shannon、Simpson、ACE、Goods-coverage等α多样性指数.
PCA分析使用R软件(Version 2.15.3)的ade4包和ggplot2软件包;CCA分析使用vegan包中的cca函数进行排序分析, 通过envfit函数可以计算出每个环境因子对物种分布影响的r2和p值.
3 结果(Results) 3.1 O3-BAC深度处理工艺运行效果O3-BAC深度处理工艺过程中水质参数变化情况如表 1所示.由表 1分析可知, 出厂水pH、浊度、CODMn、菌落总数等指标均满足《生活饮用水卫生标准》(GB5749- 2006)的要求.关于HPC指标, 美国现行饮用水水质标准限值为500 CFU·mL-1, 夏季和冬季出厂水均低于该值, 但冬季出厂水中已达200 CFU·mL-1, 需要引起关注.
| 表 1 O3-BAC深度处理工艺过程中水质参数变化情况 Table 1 Variation of water characteristics in O3-BAC advanced treatment process |
此外, 除pH、水温和溶解氧以外, 其它指标在工艺过程中基本呈下降趋势.其中, 夏季和冬季对浊度的去除率分别为99.19%和99.35%, 对UV254的去除率分别为76.07%和91.74%, 对TOC的去除率分别为52.78%和58.55%, 对CODMn的去除率分别为65.74%和43.81%, 对氨氮的去除率均为100%, 对BDOC的去除率分别为75.64%和77.66%, 对细菌总数的去除率为99.62%和100%, 对HPC的去除率分别为99.75%和98.84%.本研究对某O3-BAC深度处理工艺水厂进行一个水文年的观测结果亦表明, 对TOC和UV254的去除率分别为31.54%~58.83%和46.59%~75.24%, 平均去除率分别为44.55%和65.31%(蔡广强等, 2017), 本研究TOC结果与其基本吻合, 但对UV254的去除率明显较高, 这可能与不同水厂工艺运行状况有关.
3.2 工艺过程中细菌群落多样性变化夏季和冬季各样品α多样性指数如表 2所示.由表 2分析可知, Good′s coverage均在0.98左右, 表明16S rRNA测序对水样和生物膜样品中细菌群落的覆盖率很高, 测序深度能够满足多样性分析的需要.整体上, 夏季各样品OTUs数目和α多样性指数均高于冬季.
| 表 2 各样品OTUs数目和α多样性指数 Table 2 OTUs numbers and alpha diversity indexes of each sample |
就水样而言, OTUs数目和各α多样性指数沿O3-BAC深度处理工艺流程整体呈下降趋势, 其中, 经混凝沉淀工艺单元后先下降, 而后砂滤工艺单元后略有升高或基本相当, 经臭氧化单元后大幅下降, 但经过BAC工艺单元后大幅升高, 而后经过消毒单元后再次下降.由此可见, 对细菌多样性起到削减作用的主要是混凝沉淀工艺单元、O3工艺单元和消毒工艺单元.夏季混凝沉淀工艺单元对OTUs、Shannon和Chao1的去除率分别为12.36%、12.79%和12.32%, O3工艺单元对OTUs、Shannon和Chao1的去除率分别为47.90%、17.25%和39.99%, 消毒工艺单元对OTUs、Shannon和Chao1的去除率分别为35.77%、18.92%和26.92%.冬季混凝沉淀工艺单元对OTUs、Shannon和Chao1的去除率分别为5.18%、6.10%和6.72%, O3工艺单元对OTUs、Shannon和Chao1的去除率分别为19.98%、33.76%和34.46%, 消毒工艺单元对OTUs、Shannon和Chao1的去除率分别为52.45%、57.94%和62.47%.
就生物膜样品而言, 夏季和冬季活性炭生物膜样品(S.NBACB、S.OBACB和W.NBACB、W.OBACB)的OTUs和α多样性指数均高于滤砂生物膜样品(S.FSB和W.FSB).夏季新炭生物膜(S.NBACB)的OTUs和丰度指数Chao1与ACE高于旧炭生物膜(S.OBACB), 而多样性指数Shannon和Simpson低于冬季;冬季新炭生物膜(W.NBACB)的OTUs和α多样性指数则均低于旧炭生物膜(W.OBACB).
3.3 工艺过程中细菌群落组成 3.3.1 门、纲水平的细菌群落组成细菌群落在门水平上的组成(相对丰度较高的15种菌门)如图 2a所示.由图 2a分析可知, 夏季各水样主要菌门平均相对丰度从高到低依次为变形菌门(Proteobacteria, 67.93%)、放线菌门(Actinobacteria, 9.87%)、厚壁菌门(Firmicutes, 8.65%)、拟杆菌门(Bacteroidetes, 4.28%)和酸杆菌门(Acidobacteria, 2.21%).冬季各水样主要菌门平均相对丰度从高到低依次为变形菌门(Proteobacteria, 56.29%)、放线菌门(Actinobacteria, 23.06%)、厚壁菌门(Firmicutes, 8.84%)、拟杆菌门(Bacteroidetes, 3.76%)和蓝细菌门(Cyanobacteria, 2.19%).由以上结果可知, 夏季和冬季各水样的主要菌门基本一致, 且变形菌门(Proteobacteria)在各水样细菌群落中占有绝对优势.
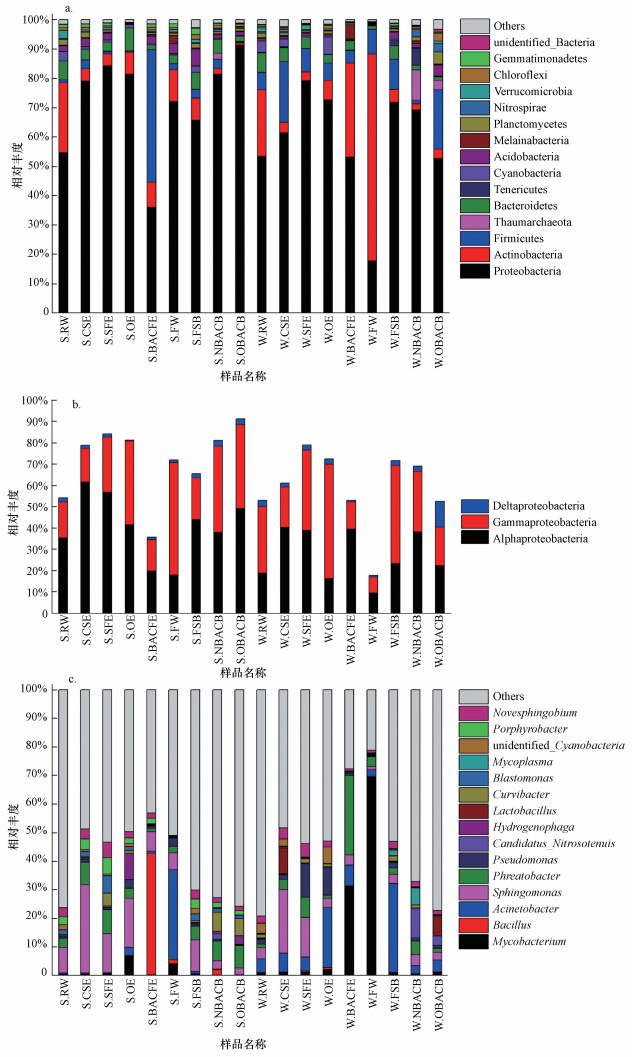 |
| 图 2 各样品在门(a)及属水平(c)上细菌群落组成及变形菌门在纲水平上组成(b) Fig. 2 Bacterial community composition of each sample at phylum (a) and genus(c) level and the composition of Proteobacteria at class level(b) |
相较各水样而言, 在生物膜样品(S.FSB、S.NBACB、S.OBACB和W.FSB、W.NBACB、W.OBACB)中, 变形菌门(Proteobacteria)优势更加明显, 夏季和冬季的相对丰度分别为79.52%和64.60%, 此外, 夏季相对丰度较高的还有拟杆菌门(Bacteroidetes, 4.11%)、放线菌门(Actinobacteria, 3.41%)、酸杆菌门(Acidobacteria, 2.77%)和厚壁菌门(Firmicutes, 2.13%), 冬季较高的有硝化厚壁菌门(Firmicutes, 10.57%)、奇古菌门(Thaumarchaeota, 4.53%)、放线菌门(Actinobacteria, 3.22%)和软壁菌门(Tenericutes, 2.65%).
占有绝对优势的变形菌门(Proteobacteria)在纲水平上组成如图 2b所示.由图 2b分析可知, 夏季水样变形菌门纲水平组成平均相对丰度从高到底依次为α-变形菌纲(Alphaproteobacteria, 38.89%)、γ-变形菌纲(Gammaproteobacteria, 27.54%)、δ-变形菌纲(Deltaproteobacteria, 1.33%).冬季水样变形菌门纲水平组成平均相对丰度从高到底依次为α-变形菌纲(Alphaproteobacteria, 27.29%)、γ-变形菌纲(Gammaproteobacteria, 26.93%)、δ-变形菌纲(Deltaproteobacteria, 1.87%).
生物膜样品中, 夏季(S.FSB、S.NBACB、S.OBACB)各菌纲相对丰度依次为α-变形菌纲(Alphaproteobacteria, 43.75%)、γ-变形菌纲(Gammaproteobacteria, 33.09%)、δ-变形菌纲(Deltaproteobacteria, 2.49%).冬季(W.FSB、W.NBACB、W.OBACB)各菌纲相对丰度依次为γ-变形菌纲(Gammaproteobacteria, 30.78%)、α-变形菌纲(Alphaproteobacteria, 28.00%)、δ-变形菌纲(Deltaproteobacteria, 5.70%).
3.3.2 属水平的细菌群落组成夏季和冬季样品在属水平上的细菌群落组成(相对丰度较高的15种菌属)如图 2c所示.由图 2c分析可知, 夏季水样中相对丰度较高(>10%)的菌属包括鞘氨醇单胞菌属(Sphingomonas)(S.CSE, 30.78%;S.SFE, 13.39%;S.OE, 17.19%)、芽孢杆菌属(Bacillus)(S.BACFE, 42.54%)、不动杆菌属(Acinetobacter)(S.FW, 31.68%).冬季水样中相对丰度较高(>10%)的菌属包括鞘氨醇单胞菌属(Sphingomonas)(S.CSE, 22.26%;S.SFE, 13.80%)、假单胞菌属(Pseudomonas)(W.SFE, 11.89%)、不动杆菌属(Acinetobacter)(W.OE, 21.18%)、分支杆菌属(Mycobacterium)(W.BACFE, 31.11%;W.FW, 69.43%)和Phreatobacter (W.BACFE, 27.87%).生物膜样品中, 夏季相对丰度较高(>10%)的菌属包括鞘氨醇单胞菌属(Sphingomonas)(S.FSB, 11.04%).冬季相对丰度较高(>10%)的菌属包括不动杆菌属(Acinetobacter) (W.FSB, 31.24%)、Candidatus_Nitrosotenuis(W.NBACB, 10.37%).
其中, 芽孢杆菌属(Bacillus)、不动杆菌属(Acinetobacter)、假单胞菌属(Pseudomonas)和分支杆菌属(Mycobacterium)为条件致病菌属(Taylor et al., 2001; Ye et al., 2011; WHO, 2011).
3.4 细菌群落组成变化及核心微生物为更加明晰样品间细菌群落组成变化情况, 对所有样品进行主成分分析, 结果如图 3所示.由图 3分析可知, 夏季和冬季样品分布在第一主成分(横坐标)两侧, 说明细菌群落组成呈明显的季节性变化特征.相邻工艺处理单元出水间均有一定距离, 说明不同处理工艺单元对细菌群落组成均有一定影响.特别是冬季臭氧化出水(W.OE)远离所有样品, 说明其与其他样品细菌群落组成差异较大.此外, 生物膜样品间均相距一定距离, 特别是夏季, 3个生物膜样品相距较远, 体现了生物膜样品间的组成差异化.
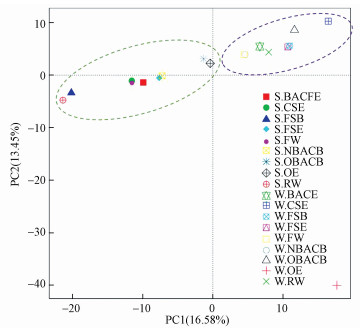 |
| 图 3 细菌群落变化主成分分析 Fig. 3 Principal component analysis illustrating the variation of bacterial community |
为进一步明确工艺中的核心微生物, 对夏季和冬季工艺过程中水样间共有和特有OTUs进行分析, 结果如图 4所示.由图 4分析可知, 夏季工艺过程中水样间共有的OTUs数目为432, 冬季为463, 其中, 夏季核心微生物OTUs数目中, 芽孢杆菌属(Bacillus)、不动杆菌属(Acinetobacter)、假单胞菌属(Pseudomonas)和分支杆菌属(Mycobacterium)等4种主要的条件致病菌属所占OTUs数目分别为5、6、5和3, 冬季核心微生物OTUs数目(463)中, 4种条件致病菌属所占OTUs数目分别为4、6、6和3.两个季节工艺过程中共有微生物数量基本相同, 说明始终有一部分微生物稳定存在于工艺过程中, 不受处理工艺的影响;稳定存在的致病菌可能通过用水管网进入用户龙头水, 进而对人体健康构成威胁.冬季臭氧化出水(W.OE)独有的OTUs数目最大, 为824, 远高于其它样品, 这与主成分分析中W.OE远离其它样品相一致.
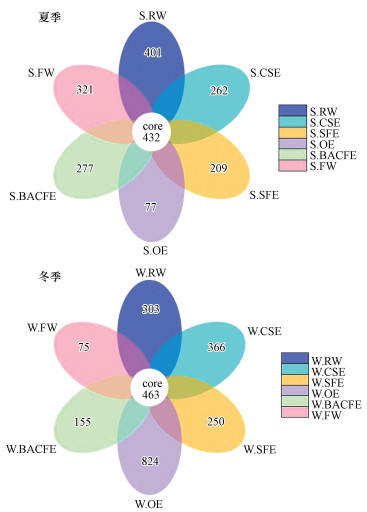 |
| 图 4 水样间基于OTUs的花瓣图 Fig. 4 Flower diagram based on OTUs among water samples |
为明确影响细菌群落的主要因素, 对细菌群落属水平组成(相对丰度较高的35种菌属)与水质参数进行典型相关分析(CCA), 结果如图 5所示.由图 5分析可知, UV254与夏季水样(S.BACFE和S.FW除外)细菌群落结构密切相关, TOC和CODMn与水样S.FW、W.SFE和W.OE细菌群落结构密切相关.TOC和TP与假单胞菌属(Pseudomonas)和不动杆菌属(Acinetobacter)两种条件致病菌属呈密切正相关关系, 而与芽孢杆菌属(Bacillus)呈负相关关系.此外, 通过envfit函数对每个环境因子的显著性进行检验, 水温(Temp)和BDOC在0.01水平上、DO在0.05水平上显著影响细菌群落分布, 而DO与水温密切负相关(高大文等, 2003).因此, 显著影响O3-BAC工艺工程中细菌群落分布的因素为水温和BDOC.
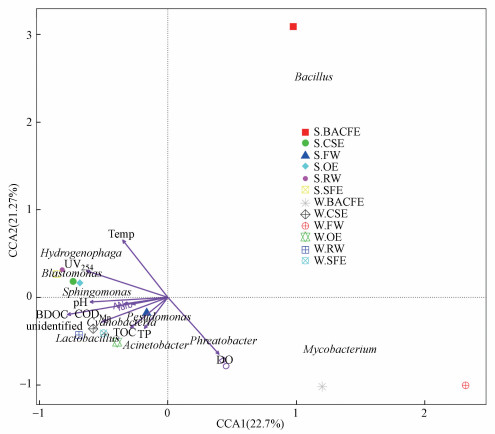 |
| 图 5 细菌群落与水质参数相关关系 Fig. 5 Relationship between bacterial community and water characteristics |
夏季各水样和生物膜样品OTUs数目和α多样性指数均高于冬季对应样品, 由此可知, 夏季细菌群落多样性高于冬季.此外, PCA的分析结果展示了夏季和冬季样品分布的差异性, CAA的分析结果亦显示了水温为细菌群落分布显著影响因素, 而水温与季节变化密切相关.因此, 以上结果均表明O3-BAC深度处理工艺中细菌群落分布的时间变化特性.任红星(2016)对我国东部某市“生物预氧化+O3-BAC深度处理工艺”水厂单元出水及生物膜的研究结果也表明, 夏季各样品OTUs数目和α多样性指数均高于冬季, 与本文的研究结果一致.但Hou等(2018)对广州某炭砂滤池处理工艺水厂的研究结果表明, 旱季(冬季)水样和生物膜样品OTUs数目和α多样性指数高于雨季(夏季), 与本文及任红星(2016)的研究结果相左.以上内容表明, 不同地域细菌群落丰度及多样性时间变化特性可能不同, 故可能与原水中营养物质的构成有关(Pinto et al., 2014), 需要进一步深入研究.细菌群落组成方面, 虽然两个季节水样和生物膜样品绝对优势菌门均为变形菌门(Proteobacteria), 且主要菌门组成类别大体相同, 但同一工艺单元细菌群落门水平相对丰度仍存在一定的差异.如厚壁菌门(Firmicutes)在S.BACFE中相对丰度为45.07%, 超过变形菌门(Proteobacteria)成为绝对优势菌门, 而在W.BACFE中其相对丰度仅为4.31%;放线菌门(Actinobacteria)在S.FW中相对丰度为10.83%, 而其在W.FW中相对丰度高达70.44%, 为绝对优势菌门.在属水平组成上, 两个季节水样和生物膜样品细菌群落组成方面差异化更为明显.如在S.OE中绝对优势菌属为鞘氨醇单胞菌属(Sphingomonas, 17.18%), W.OE中为不动杆菌属(Acinetobacter, 21.18%);在S.FW中, 绝对优势菌属为不动杆菌属(Acinetobacter, 31.68%), 而W.FW中为分支杆菌属(Mycobacterium, 69.43%).需要特别注意的是, 在臭氧化出水及出厂水中能够占据优势的菌属, 均可能具有一定的耐氯性或抗氧化性.相关研究(祝泽兵, 2015; 陆品品, 2013; Simoes et al., 2013)亦表明, 鞘氨醇单胞菌属(Sphingomonas)、不动杆菌属(Acinetobacter)、分支杆菌属(Mycobacterium)和芽孢杆菌属(Bacillus)均为耐氯菌属.
4.2 细菌群落分布空间变化细菌群落多样性在O3-BAC深度处理工艺过程中整体上呈下降趋势, 但在砂滤工艺单元出水基本不变或略有升高, 而在BAC工艺单元出水大幅上升, 这可能是由于过滤介质上孳生的生物膜脱落导致的, 亦说明BAC滤池存在大量微生物泄漏的可能, 相关研究结果也表明BAC滤池出水中大量微生物的存在(Boon et al., 2011; Hou et al., 2018).此外, S.BACFE中绝对优势菌属为芽孢杆菌属(Bacillus, 42.54%), W.BACFE中为分支杆菌属(Mycobacterium, 31.11%), 二者均具有耐氯性和致病性, 且分支杆菌属(Mycobacterium)在W.FW中占绝对优势, 可能会对人体健康构成威胁.芽孢杆菌属(Bacillus)在S.FW中占比较小, 仅为1.32%, 这可能是由于在液氯刺激下, 芽孢杆菌转化为休眠体芽孢, 而芽孢具有较好的沉降性能(蒋旗军等, 2018), 在清水池2 h的停留时间中可能沉降至池底, 但具体机理需要进一步深入研究.混凝沉淀、臭氧化及氯化消毒工艺单元对细菌群落丰度和多样性均具有去除作用, 但混凝沉淀工艺去除率为10%左右, 相对较低.Poitelon等(2010)和Lin等(2014)的研究结果也表明混凝沉淀工艺单元对细菌群落的影响作用较小, 与本研究结果一致.臭氧为强氧化剂, 液氯亦具有较好的消毒效果, 均对细菌群落多样性起到较强的削减作用, 此前已有相关研究报道.就生物膜样品而言, 活性炭生物膜(S.NBACB、S.OBACB和W.NBACB、W.OBACB)细菌群落多样性均高于滤砂生物膜样品(S.FSB和W.FSB);此外, 夏季新炭生物膜(S.NBACB)的OTUs和丰度指数Chao1、ACE已略高于旧炭生物膜(S.OBACB), 说明换炭5个月后, 生物膜已经基本成熟.
4.3 条件致病菌芽孢杆菌属(Bacillus)、不动杆菌属(Acinetobacter)、假单胞菌属(Pseudomonas)和分支杆菌属(Mycobacterium)4种主要的条件致病菌属, 在夏季和冬季核心微生物OTUs数目中所占数量均为19, 说明O3-BAC深度处理工艺过程中主要的条件致病菌属丰度不受季节性变化的影响.此外, 在其它水源、水处理工艺过程细菌多样性研究中亦有多种条件致病菌属被检出, 如梭菌属(Clostridium)、军团菌属(Legionella)、弓形菌属(Arcobacter)、金黄杆菌属(Chryseobacterium)、弯曲杆菌属(Flectobacillus)等(Kwon et al., 2011; Lin et al., 2014; 杨浩等, 2017; Li et al., 2017).虽然条件致病菌属所占丰度较低, 且其亦包含非致病菌种(Sun et al., 2017), 但仍需引起关注, 需要加强其在种水平及灭活方式方面的研究.
5 结论(Conclusions)1) 本研究O3-BAC深度处理工艺水厂出厂水pH、浊度、CODMn、菌落总数等指标均满足《生活饮用水卫生标准》(GB5749- 2006)的要求.
2) 夏季水样和生物膜样品细菌群落多样性显著高于冬季, 活性炭生物膜细菌群落多样性高于滤砂生物膜, 细菌群落多样性在工艺过程中呈明显的空间分布变化, 混凝沉淀、臭氧化和消毒等工艺单元起主要的削减作用.
3) 细菌群落组成呈现一定的时空变化, 水样和生物膜样品中, 变形菌门(Proteobacteria)均为绝对优势菌门, 还包括放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)等, 两个季节门水平主要组成类似, 但相对丰度存在一定差异, 属水平上差异更为明显.
4) 条件致病菌属主要包括芽孢杆菌属(Bacillus)、不动杆菌属(Acinetobacter)、假单胞菌属(Pseudomonas)和分支杆菌属(Mycobacterium), 且除假单胞菌属(Pseudomonas)以外, 其余3种菌属均具有耐氯性.
5) 夏季和冬季核心微生物OTUs数目相近, 且4种主要条件致病菌属所占数量不受季节性变化影响.
6) 显著影响细菌群落分布的水质参数为水温和BDOC.O3-BAC深度处理工艺中细菌群落呈明显的时空变化特性.
Boon N, Pycke B F, Marzorati M, et al. 2011. Nutrient gradients in a granular activated carbon biofilter drives bacterial community organization and dynamics[J]. Water Research, 45(19): 6355-6361. DOI:10.1016/j.watres.2011.09.016 |
蔡广强, 卢小艳, 张金松, 等. 2017. O3-BAC深度处理工艺对有机物及三氯乙醛生成潜能的去除[J]. 给水排水, 43(12): 35-40. |
Douterelo I, Fish K E, Boxall J B. 2018. Succession of bacterial and fungal communities within biofilms of a chlorinated drinking water distribution system[J]. Water Research, 141: 74-85. DOI:10.1016/j.watres.2018.04.058 |
高大文, 王淑莹, 彭永臻, 等. 2003. 温度变化对DO和ORP作为过程控制参数的影响[J]. 环境科学, 24(1): 63-69. |
郭建宁.2013.陶瓷膜及其集成工艺处理微污染饮用水的研究[D].北京: 清华大学
|
侯鸾凤.2018.饮用水给水处理系统微生物多样性研究[D].广州: 华南理工大学
|
Hou L, Zhou Q, Wu Q, et al. 2018. Spatiotemporal changes in bacterial community and microbial activity in a full-scale drinking water treatment plant[J]. Science of the Total Environment, 625: 449-459. DOI:10.1016/j.scitotenv.2017.12.301 |
蒋旗军, 黄慧, 王长平, 等. 2018. 常规工艺给水厂中芽孢杆菌及其芽孢时空分布规律[J]. 中国给水排水, 34(5): 10-14. |
Kwon S, Moon E, Kim T, et al. 2011. Pyrosequencing demonstrated complex microbial communities in a membrane filtration system for a drinking water treatment plant[J]. Microbes and Environments, 26(2): 149-155. DOI:10.1264/jsme2.ME10205 |
Lautenschlager K, Hwang C, Ling F, et al. 2014. Abundance and composition of indigenous bacterial communities in a multi-step biofiltration-based drinking water treatment plant[J]. Water Research, 62: 40-52. DOI:10.1016/j.watres.2014.05.035 |
Li Q, Yu S L, Li L, et al. 2017. Microbial communities shaped by treatment processes in a drinking water treatment plant and their contribution and threat to drinking water safety[J]. Frontiers in Microbiology, 8: 1-16. |
Lin W, Yu Z, Zhang H, et al. 2014. Diversity and dynamics of microbial communities at each step of treatment plant for potable water generation[J]. Water Research, 52: 218-230. DOI:10.1016/j.watres.2013.10.071 |
刘文君.1999.饮用水中可生物降解有机物和消毒副产物特性研究[D].北京: 清华大学
|
刘文君, 王小毛, 王占生. 2017. 饮用水水质标准的发展:从卫生, 安全到健康的理念[J]. 给水排水, 43(10): 1-3. |
陆品品.2013.南方某市氯胺消毒管网生物稳定特性及控制技术研究[D].北京: 清华大学
|
Pinto A J, Schroeder J, Lunn M, et al. 2014. Spatial-temporal survey and occupancy-abundance modeling to predict bacterial community dynamics in the drinking water microbiome[J]. MBIO, 5(3): e1114-e1135. |
Poitelon J, Joyeux M, Welté B, et al. 2010. Variations of bacterial 16S rDNA phylotypes prior to and after chlorination for drinking water production from two surface water treatment plants[J]. Journal of Industrial Microbiology & Biotechnology, 37(2): 117-128. |
任红星.2016.饮用水给水系统中微生物群落时空分布及其动态变化规律研究[D].杭州: 浙江大学
|
Simoes L C, Simões M. 2013. Biofilms in drinking water:problems and solutions[J]. RSC Advances, 3(8): 2520-2533. DOI:10.1039/C2RA22243D |
Sun H, He X, Ye L, et al. 2017. Diversity, abundance, and possible sources of fecal bacteria in the Yangtze River[J]. Applied Microbiology & Biotechnology, 101(5): 2143-2152. |
Taylor L H, Latham S M, Woolhouse M E J. 2001. Risk factors for human disease emergence[J]. Philosophical Transactions of the Royal Society of London, 356(1411): 983-989. DOI:10.1098/rstb.2001.0888 |
Wang F, Li W, Li Y, et al. 2018. Molecular analysis of bacterial community in the tap water with different water ages of a drinking water distribution system[J]. Frontiers of Environmental Science & Engineering, 12(3): 1-6. |
王杨, 朱斌, 童俊, 等. 2019. 基于活性微生物特征的供水管壁生物膜生长特性[J]. 环境科学, 40(2): 343-348. |
WHO. 2011. Guidelines for Drinking-Water Quality(4th edition)[M]. Switzerland: World Health Organization, 232-258.
|
杨浩, 张国珍, 杨晓妮, 等. 2017. 16S rRNA高通量测序研究集雨窖水中微生物群落结构及多样性[J]. 环境科学, 38(4): 1704-1716. |
Ye L, Zhang T. 2011. Pathogenic bacteria in sewage treatment plants as revealed by 454 pyrosequencing[J]. Environmental Science & Technology, 45(17): 7173-7179. |
Zhang M, Liu W, Nie X, et al. 2012. Molecular analysis of bacterial communities in biofilms of a drinking water clearwell[J]. Microbes and Environments, 27(4): 443-448. DOI:10.1264/jsme2.ME12035 |
周常, 蔡广强, 张金松, 等. 2018. 湿热地区O3/BAC工艺的微生物多样性解析[J]. 中国给水排水, 34(11): 45-50. |
祝泽兵.2015.供水管网中的耐氯菌群及其耐氯机制研究[D].哈尔滨: 哈尔滨工业大学
|
 2020, Vol. 40
2020, Vol. 40


