2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049
随着经济发展与人口增长, 人类活动新增“活性”氮的量已导致全球氮循环严重失衡, 并引发了水体富营养化、温室气体增排等一系列环境问题(Mulholland et al., 2008).“活性”氮主要是指溶解态无机氮化合物, 能直接或间接以“活性”氮原子构成的含氮化合物(硝酸盐、铵盐及游离态有机氮)形式进入到水体等环境(Galloway et al., 2003).研究表明, 农田中约有30%的氮肥通过径流和淋溶等方式流失, 导致大量“活性”氮尤其是硝态氮(NO3--N)进入水体(Zhu et al., 2009).自然沟渠是农业灌溉和排水的重要水文通道, 由于其具有利于氮素削减的生物地球化学条件, 被很多研究者认为是重要的“氮”汇场所(Mulholland et al., 2008; 田琳琳等, 2018).氮素在沟渠中的去除主要通过沉积物的吸附作用、植物的吸收作用、微生物的硝化和反硝化脱氮作用、厌氧氨氧化作用等方式(Senzia et al., 2003; 徐红灯等, 2007; 刘莲等, 2019; 肖琳等, 2019).在这些去除方式中, 反硝化脱氮作用可最终将沉积物或水体中的氮素以气体形式排出, 是氮素去除最彻底的途径之一(Seitzinger et al., 2006).目前, 关于平原区沟渠沉积物反硝化作用的研究已有报道(Moore et al., 2010; 秦如彬等, 2017).山区沟渠地形高低落差是山区沟渠异于平原地区沟渠的最显著特征之一.高低落差造成了山丘区沟渠快速的干湿交替过程, 导致山区沟渠不同区域的水分含量状况不同, 而水分含量是影响沉积物反硝化脱氮作用的最重要的因素之一(颜晓元等, 2000; Weitz et al., 2001).因此, 干湿交替过程可能对山区沟渠反硝化脱氮产生巨大影响.
反硝化作用不仅是氮循环的重要环节, 也是影响沟渠沉积物氮素去除的重要过程.反硝化作用是将NO3-和NO2-逐步还原成N2.其中, NO2-还原成NO的过程不仅是反硝化作用的标志性过程(Braker et al., 2011; 贺纪正等, 2013), 也是反硝化速率的重要限速性步骤(张旭志等, 2018), 该过程主要由亚硝酸还原酶nirK和nirS基因完成.氧化亚氮还原酶nosZ基因控制反硝化过程最后一步反应(Kuypers et al., 2018), 是将N2O还原成N2的关键步骤, 也是减少温室气体N2O排放的重要途径.反硝化过程不仅是降低沉积物和水体中“活性”氮并维护氮循环平衡的重要环节, 也是氮循环相关研究的热点内容.目前, 很多研究主要集中于湖泊(丁浩等, 2019)、河口湿地等区域(Dang et al., 2008; Francis et al., 2013), 而针对沟渠沉积物反硝化功能基因的研究并不多见.此外, 大量研究关注生物炭(刘杏认等, 2018)、植物类型(刘莲等, 2019)和施肥(曾希柏等, 2014)等对反硝化功能基因的影响, 但尚未见干湿交替条件与沟渠沉积物反硝化相关功能基因的相关研究报道.
川中丘陵区位于长江上游, 属于典型的山地丘陵区, 地势起伏.由于降雨径流而形成各种天然的排水沟渠, 这些沟渠大多具有高低跌落、小型积水等特点.干湿交替是一种最常见的由地形特点引起的水文条件变化现象.目前, 虽然已有不少研究报道了山区沟渠氮素的去除, 但有关干湿交替对沉积物反硝化作用效率和功能基因的影响尚不清楚.因此, 本文拟通过室内模拟实验探讨干湿交替过程对自然沟渠沉积物反硝化速率及相关功能基因的影响, 以期为提高山丘区沟渠中“活性”氮的去除效率, 减少长江上游地表水中“活性”氮输入提供一定的科学依据.
2 材料与方法(Materials and methods) 2.1 研究区域概况本研究依托中国科学院盐亭紫色土农业生态试验站(31°16′N, 105°27′E).该站位于长江上游涪陵支流的弥江、湍江分水岭地带, 是典型的山地丘陵区;区域气候类型主要以亚热带湿润季风气候为主, 年平均降水量约为825 mm, 年内降雨分布不均, 6—9月为雨季.山地植被类型主要以桤木(Alder cremastogyne)和柏木(Cypresses fineries)为主, 农作物主要以种植小麦、玉米和水稻为主.所选自然沟渠位于该站西南方向约2 km处, 地处林山乡的截流小流域内, 沟渠两岸植被丰富, 主要有稗草(Echinochloa crusgalli (L.) Beauv.)、狗牙根(Cynodon dactylon)和水蓼(Polygonum hydropiper)等.沟宽约为1 m, 沟深约为0.7 m;长期淹水区域水深约为0.34 m, 平均流速约为0.08 m·s-1;长期淹水区上覆水水质基本理化性质的均值为:pH=7.83、电导率610 μS·cm-1、TN 3.23 mg·L-1、NO3--N 1.92 mg·L-1、NH4+-N 0.09 mg·L-1、DOC 4.01 mg·L-1.
2.2 试验设计 2.2.1 处理设置与样品采集共设4种干湿交替处理, 分别为低强度、中强度、高强度和长期淹水对照处理, 每个处理3次重复.试验土柱采集自农田源头沟渠.该沟渠主要用于农业灌溉和排水, 周边土地利用类型为坡耕地和水田.利用由PVC管制成的采样工具(图 1)采取原状沉积物柱, 原状沉积物取样装置长度为15 cm, 直径为10 cm, 顶盖装有三通阀的长进气管和短采气管, 底盖密封.沉积物柱采集完成后, 现场封底, 并运回实验室.
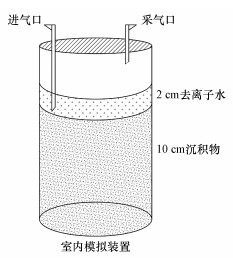 |
| 图 1 实验装置示意图 Fig. 1 Schematic diagram of the experimental setup |
沉积物柱采集后先在25 ℃培养箱中预培养4 d, 用于恢复并排除其在采样过程中可能受到的干扰.试验从2019年11月2日开始, 持续28 d, 分3个周期, 每个周期8 d.每个周期内低强度处理干湿交替1次, 中强度处理干湿交替2次, 高强度处理干湿交替4次, 对照淹水处理保持长期淹水.长期淹水控制淹水水深2 cm, 其它处理为淹水2 cm稳定后用一次性无菌注射器将上覆水抽取出来, 再继续培养落干.整个实验过程均放在25 ℃培养箱中, 每次所添加的水均为灭菌后的去离子水.第一次采气时间为2019年11月6日, 以后每个周期结束后采集一次气体与沉积物, 直至实验结束.
2.3 样品分析与测定 2.3.1 反硝化速率测定反硝化速率测定采用原状土柱-乙炔抑制培养法(邹国元等, 2002).采气前先进行He气通洗5 min用于置换培养装置内的空气, 形成无氧环境.为保证培养装置内乙炔浓度为顶空浓度的8%~10%, 通入乙炔前抽取等量的30 mL He气.前期工作做好后, 在培养初期(初始零时刻)抽取10 mL气体, 再置于25 ℃恒温培养箱中, 然后分别再在2、4 h时抽取10 mL气体.利用Agilent7890A(USA)和Agilent7890B(USA)气相色谱仪对N2O进行分析.反硝化速率计算方法见式(1).

|
(1) |
式中, f为反硝化速率(μg·m-2·h-1), V为瓶盖和固定部分形成的空间体积(m3)加上针筒抽出的体积(m3), A为固定部分的覆盖面积(m2), Δm/Δt为单位时间培养瓶中N2O浓度的变化(μg·m-3·h-1), 28/44为N2O中氮的分子量所占的比例.
2.3.2 沉积物理化性质测定沉积物含水率测定方法为称取一定质量的新鲜沉积物样品并置于105 ℃的烘箱中烘干直至恒重, 损失的水分质量与烘干沉积物质量的比值即为沉积物的含水率.采用FJA-6型氧化还原电位仪(南京土壤所研发)测定沉积物5 cm处的氧化还原电位(ORP).
采用KCl溶液浸提方法测沉积物中NO3--N和NH4+-N含量(刘莲等, 2019).具体操作为:称取(5.00±0.03) g鲜土样品于50 mL离心管中, 加入40 mL去离子水用于浸提沉积物中的NO3--N和NH4+-N, 拧紧盖子摇匀后放入振荡机中, 25 ℃、280 r·min-1下振荡1 h后取出, 用0.45 μm孔径的微孔滤膜进行过滤后, 利用连续性流动分析仪AA3(SEAL, Germany)测定NO3--N和NH4+-N浓度.
采用去离子水浸提方法测沉积物中DOC(Dissolved Organic Carbon)含量(张雪雯等, 2014).具体操作为:称取(5.00±0.03) g鲜土样品于50 mL离心管中, 加入40 mL去离子水用于浸提沉积物中的DOC, 拧紧盖子摇匀后放入振荡机中, 25 ℃、280 r·min-1下振荡1 h后取出, 采用高速离心机(3500 r·min-1)离心10 min后, 取上清液进行过滤.再利用连续性流动分析仪AA3(SEAL, Germany)测定DOC浓度.所测浸提液中各指标浓度(mg·L-1)按式(2)换算成沉积物中NO3--N、NH4+-N和DOC含量(mg·kg-1).

|
(2) |
式中, Di为沉积物中NO3--N、NH4+-N和DOC含量(mg·kg-1), Ci为浸提液中NO3--N、NH4+-N和DOC浓度(mg·L-1), V1为浸提液体积(mL), M为沉积物鲜重(g), W为含水率.
2.3.3 相关功能基因测定首次和末次采集的沉积物样品取部分放置于液氮罐中保存, 用于沉积物中总DNA提取.沉积物总DNA按照FAST DNA SPIN Kit For Soil(aidlab DN27, China)的试剂盒方法进行提取, 每个沉积物样品做3次重复.DNA样品用1%的琼脂糖凝胶电泳检测DNA片段大小, 并放于-20 ℃冰箱保存备用.
实时荧光定量PCR分析:nirK、nirS和nosZ基因扩增引物序列及扩增片段大小见表 1.PCR反应体系(50 μL):AceQⓇ qPCR SYBRⓇ Green Master Mix 10 μL, 10 μmol·L-1正向反向引物各0.40 μL, DNA模板1 μL, 充足的灭菌dd H2O.反应程序为降落式(touchdown)PCR:95 ℃预变性5 min;95 ℃变性15 s, 67 ℃退火30 s(每个循环减小1 ℃, 直到58℃), 72 ℃延伸20 s, 10个循环;然后95 ℃变性15 s, 57 ℃退火30 s, 72 ℃延伸20 s, 35个循环;最后72 ℃延伸7 min.分析过程中使用的仪器型为analytikjena-qTOWER2.2型荧光定量PCR仪(德国).
| 表 1 PCR引物 Table 1 Primers used in this study |
扩增完成后, 分别以nirK、nirS和nosZ基因的重组质粒DNA为标准品, 做出各基因的标准曲线, 通过测定出待测样品的阈值循环数, 根据不同基因的阈值线对应的各沉积物样品的平均Ct值, 实现对样本基因nirK、nirS和nosZ拷贝数的计算.
2.4 统计分析试验数据的统计分析利用SPSS21和Excel(2018)软件完成.采用单因子方差分析和LSD法比较不同处理间的差异, 利用Pearson相关系数检验沉积物反硝化速率与沉积物NH4+-N含量、NO3--N含量、DOC含量、ORP及功能基因(nirK、nirS和nosZ)拷贝数等因子之间的相关性.采用Origin Pro 9做图.
3 结果(Results) 3.1 干湿交替对沉积物基本理化性质的影响图 2为不同干湿交替处理的沉积物NH4+-N、NO3--N、DOC含量和ORP变化曲线.由图 2a可知, 不同干湿交替处理的沉积物NH4+-N含量变化趋势大致相同, 长期淹水处理的NH4+-N含量变化趋势较为稳定.与长期淹水处理对比, 干湿交替处理对沉积物的NH4+-N含量有显著影响(p < 0.05).24 d后各处理的NH4+-N含量与初始相比, 下降幅度表现为低强度(73.49%)>中强度(64.74%)>高强度(53.76%)>长期淹水(17.86%).
 |
| 图 2 不同处理沉积物的NH4+-N(a)、NO3--N(b)、DOC(c)含量和ORP(d)变化 Fig. 2 Changes of NH4+-N(a), NO3--N(b), DOC(c) content and ORP(d) in different treatments |
与沉积物的NH4+-N含量相比, 不同处理沉积物的NO3--N初始含量较低(图 2b).长期淹水处理沉积物的NO3--N含量逐渐减少, 干湿交替处理沉积物的NO3--N含量均表现先增加后减少的趋势.在16 d时出现明显的峰值, 且各处理之间差异显著(p < 0.05).16 d后各处理的NO3--N含量与初始相比, 增加幅度表现为低强度(184.85%)>中强度(173.84%)>高强度(125.56%)>长期淹水(-49.18%).16~24 d期间, 各处理沉积物的NO3--N含量均有所下降.总体来看, 在16 d时干湿交替处理对沉积物的NO3--N含量增幅显著, 说明沉积物在落干过程中会促进NO3--N含量增加.
图 2c为不同处理沉积物的DOC含量变化情况, 总体表现为下降趋势.整个实验周期结束后, 各处理的DOC含量与初始相比, 下降幅度表现为中强度(83.07%)>低强度(75.2%)>高强度(72.71%)>长期淹水(52.76%).
图 2d为不同处理沉积物的ORP变化, 不同干湿交替处理的ORP变化趋势大致相同且均小于300 mV, 长期淹水处理的ORP变化趋势较为稳定.与长期淹水处理相比, 干湿交替处理对沉积物的ORP有显著影响(p < 0.05).24 d后各处理的ORP较初始相比, 增加幅度表现为低强度(232.45%)>中强度(170.92%)>高强度(154.7%)>长期淹水(4.81%).
3.2 干湿交替对沉积物反硝化速率的影响图 3为不同处理沉积物反硝化速率的变化.由图可知, 长期淹水处理反硝化速率总体保持较低的水平, 而其他处理反硝化速率变化显著.自第2周期开始, 多重比较结果显示, 不同处理之间的差异显著.11月6日试验开始时, 不同处理之间的反硝化差异很小, 反硝化速率为0.27~0.86 μg·m-2·h-1, 均值为(0.50±0.26) μg·m-2·h-1.培养16 d后, 与长期淹水处理对比, 其他处理沉积物反硝化速率发生显著变化, 低强度、中强度、高强度处理的反硝化速率均值分别为(364.79±68.13)、(435.78±128.74)和(262.61±62.3) μg·m-2·h-1, 分别增加68.59、82.13和49.10倍(p < 0.01).培养结束时(12月1日), 低强度、中强度、高强度处理的反硝化速率均值分别为(189.88±42.22)、(601.92±342.42)和(469.46±187.24) μg·m-2·h-1.总体而言, 不同处理反硝化速率均值表现为中强度(266.42 μg·m-2·h-1)>高强度(199.10 μg·m-2·h-1)>低强度(152.93 μg·m-2·h-1)>长期淹水(9.57 μg·m-2·h-1).
 |
| 图 3 不同干湿交替强度对沉积物反硝化速率的变化 Fig. 3 Variations of different dry and wet intensities on sediment denitrification rates |
由图 4a可知, 不同处理沉积物的nirK基因拷贝数为5.10×105~4.74×106 copies·g-1.不同处理在实验前后基因拷贝数的变化分别为:低强度处理增加312.3%(p < 0.05), 中强度处理增加717.2%(p < 0.05), 高强度处理增加77.2%(p>0.05), 长期淹水处理减少20.3%(p>0.05).与实验初期相比, 除长期淹水处理外, 干湿交替处理的nirK基因拷贝数均有所增加, 且中强度处理增幅最大.24 d后不同处理之间对比分析发现, 低强度与中强度处理差异显著(p < 0.05), 高强度与长期淹水处理无显著差异(p>0.05).
 |
| 图 4 不同处理下沉积物反硝化功能基因拷贝数(a.nirK, b.nirS, c.nosZ) Fig. 4 Copy number of denitrification function genes in sediments under different treatments |
由图 4b可知, 不同处理沉积物的nirS基因拷贝数为3.87×106~8.77×106 copies·g-1.不同处理在实验前后基因拷贝数的变化分别为:低强度处理增加4.6%(p>0.05), 中强度处理增加98.0%(p < 0.05), 高强度处理增加23.3%(p>0.05), 长期淹水处理减少25.5%(p>0.05).与实验初期相比, 除长期淹水处理, 干湿交替处理的nirS基因拷贝数均有所增加, 且中强度处理增幅最大.24 d后不同处理之间对比分析, 除中强度处理差异显著(p < 0.05)外, 其他处理无显著差异(p>0.05).
由图 4c可知, 不同处理沉积物的nosZ基因拷贝数为2.2×106~3.4×106 copies·g-1.不同处理在实验前后基因拷贝数的变化分别为:低强度处理增加29.2%(p>0.05), 中强度处理增加18.8%(p>0.05), 高强度处理增加54.5%(p>0.05), 长期淹水处理减少8.9%(p>0.05).24 d后不同处理之间对比分析, 各处理之间均无显著差异(p>0.05).
4 讨论(Discussion) 4.1 干湿交替影响沉积物理化性质的原因分析干湿交替是影响沉积物中氮素转化的重要环境因子之一(张威等, 2010).许多研究表明(Fierer et al., 2002; 陈林等, 2013), 干湿交替会刺激土壤提升硝化潜势, 从而降低NH4+-N含量, 增加NO3--N含量, 本文研究结果与前人研究结果相似.本研究中干湿交替处理的沉积物NO3--N含量在实验过程中呈现出先增加后减少的趋势(图 2b).Miller等(2005)认为高强度干湿交替循环更有利于促进氮矿化, 还有研究发现, 随着培养时间的延长, 氮素的矿化趋于稳定状态(Saetre et al., 2005).这可能是因为氮素的矿化趋于平衡状态, 随着沉积物反硝化速率的增加, NO3--N发生还原反应而减少.
在整个实验周期中, 不同处理的沉积物中DOC含量均呈现出显著降低趋势(图 3c).主要原因是DOC作为小分子有机碳水化合物, 能直接被微生物利用从而提供能量.在落干过程中, 沉积物中通气性较好, 有利于硝化微生物进行耗能过程(张雪雯等, 2014);在土壤含水量饱和或淹水条件下, DOC为反硝化微生物提供电子供体, 从而促进反硝化作用(Bateman et al., 2005).尽管有学者认为频繁的干湿交替会破坏土壤团聚体和结构膨胀等过程, 从而促进DOC含量增加(王君等, 2013), 但目前对于土壤中DOC的相关研究中, 也有学者认为干湿交替中土壤(沉积物)的DOC消耗是大于其DOC供应(王苑等, 2014).
本文研究结果表明, 干湿交替处理增加了沉积物ORP.Mossman等(2020)研究认为潮汐流造成的干湿交替使得不同高度的湿地ORP增加, 本文研究结果与之相似.这可能是由于局部排水的增加和沉积物落干过程通气性的增加促进了沉积物ORP增加.Akatsuka等(2011)对日本琵琶湖沿岸沉积物开展了干湿交替研究, 结果表明, 与大气接触的裸露沉积物的ORP高于淹水区域.
4.2 干湿交替影响反硝化速率的相关机理分析相关分析显示, 反硝化速率与NO3--N、ORP和nirK基因拷贝数呈显著正相关(表 2).NO3--N不仅是反硝化反应的直接底物, 还是反硝化过程的电子受体, 约有70%的反硝化细菌以NO3--N作为反硝化过程的电子受体(Verbaenderta et al., 2011).有研究表明底泥NO3--N含量的增加可以促进反硝化速率, 还有研究认为NO3--N含量与沉积物反硝化速率呈正相关关系(Smith et al., 2006; Wray et al., 2007).土壤从干燥到湿润的环境有助于增加土壤碳、氮的可利用性(Włodarczyk et al., 2014)和微生物活性(Baldwin et al., 2000), 落干有氧条件能促进硝化过程积累反硝化作用的底物NO3--N, 淹水环境有利于厌氧条件下反硝化过程的发生, 从而促进沉积物的反硝化速率.Kern等(1996)对亚马逊洪泛区的研究结果显示, 沉积物的NO3--N含量是限制反硝化速率的主要因素.说明长期淹水条件下反硝化速率低可能主要是由沉积物中NO3--N含量低造成的.
| 表 2 不同因子与反硝化速率的相关分析 Table 2 Correlation analysis of various factors |
ORP对沉积物反硝化作用的发生起着关键性作用.Faulkner等(1992)认为300 mV的氧化还原电位为反硝化作用发生的阈值.在24 d模拟实验中, 干湿交替处理的ORP均小于300 mV, 说明沉积物5 cm处依然发生反硝化反应.Harada等(2014)通过生物扰动和添加化学物质增加淤泥中ORP促进了沉积物反硝化速率.说明在适当的条件下, 改变沉积物中ORP可以促进沉积物反硝化速率.
反硝化脱氮作用中, nirK、nirS和nosZ基因是被广泛研究的功能基因.干湿交替条件增加了沉积物中nirK、nirS和nosZ基因的拷贝数, 进而促使3种基因型反硝化细菌在反硝化作用中发挥了重要作用.实验后期, nirK基因拷贝数增幅显著的原因可能是nirK基因在自然沟渠沉积物环境中的生态位优势促使其更适应干湿交替条件的变化.有研究表明, nirS与nirK基因型反硝化微生物在环境中有不同的生态位差异(Zhang et al., 2014);Desnues等(2007)研究认为在有氧条件下, nirK基因比nirS基因在反硝化过程中更有优势.还有研究者总结得出, nirK基因型反硝化细菌在河流沉积物中丰度更高, nirS基因型反硝化细菌在海洋沉积物中丰度更高(Gao et al., 2016).此外, 沉积物反硝化速率与nirS和nosZ基因拷贝数的相关系数虽然为正, 但它们之间的相关关系并不显著(p>0.05), 说明nirS和nosZ基因有可能对反硝化速率产生影响, 但它们不是干湿交替过程中影响反硝化速率变化的主要影响或限制因子.沉积物反硝化速率与nirK基因拷贝数呈显著正相关(r=0.521, p < 0.05), 且nirK基因型反硝化细菌更能适应干湿交替条件的变化, 说明干湿交替主要通过影响沟渠沉积物nirK基因的数量来影响反硝化速率.
5 结论(Conclusions)1) 实验中干湿交替处理显著降低了沉积物中NH4+-N和DOC含量, 沉积物的NO3--N含量表现出先增加后减少的趋势, 干湿交替改变了沉积物的ORP.干湿交替影响下, 反硝化速率与NO3--N含量、ORP呈显著正相关(p < 0.05).
2) 与长期淹水处理相比, 干湿交替处理促进了沉积物反硝化速率增加(p < 0.01), 且中强度处理的增幅最显著.反硝化速率均值表现为中强度(266.42 μg·m-2·h-1)>高强度(199.10 μg·m-2·h-1)>低强度(152.93 μg·m-2·h-1)>长期淹水(9.57 μg·m-2·h-1).
3) 与对照组相比, 干湿交替增加了反硝化功能基因的拷贝数.多重比较结果表明, nosZ基因拷贝数在实验前后无显著差异;nirK基因拷贝数在实验前后差异显著的为低强度和中强度处理, nirS基因拷贝数在实验前后差异显著的为中强度处理.相关性分析表明, 反硝化速率与nirK基因拷贝数之间呈显著正相关(p < 0.05).
Akatsuka T, Mitamura O. 2011. Response of denitrification rate associated with wetting and drying cycles in a littoral wetland area of Lake Biwa, Japan[J]. Limnology, 12(2): 127-135. DOI:10.1007/s10201-010-0329-x |
Baldwin D S, Mitchell A M. 2000. The effects of drying and re-flooding on the sediment and soil nutrient dynamics of lowland river-floodplain systems:a synthesis[J]. Regulated Rivers Research and Management, 16: 457-467. DOI:10.1002/1099-1646(200009/10)16:5<457::AID-RRR597>3.0.CO;2-B |
Bateman E J, Baggs E M. 2005. Contributions of nitrification and denitrification to N2O emissions from soil at different water-filled pore space[J]. Biology and Fertility of Soils, 41: 379-388. DOI:10.1007/s00374-005-0858-3 |
Braker G, Conrad R. 2011. Diversity, structure, and size of N2O producing microbial communities in soils-what matters for their functioning?[J]. Advances in Applied Microbiology, 75: 33-70. DOI:10.1016/B978-0-12-387046-9.00002-5 |
Braker G, Fesefeldt A, Witzel K P. 1998. Development of PCR primer stems for amplification of nitrite reductase genes(nirK and nirS)to detect denitrifying, bacteria in environment samples[J]. Applied & Environmental Microbiology, 64: 3769-3775. |
陈林, 张佳宝, 赵炳梓, 等. 2013. 不同施氮水平下土壤的生化性质对干湿交替的响应[J]. 土壤学报, 50(4): 675-683. |
Dang H Y, Wang C, Li J, et al. 2008. Diversity and distribution of sediment nirS-encoding bacterial assemblages in response to environmental gradients in the Eutrophied Jiaozhou Bay, China[J]. Microbial Ecology, 58(1): 161-169. |
Desnues C, Michotey V D, Wieland A, et al. 2007. Seasonal and diel distributions of denitrifying and bacterial communities in a hypersaline microbial mat (Camargue, France)[J]. Water Research, 41(15): 3407-3419. DOI:10.1016/j.watres.2007.04.018 |
丁浩, 徐慧敏, 苏芮, 等. 2019. 若尔盖花湖沉积物氨氧化与反硝化功能基因丰度垂向分布特征及其环境响应[J]. 环境科学学报, 39(10): 3482-3491. |
Faulkner S P, Patrick W H. 1992. Redox processes and diagnostic wetland soil indicators in bottomland hardwood forest[J]. Soil Science Society America Journal, 56: 856-865. DOI:10.2136/sssaj1992.03615995005600030030x |
Fierer N, Schimel J P. 2002. Effects of drying-rewetting frequency on soil carbon and nitrogen transformations[J]. Soil Biology and Biochemistry, 34(6): 777-787. DOI:10.1016/S0038-0717(02)00007-X |
Francis C A, OMullan G D, Cornwell J C, et al. 2013. Transitions in nirS-type denitrifier diversity, community composition, and biogeochemical activity along the Chesapeake Bay estuary[J]. FrontIers in Microbiology, 4: 237. |
Galloway J N, Aber J D, Erisman J W, et al. 2003. The nitrogen cascade[J]. Bioscience, 53(4): 341-356. DOI:10.1641/0006-3568(2003)053[0341:TNC]2.0.CO;2 |
Gao J, Hou L J, Zheng Y L, et al. 2016. nirS-encoding denitrifier community composition, distribution, and abundance along the coastal wetlands of China[J]. Applied Microbiology and Biotechnology, 100(19): 8573-8582. DOI:10.1007/s00253-016-7659-5 |
Harada H, Akagi K, Tutioka H, et al. 2014. Remediation of coastal sediments by addition of calcium nitrate and presence of benthos in a muddy tidal flat[J]. Journal of Environmental Protection, 5(8): 703-708. DOI:10.4236/jep.2014.58071 |
贺纪正, 张丽梅. 2013. 土壤氮素转化的关键微生物过程及机制[J]. 微生物学通报, 40(1): 98-108. |
Kern J, Darwich A, Furch K, et al. 1996. Seasonal denitrification in flooded and exposed sediments from the Amazon floodplain at Lago Camaleao[J]. Microbial Ecology, 32: 47-57. |
Kuypers M M, Marchant H K, Kartal B. 2018. The microbial nitrogen cycling network[J]. Nature Reviews Microbiology, 16(5): 263-276. DOI:10.1038/nrmicro.2018.9 |
刘莲, 汪涛, 任晓, 等. 2019. 不同植物对沟渠沉积物反硝化速率及功能基因的影响研究[J]. 环境科学学报, 39(6): 1808-1815. |
刘杏认, 赵光昕, 张晴雯, 等. 2018. 生物炭对华北农田土壤N2O通量及相关功能基因丰度的影响[J]. 环境科学, 39(8): 3816-3824. |
Miller A E, Schimel J P, Meixner T, et al. 2005. Episodic rewetting enhances carbon and nitrogen release from chaparral soils[J]. Soil Biology and Biochemistry, 37(12): 2195-2204. DOI:10.1016/j.soilbio.2005.03.021 |
Moore M T, Kroger R, Locke M A, et al. 2010. Nutrient mitigation capacity in Mississippi Delta, USA drainage ditches[J]. Environment Pollution, 158(1): 175-184. DOI:10.1016/j.envpol.2009.07.024 |
Mossman H L, Grant A, Davy A J. 2020. Manipulating saltmarsh microtopography modulates the effects of elevation on sediment redox potential and halophyte distribution[J]. Journal of Ecology, 108(1): 94-106. DOI:10.1111/1365-2745.13229 |
Mulholland P J, Helton A M, Poole G C, et al. 2008. Stream denitrification across biomes and its response to anthropogenic nitrate loading[J]. Nature, 452(7184): 202-205. DOI:10.1038/nature06686 |
秦如彬, 李如忠, 高苏蒂, 等. 2017. 城乡交错带典型溪流沟渠沉积物氮污染特征及硝化-反硝化潜力[J]. 环境科学, 38(3): 936-945. |
Saetre P, Stark J M. 2005. Microbial dynamics and carbon and nitrogen cycling following re-wetting of soils beneath two semi-arid plant species[J]. Oecologia, 142(2): 247-260. DOI:10.1007/s00442-004-1718-9 |
Seitzinger S, Harrison J, Bohlke J, et al. 2006. Denitrification across landscapes and waterscapes:asynthesis[J]. Ecological Applications, 16: 2064-2090. DOI:10.1890/1051-0761(2006)016[2064:DALAWA]2.0.CO;2 |
Senzia M A, Mashauri D A, Mayo A W. 2003. Suitability of constructed wetlands and waste stabilization ponds in waste water reatment:nitrogen transformation and removal[J]. Physics and Chemistry of the Earth, 28: 1117-1124. DOI:10.1016/j.pce.2003.08.033 |
Smith L K, Voyter M A, Bohlke J K, et al. 2006. Denitrification in nitraterich streams:Application of N2:Ar and 15N-tracer methods in intact cores[J]. Ecological Applications, 16(6): 2191-2207. DOI:10.1890/1051-0761(2006)016[2191:DINSAO]2.0.CO;2 |
Throback I N, Enwall K, Jarvis A, et al. 2004. Reassessing PCR primers targeting nirS, nirK and nosZ genes for community surveys of denitrifying bacteria with DGGE[J]. FEMS Microbiology Ecology, 49(3): 401-417. DOI:10.1016/j.femsec.2004.04.011 |
田琳琳, 王正, 朱波. 2018. 长江上游农业源溪流雨季中N2O间接排放特征[J]. 环境科学, 39(12): 5391-5399. |
Verbaendert I, Boom N, De VP, et al. 2011. Denitrification is a common feature among members of the genus Bacillus[J]. Systematic and Applied Microbiology, 34(5): 385-391. DOI:10.1016/j.syapm.2011.02.003 |
王君, 宋新山, 严登华, 等. 2013. 多重干湿交替格局下土壤Birch效应的响应机制[J]. 中国农学通报, 29(27): 120-125. |
王苑, 宋新山, 王君, 等. 2014. 干湿交替对土壤碳库和有机碳矿化的影响[J]. 土壤学报, 51(2): 342-350. |
Weitz A M, Linder E, Frolking E, et al. 2001. N2O emissions from humid tropical agricultural soils:Effects of soil moisture, texture and nitrogen availability[J]. Soil Biology and Biochemistry, 33: 1077-1093. DOI:10.1016/S0038-0717(01)00013-X |
Włodarczyk T, Szarlip P, Kozieł W, et al. 2014. Effect of long storage and soil type on the actual denitrification and denitrification capacity to N2O formation[J]. International Agrophysics, 28(3): 371-381. DOI:10.2478/intag-2014-0027 |
Wray H, Ba Y L. 2007. Denitrification rates in marsh fringes and fens in two boreal peat lands in Alberta, Canada[J]. Wetlands, 27(4): 1036-1045. DOI:10.1672/0277-5212(2007)27[1036:DRIMFA]2.0.CO;2 |
肖琳, 杨佳怡. 2019. 水华对沉积物中氮的转化和去除的影响[J]. 环境科学, 40(9): 4018-4022. |
徐红灯, 席北斗, 翟丽华. 2007. 沟渠沉积物对农田排水中氨氮的截留效应研究[J]. 农业环境科学学报, 26(5): 1924-1928. |
颜晓元, 施书莲, 杜丽娟, 等. 2000. 水分状况对水田土壤N2O排放的影响[J]. 土壤学报, (4): 482-489. |
曾希柏, 王亚男, 王玉忠, 等. 2014. 施肥对设施菜地nirK型反硝化细菌群落结构和丰度的影响[J]. 应用生态学报, 25(2): 505-514. |
张威, 张旭东, 何红波, 等. 2010. 干湿交替条件下土壤氮素转化及其影响研究进展[J]. 生态学杂志, 29(4): 783-789. |
Zhang X L, Agogué H, Dupuy C, et al. 2014. Relative abundance of ammonia oxidizers, denitrifiers, and anammox bacteria in sediments of hyper-nutrified estuarine tidal flats and in relation to environmental conditions[J]. CLEAN-Soil Air Water, 42(6): 815-823. DOI:10.1002/clen.201300013 |
张旭志, 杨倩倩, 赵俊. 2018. 反硝化功能基因nirS和nirK及其检测技术研究进展[J]. 微生物学杂志, 38(4): 84-91. |
张雪雯, 莫熠, 张博雅, 等. 2014. 干湿交替及凋落物对若尔盖泥炭土可溶性有机碳的影响[J]. 湿地科学, 12(2): 134-140. |
邹国元, 赵紫娟, 张福锁, 等. 2002. 运用乙炔抑制-静态土柱培养法测定旱地土壤氮素反硝化损失[J]. 土壤通报, (5): 381-384. |
Zhu B, Wang T, Kuang F H, et al. 2009. Measurements of nitrate leaching from a hillslope cropland in the Central Sichuan Basin, China[J]. Soil Science Society of America Journal, 73(4): 1419-1426. DOI:10.2136/sssaj2008.0259 |
 2020, Vol. 40
2020, Vol. 40


