2. 上海格林曼环境技术有限公司, 上海 200001
2. Shanghai Greenment Environment Technology Co., Ltd. Shanghai 200001
多环芳烃(Polycyclic Aromatic Hydrocarbons, PAHs)是目前我国污染土壤中检出频率较高的优先控制污染物, 具有明确的“三致”效应.近年来利用微生物强化修复PAHs污染土壤日益受到关注(倪妮等, 2016), 目前实验室模拟恒温恒湿等条件下微生物降解效率高, 而实际污染土壤中微生物降解受到温度、氧气、水分等环境因素和土著微生物竞争的影响, 使其在实际环境中存活能力差、降解活性低(周宇等, 2017).因此, 探究如何在实际环境中保持微生物的活性、促进土壤中的PAHs转移至细菌细胞已成为当今土壤微生物修复的热点之一(Crampon et al., 2014).
生物炭具有较大的比表面积和丰富的孔隙度, 可为微生物的生长和繁殖提供较好的栖息地(Lou et al., 2019), 并为附着在生物炭上的微生物提供营养物质(Zhu et al., 2017), 常添加到污染土壤中或作为固定化降解菌的载体, 提高土壤中PAHs的生物降解效率(Chen et al., 2012).Xiong等研究发现稻草生物炭固定化M. gilvum菌剂对芘的去除率较游离M. gilvum提高了23.4%(Xiong et al., 2017).任宏洋等研究发现经玉米芯和秸秆生物炭固定化石油高效降解菌F-3、R-7及混合菌后, 除油率较游离菌显著提高了约5%~20%(任宏洋等, 2017), 可见通过生物炭的固定化提高了降解效果, 同时固态菌剂便于储存和运输, 对降低菌剂运输和使用成本具有重要意义.
目前利用生物炭固定化微生物修复有机污染土壤已经被广泛关注(张博凡等, 2019), 但大多研究聚焦于生物炭固定化菌剂的降解效果、对微生物群落结构的影响, 有关生物炭的筛选、固定化条件优化的研究较少.因此, 本文通过对比稻壳、秸秆、杉木和竹炭4种生物炭的理化性质, 优选Zeta电位较高、比表面积和孔隙较大的稻壳生物炭作固定化微生物的载体, 并优化固定化时间、接种量以及固定化培养基, 期望获得固定微生物量大、去除率高的生物修复功能材料, 为固定化菌剂的制备和PAHs污染土壤的高效修复提供基础数据和技术支持.
2 材料与方法(Materials and methods) 2.1 仪器与设备LC-10ATVP高效液相色谱仪(Shimadzu, JPN), S-3400N扫描电子显微镜(Hitachi Limited, JPN), TriStar II 3020 2.00全自动比表面积和空隙分析仪(Micromeritics, USA), ZetsProbe Zeta电位分析仪(Colloidal Dynamics, USA), VARIO EL Ⅲ元素分析仪(Elementar, GER), DC-12氮气吹干仪(上海安谱科学仪器有限公司), ZQZY-78CN全温振荡培养箱(上海知楚仪器有限公司).
2.2 实验材料生物炭:稻壳、秸秆、杉木、竹炭4种生物炭购自河南生物炭厂家, 将4种生物炭研磨、筛分至30~80目;3% LB培养基:NaCl 30 g、蛋白胨10 g、酵母粉5 g、蒸馏水1000 mL;无机盐培养基(Salt Defined Medium, SSDM)盐度为3%, 调节pH 9.0, 于121 ℃灭菌20 min (Feng et al., 2012);供试菌株:中度嗜盐菌Martelella sp. AD-3(CCTCC M 2011218)是本课题组2009年筛选获得的一株PAHs高效降解菌(崔长征等, 2012).
生物炭固定化菌剂制备:将已活化的Martelella sp. AD-3在3% LB中扩大培养后, 离心、重悬制备菌液.称取1.0 g生物炭于100 mL锥形瓶中置于121 ℃温度下高温高压灭菌20 min, 冷却至常温, 加入20 mL已制好的AD-3菌液, 置于30 ℃、100 r·min-1的振荡培养箱内固定培养后取出, 以200目滤网过滤出生物炭固定化菌剂, 以灭菌后的盐水清洗表面的浮游菌体, 重复2次, 所得固体即为生物炭固定化菌剂.
2.3 实验方法 2.3.1 生物炭的表征生物炭的C、H、N元素含量由元素分析仪测得.生物炭的比表面积及孔隙在77 K下进行N2吸附, 以全自动比表面积和空隙分析仪测定(肖冬林等, 2019).称取0.3 g生物炭, 加入30 mL pH 7的超纯水超声分散后, 测悬浮液的Zeta电位(Julien et al., 1998).
2.3.2 生物炭固定化菌剂去除效果测定将1 g制好的生物炭固定化菌剂置于20 mL 3% SSDM中, 加入200 mg·L-1的菲、80 mg·L-1蒽置于30 ℃、150 r·min-1的振荡培养箱上.于16 h后取样、萃取、氮吹、过滤, 以高效液相色谱测定体系中多环芳烃含量选择去除效果好的1种生物炭做后续优化(石杰, 2017).
2.3.3 生物炭固定化菌剂固定效果观察以0.2 mol·L-1的磷酸缓冲液(pH 7.4)洗涤生物炭固定化菌剂, 加入2.5%戊二醛溶液固定, 离心去上清, 洗涤2次, 将样品置于30%、50%、70%、90%、100%的乙醇溶液中进行梯度脱水(Karcz et al., 2012).冷冻干燥, 喷金后即可进行扫描电镜观察.
2.3.4 生物炭固定化菌剂制备条件优化通过扫描电子显微镜(SEM)照片观察不同固定化时间、接种量以及固定化培养基条件下制备的生物炭固定化菌剂表面固定化微生物数量及其对菲的去除效率等指标, 优化生物炭固定化菌剂的最佳制备条件.
固定化时间:分别选取1、2、3 d制备生物炭固定化菌剂(制备方法同2.2节中生物炭固定化菌剂的制备), 观察菌剂表面微生物数量并测定其对200 mg·L-1菲的去除率.
接种量:在选定最佳固定化时间的基础上, 向20 mL 3% LB中, 分别接入2.9×108、2.9×109 CFU·mL-1菌量, 其他条件同2.2节所述制备生物炭固定化菌剂, 进行镜检及去除率测定.
固定化培养基:在选定最佳固定化时间、接种量的基础上, 固定化培养基分别选取3% LB、3% SSDM重悬菌体制备AD-3菌液, 其他条件同2.2节所述制备生物炭固定化菌剂, 观察菌剂表面微生物数量并测定其去除率.
2.3.5 生物炭固定化菌剂保存在最佳固定化时间、接种量和固定化培养基条件下制备稻壳生物炭固定化菌剂、培养等量游离菌, 于室温条件下(室内温度在25 ℃左右、避光)保存0 d、14 d和21 d, 将其施用于已投加200 mg·L-1菲的3% SSDM培养基中16 h, 测生物炭固定化菌剂、游离菌对菲的去除率.
2.4 数据处理方法
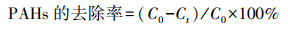
|
(1) |
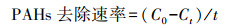
|
(2) |
式中, C0为空白对照组PAHs浓度, Ct为体系中PAHs残留浓度, t为施用时间.
本文中的实验数据均取自实验结果的平均值±标准误差, 利用Excel 2016和OriginPro 9.0软件对实验数据进行处理和制图.
3 结果与分析(Results and analysis) 3.1 生物炭的结构性质4种生物炭的表征数据如表 1所示, 4种生物炭中稻壳生物炭总孔孔容最大, 为0.032 cm3·g-1, 远高于其余3种生物炭(0~0.003 cm3·g-1).生物炭较大的孔隙体积有利于体积较小且生长速率较快微生物进入生物炭生长发育(Pietikainen et al., 2000).4种生物炭中稻壳生物炭比表面积最大(51.340 m2·g-1), 其余3种生物炭的比表面积较小均未超过2 m2·g-1.相较于孔隙体积, 生物炭比表面积对吸附微生物影响较大(Kasozi et al., 2010), 比表面积较大的生物炭可以提供更多的空间供微生物附着, 为微生物的生长繁殖提供栖息地(Quilliam et al, 2013).因此, 比表面积越大的生物炭, 固定化微生物效果越好.稻壳生物炭的Zeta电位最高, 为-19.20 mV;其次为秸秆生物炭和杉木生物炭, 其Zeta电位分别为-41.60、-54.60 mV;竹炭生物炭的Zeta电位最小仅为-63.30 mV.在中性或者碱性环境下细菌表面带负电(San et al., 2020), 当载体表面带正电荷越多时, 载体吸附微生物的数量越高(丁文川等, 2011).根据DLVO理论, 在细菌吸附到载体表面的过程中, 会受到范德华力和静电作用(Hermansson et al., 1999), 载体表面Zeta电位越高, 载体与带负电的微生物之间的静电排斥力越小, 更容易固定化降解微生物(Suliman et al., 2017).4种不同类型生物炭, 稻壳生物炭Zeta电位高、表面积和孔隙度大, 更适宜固定化高效降解菌.
| 表 1 4种不同生物炭元素组成及基本性质 Table 1 Elemental composition and basic properties of four different biochars |
竹炭生物炭的C/H值最大, 为2.65.生物炭的C/H代表生物炭在碳化的过程中的芳香化程度, C/H值越大, 其芳香化程度越高(Qian et al., 2016).生物炭芳香环之间不规则的电荷分配导致生物炭的电子密度增加或降低, 产生富含π电子或缺乏π电子的介质(Zohaib et al., 2018), 可与疏水性有机污染物的π电子形成较强的π-π共轭, 通过π-π共轭将有机污染物吸附在生物炭上(季雪琴, 2015).虽然通过元素分析竹炭生物炭对有机污染物的吸附能力可能是最高的, 但Zeta电位最低使其吸附细菌的静电排斥力最大、比表面积和空隙度最小不利于细菌的固定和繁殖.综合生物炭的表征数据, 初步选定稻壳生物炭作为固定化微生物的载体.
3.2 不同生物炭固定化菌剂的降解性能稻壳生物炭固定化菌剂施用16 h后, 对菲和蒽的去除率分别为30.01%±9.21%和18.48%±8.40%;秸秆生物炭固定化菌剂对菲的去除率为39.56%±1.16%, 高于稻壳生物炭菌剂, 但对蒽的去除率仅为8.78%±1.90%.总的来说, 稻壳生物炭菌剂与秸秆生物炭菌剂去除率相差不大.杉木、竹炭生物炭固定化菌剂的降解效果较差, 对菲、蒽的去除率均小于20%.张雪娜将玉米、黄瓜和番茄秸秆作为载体材料固定化PAHs高效降解菌ZH-H2, 研究了不同材料固定化降解菌对PAHs污染土壤的修复效果, 研究发现3种载体中玉米秸秆作为固定化载体修复效果最好, 能降解10种HMW-PAHs总量的21.65%(张雪娜等, 2017).Yang以生物炭固定化菲降解菌修复PAHs污染沉积物, 修复100 d后, 沉积物中菲去除率为26.7%, 对照组自然衰减了22%的菲, 其生物炭固定化菌剂的降解效果不甚明显(Yang et al., 2018).上述文献中生物炭固定化菌剂在土壤中去除效果不显著、未关注固定化菌剂的优化, 而本研究中生物炭固定化菌剂去除时间较短、效率较高, 且聚焦了生物炭固定化菌剂制备条件的优化, 以期望获得降解效果较好的固定化菌剂.
综合比较4种生物炭的理化性质和固定化菌剂的去除率, 虽然稻壳、秸秆菌剂的去除率相差不大, 但稻壳生物炭Zeta电位高、比表面积和孔隙度大, 更容易吸附微生物并为微生物提供良好的栖息地.因此, 选择稻壳生物炭作为固定化AD-3菌载体.
3.3 不同固定化时间制备菌剂的表面结构SEM对稻壳生物炭和不同固定化时间制备稻壳生物炭固定化菌剂的表面结构观察如图 2所示.未固定化微生物的稻壳生物炭, 其表面较平整、存在条形褶皱(图 2a).稻壳生物炭固定化菌剂在固定化2 d时表面附着的微生物量最多, 如图 2c可见稻壳生物炭表面附着大量的AD-3菌体;固定化1、3的稻壳生物炭固定化菌剂, 表面均零星的附着AD-3菌体, 其附着的微生物量明显小于固定化2 d的稻壳生物炭固定化菌剂.杜勇研究表明生物炭固定微生物主要发生在吸附初期, 完成吸附初期后吸附饱和, 微生物开始在生物炭表面新陈代谢分泌胞外聚合物形成生物膜(杜勇, 2012).固定化1 d由于时间较短可能尚未完成饱和吸附使得生物炭表面微生物数量较少, 固定化时间较长时外层生物膜会脱落致使固定化在生物炭上的微生物数量减少.
 |
| 图 1 4种不同生物炭固定化菌剂对菲、蒽的去除率 Fig. 1 Removal rate of phenanthrene and anthracene by four different immobilized bacteria based on biochar |
 |
| 图 2 稻壳生物炭(a)和固定化1 d (b)、2 d (c)及3 d (d)制备稻壳生物炭固定化菌剂SEM图(×3500) Fig. 2 SEM images of rice husk biochar(a) and different immobilized time(b. 1 d, c. 2 d, d. 3 d) prepared immobilized bacteria based on rice husk biochar |
不同接种量、不同固定化培养基制备的稻壳生物炭固定化菌剂表面结构观察如图 3所示.图 3b、3c为以3% LB为固定化培养基接入AD-3菌体数量分别为2.9×109、2.9×108 CFU·mL-1制备的生物炭固定化菌剂SEM图, 从图 3b中可清晰地看到稻壳生物炭表面附着少量AD-3菌体, 图 3c中稻壳生物炭表面密集附着大量菌体, 数量明显高于图 3b.可见当初始接入菌体数量少时(2.9×108 CFU·mL-1), 生物炭表面固定化的微生物数量多.徐成斌指出当培养基内微生物密度较大时, 微生物将竞争氧气和营养物质无法较好的生长繁殖(徐成斌等, 2015).因此, 当接种量为2.9×109 CFU·mL-1时, 固定化培养基内微生物浓度过高无法较好的生长发育, 造成了生物炭固定化的微生物量较少.
 |
| 图 3 稻壳生物炭(a)和不同固定化培养基、接种量(b. 3% LB中接菌2.9×109 CFU·mL-1, c. 3% LB中接菌2.9×108 CFU·mL-1, d. 3% SSDM中接菌2.9×108 CFU·mL-1)制备稻壳生物炭固定化菌剂SEM图(×3500) Fig. 3 SEM images of rice husk biochar(b) and different immobilized medium, inoculation(b. inoculating 2.9×109 CFU·mL-1 bacteria in 3% LB, c. Inoculating 2.9×108 CFU·mL-1 bacteria in 3% LB, d. inoculating 2.9×108 CFU·mL-1 bacteria in 3% SSDM) prepared immobilized bacteria based on rice husk biochar |
图 3c、3d是接种量为2.9×108 CFU·mL-1时分别以3% LB、3% SSDM为固定化培养基制备的稻壳生物炭固定化菌剂SEM图.图 3c中生物炭上固定化的AD-3菌体数量远大于图 3d.可能是由于微生物在无机盐培养基(3% SSDM)中无法获得足够的营养使其快速生长发育, 致使在吸附过程中生物炭固定化的微生物数量较小.
3.5 不同条件下制备生物炭固定化菌剂的降解性能由不同制备条件下固定化菌剂的SEM图可见, 在固定化2 d、接种量为2.9×108 CFU·mL-1、3% LB为固定化培养基时稻壳生物炭表面固定化微生物数量最多.为验证不同固定化菌剂的去除效果, 对不同条件下制备的固定化菌剂进行去除实验.由表 2可见, 接种量为2.9×108 CFU·mL-1、3% LB为固定化培养基、固定化2 d的稻壳生物炭固定化菌剂去除率较高, 在16 h可去除63.85%的菲, 固定化1 d、3 d的稻壳菌剂的去除率分别为62.70%、61.28%, 略低于固定化2 d的稻壳生物炭固定化菌剂, 这可能是由于固定化时间短时, 生物炭吸附菌量少;固定化时间过长时, 微生物已处于稳定期, 繁殖率与死亡率接近, 生物炭中有活性的微生物数量减少(任宏洋等, 2017).通过SEM对不同固定化时间制备的菌剂固定化菌体数量观察及其对菲的去除效果比较, 生物炭固定化AD-3菌剂的固定化时间选定为2 d.
| 表 2 不同影响因素下制备的稻壳生物炭固定化菌剂对菲的去除率 Table 2 Removal rate of Phe by immobilized bacteria based on rice husk biochar prepared under different influence factors |
从不同接种量、不同固定化培养基制备菌剂的去除率可以看出, 3% LB为固定化培养基、接入菌量2.9×108 CFU·mL-1时制备的稻壳生物炭固定化菌剂效果最佳, 去除率达63.85%, 高于同种固定化培养基下接种量为2.9×109 CFU·mL-1以及相同接种量下3% SSDM为固定化培养基的菌剂;与SEM显示结果对应, 3% LB为固定化培养基、接入菌量2.9×108 CFU·mL-1时制备的固定化菌剂表面微生物数量最多.综合菌剂的电镜观察与去除效果比较, 选定3% LB为固定化培养基, 接种量为2.9×108 CFU·mL-1.
3.6 生物炭固定化菌剂的保存效果为验证生物炭固定化菌剂在实际环境中能保持活性, 以3% LB为固定化培养基、接种量为2.9×108 CFU·mL-1、固定化2 d制备出的稻壳生物炭固定化菌剂在16 h对菲的去除率可达64.49%(表 3), 对应去除速率达8.08 mg·L-1·h-1.将制备好的菌剂放于室温下14 d后, 稻壳生物炭固定化菌剂的活性降低, 去除率为40.96%;相较于新鲜制备的菌剂, 降低了23.53%.保存0 d的游离菌施用16 h去除速率为7.58 mg·L-1·h-1, 置于室温下14 d后对菲的去除率仅为5.75%.保存0 d的游离菌去除速率略低于稻壳生物炭固定化菌剂, 主要由于AD-3菌自身能高效降解菲, 因此, 在保存0 d时两者差别不显著.但保存21 d后游离菌已基本无降解活性, 固定化菌剂去除率虽降低较多, 仍能去除35.60%的菲(去除速率为4.46 mg·L-1·h-1), 另外相较于稻壳生物炭仅能去除19.97%的菲, 固定化菌剂仍高出15.63%.可见稻壳生物炭固定化菌剂稳定性较好, 室温下21 d后固定于其表面的AD-3菌仍旧具备降解活性.Garcia-Delgado将真菌P. ostreatus定殖于秸秆并联合生物炭修复PAHs污染土壤, 42 d后土壤中菲的去除率为62%, 而土壤中菲自然衰减了41%(Garcia-Delgado et al., 2015).本研究则直接将PAHs的高效降解菌固定在筛选出的稻壳生物炭上, 操作更为简便、中间过程更少.并且本文通过优化固定化条件使降解菌能更好的定殖于生物炭、发挥AD-3菌的高效降解作用, 且在室温下一定时间后仍能保持降解活性.因此, 通过生物炭的固定化不仅能使降解效果增加, 也在一定程度上延长微生物的存活时间, 保持了微生物的活性.
| 表 3 稻壳生物炭固定化菌剂、游离菌保存不同时间后对菲的去除率 Table 3 Removal rate of phenanthrene by immobilized bacteria based on rice husk biochar and free bacteria after different time |
1) 稻壳生物炭较其余3种生物炭比表面积及孔隙大、Zeta电位高, 选择其作为固定化AD-3菌的载体.
2) 以3% LB为固定化培养基、接种量为2.9×108 CFU·mL-1、固定化2 d制备的稻壳生物炭固定化菌剂固定化效果和去除效果最好.
3) 生物炭固定化可保持微生物活性, 固定化菌剂置于室温下21 d后仍具有较高活性.
Chen B, Yuan M, Qian L. 2012. Enhanced bioremediation of PAH-contaminated soil byimmobilized bacteria with plant residue and biochar as carriers[J]. Journal of Soils and Sediments, 12(9): 1350-1359. DOI:10.1007/s11368-012-0554-5 |
Crampon M, Bureau F, Akpa-Vinceslas M, et al. 2014. Correlations between PAH bioavailability, degrading bacteria, and soil characteristics during PAH biodegradation in five diffusely contaminated dissimilar soils[J]. Environmental Science and Pollution Research, 21(13): 8133-8145. |
崔长征, 冯天才, 于亚琦, 等. 2012. 降解蒽嗜盐菌AD-3的筛选、降解特性及加氧酶基因的研究[J]. 环境科学, 33(11): 4062-4068. |
丁文川, 曾晓岚, 王永芳, 等. 2011. 生物炭载体的表面特征和挂膜性能研究[J]. 中国环境科学, 31(9): 1451-1455. |
杜勇. 2012.生物炭固定化微生物去除水中苯酚的研究[D].重庆: 重庆大学
|
Feng T C, Cui C Z, Dong F, et al. 2012. Phenanthrene biodegradation by halophilic Martelella sp. AD-3[J]. Journal of Applied Microbiology, 113(4): 779-789. DOI:10.1111/j.1365-2672.2012.05386.x |
Garcia-Delgado C, Alfaro-Barta I, Eymar E. 2015. Combination of biochar amendment and mycoremediation for polycyclic aromatic hydrocarbons immobilization and biodegradation in creosote-contaminated soil[J]. Journal of Hazardous Materials, 285: 259-266. DOI:10.1016/j.jhazmat.2014.12.002 |
Hermansson M. 1999. The DLVO theory in microbial adhesion[J]. Colloids and surfaces B:Biointerfaces, 14(1/4): 105-119. |
季雪琴.2015.表面活性剂条件下生物炭对水中PAHs的去除作用和机制[D].杭州: 浙江工商大学
|
Julien F, Baudu M, Mazet M. 1998. Relationship between chemical and physical surface properties of activated carbon[J]. Water Research, 32(11): 3414-3424. DOI:10.1016/S0043-1354(98)00109-2 |
Karcz J, Bernas T, Nowak A, et al. 2012. Application of lyophilization to prepare the nitrifying bacterial biofilm for imaging with scanning electron microscopy[J]. Scanning, 34(1): 26-36. DOI:10.1002/sca.20275 |
Kasozi G N, Zimmerman A R, Nkedi-Kizza P, et al. 2010. Catechol and humic acid sorption onto a range of laboratory-produced black carbons (biochars)[J]. Environmental Science & Technology, 44(16): 6189-6195. |
Lou L P, Huang Q, Lou Y L, et al. 2019. Adsorption and degradation in the removal of nonylphenol from water by cells immobilized on biochar[J]. Chemosphere, 218: 676-684. |
倪妮, 宋洋, 王芳, 等. 2016. 多环芳烃污染土壤生物联合强化修复研究进展[J]. 土壤学报, 53(3): 561-571. |
PietikainenJ, Kiikkila O, Fritze H. 2000. Charcoal as a habitat for microbes and its effect on the microbial community of the underlying humus[J]. Oikos, 89(2): 231-242. DOI:10.1034/j.1600-0706.2000.890203.x |
Qian L, Zhang W, Yan J, et al. 2016. Effective removal of heavy metal by biochar colloids under different pyrolysis temperatures[J]. Bioresource Technology, 206: 217-224. DOI:10.1016/j.biortech.2016.01.065 |
Quilliam R S, Rangecroft S, Emmett B A, et al. 2013. Is biochar a source or sink for polycyclic aromatic hydrocarbon (PAH) compounds in agricultural soils?[J]. Global Change Biology Bioenergy, 5(2): 96-103. DOI:10.1111/gcbb.12007 |
任宏洋, 马伶俐, 王兵, 等. 2017. 生物炭基固定化菌剂对石油类污染物的高效降解[J]. 环境工程学报, 11(11): 6177-6183. |
San Martin F, Kracht W, Vargas T, et al. 2020. Mechanisms of pyrite biodepression with Acidithiobacillus ferrooxidans in seawater flotation[J]. Minerals Engineering, 145: 1-6. |
石杰. 2017.中度嗜盐菌Martelella sp. AD-3生物强化修复多环芳烃污染盐碱土壤的研究[D].上海: 华东理工大学
|
Suliman W, Harsh J B, Fortuna A M, et al. 2017. Quantitative effects of biochar oxidation and pyrolysis temperature on the transport of pathogenic and nonpathogenicEscherichia coli in biochar-amended sand columns[J]. Environmental Science & Technology, 51(9): 5071-5081. |
肖冬林, 赵玲, 曹心德, 等. 2019. 生物炭强化模拟废水中高浓度苯酚的微生物降解[J]. 环境科学学报, 9(7): 2108-2116. |
Xiong B, Zhang Y, Hou Y, et al. 2017. Enhanced biodegradation of PAHs in historically contaminated soil by M. gilvum inoculated biochar[J]. Chemosphere, 182: 316-324. DOI:10.1016/j.chemosphere.2017.05.020 |
徐成斌, 王闻烨, 李鲜珠, 等. 2015. 一株菲降解菌的鉴定及降解特性[J]. 环境科学学报, 35(3): 684-691. |
Yang X, Chen Z, Wu Q, et al. 2018. Enhanced phenanthrene degradation in river sediments using a combination of biochar and nitrate[J]. Science of the Total Environment, 619: 600-605. |
张博凡, 熊鑫, 韩卓, 等. 2019. 菌糠强化微生物降解石油污染土壤修复研究[J]. 中国环境科学, 39(3): 1139-1146. |
张雪娜, 贾海滨, 王伟, 等. 2017. 不同载体材料固定化Fusarium.sp修复老化污染土壤中HMW-PAHs的研究[J]. 环境科学学报, 37(3): 1107-1114. |
周宇, 马刚平, 张向伟, 等. 2017. 多环芳烃类污染土壤强化生物修复技术研究及应用[J]. 环境工程, 35(12): 184-188. |
Zhu X, Chen B, Zhu L, et al. 2017. Effects and mechanisms of biochar-microbeinteractions in soilimprovement and pollution remediation:A review[J]. Environmental Pollution, 227: 98-115. DOI:10.1016/j.envpol.2017.04.032 |
Zohaib A, Shafaqat A, Muhammad R, et al. 2018. A critical review of mechanisms involved in the adsorption of organic and inorganic contaminants through biochar[J]. Arabian Journal of Geosciences, 11(16): 1-23. |
 2020, Vol. 40
2020, Vol. 40


