2. 内蒙古自治区环境污染控制与废物资源化重点实验室, 呼和浩特 010021;
3. 内蒙古大学生态与环境学院, 呼和浩特 010021;
4. 内蒙古农业大学兽医学院, 呼和浩特 010018
2. Inner Mongolia Key Laboratory of Environmental Pollution Control&Waste Resource Reuse, Hohhot 010021;
3. School of Ecology and Environment, Inner Mongolia University, Hohhot 010021;
4. College of Veterinary Medicine, Inner Mongolia Agricultural University, Hohhot 010018
蓝细菌(Cyanobacteria)广泛分布在海洋(Ferris et al., 1988)、淡水(薛银刚等, 2018)、潮湿土壤(Büdel et al., 2017)、沙漠(李靖宇等, 2018)甚至极地(Rippin et al., 2018)等自然环境中, 在推动早期地球演化和现代环境演变中发挥着重要的作用(Ishiura et al., 1998; Rasmussen et al., 2008; Bahl et al., 2011).Cyanobacteria作为叶绿体的祖细胞是唯一能够进行光合产氧的原核生物(Xu et al., 1990; Summons et al., 1999), 也是具有生物钟的最简单生物(Ishiura et al., 1998).迄今, Cyanobacteria不仅是研究盐度演替的模式生物(Nakov et al., 2017; Herrmann et al., 2019), 还是研究生物固氮、生物土壤结皮(biological soil crust, BSC)和水体富营养化的标志生物(Lesser et al., 2004; 李靖宇等, 2018; 王敏等, 2018).有研究表明, 氨态氮、硝态氮、全氮、全磷等营养物质, 以及温度、pH等是影响富营养化浅水湖泊Cyanobacteria等浮游生物空间分化的主要环境因子(吕明姬等, 2011; Cremona et al., 2018);盐度是调控滨海土壤Cyanobacteria群落结构的重要环境因子(李寒等, 2015);水分是影响生物土壤结皮BSC固氮酶活性的重要因子(虎瑞等, 2016);有机碳能影响Cyanobacteria的细胞裂解率和溶解性(叶琳琳等, 2011);改性粘土能影响水体Cyanobacteria的数量(Wei et al., 2018).综上所述, 氨态氮、硝态氮、全氮、全磷、盐度、有机碳、pH、温度、水分、颗粒大小等基质环境因素均能影响Cyanobacteria群落结构和功能分化.
基于此, 本研究通过设置河床中心低氨低盐相对寡营养的湍流区沉积物B1、河床边缘高氨中盐相对中营养的缓流区沉积物B2、牛轭湖高氨中盐相对富营养的滞流区沉积物B3、低河漫滩中氨中盐相对中营养的土壤F1、高河漫滩中氨中盐相对全营养的土壤F2、二级阶地中氨高盐相对全营养的土壤T1和T2等环境水文梯度.应用细菌16S rRNA基因高通量测序技术研究锡林河流域不同梯度沉积物/土壤中Cyanobacteria群落结构组成、丰度及空间分布特征, 并利用Pearson相关性分析、冗余分析(Redundancy Analysis, RDA)、蒙特卡洛置换检验(Monte Carlo Permutation Test)及变异权重分析(Variation Partitioning Analysis, VPA)等生物信息学方法研究氨态氮、盐度、有机碳等各个环境因子对锡林河流域Cyanobacteria群落空间分化的影响, 结合文献资料探讨锡林河流域Cyanobacteria群落的生态功能, 以期为放牧环境下锡林河流域的生态安全评价及综合防治提供科学依据.
2 材料与方法(Materials and methods) 2.1 样品的采集保存锡林河流域(43°39′~44°36′N、115°33′~117°28′E)位于我国温带半干旱大陆性季风气候区, 多年平均气温为-0.4 ℃, 年平均降水量为336.9 mm, 其中, 5—8月降水量占全年的51%~89%.代表性湿生植被主要为灯芯草(Juncus effusus)和鹅绒委陵菜(Potentilla anserina), 中生植被主要为羊草(Leymus chinensis)和大针茅(Stipa grandis).采样时间为2017年7月上旬, 沿着由水至陆的方向依次采集河床中心湍流区样带沉积物B1(4个样点:B11、B12、B13、B14)、河床边缘缓流区样带沉积物B2(4个样点:B21、B22、B23、B24)、古河床牛轭湖滞流区样带沉积物B3(4个样点:B31、B32、B33、B34)、低河漫滩灯芯草(Juncus effusus)湿地样带土壤F1(4个样点:F11、F12、F13、F14)、高河漫滩鹅绒委陵菜(Potentilla anserina)湿地样带土壤F2(4个样点:F21、F22、F23、F24)、二级阶地羊草(Leymus chinensis)草原样带土壤T1(4个样点:T11、T12、T13、T14)和大针茅(Stipa grandis)草原样带土壤T2(4个样点:T21、T22、T23、T24)(陈佐忠, 1988).每个样带沿着河流走向依次设计4个样点(样点间距500~2000 m), 7个样带合计28个采样点(图 1).样带B1~F2的中心间距为5~100 m, 样带T1~T2的中心间距为50~500 m, 样带F~T的中心间距大于1 km.表层沉积物/土壤是链接生物圈、大气圈、水圈的纽带和关键界面系统, 是生物多样性最丰富和生物地球化学循环最活跃的层次(Preston et al., 1980; Zhu et al., 2017), 因此, 本研究采集0~10 cm表层沉积物/土壤.每个采样点均按照S型进行5点取样, 混合后制备成1个样品(约1 kg)置于无菌塑料袋中, 24 h内用冰盒运到实验室.按四分法分取样品, 部分样品于-80 ℃保存供分子生物学分析, 其余土样风干、研磨、过筛供理化因子检测.
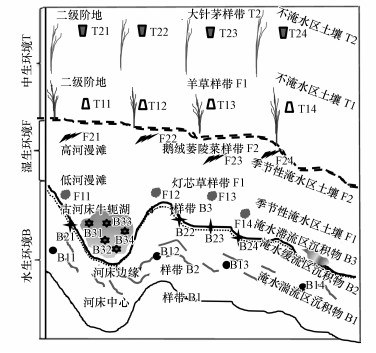 |
| 图 1 锡林河流域中游样带及采样点分布 Fig. 1 Distribution map of sample zones and sampling sites in the middle reaches of Xilin River basin |
沉积物/土壤样品的理化指标主要依照《土壤农化分析》(鮑士旦, 2002)中的方法进行.其中, 黏粒(Clay)、粉粒(Silt)、砂粒(Sand)含量利用激光粒度分析仪进行测定;水分(Moisture)含量采用105 ℃烘干称重法测定;pH值采用电极电位法(水土比2.5:1)测定;盐度(Salinity)利用DDS-11A型电导率仪测定;氨态氮(Ammonia-N)和硝态氮(Nitrate-N)测定时先将样品与2 mol·L-1的KCl溶液按1:2.5浸提1 h, 用0.45 μm微孔滤膜过滤后利用连续流动分析仪(SAN plus, Skalar Analytical B. V., Breda, the Netherlands)进行测定;有机碳(TOC)采用重铬酸钾容量法-外稀释法测定;全氮(TN)采用凯式定氮法测定;全磷(TP)采用碱熔-钼锑抗分光光度法测定.所有理化指标测定3次重复, 表 1中数据为3个测定重复的平均值.
| 表 1 本研究沉积物/土壤样品的理化特性 Table 1 Physicochemical properties of sediment/soil samples in this study |
基于氨态氮(Ammonia-N)梯度将环境区分为低氨(< 5 mg·kg-1)的河床中心B1, 中氨(5~10 mg·kg-1)的低河漫滩F1、高河漫滩F2、二级阶地羊草草原T1和大针茅草原T2, 高氨(>20 mg·kg-1)的河床边缘B2和牛轭湖B3.基于盐度(Salinity)梯度将环境区分为低盐(< 0.5 mg·kg-1)的B1, 中盐(1.0~1.5 mg·kg-1)的B2、B3、F1和F2, 高盐(>1.5 mg·kg-1)的T1和T2.基于总有机碳(TOC)梯度将环境区分为相对寡营养(< 5 g·kg-1)的B1, 相对中营养的B2和F1(5~10 g·kg-1), 相对全营养的F2、T1和T2(10~20 g·kg-1), 相对富营养的B3 (>20 g·kg-1).总体上, 河床中心湍流区B1是低氨低盐相对寡营养的生境, 河床边缘缓流区B2是高氨中盐相对中营养的生境, 牛轭湖滞流区B3是高氨中盐相对富营养的生境, 低河漫滩F1是中氨中盐相对中营养的生境, 高河漫滩F2是中氨中盐相对全营养的生境, 二级阶地羊草草原T1是中氨高盐相对全营养的生境, 二级阶地大针茅草原T2是中氨高盐相对全营养的生境, 结果见图 2.
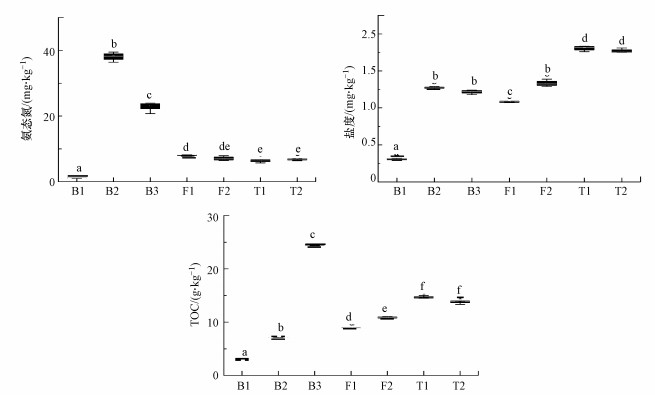 |
| 图 2 锡林河流域各样带环境因子的梯度变化(单因素方差分析和Tamhane′s T2检验中字母相同代表差异不显著(p>0.05), 字母不同代表差异显著(p < 0.05)) Fig. 2 The gradients changes of environmental factors of sampling sites in the middle reaches of Xilin River basin |
沉积物/土壤样品总DNA提取按照FastDNA SPIN试剂盒说明进行.利用16S rRNA基因V3~V4区通用引物(F338/R806)进行PCR扩增, 每一个样品加8 bp的标签序列以示区分待后续大规模样品平行测序.扩增反应体系和工作条件参照文献(于景丽等, 2020).所有样品的PCR产物经纯化和定量后送往北京百迈客生物科技有限公司的Illumina MiSeqPE300测序平台进行高通量测序.全部样品16S rRNA基因序列已上传至NCBI, 登录号为SRR8835 404-447.使用Trimmomatic和FLASH软件优化拼接获取高质量序列, 使用UPARSE软件在97%的相似度水平上进行操作分类单元(Operational Taxonomic Unit, OTU)聚类分析同步剔除嵌合体.利用RDP classifier对每条序列进行分类学(门、纲、目、科、属、种)注释, 相似性达到97%的OTU归为同一种细菌, 再将每条序列与SILVA数据库(SSU128)进行序列比对(比对阈值70%), 最后将每个样品中分配的细菌种类及其种类对应的序列数进行物种组成的划分和相对丰度的计算.高通量测序数据庞大导致获得的大量种属甚至科目水平都无具体的名称, 本研究基于“溯源命名法”将选定的物种重新命名, 将没有明确分类学名称的物种(Other, uncultured bacterium)向上追溯到属、科、目、纲甚至门水平直至有明确的分类学名称为止, 并加注数字编号以便于后续分析.
2.5 数据的统计分析用Excel 2010和Oringin 2017进行柱状图、折线图及箱线图等基本图形绘制.采用SPSS 20.0进行Pearson相关性分析与单因素方差分析(Analysis of Variance, ANOVA)及Tamhane′s T2检验.用百迈客生物云计算平台(BMKCloud)内置R语言进行Heatmap热图分析.用CANOCO 5.0对Cyanobacteria群落与黏粒、粉粒、砂粒、水分、pH、盐度、氨态氮、硝态氮、有机碳、全氮和全磷等环境因子进行冗余分析(Redundancy Analysis, RDA)、蒙特卡洛置换检验(Monte Carlo Permutation Test)及变异权重分析(Variation Partitioning Analysis, VPA)等, 以研究每个环境因子对锡林河流域Cyanobacteria群落空间分化的影响.
3 结果(Results) 3.1 高通量测序结果28个样品在97%相似性水平上划分为43830个OTUs和791种细菌, 隶属于37个门类.Cyanobacteria门类包含的7种细菌隶属于Melainabacteria、Cyanobacteria和ML635J-21等3个纲和Caenarcaniphilales、SubsectionIII、SubsectionI和Other等4个目, 以及Leptolyngbya和Phormidium等6个属, 具体见表 2.
| 表 2 锡林河流域沉积物/土壤中蓝细菌群落的全部物种分类谱系 Table 2 Sediment/soil bacterial lineages of all species affiliated to Cyanobacteria community in Xilin River basin |
28个样品中7个Cyanobacteria种群的最高相对丰度依次为Caenarcaniphilales_ub_o.o1(0.06%)、Leptoly ngbya.o2(0.17%)、Phormidium.ub3 (0.62%)、Cyanobacteria_SIII_FI_ub.o4(0.17%)、Cyanobacteria _SIII_FI_u.ub5(0.14%)、Cyanobacteria_SI_FI_o.o6(0.64%)、ML635J-21_o_o_o.o7(0.03%).其中, Phormidium.ub3和Cyanobacteria_SI_FI_o.o6的相对丰度介于0.50%~1.00%之间, 剩余5种菌相对丰度低于0.50%.
3.2 锡林河流域沉积物/土壤Cyanobacteria群落的组成、丰度及空间分布特征Cyanobacteria群落7个种群的组成及丰度差异较大(图 3), 其累积相对丰度依次为0.036%~0.052%(B1)、0.263%~0.306%(B2)、1.001%~1.123%(B3)、0~0.005%(T1)、0.022%~0.025%(T2)、0.013%~0.023%(F1)、0.014%~0.019%(F2).沿着水生的河床中心B1与河床边缘B2及牛轭湖B3, 湿生的低河漫滩F1与高河漫滩F2, 以及中生的二级阶地羊草草原T1与大针茅草原T2的环境梯度, Cyanobacteria群落整体呈先升高后下降的分布趋势.具体为Caenarcaniphilales_ub_o.o1、Leptolyngbya.o2、Phormidium.ub3、Cyanobacteria_SIII_FI_ub.o4、Cyanobacteria_SIII_FI_u.ub5、Cyanobacteria_SI_FI_o.o6主要分布在水生生境, 最大相对丰度依次为0.047%(B14)、0.166%(B33)、0.250%(B22)、0.133%(B33)、0.140%(B31)、0.644%(B32);相比之下, ML635J-21_o_o_o.o7广泛分布在水生、湿生、中生生境中, 最大相对丰度为0.025%(T21).具体而言, Caenarcaniphilales_ub_o.o1最适合生存于低氨低盐相对寡营养的湍流区B1, Phormidium.ub3最适合生存于高氨中盐相对中营养的缓流区B2, Leptolyngbya.o2、Cyanobacteria_SIII_FI_ub.o4、Cyanobacteria_SIII _FI_u.ub5和Cyanobacteria_SI_FI_o.o6最适合生存于高氨中盐相对富营养的滞流区B3, ML635J-21_o_o_o.o7适合生存于中氨高盐相对全营养的高河漫滩F2及中氨高盐相对全营养的二级阶地T1和T2中(图 3).
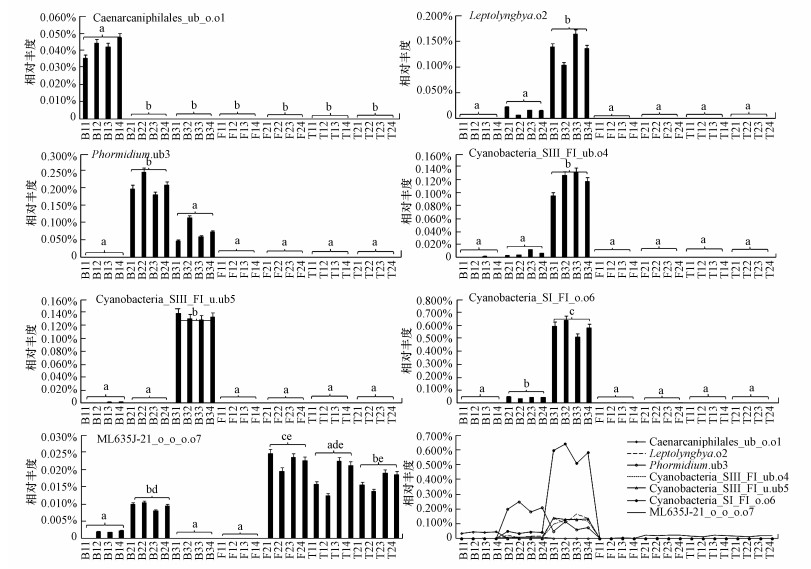 |
| 图 3 锡林河流域Cyanobacteria群落单个种群和全部种群的空间分化特征 (单因素方差分析和Tamhane′s T2检验中字母相同代表差异不显著(p>0.05);字母不同代表差异显著(p < 0.05)) Fig. 3 Spatial differentiation characteristics of single populations and total from Cyanobacteria communities in Xilin River basin |
Heatmap(图 4)显示, 高氨中盐相对中营养的缓流区B2和高氨中盐相对富营养的滞流区B3的种群相似度高且组成丰富聚为第一大类, 其中, 在相对富营养滞流区B3的相似度较高聚为一簇, 相对中营养缓流区B2的相似度较高聚为一簇.在F、T生境和相对寡营养湍流区B1的种群相似度较高且组成单一聚为第二大类, 其中, F和T生境中种群最为单一聚为一簇, 相对寡营养湍流区B1的种群略微丰富聚为一簇.Cyanobacteria群落中的Leptolyngbya.o2、Phormidium.ub3、Cyanobacteria_SIII_FI_ub.o4、Cyanobacteria_SIII_FI_u.ub5和Cyanobacteria_SI_FI_o.o6主要分布在高氨中盐相对中营养的缓流区B2和高氨中盐相对富营养的滞流区B3中, 相似度较高聚为一大类;Caenarcaniphilales_ub_o.o1只分布在低氨低盐相对寡营养的湍流区B1;ML635J-21 _o_o_o.o7主要分布在中氨高盐相对全营养的高河漫滩F2及中氨高盐相对全营养的二级阶地T1和T2中.由此可知, 锡林河流域Cyanobacteria群落存在明显的空间分化特征, 大多数种群分布在相对中富营养的缓滞区(B2和B3).
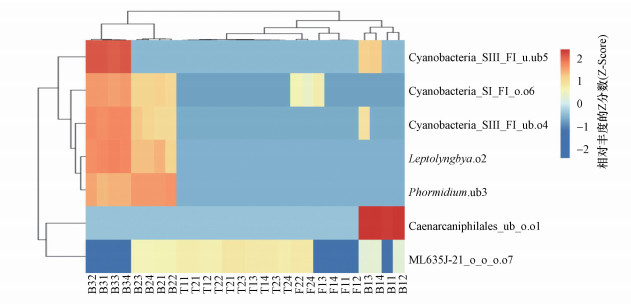 |
| 图 4 锡林河流域样品间Cyanobacteria群落不同种群的相似性 Fig. 4 Similarity analysis of different populations from Cyanobacteria communities among samples in Xilin River basin |
从Pearson相关性分析(表 3)可知, Caenarcaniphilales_ub_o.o1仅与砂粒含量呈显著正相关(p < 0.05);与盐度、pH、全氮、总有机碳和全磷呈显著负相关(p < 0.01), 与粉粒、硝态氮和氨态氮呈显著负相关(p < 0.05), 与黏粒和水分含量的相关性不显著(p>0.05).Leptolyngbya.o2、Cyanobacteria_SIII_ FI_ub.o4、Cyanobacteria_ SIII_FI_ u.ub5和Cyanobacteria_SI_FI_o.o6与总有机碳、水分和pH均呈显著正相关(p < 0.01), 与氨态氮呈显著正相关(除Cyanobacteria_SIII_FI _ u.ub5外), 与砂粒和全氮的相关系数为正, 但相关性不显著(p>0.05);与黏粒、粉粒、硝态氮、盐度和全磷的相关系数为负数, 但相关性不显著(p>0.05).Phormidium.ub3与氨态氮呈显著正相关(p < 0.01), 与砂粒、水分、硝态氮、pH和盐度的相关系数为正, 但相关性不显著(p>0.05);与黏粒、粉粒、总有机碳、全氮、全磷的相关系数为负, 但相关性不显著(p>0.05).ML635J-21_o_o_o.o7与粉粒、黏粒、盐度、硝态氮和全磷都呈显著的正相关关系(p < 0.01), 与全氮呈现显著正相关关系(p < 0.05), 与总有机碳的相关性不显著(p>0.05);与砂粒和水分呈显著的负相关关系(p < 0.01), 与氨态氮和pH的相关性不显著(p>0.05).
| 表 3 锡林河流域沉积物/土壤环境因子与Cyanobacteria不同种群之间的皮尔逊相关性 Table 3 Pearson correlations between sediment/soil environmental factors and different populations of Cyanobacteria in Xilin River basin |
RDA结果显示, 第1排序轴与第2排序轴的解释度分别为73.44%和13.60%.Leptolyngbya.o2、Cyanobacteria_SIII_FI_ub.o4、Cyanobacteria_SIII_FI_u.ub5、Cyanobacteria_SI_FI_o.o6和Phormidium.ub3主要分布在高氨中盐相对富营养的滞流区B3和高氨中盐相对中营养的缓流区B2中;Caenarcaniphilales_ub_o.o1主要分布在低氨低盐相对寡营养的湍流区B1;ML635J-21_o_o_o.o7主要分布在中氨中盐相对全营养的高河漫滩F2及中氨高盐相对全营养的二级阶地T1和T2中(图 5a).
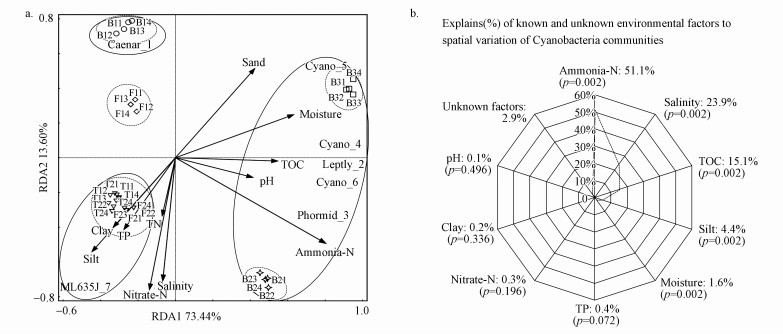 |
| 图 5 锡林河流域Cyanobacteria群落与环境因子的冗余分析(a)及环境因子的变异权重分析(b) (注: Caenar_1:Caenarcaniphilales_ub_o.o1; Leptly_2:Leptolyngbya.o2; Phormid_3:Phormidium.ub3; Cyano_4:Cyanobacteria_SIII_FI_ub.o4; Cyano_5:Cyanobacteria_SIII_FI_u.ub5; Cyano_6:Cyanobacteria_SI_FI_o.o6; ML635J_7:ML635J-21_o_o_o.o7.) Fig. 5 Redundancy analysis (RDA) of the different populations from Cyanobacteria communities and environmental factors (a) as well as variation partitioning analysis of environmental factors (b) in Xilin River basin |
变异权重分析显示, 氨态氮(Ammonia-N)的解释度最高达51.1%, 盐度(Salinity)为23.9%, 总有碳(TOC)为15.1%, 粉粒(Silt)为4.4%, 水分(Moisture)为1.6%, 蒙特尔检验显示这些环境因子的解释度均达到统计学显著性水平(p < 0.05);解释度较低的环境因子包括全磷(TP)(0.4%)、硝态氮(Nitrate-N)(0.3%)、黏粒(Clay)(0.2%)和pH(0.1%)等.已知环境因子对Cyanobacteria群落空间变异的解释度为97.1%.其中, 氨态氮、盐度、总有机碳三者的解释度高达90.1%, 占已知环境因子总解释度的92.8%, 说明氨态氮、盐度和总有机碳是影响Cyanobacteria群落空间分化的主要环境因子(图 5b).
4 讨论(Discussion) 4.1 锡林河流域Cyanobacteria群落的空间分化特征在锡林河流域发现的Leptolyngbya.o2、Phormidium.ub3、Cyanobacteria_SIII_FI_ub.o4、Cyanobacteria_SIII _FI_u.ub5和Cyanobacteria_SI_FI_o.o6主要分布在高氨中盐相对中营养的缓流区B2和高氨中盐相对富营养的滞流区B3, 该研究结果与太湖(王敏等, 2018)、滇池(吕明姬等, 2011)等富营养化湖泊引起的Cyanobacteria水华现象相似, 说明锡林河流域缓滞流区相对中富营养环境也可引起Cyanobacteria水华现象, 这使得我们对河流Cyanobacteria水华有了新的认识.Caenarcaniphilales_ub_o.o1主要分布在低氨低盐相对寡营养的湍流区B1, 这与寡营养海洋环境中光合自养微微型Cyanobacteria(秦松等, 2015)及寡营养淡水湖泊中Cyanobacteria等(Cabello-Yeves et al., 2018)能够固氮的研究结果具有相似性, 推测锡林河流域相对寡营养的湍流区沉积物Cyanobacteria可能具有固氮作用.Cyanobacteria是生物土壤结皮BSC的优势菌(Büdel et al., 2016; 2017;李靖宇等, 2018), 这为ML635J21_o_o_o.o7主要分布在中氨中盐相对全营养的高河漫滩F2及中氨高盐相对全营养的二级阶地T1和T2中的研究结果提供了理论依据, 推测锡林河流域Cyanobacteria的出现可能与形成生物土壤结皮BSC有关.简言之, 锡林河流域Cyanobacteria群落具有明显的空间分化特征, 与Leptolyngbya和Phormidium等关联的5个种群主要分布在高氨中盐相对中富营养的缓滞流区(B2和B3), 推测这5个种群可能与Cyanobacteria水华有关(吕明姬等, 2011; 王敏等, 2018);主要分布在低氨低盐相对寡营养湍流区(B1)的Caenarcaniphilales_ub_o.o1种群可能与固氮作用有关(秦松等, 2015; Cabello-Yeves et al., 2018);主要分布在中氨中盐相对全营养的高河漫滩(F2)与中氨高盐相对全营养的二级阶地(T1和T2)的ML635J21_o_o_o.o7种群可能与形成生物土壤结皮BSC有关(Büdel et al., 2016; 2017;李靖宇等, 2018).锡林河流域Cyanobacteria群落广泛分布于水生、湿生、中生环境的研究结果与Cyanobacteria广泛分布于海洋(Ferris et al., 1988)、淡水(薛银刚等, 2018)等水体及潮湿土壤(Büdel et al., 2017)和沙漠(李靖宇等, 2018)等多种环境的研究报道是一致的, 暗示Cyanobacteria群落结构功能的空间分化与环境异质性密切相关.
4.2 锡林河流域Cyanobacteria群落空间分化的环境影响因素本研究发现氨态氮是影响Cyanobacteria群落空间分化的最主要环境因子, 这与氨态氮是引起太湖蓝藻水华的主要因子(Hampel et al., 2018)的研究结果具有一致性, 也与氨态氮影响全球、区域及局域尺度上Cyanobacteria群落空间异质性的研究报道相吻合(Bahl et al., 2011; 王敏等, 2018; Özer et al., 2019).例如, 氨态氮是影响太湖西北湖区Cyanobacteria群落空间分化(王敏等, 2018)和太湖竺山湾Cyanobacteria关联浮游细菌群落结构分化(薛银刚等, 2018)的主要因素.又如, 生活污水和工业废水排放相关的氨态氮是影响土耳其安卡拉溪流Cyanobacteria关联藻类时空分化的重要因素(Özer et al., 2019).上述研究报道均为锡林河流域缓滞流区存在由氨态氮诱导的Cyanobacteria水华的研究结果提供了科学支撑.此外, 在菲律宾海域Cyanobacteria关联菌群能氧化氨, 说明Cyanobacteria是氨氧化微生物(Gajigan et al., 2018), 这为本研究发现的Cyanobacteria可能是氨氧化菌提供了科学依据.本研究发现Cyanobacteria群落大多数种群与氨态氮呈现正相关关系而与硝态氮呈现负相关关系, 说明锡林河流域Cyanobacteria群落大多数种群主要利用氨态氮而非硝态氮, 原因可能是氨态氮能调控Cyanobacteria相关调节因子NtcA与激活因子PipX之间的相互作用(Forcada-Nadal et al., 2017).这印证了氨态氮是Cyanobacteria群落大多数种群优先利用的无机氮源(Boussiba et al., 1991).
本研究发现盐度也是影响Cyanobacteria群落空间分化的主要环境因子.一些研究通过模型推理认为Cyanobacteria起源于海洋环境(Nakov et al., 2017), 也有一些现代分子进化研究认为Cyanobacteria起源于太古界的淡水环境(Herrmann et al., 2019), 相当多的研究证明Cyanobacteria作为盐驯化的模式生物能适应不同的盐度梯度(Hagemann et al., 2016; Nakov et al., 2017; Herrmann et al., 2019).简言之, 盐度是影响Cyanobacteria群落时空分化的重要因子.这支持本文关于盐度是影响锡林河流域Cyanobacteria群落空间分化主要因子的研究结果.具体而言, 主要分布在高盐相对全营养土壤环境中的ML635J21_o_o_o.o7与盐度呈现显著的正相关关系(p < 0.01), 这与盐渍化程度是调控土壤Cyanobacteria群落结构与丰度的核心环境因子(李寒等, 2015)的结论具有一致性.主要分布在水生环境中的Cyanobacteria群落的6个种群(除Phormidium.ub3外)都与盐度呈现负相关关系, 这与太湖和洋河盐度负向调控Cyanobacteria群落时空变化(Jia et al., 2018)的研究结果具有一致性.简言之, 中生环境和水生环境中的盐度因子对Cyanobacteria群落空间分化分别有正向和负向调控作用.
本研究基于Pearson相关性分析发现, 相对富营养化环境中的Cyanobacteria优势种群与总有机碳呈正相关关系, 原因可能是牛轭湖中大量繁殖的Cyanobacteria释放出大量的溶解性有机碳导致水体中总有机碳增加(叶琳琳等, 2011).Cyanobacteria主导的加利福尼亚蒙特利湾埃尔克霍恩泥沼Cyanobacteria相关生物优先利用含有α或β-1, 4糖苷键的葡聚糖(Stuart et al., 2016), 说明碳源类型是影响Cyanobacteria群落结构及功能分化的重要因素.此外, 内蒙古高原半干旱典型草原区是我国畜牧业的主战场, 横贯内蒙古高原半干旱典型草原区的锡林河是牲畜重要的水源地和活动热区.牲畜粪尿在锡林河缓滞流区富集可能是导致有机碳增加及Cyanobacteria快速繁殖的重要因素.
富营养化的浅水型湖泊Cyanobacteria与硝酸盐呈负相关关系, 与pH呈正相关关系, 对全氮和全磷的响应很弱(Cremona et al., 2018), 这与本研究结果高度一致.本研究发现, 优先分布在相对富营养滞流区的Cyanobacteria与硝态氮总体呈现负相关关系, 与pH呈现正相关关系, 与全氮和全磷的相关性不显著.通过宏基因组测序证明土壤结皮中Cyanobacteria主要利用硝态氮进行反硝化作用(李靖宇等, 2018), 这与本研究主要分布在中氨高盐相对全营养土壤环境中的ML635J21 _o_o_o.o7与硝态氮呈显著正相关关系(p < 0.01)的结果是一致的.
5 结论(Conclusions)1) 锡林河流域Cyanobacteria群落具有明显的空间分化特征.其中, Leptolyngbya和Phormidium等关联的5个种群分布在高氨中盐相对中营养的河边缓流区及相对富营养的牛轭湖滞流区;Caenarcaniphilales_ub_o.o1种群分布在低氨低盐相对寡营养的湍流区;ML635J21 _o_o_o.o7种群分布在中氨中高盐相对全营养的高河漫滩及二级阶地土壤.
2) 锡林河流域Cyanobacteria群落大多数种群与氨态氮、总有机碳和水分等存在正相关关系;主要分布在湍流区的Caenarcaniphilales_ub_o.o1种群仅与砂粒存在正相关关系;主要分布在土壤环境的ML635J21 _o_o_o.o7种群与黏、粉粒、盐度和硝态氮等存在正相关关系.简言之, 氨态氮、盐度、总有机碳等环境因子的变化与锡林河流域Cyanobacteria群落结构的空间分化密切相关.
3) 锡林河流域Cyanobacteria群落大多数种群分布在牲畜粪尿相对集中的高氨中富营养化缓滞流区, 与水华形成有关;少数种群分布在低氨低盐相对寡营养的湍流区, 可能与固氮作用有关;少数种群分布在中氨中高盐相对全营养的高河漫滩及二级阶地土壤, 可能与形成生物土壤结皮有关.
Bahl J, Lau M C Y, Smith G J D, et al. 2011. Ancient origins determine global biogeography of hot and cold desert cyanobacteria[J]. Nature Communications, 2(1): 163. DOI:10.1038/ncomms1167 |
鮑士旦. 2002. 土壤农化分析[M]. 第3版. 北京: 中国农业出版社.
|
Boussiba S, Gibson J. 1991. Ammonia translocation in cyanobacteria[J]. FEMS Microbiology Reviews, 8(1): 1-14. |
Büdel B, Dulic' T, Darienko T, et al. 2016. Cyanobacteria and Algae of Biological Soil Crusts[M]. Berlin: Springer International Publishing.
|
Büdel B, Williams W J, Reichenberger H.2017.Annual net primary productivity of a cyanobacteria dominated biological soil crust in the Gulf savanna, Queensland, Australia[J].Biogeosciences Discussions, DOI: 10.5194/bg-2017-374
|
Cabello-Yeves P J, Antonio P, Antonio C, et al. 2018. Ecological and genomic features of two widespread freshwater picocyanobacteria[J]. Environmental Microbiology, 20(10): 3757-3771. |
陈佐忠. 1988. 锡林河流域地形与气候状况, 草原生态系统研究(第三集)[M]. 北京: 科学出版社.
|
Cremona F, Tuvikene L, Haberman J, et al. 2018. Factors controlling the three-decade long rise in cyanobacteria biomass in a eutrophic shallow lake[J]. Science of the Total Environment, 621(15): 352-359. |
Ferris M J, Palenik B. 1998. Niche adaptation in ocean cyanobacteria[J]. Nature, 396(6708): 226-228. |
Forcada-Nadal A, Palomino-Schätzlein M, Neira J L, et al. 2017. The PipX protein, when not bound to its targets, has its signaling C-Terminal helix in a flexed conformation[J]. Biochemistry, 56(25): 3211-3224. |
Gajigan A P, Yñiguez A T, Villanoy C L, et al. 2018. Diversity and community structure of marine microbes around the Benham Rise underwater plateau, northeastern Philippines[J]. Peerj, 6(3): e4781. |
Hagemann M.2016.Coping with High and Variable Salinity: Molecular Aspects of Compatible Solute Accumulation[M].Berlin: Springer International Publishing.359-372
|
Hampel J J, Mccarthy M J, Gardner W S, et al. 2018. Nitrification and ammonium dynamics in Taihu Lake, China:seasonal competition for ammonium between nitrifiers and cyanobacteria[J]. Biogeosciences, 15(3): 733-748. |
Herrmann A J, Gehringer M M.2019.An investigation into the effects of increasing salinity on photosynthesis in freshwater unicellular cyanobacteria during the late Archaean[J].Geobiology, 17(1), DOI: 10.1111/gbi.12339
|
虎瑞, 王新平, 潘颜霞, 等. 2016. 沙坡头地区生物土壤结皮-土壤系统生长季氮矿化动态[J]. 中国沙漠, 36(1): 174-180. |
Ishiura N U A J, Kutsuna S, Aoki S, et al. 1998. Expression of a gene cluster kaiABC as a circadian feedback process in cyanobacteria (see comments)[J]. Science, 281(5382): 1519-1523. |
Jia J, Chen Q, Wang M, et al. 2018. The production and release of microcystin related to phytoplankton biodiversity and water salinity in two cyanobacteria blooming lakes[J]. Environmental Toxicology & Chemistry, 37(9): 2312-2322. |
Lesser M P, Mazel C H, Gorbunov M Y, et al. 2004. Discovery of Symbiotic nitrogen-fixing cyanobacteria in corals[J]. Science, 305(5686): 997-1000. |
李寒, 张晓黎, 郭晓红, 等. 2015. 滨海盐渍化土壤中蓝细菌多样性及分布[J]. 微生物学通报, 42(5): 957-967. |
李靖宇, 刘建利, 张琇, 等. 2018. 腾格里沙漠东南缘藓结皮微生物组基因多样性及功能[J]. 生物多样性, 26(7): 727-737. |
吕明姬, 汪杰, 范铮, 等. 2011. 滇池浮游细菌群落组成的空间分布特征及其与环境因子的关系[J]. 环境科学学报, 31(2): 299-306. |
Nakov T, Boyko J D, Alverson A J, et al. 2017. Models with unequal transition rates favor marine origins of cyanobacteria and photosynthetic eukaryotes[J]. Proceedings of the National Academy of Sciences of the United States of America, 114(50): 10606-10607. |
Özer T, Erkaya I A, Koçer M A T, et al. 2019. Spatial and temporal variations in composition of algae assemblages with environmental variables in an urban stream (Ankara, Turkey)[J]. Environmental Monitoring & Assessment, 191(6): 1-14. |
Preston T, Stewart W D P, Reynolds C S. 1980. Bloom-forming cyanobacterium Microcystis aeruginosa overwinters on sediment surface[J]. Nature, 288(5789): 365-367. |
秦松, 李佳霖. 2015. 海洋微微型蓝细菌分子生态学研究进展[J]. 地球科学进展, 30(4): 477-486. |
Rasmussen B, Fletcher I R, Brocks J J, et al. 2008. Reassessing the first appearance of eukaryotes and cyanobacteria[J]. Nature, 455(7216): 1101-1104. |
Rippin M, Borchhardt N, Williams L, et al. 2018. Genus richness of microalgae and cyanobacteria in biological soil crusts from Svalbard and Livingston Island:morphological versus molecular approaches[J]. Polar Biology, 41(5): 909-923. |
Stuart R K, Mayali X, Lee J Z, et al. 2016. Cyanobacterial reuse of extracellular organic carbon in microbial mats[J]. The ISME Journal, 10(5): 1240-1251. |
Summons R E, Jahnke L L, Hope J M, et al. 1999. 2-Methylhopanoids:biomarkers for cyanobacteria and for oxygenic photosynthesis[J]. Nature, 23: 554-557. |
王敏, 张建云, 陈求稳, 等. 2018. 太湖西北湖区2003-2012年间氮磷浓度及浮游植物主要类群变化趋势分析[J]. 生态学报, 39(1): 164-172. |
Wei Y, Yang W, Simon T W, et al. 2018. Selective control of cyanobacteria by a combined method of sonication and modified clay:an enclosure study[J]. Fundamental & Applied Limnology, 191(3): 199-212. |
Xu M, Kathe S, Goodrich-Blair H, et al. 1990. Bacterial origin of a chloroplast intron:conserved self-splicing group I introns in cyanobacteria[J]. Science, 250(4987): 1566-1570. |
薛银刚, 刘菲, 孙萌, 等. 2018. 太湖竺山湾春季浮游细菌群落结构及影响因素[J]. 环境科学, 39(3): 1151-1158. |
叶琳琳, 史小丽, 吴晓东, 等. 2011. 西太湖秋季蓝藻水华过后细胞裂解对溶解性有机碳影响[J]. 中国环境科学, 31(1): 131-136. |
于景丽, 夏晶晶, 李传虹, 等. 2020. 锡林河流域Nitrospira的生态位分化及环境驱动力[J]. 微生物学通报, 47(5): 1418-1429. |
Zhu Y G, Zhao Y, Li B, et al. 2017. Continental-scale pollution of estuaries with antibiotic resistance genes[J]. Nature Microbiology, 2(4): 1806-1809. |
 2020, Vol. 40
2020, Vol. 40


