离子液体是绿色溶剂的代表之一, 研究发现, 许多离子液体具有可吸收CO2的性能, 但同时都存在一些不足.以咪唑类为主的常规离子液体在常温常压下对CO2的吸收量较小, 不利于工程实际应用;聚合物离子液体和负载型离子液体在吸收CO2的过程中, 黏度会随着吸附量的增加而变大, 不利于CO2传质.胺基功能型离子液体与常规离子液体相比, 不仅具有熔点低、热稳定性高和结构可调等特性, 而且具有更高的CO2吸收性能, 因而成为捕集CO2的重要研究对象(于荣等, 2009;夏裴文等, 2019).研究显示, 胺基功能化离子液体吸收CO2是通过胺基—NH2与CO2反应生成—NH2+COO-(Xu et al., 2011), 因此, 理论上, 离子液体所含胺基越多, 其捕集CO2的量越大.杨旗等(2016)的研究表明, 阴离子相同的三乙烯四胺离子液体捕集CO2的量明显高于二乙烯三胺离子液体捕集CO2的量.然而, 胺基数越多离子液体粘度越大, 其吸收CO2的传质推动力下降, 进而会影响离子液体的CO2吸收容量和达到吸收平衡所需要的时间(代成娜等, 2015).为了降低多胺基离子液体的黏度, 许多研究者采用将离子液体添加到助溶剂中的方法.例如, 张慧等(2016)的实验结果表明, 胺基离子液体[NH2e-mim]Br、[NH2p-bmim]Br、[NH2e-mim]BF4、[NH2p-bmim]BF4在纯溶剂状态下的CO2吸收容量为0.2~0.3 mol · mol-1, 在水溶液状态下为0.4~0.5 mol · mol-1.胡辉等(2014)构成的[TETAH]+[BF4]--H2O混合体系在含水率为40%时, 其对CO2的吸收容量由纯离子液体时的0.96 mol · mol-1提高到2.04 mol · mol-1.
由于水的比热容和蒸发潜热大, 离子液体-H2O混合体系吸收CO2后的再生能耗偏大, 为此, 研究者选择比热容较小的溶剂代替水.陈阳等(2017)的研究表明, 离子液体-聚乙二醇混合体系中的聚乙二醇不仅作为助溶剂, 而且还参与离子液体吸收CO2的过程, 从而提高了离子液体对CO2的吸收容量.王占丽等(2013)将离子液体[N2222][Ala]、[N2222][Ser]和甲基二乙醇胺(MDEA)混合, 发现离子液体浓度为10%时, 混合体系的CO2吸收量增加了8.63%.Saleem等(2017)配制了30%MDEA+30%PZ(哌嗪)+10%[bmim][AC]+30%水的混合体系, 发现该混合体系的CO2吸收容量达到1.84 mol · mol-1, 比MDEA水溶液增加了0.72 mol · mol-1;同时, 选择有机溶剂替代水还能提高混合体系的再生性能.Liu等(2019)用聚乙二醇(PEG200)替代混合体系[Cho][Gly]/H2O中的部分溶剂水配制成了含30%PEG200的[Cho][Gly]/H2O/PEG200混合体系, 该研究表明, 混合体系[Cho][Gly]/H2O/PEG200的再生性能显著优于[Cho][Gly]/H2O混合体系.然而, Hussen等(2010)实验表明, 离子液体含水率的增加会导致其CO2吸收容量降低, 这表明离子液体与助溶剂之间需要一个适当的比例.
本研究在合成离子液体[TETAH]+[BF4]-并与乙二醇(EG)构成[TETAH]+[BF4]--EG混合体系的基础上, 开展不同离子液体浓度、温度和气体流量等条件下, [TETAH]+[BF4]--EG混合体系吸收CO2性能及再生性能的实验研究.
2 实验部分(Experimental) 2.1 离子液体的合成与纯化本文采用一步合成法(Hu et al., 2014), 即取一定量的三乙烯四胺(TETA)至烧瓶中, 用无水乙醇稀释至60%, 在15 ℃水浴条件下强烈搅拌;然后称取相同质量的氟硼酸(HBF4), 用无水乙醇稀释至60%, 加入到滴液漏斗中, 控制滴液滴入烧瓶的速度;滴定结束后继续在水浴中搅拌12 h, 待反应完全后用乙醚萃取;最后在70 ℃下采用N2吹扫和减压蒸馏相结合的方法进行纯化, 得到目标离子液体[TETAH]+[BF4]-.实验所使用的试剂包括氟硼酸(HBF4, 分析纯)、三乙烯四胺(TETA)、无水乙醇、乙醚(分析纯)、乙二醇(EG, 分析纯).
2.2 混合体系吸收性能评价方法 2.2.1 实验装置及实验方法本文采用如图 1所示的实验装置(Hu et al., 2014), 开展混合体系[TETAH]+[BF4]--EG吸收CO2的性能评价.该实验装置由气体传输系统、CO2吸收系统与尾气吸收排放系统三部分组成.
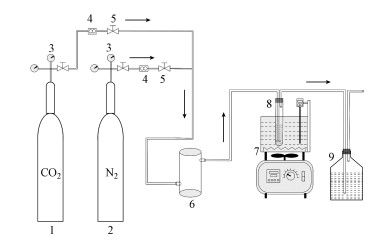 |
| 图 1 混合体系吸收CO2实验装置(1.CO2气罐, 2.N2气罐, 3.减压阀, 4.转子流量计, 5.阀门, 6.缓冲室, 7.恒温水浴锅, 8.吸收管, 9.尾气吸收瓶) Fig. 1 Experiment equipment of CO2 absorption by ionic liquid |
按照表 1的实验条件, 开展[TETAH]+[BF4]--EG混合体系吸收CO2性能的实验研究.实验前采用粘度计(上海加内特机电设备有限公司, NDJ-5S)测量[TETAH]+[BF4]-和EG的粘度.实验时先按设计实验条件把水浴温度调至实验温度, 配置一定浓度的离子液体-EG混合体系, 并把混合体系装入吸收管内, 在万分之一的电子天平(德国赛多利斯公司, TE124S)上称重记录, 然后把吸收管置于水浴中, 通入N2(99.99% N2)来检查整个气路装置的气密性, 排除气体输送系统和吸收装置内的空气, 30 min之后停止通入N2并开始通入CO2进行吸收实验.每吸收5 min后取出吸收管, 用吸水滤纸擦干后称重记录.称重后将吸收管放回气路中继续进行吸收实验并循环上述步骤, 待前后两次质量不变时, 表明离子液体[TETAH]+[BF4]--EG混合体系对CO2的吸收达到饱和.期间气路中持续通入CO2, 待实验结束后关闭.
| 表 1 [TETAH]+[BF4]--EG混合体系吸收CO2的实验条件 Table 1 Experimental conditions of CO2 absorption in [TETAH]+[BF4]--EG mixed solvent |
采用重量法来测量离子液体的CO2吸收能力, 评价指标为CO2吸收摩尔分率x(式(1)).x值越大, 表明离子液体对CO2的吸收容量越大.
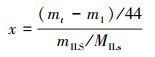
|
(1) |
式中, x为CO2吸收摩尔分率(mol · mol-1);m1为吸收装置的初始质量(g);mt为t时刻吸收装置的质量(g);mILs为离子液体的质量(g);MILs为离子液体的分子量.
2.3 混合体系的循环再生在离子液体[TETAH]+[BF4]-的浓度为20%, 吸收温度为15 ℃, 气体流量为200 mL · min-1的条件下进行吸收实验, 吸收饱和后, 在80 ℃水浴条件下用流量为200 mL · min-1的N2吹扫, 将CO2从离子液体中脱附出来, 再次进行吸收实验, 依次循环, 进行5次吸收-解吸循环实验, 考察[TETAH]+[BF4]--EG混合体系的循环再生性能.
3 结果与讨论(Results and discussion) 3.1 离子液体[TETAH]+[BF4]-和助溶剂乙二醇吸收CO2的基本特性分别在实验1、实验2条件下开展了助溶剂乙二醇EG和离子液体[TETAH]+[BF4]-吸收CO2的实验研究, 结果如图 2所示.从图 2可知, 随着时间的推移, EG吸收CO2的容量呈缓慢增长趋势, 大约在120 min时达到了吸收平衡, 此时EG的吸收容量为0.021 mol · mol-1;同理, 随着时间的推移, [TETAH]+[BF4]-吸收CO2的容量则呈快速增长趋势, 大约在190 min时, 离子液体[TETAH]+[BF4]-对CO2的吸收达到平衡, 此时[TETAH]+[BF4]-对CO2的吸收容量为0.13 mol · mol-1.由此可见, 纯EG和[TETAH]+[BF4]-对CO2的吸收容量均很小, 尤其是助溶剂EG.另外, 从EG和[TETAH]+[BF4]-吸收CO2达到平衡的时间看, EG所需的时间比[TETAH]+[BF4]-短得多, 其原因是25 ℃时纯离子液体的黏度(12861 mPa · s)约是乙二醇(363 mPa · s)的10倍, 导致离子液体吸收CO2的传质推动力比EG小.
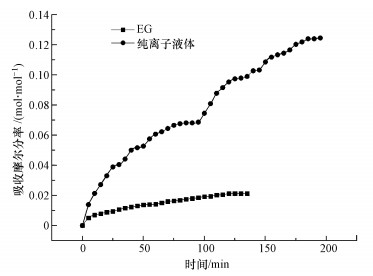 |
| 图 2 实验1、实验2条件下EG和[TETAH]+[BF4]-的CO2吸收容量随时间的变化曲线 Fig. 2 Curve of CO2 absorption capacity of EG and [TETAH]+[BF4]- with time under Expt.1 and Expt.2 conditions |
图 3是在实验3条件下, [TETAH]+[BF4]-浓度对混合体系[TETAH]+[BF4]--EG吸收CO2性能的影响, 图中a~e处分别表示离子液体达到吸收平衡所需的时间.由图 3可知, 随着混合体系中[TETAH]+[BF4]-浓度的增加, 混合体系[TETAH]+[BF4]--EG吸收CO2的容量呈减少趋势, 从[TETAH]+[BF4]-浓度为20%时的1.13 mol · mol-1下降到60%时的0.84 mol · mol-1, 下降幅度达到25.7%.另外, 随着吸收时间的延长, 不管哪一种浓度的离子液体, 其对CO2的吸收容量均呈快速上升的趋势, 尤其在开始吸收的60 min期间.然而, 从图 3还可知, 离子液体的浓度不同, 混合体系达到吸收平衡的时间也存在差异.这表明离子液体的浓度不仅影响混合体系吸收CO2的容量, 还影响其吸收CO2的速率和达到吸收平衡的时间.
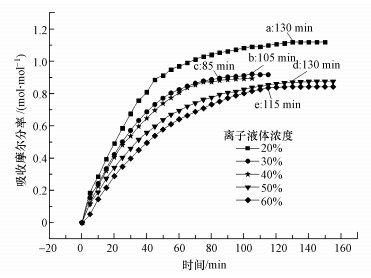 |
| 图 3 实验3条件下[TETAH]+[BF4]--EG混合体系吸收CO2的吸收曲线 Fig. 3 Absorption curve of CO2 absorption in [TETAH]+[BF4]--EG mixed solvent under Expt.3 condition |
结合图 2所示的[TETAH]+[BF4]-和EG单独对CO2的吸收容量可知, 一定浓度的[TETAH]+[BF4]-与EG混合后, 均显著提高了其对CO2的吸收容量, 而且达到吸收平衡的时间与纯离子液体相比均缩短, 即助溶剂改善了离子液体的CO2吸收性能.这种现象暗示离子液体与助溶剂之间存在某种协同作用, 这种协同作用大大提高了[TETAH]+[BF4]--EG混合体系对CO2的吸收容量.
3.3 气体流量对混合体系吸收CO2性能的影响压力是影响溶剂吸收气体容量的因素之一, 为此, 本文开展了实验4条件下混合体系[TETAH]+[BF4]--EG对CO2吸收性能的影响, 结果如图 4所示.从图 4可知, 随着气体流量的增加, 混合体系[TETAH]+[BF4]--EG吸收CO2的吸收容量呈上升趋势, 当气体流量从50 mL · min-1增加到200 mL · min-1时, 混合体系对CO2的吸收容量从0.97 mol · mol-1上升到1.13 mol · mol-1.这表明在一定的气体流量范围内, 增加气体流量有利于CO2的吸收, 其原因是吸收容器体积一定时, 气体流量的增大增加了吸收容器内CO2的分压, 增大了CO2在气液两相间的传质推动力, 从而提高了混合体系的吸收容量和吸收速率.
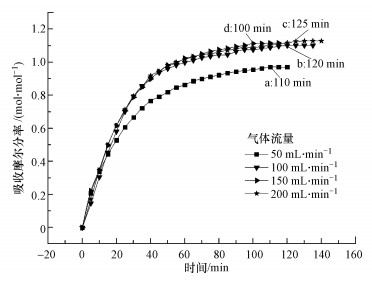 |
| 图 4 实验4条件下[TETAH]+[BF4]--EG混合体系吸收CO2的吸收曲线 Fig. 4 Absorption curve of CO2 absorption in [TETAH]+[BF4]--EG mixed solvent under Expt.4 condition |
由于温度是影响气体在吸收溶剂中溶解度的关键因素之一, 为此开展了实验5条件下, 吸收温度对混合体系[TETAH]+[BF4]--EG吸收CO2性能影响的实验研究, 结果如图 5所示.由图 5可知, 随着吸收温度的升高, 混合体系[TETAH]+[BF4]--EG吸收CO2的容量呈快速下降趋势, 当吸收温度为15 ℃时, 该混合体系的吸收容量为1.50 mol · mol-1;当吸收温度为55 ℃时, 混合体系的吸收容量仅为0.49 mol · mol-1.由此可见, 当吸收温度从15 ℃升高到55 ℃时, 该混合体系的吸收容量从1.50 mol · mol-1下降到0.49 mol · mol-1, 下降幅度达到67.3%.这表明温度越低越有利于提高该混合体系对CO2的吸收容量, 其原因是CO2与含胺基离子液体间的反应为酸碱中和反应, 该反应过程放热, 因此, 降低温度有利于反应的进行.
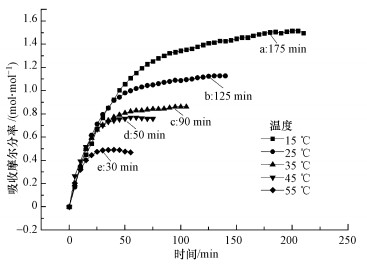 |
| 图 5 实验5条件下[TETAH]+[BF4]--EG混合体系吸收CO2的吸收曲线 Fig. 5 Absorption curve of CO2 absorption in [TETAH]+[BF4]--EG mixed solvent under Expt.5 condition |
此外, 从图 5还可以看出, 随着温度的增加, 混合体系达到吸收饱和所需的时间越短, 这是由于升高温度增加了反应活化分子数, 使有效碰撞增加, 反应速率加快, 因此, 混合体系达到吸收平衡的时间也明显缩短.
3.5 混合体系的再生性能为了考察[TETAH]+[BF4]--EG混合体系解吸再生之后的吸收能力, 对该离子吸收液进行了5次吸收-解吸循环实验, 实验结果如图 6所示.由图 6可以看出, 混合体系在第一次吸收时吸收效果最好, 其吸收摩尔分率为1.50 mol · mol-1, 混合体系的吸收性能随着再生次数的增加而下降.吸收性能下降的原因可能是:解吸过程中造成了离子液体的损失, 使离子液体总体含量减小;其次, 混合体系中的CO2未能完全解吸出来, 导致吸收率降低.混合体系经过5次吸收-解吸循环实验后的吸收摩尔分率为1.00 mol · mol-1, 性能下降仅为33.3%, 且再生温度低, 仅为80 ℃, 说明其再生性能良好.另外, 乙二醇在80 ℃下的比热容仅为2.786 kJ · kg-1 · K-1, 相比于水的4.2 kJ · kg-1 · K-1较低, 且不像水一样有蒸发潜热, 由此可说明乙二醇作助溶剂的混合体系再生能耗低, 具有优越性.
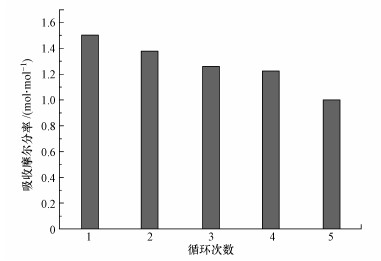 |
| 图 6 实验6条件下[TETAH]+[BF4]--EG混合体系再生后吸收CO2性能 Fig. 6 Histogram of CO2 absorption after regeneration of [TETAH]+[BF4]--EG mixed solvent under Expt.6 condition |
通过开展混合体系[TETAH]+[BF4]--EG在不同条件下吸收CO2性能的实验研究, 发现该混合体系对CO2具有良好的吸收性能.当离子液体[TETAH]+[BF4]-的浓度为20%, 吸收温度为15 ℃, 气体流量为200 mL · min-1时, 该混合体系的吸收容量可达1.50 mol · mol-1, 远高于[TETAH]+[BF4]-和EG单独吸收CO2的容量.同时, 离子液体的浓度、CO2气体流量和吸收温度均影响该混合体系达到吸收平衡的时间与CO2吸收容量.在一定范围内, 降低温度、增大气体流量、降低离子液体浓度均能提高混合体系的CO2吸收容量, 但降低温度会增加其达到吸收平衡所需的时间.因此, 在实际应用中可通过控制该混合体系的吸收条件来控制其CO2吸收容量和吸收所需时间, 使混合体系吸收CO2在最经济的状态下进行.
另外, 该混合体系再生性能良好, 在80 ℃的条件下经过5次吸收-解吸循环实验后的吸收摩尔分率为1.00 mol · mol-1.由此可见, 乙二醇是一种优良的助溶剂, 它既可以提高离子液体对CO2的吸收容量, 又可以使形成的混合体系[TETAH]+[BF4]--EG在低能耗条件下拥有良好的再生性能.因此, 混合体系[TETAH]+[BF4]--EG具有很好的工业应用潜力.
Chen Y, Hu H. 2017. Carbon dioxide capture by diethylenetriamine hydrobromide in nonaqueous solvents and phase-change formation[J]. Energy&Fuels, 31(5): 5363-5375. |
代成娜, 项银, 雷志刚. 2015. 规整填料塔中离子液体吸收CO2的传质与流体力学性能[J]. 化工学报, (8): 2953-2961. |
Hui H, Fang L, Qi X, et al. 2014. Research on influencing factors and mechanism of CO2 absorption by poly-amino-based ionic liquids[J]. International Journal of Greenhouse Gas Control, 31: 33-40. DOI:10.1016/j.ijggc.2014.09.021 |
Husson P, Pison L, Jacquemin J, et al. 2010. Influence of water on the carbon dioxide absorption by 1-ethyl-3-methylimidazoliumbis (trifluoromethylsulfonyl) amide[J]. Fluid Phase Equilib, 294: 98-104. DOI:10.1016/j.fluid.2010.02.021 |
Liu S D, Li H, Chen Y F, et al. 2019. Improved CO2 separation performance of aqueous choline-glycine solution by partially replacing water with polyethylene glycol[J]. Fluid Phase Equilibria, 495: 12-20. DOI:10.1016/j.fluid.2019.05.006 |
Saleem N K, Sintayehu M H, Zakaria M, et al. 2017. Thermophysical properties of concentrated aqueous solution of N-methyldiethanolamine (MDEA), piperazine (PZ), and ionic liquids hybrid solvent for CO2 capture[J]. Journal of Molecular Liquids, 3(229): 221-229. |
王占丽, 徐凡, 邢小林, 等. 2013. 功能化离子液体-MDEA复配体系吸收CO2[J]. 化工进展, 32(2): 394-399. |
Xu Z M, Zhang Z F, Hua J, et al. 2011. Carbon dioxide capture by a dual amino ionic liquid with amino-functionalized imidazolium cation and taurine anion[J]. International Journal of Greenhouse Gas Control, 5: 628-633. DOI:10.1016/j.ijggc.2011.05.014 |
夏裴文, 丁保宏, 张鹏军, 等. 2019. 离子液体及其吸收机理的研究进展[J]. 应用化工, 48(6): 1469-1473. DOI:10.3969/j.issn.1671-3206.2019.06.048 |
杨旗, 胡辉, 夏琪, 等. 2016. γ-Al2O3负载型多胺基离子液体对CO2的吸附特性[J]. 应用化工, 45(1): 1-6. |
于荣, 宋宝华. 2009. 二氧化碳捕集技术发展动态研究[J]. 中国环保业, (10): 27-30. |
张慧, 张红梅, 沈锦优, 等. 2016. 胺基功能型离子液体吸收CO2的性能[J]. 化工学报, (12): 5057-5065. |
 2020, Vol. 40
2020, Vol. 40


