为减少进入水环境的污染物总量, “水十条”明确要求全国敏感区域(重点湖泊、重点水库、近岸海域汇水区域)污水处理厂出水应达到国标一级A标准, 尤其需严格控制出水中磷的含量(< 0.5 mg·L-1)以降低富营养化发生的风险(国务院, 2015).此外, 部分省市基于当地水环境状况, 制定了更为严格的地方标准.例如, 北京市京标A中要求出水TP浓度需达到 < 0.2 mg·L-1(北京市环境保护局等, 2012).可见, 执行较为严格的磷排放标准将是我国改善和保持水体环境的必然选择和未来常态, 同时, 也是对污水处理工艺研发和运行管理优化的刺激动力.就目前污水处理厂除磷工艺而言, 强化生物除磷(EBPR)是世界范围内应用最为广泛且最为经济的除磷工艺.依靠聚磷菌(PAOs, 目前普遍认为以Accumulibacter菌(A菌)为主)在厌氧和好氧条件下(动态有机物丰富-匮乏(Feast-Famine)环境)交替运行, 利用污水中存在的挥发性脂肪酸(VFAs)作为碳源在厌氧环境下充分释磷, 以实现好氧/缺氧吸磷, 最终以富磷污泥形式排出系统, 从而达到除磷之目的(郝晓地, 2006).荷兰的实际运行经验表明, 一个运行良好的EBPR系统, 在不添加化学试剂情况下可以轻松实现出水TP < 0.1 mg·L-1(Blackall et al., 2002; Melia et al., 2017).然而, EBPR的运行稳定性和可靠性常常取决于可获得的进水碳源(VFAs)总量, 为获得可靠的生物除磷效果, 进水COD/TP应>40, 同时, 厌氧区VFAs(COD)浓度应>25 mg·L-1(Park et al., 2019).鉴于我国市政污水进水COD普遍偏低(< 300 mg·L-1), 进水VFAs含量更低(< 10 mg·L-1)的现状(蔡健明等, 2009), 仅仅依靠生物除磷似乎难以达到目前规定的出水排放标准.
在此情形下, 面对日益严格的排放标准, 国内既有污水处理厂升级改造工艺多以投加碳源满足生物脱氮需要, 以投加化学药剂实现化学除磷(郝晓地等, 2018).投加化学药剂方法固然可以奏效, 但会导致运行成本增加, 也有悖于节能减排的可持续发展目标.为此, 有人寄希望于通过EBPR工艺内部持续改进和优化, 最大程度地发挥EBPR工艺特点, 以实现同步生物脱氮除磷.
现代分子生物技术的不断进步让人们对活性污泥群落结构有了更加微观的认识, 其中, 一种具有聚磷能力的新PAOs菌群—Tetrasphaera菌(T菌)被陆续检测并成功鉴别.在丹麦的污水处理厂中, T菌丰度远远大于传统认知的A菌(其丰度分别为35%和17%)(Nguyen et al., 2011; Mielczarek et al., 2013).目前, 大量研究已经证明了T菌在EBPR中作为PAOs的除磷作用(Kong et al., 2005; Mckenzie et al., 2006; Nguyen et al., 2011; Kristiansen et al., 2013).借助拉曼光谱(Raman Micro-Spectroscopy)原位定量多聚磷酸盐(Poly-P)检测技术, 研究人员发现T菌在丹麦部分污水处理厂中对磷去除的贡献与A菌旗鼓相当(Fernando et al., 2019).况且, 与A菌倾向于只利用VFAs作为碳源进行生物除磷代谢相比, T菌更倾向于利用葡萄糖、蛋白质、氨基酸等大分子有机物进行生物除磷代谢.可见, T菌这一生物代谢特性对低VFAs污水似乎具有一定的生物除磷优势(Marques et al., 2017).对此, 部分学者呼吁应重新审视已有的基于A菌的生物除磷模型, 正视T菌在EBPR中的作用和贡献.
然而, 目前对T菌的研究和认识仍然处于探索和研究阶段, 已有的认识和信息并不足以支持上述实验发现和观点认识.另外, T菌代谢路径较为复杂且易受环境条件影响, 在实际污水处理厂中能否稳定、持续发挥其除磷代谢功能依然模糊.鉴于此, 本文着眼于T菌在生物除磷方面的特异性表现, 总结有关T菌的最新研究进展(包括菌群鉴别、种群分类、存在丰度及代谢机理), 分析可能影响T菌存在及代谢的环境因素, 以引导对T菌的理性认识.
2 T菌发现及认识历程(Discovery and cognitive process of Tetrasphaera)对T菌的研究要比A菌晚得多.对T菌门类的报道最早可追溯至1994年(Wagner et al., 1994), 但对T菌的重要认知也仅仅是近十年的事情.综合T菌发现和认识历程, 其研究可大致分为如图 1所示的3个阶段:①菌群鉴别与分类; ②菌群丰度检测及除磷能力辨析; ③生理学及代谢研究(Nguyen et al., 2011; Marques et al., 2017).
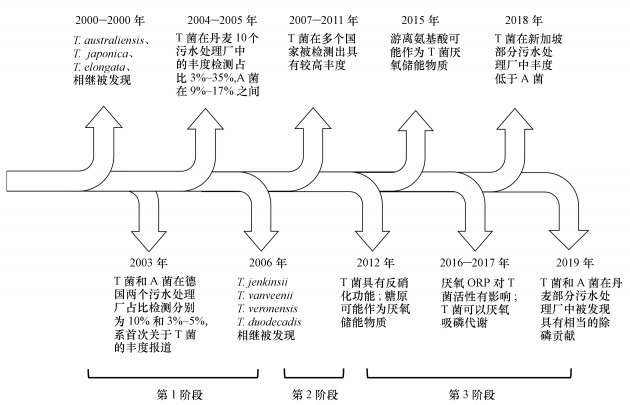 |
| 图 1 T菌研究历程 Fig. 1 Timeline of research on Tetrasphaera |
德国的Wagner等(1994)在研究EBPR时发现, HGC探针所指向的目标门类表现出了聚磷特性, 且生物量最高可占总生物量的36%, 平均丰度为4%~36%, 而传统A菌平均丰度仅为3%~32%.随后的研究表明, HGC探针的目标菌落门类大都属于T菌(当时称之为Actinobacteria门)菌属(Kong et al., 2004; 2008).然而, 当时对PAOs的研究主要集中于A菌, 所以, 此次发现并没有引起过多的关注.直到澳洲的Maszenan等(2000)从活性污泥中分离出两株具有聚磷功能的革兰氏阳性菌, 即Ben 109T和Ben 110(同为一种菌), 并借助16S rRNA基因测序技术进行了分析.结果显示, 这两株菌并不属于已知的Actinobacteria门下任一菌属, 故将其与日本的Kataoka等(1996)分离并编号为T1-X7T的菌株归为一类, 并命名为Tetrasphaera菌属.同时, 这两种菌株根据发现地不同而分别被命名为T. australiensis和T. japonica.两年后, 日本的Hanada等(2002)从活性污泥中分离出另一株具有聚磷特性的菌株, 同属T菌菌属, 命名为T. elongata.澳洲的Mckenzie等(2006)对Blackll等(2000)发现的“Candidatus Nostocoida Iimicola”丝状系列菌进行了16S rRNA测序, 并成功从中分离出3株新的T菌菌株, 分别命名为T. jenkinsii、T. vanveenii和T. veronensis.加之同年日本的Ishikawa等(2006)发现并命名的T. duodecadis, Tetrasphaera菌属共包括7种T菌菌株, 各菌株形态及其它基本信息如表 1所示(Nguyen et al., 2011; Kristiansen et al., 2013).
| 表 1 Tetrasphaera菌分支及形态等基本信息总结 Table 1 Summary of taxonomy, morphology, and other information on Tetrasphaera |
Eschenhagen等(2003)在德国两座污水厂中检测到两种T菌(T. australiensis、T. japonica), 占系统总生物量的10%, 而A菌丰度只占3%~5%.这是T菌被确定为新型聚磷菌属后首次在实际EBPR中被检测到.随后Kong等(2005)在丹麦10座污水处理厂中检测到了最高高达35%的T菌丰度, 而A菌丰度只有9%~17%.尤其重要的是, 研究人员第一次在动态条件下(厌氧-好氧)证明了T菌的释磷/吸磷特性, 正式确认其是一种新的PAOs.然而, Kong等的报道在当时并没有引发更多关于T菌的研究, 只有一些不同国家污水处理厂中T菌丰度的零星报道.2007—2011年期间, 研究人员在大量实际污水处理厂中对T菌丰度进行了检测(第2阶段); 同时, 不同研究结果进一步确认了T菌的释磷/吸磷能力(Kong et al., 2008; Nguyen et al., 2011).结合T菌在某些污水处理厂中的高丰度, 对其研究遂日益增多, 研究重点也转移至对T菌生理及代谢路径的探究(第3阶段).需要强调的是, 尽管期间部分研究强调T菌的“重要作用”、“重要功能”, 甚至声称应“重新审视已有的EBPR模型”, 但类似结论仅依靠T菌的高丰度或者异位培养纯化实验获得, 并不具有足够的信服力.最近, Fernando等(2019)应用Raman光谱技术在实际污水处理厂内原位定量了T菌对系统磷去除的贡献, 第一次在实际污水处理环境下证明了T菌具有与A菌相当的除磷贡献.
3 T菌在实际污水处理厂中的丰度(Abundance of Tetrasphaera in full-scale WWTPs)表 2总结了目前关于T菌丰度的定量结果.在绝大多数实验中, T菌丰度都大于A菌丰度, 但两者丰度差距不尽相同; 其中, 丹麦污水处理厂T菌丰度高达30%, 是当地A菌丰度的4倍之多, 但在德国、比利时、荷兰、挪威、瑞士、意大利的8座MBR项目(2座为EBPR工艺, 6座是非EBPR工艺)中T菌与A菌丰度相差无几(T菌与A菌平均丰度分别为0~7.9%和0~10.8%)(Silva et al., 2012).澳大利亚被检测污水处理厂中T菌和A菌丰度也相差无几(Beer et al., 2006), 而地处热带的新加坡所检测到的T菌丰度则不及A菌(Qiu et al., 2019).不同国家污水处理厂中T菌与A菌表现出的不同丰度比较说明, T菌的存在及其丰度可能与环境条件息息相关.最近Nielsen等(2019)调查了五大洲12个国家的实际污水处理厂, 结果显示T菌丰度(1.3%~11.9%)明显高于A菌(0~2.9%).不同的丰度调查结果表明, 污水处理厂中T菌的高丰度并非偶然, 具有一定的普遍性, 但其存在与否及丰度情况受环境条件影响较大.需要强调的是, 已报道的T菌丰度高低并不代表其除磷能力的大小.Silva等(2012)曾对中试和实际MBR工艺中的除磷效率进行了分析, 揭示出磷去除率最高的反应器中A菌和T菌的丰度都不是最高的.
| 表 2 已知实际污水厂中A菌和T菌的丰度总结 Table 2 Summary of the abundances of Accumulibacter and Tetrasphaera reported in full-scale WWTPs |
此外, 对PAOs丰度的定量方法主要为FISH和16S rRNA技术, 而这两种技术的结果存在偏差.Rubio-Rincón等(2019)分别用FISH和16S rRNA技术对一PAOs富集反应器中两种PAOs的丰度进行了定量分析, FISH结果显示A菌占系统总生物量的61%, 而16S rRNA技术结果显示A菌只占系统总生物量的2%.根据Mads等(2016)及Valverde-Pérez等(2016)对两种检测手段的结果分析, 应用16S rRNA技术测量微生物种群结构时, 对低丰度微生物的DNA扩增效率远远小于高丰度微生物的DNA扩增效率, 从而导致了高低两种丰度微生物误差的扩大; 同时, qPCR技术对丰度低于5%的微生物往往存在严重低估, 对DNA提取效率偏差也会严重影响到测量结果.因此, 本研究建议对T菌定量检测时为确保其准确性及可靠性, 应尽量避免采用与DNA提取相关的技术(如16S rRNA技术), 应尽量采用FISH技术.另外, 不同时期使用FISH技术对T菌的定量检测所采用的探针型号也有所不同, 导致覆盖范围存在差别或重叠, 这也会对定量结果产生影响.例如, Wagner等(1994)利用HGC69a探针对Actinobacterial门(包括T菌属)进行了特异性检测; Eschenhagen等(2003)使用的Actino1011探针只能对T. australiensis、T. japonica两种菌进行特异性检测; Kong等(2005)则使用Actino221和Actino658对放线性PAOs菌(即T菌)进行特异性检测; Beer等(2006)采用TET63及Actino1011对T. japonica、T. australiensis、T. elongata 3种菌进行特异性检测.直到Nguyen等(2011)针对T菌的知识积累, 设计了一系列新型探针, 完善覆盖了T菌的各个分支, 保障了T菌丰度定量检测的准确性(表 1), 这之后才被其他研究人员广泛采纳.
4 T菌生理和代谢途径(Physiological and metabolic pathways of Tetrasphaera) 4.1 T菌有别于A菌的生理学特点2011年后, 研究人员对T菌的生理学及代谢路径进行了初步研究(图 1), 以了解T菌除磷代谢过程发生的具体路径、代谢产物及可利用化学物质的变化等, 结果发现, T菌部分除磷代谢特点和路径不同于A菌.尽管有关T菌的生理特性和代谢路径还未被完全揭示, 且目前有关其代谢路径的报道仍存在矛盾, 但T菌独有的一些生理学特点逐渐明晰.总的来看, T菌区别于A菌的生理学特点包括3个方面:①T菌具有发酵能力, 可以依靠发酵代谢进行细胞维持或增殖; ②实际污水处理厂中丰度最大的T菌(T. elongata)在除磷代谢时无法合成PHA作为储能物质; ③T菌可以利用葡萄糖等大分子碳源进行厌氧释磷.
目前, 关于T菌代谢路径的研究报道中, 几乎均发现了其在厌氧环境下的发酵能力, 即可以吸收利用糖类和氨基酸(包括葡萄糖、谷氨酸、天冬氨酸等)进行发酵并降解为VFAs(乙酸等)、羧酸盐等小分子物质, 产生的能量供给自身细胞增殖或细胞维持.同时, 发酵产物亦可供给其它异养细菌代谢利用(Nguyen et al., 2011; Kristiansen et al., 2013).由此可知, T菌的发酵代谢能力可以与其它微生物进行协同代谢, 尤其是在生物除磷工艺的厌氧池中, 其降解大分子的能力可以提高厌氧池中VFAs的浓度, 从而为A菌厌氧释磷提供必要碳源(Kong et al., 2005; Mckenzie et al., 2006; Kristiansen et al., 2013).因此, 在进水VFAs浓度较低或工业废水比例较大的污水厂中, T菌的发酵特性有利于系统的协同除磷.进言之, T菌在厌氧环境下供给自身细胞维持或增殖的能量来源可以是Poly-P的分解, 也可以是来自它们对大分子的发酵过程.T菌的这一特点也许是其在许多污水处理厂中丰度较A菌要高的原因之一, 即T菌能够适应不同的底物环境.
与此同时, Margues等(2017)在实验中发现, T菌厌氧发酵某些碳源(葡萄糖、谷氨酸、天冬氨酸、甘氨酸)后会导致磷吸收现象的出现.推测原因是在厌氧阶段, T菌通过发酵代谢所获取的能量已足够用于细胞代谢和维持, 并不需要额外通过体内Poly-P水解获取能量, 且发酵代谢产生的能量还可用于对磷酸盐的吸收, 这是在之前对EBPR工艺研究中从未观测到的现象, 也许是一种新的除磷机制.另外, 在Rubio-Rincón等(2019)的研究中发现, 当系统从混合碳源(乙酸、丙酸、乳酸)转换为乳酸作为唯一碳源时, 系统生物除磷功能丧失, 同时16S rRNA技术检测系统中A菌丰度从20%降至2%, T菌丰度则从4%升至27%.同样证明了当只有乳酸存在时T菌可以依靠乳酸发酵代谢生存, 而不需要进行Poly-P的水解获取能量.T菌这一发酵特性对系统EBPR过程的利弊值得进一步研究.
以A菌为主体的传统EBPR模型认为, PHA是厌氧环境下PAOs吸收碳源后合成的能量载体, 可为好氧环境下过量吸磷提供碳源和能源.因此, PHA是否也是T菌进行除磷代谢时的内聚物是最初研究的重点之一.然而, Maszenan等(2000)首次分离出的两种T菌(T. australiensis、T. japonica)均未在其胞内检测到PHA的存在.作者由此推测, T菌在厌氧环境下可能并不以PHA作为储能物质.Kristiansen等(2013)对4种T菌(T. australiensis、T. japonica、T. jenkinsii、T. elongata)进行了宏基因组学分析, 结果显示, 只在T. japonica体内发现了控制PHA合成相关酶的基因(phaA、phaB、phaC), 后续实验也证明了T. japonica代谢葡萄糖后可以合成PHA.另外, T菌分支2中部分丝状菌同样可以合成PHA(Kristiansen et al., 2013).除此之外, 其它T菌均未被检测到具有合成PHA能力.进一步的, 在实际污水处理厂中丰度往往最高的T. elongata也并没有被检测到有合成PHA的现象(Kristiansen et al., 2013; Mielczarek et al., 2013).最近Fernando等(2019)应用Raman光谱技术分别对纯种T. elongata和实际处理厂中T菌胞内聚合物进行了分析, 同样未检测到PHA.综上所述, 与A菌除磷代谢中PHA发挥重要作用不同, T菌在厌氧阶段并不会合成PHA为好氧吸磷提供碳源和能源.因此, T菌代谢中PHA的功能替代物仍是目前研究的热点之一.
厌氧阶段, T菌与A菌可利用的碳源存在区别.Kristiansen等(2013)分别对两种PAOs进行宏基因组学分析发现, T菌存在一些编码糖类转运基因、糖类激酶基因和氨基酸类基因, 而A菌基因组中缺少对应的糖类、氨基酸类转运和同化基因.因此, 在底物利用上T菌相比A菌具有更广泛的选择性, 可直接吸收利用葡萄糖或氨基酸作为碳源进行代谢, 这与实际环境中两种PAOs可利用碳源的区别也是一致的(Nguyen et al., 2011; Nielsen et al., 2019; Qiu et al., 2019).但Kong等(2005)测试了厌氧条件下T菌对不同碳源(甲酸、乙酸、丙酸、丁酸、丙酮酸、乳酸、乙醇、葡萄糖、油酸、天冬氨酸、谷氨酸、亮氨酸、甘氨酸、胸苷和混合氨基酸)的吸收能力, 结果显示, 杆状T菌(T. elongata)无法吸收上述所有碳源, 球状T菌(T. australiensis、T. japonica)只可以吸收油酸, 但之后并不会进行磷吸收代谢.但后续大量的实验证明所有类型T菌均可以吸收葡萄糖(Kristiansen et al., 2013; Muszyski et al., 2015; Marques et al., 2017; Onnis-Hayden et al., 2018).Kong等(2008)证实被Action-221标记的T菌可以吸收利用葡萄糖; Nielsen等(2019)同样证实所有T菌均可吸收利用葡萄糖.Kristiansen等(2013)在实验中发现, T菌在厌氧阶段吸收葡萄糖后, 部分以糖原形式被储存, 另一部分则被发酵降解为琥珀酸酯、乳酸、丙氨酸和乙酸酯, 同时伴随着磷酸盐的释放.T菌这一代谢特性是A菌所不具备的, 同时在高动态变化的实际污水环境中, T菌这一代谢特性为其存活增殖提供了优势, 这可能是导致实际污水处理厂中T菌丰度普遍高于A菌的原因, 尤其是在以工业进水为主的污水处理厂中.
4.2 T菌摄取VFAs与否Kong等(2005)在厌氧-好氧交替运行环境下, 用乙酸作为单独碳源对T菌进行培养, 结果表明, T菌并不能吸收利用乙酸.而Nguyen等(2011)的实验结果表明, 厌氧阶段T菌可以摄取乙酸, 但在3 h内摄取逐渐停止.因此, T菌能否利用VFAs进行代谢仍存在争议.虽然部分T菌厌氧时可以代谢VFAs, 但在实际环境中VFAs似乎并不是T菌代谢的首选碳源(Nielsen et al., 2019).从宏基因组学分析结果来看, 每种T菌都具有乙酸转运和参与乙酸代谢的激活酶合成基因(actP、acs、ackA、pta), 因此, 每种T菌均具有吸收利用VFAs的能力(Kristiansen et al., 2013).尽管T菌体内存在乙酸相关代谢基因, 但T菌对乙酸的亲和性较低, 这可能是因为乙酸分流基因缺失所致, 导致当乙酸作为唯一碳源时T菌生存状况不佳(Kristiansen et al., 2013).Lanham等(2013)的实验亦表明, T菌对VFAs类碳源的竞争力较A菌要逊色.Marques等(2017)的实验表明(表 1), T菌对VFAs的利用与分支有关, 分支1中的T菌不吸收VFAs; 分支3中部分亚系可以吸收VFAs(Nguyen et al., 2011; Wang et al., 2018); 分支2中的T菌由于在与A菌竞争VFAs时处于劣势而被系统淘汰.说明这两种PAOs菌对VFAs类碳源的选择是有区别的.
4.3 T菌潜在代谢路径 4.3.1 厌氧合成糖原代谢综上可知, 多数T菌在厌氧环境下并不能合成PHA作为储能物质.为了解释T菌除磷代谢机理, 尤其是厌氧环境下的储能内聚物, 部分学者认为糖原作为PHA的“替代品”在T菌除磷代谢中发挥着关键作用.Kristiansen等(2013)通过宏基因组学分析, 在T菌体内发现了编码TCA循环、糖酵解、糖异生、糖原合成及糖原分解相关的酶的基因.另一方面, 糖原合成酶(GlgB、GlgC、N0E1Q7、N0E176)和分解酶(GlgX、GlgP)的发现也证明了T菌在厌氧环境下具有合成糖原的能力.同时, 研究者在厌氧-好氧循环条件下用葡萄糖培养纯种T.elongata菌, 在其胞内观察到了糖原生成, 并据此提出了T菌除磷代谢模型(图 2).另外, Marques等(2017)使用葡萄糖、天冬氨酸、谷氨酸分别作为碳源对T菌进行培养, 均检测到了糖原的生成.
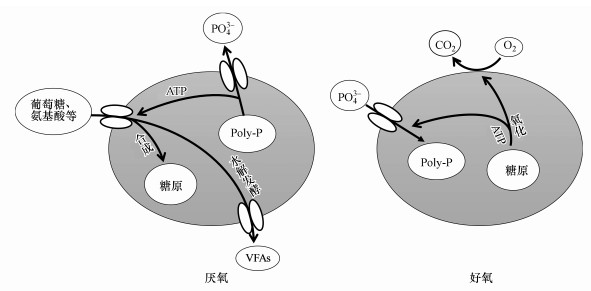 |
| 图 2 T菌以糖原作为内聚物时的除磷模型 Fig. 2 Model of P-removal by Tetrasphaera with glycogen as intracellular storage compound |
Kristiansen等(2013)认为, 在厌氧环境下, T菌吸收葡萄糖、蛋白质、氨基酸等大分子物质并以糖原形式储存在体内, 也可水解发酵为VFAs(乙酸等)等供给其它异养细菌利用.糖原合成所需的能量来源于T菌体内Poly-P水解和葡萄糖、蛋白质等基质发酵时产生的ATP.在好氧段, T菌体内储存的糖原被氧化降解, 提供能量用于维持自身生长和从环境中过量吸收磷酸盐用于Poly-P再生.富含Poly-P的T菌以剩余污泥形式排出系统, 完成系统生物除磷过程.可见, T菌这一除磷代谢途径与A菌代谢模型部分类似, 同样存在TCA循环和Poly-P的降解和再生过程, 主要区别是糖原代替PHA成为储能内聚物.
然而, 最近Fernando等(2019)用葡萄糖作为唯一碳源对纯种培养的T. elongata菌进行了代谢研究, 通过FISH-Raman技术在T. elongata菌体内并没有检测到糖原内聚物.同时, 在实际污水处理厂中的T菌体内也未检测到糖原的存在, 故对糖原作为储能物质的假设提出了质疑.作者将不同实验结果归结于糖原检测定量方法(酸化水解葡萄糖当量法并不是直接定量糖原, 而是定量糖原降解后的葡萄糖当量)的弊端.事实上, 葡萄糖当量法目前已被广泛应用, 其准确性也被普遍认可(Kristiansen et al., 2013; Nielsen et al., 2019).在该实验中未检测到糖原存在, 极大的可能性归因于T菌的多种代谢途径; 在该实验条件下, T菌可能确实未合成糖原代谢, 但这并不代表T菌不能合成糖原.另外, 该实验中采用Actino658探针对T菌进行特异性检测, 而Actino658不能覆盖T菌中的分支1和分支2中的大多数菌株(Nguyen et al., 2011), 探针覆盖范围的差别会对T菌特异性检测产生误差.因此, 糖原是否为T菌进行除磷代谢的内聚物仍待研究确认.
4.3.2 厌氧以游离氨基酸储能代谢除糖原外, 游离氨基酸亦可能是T菌在厌氧环境下的储能内聚物.Nguyen等(2015)在厌氧环境下使用甘氨酸作为唯一碳源, 对T. elongata菌进行了代谢内聚物种类及代谢产物的实验分析, 结果在T. elongata菌体内检测到了游离的甘氨酸, 并没有发现糖原的踪迹.他们由此推测, T菌代谢某些氨基酸时可能会以游离氨基酸的形式储存能量, 继而在好氧环境下促进磷的过量吸收, 即扮演A菌代谢中PHA角色, 由此提出了基于游离氨基酸为储能内聚物的代谢模型(图 3).
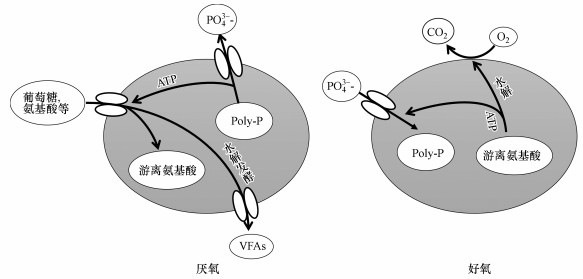 |
| 图 3 T菌以游离氨基酸作为内聚物的除磷模型 Fig. 3 Model of P-removal by Tetrasphaera with free amino acid as intracellular storage compound |
在Nguyen等(2015)的实验中, 厌氧条件下用被13C标记的甘氨酸作为唯一碳源培养T. elongate菌, 厌氧3 h后检测环境中含13C有机物的变化, 结果显示, 大约11%的甘氨酸被转化谷氨酸、丝氨酸、丙氨酸, 用于合成蛋白质; 大约60%的甘氨酸被水解发酵为丙氨酸、乙酸和琥珀酸; 9%的甘氨酸以游离形式储存于体内; 与此同时并没有发现存在PHA和糖原积累现象; 随后, 在好氧阶段3 h内所有被13C标记的物质均被消耗殆尽.厌氧条件下T菌吸收甘氨酸的同时伴随着磷酸盐的释放, 得到的P释放/C吸收值大约为0.5, 该值与厌氧时A菌吸收乙酸释放磷酸盐的效率类似(Hesselmann et al., 2000; Martin et al., 2006).厌氧时A菌吸收VFAs的能力往往会受到体内Poly-P和糖原含量的限制(Nguyen et al., 2011); Nguyen等在实验中同样发现, 厌氧时T. elongate菌吸收甘氨酸的能力也会受到体内Poly-P含量的限制; 在厌氧阶段开始的30 min内, T. elongate菌体内的甘氨酸浓度迅速达到2 mmol·L-1, 之后缓慢上升, 3 h厌氧结束后达到3 mmol·L-1; 当T. elongate菌体内的Poly-P消耗殆尽后, 该菌便停止对甘氨酸的摄取.同时, 当投加甘氨酸作为唯一碳源时, 系统中检测到甘氨酸的消耗伴随着糖原的消耗, 而投加天冬氨酸、谷氨酸、葡萄糖时, 对应碳源的消耗则伴随着糖原的生成.这也证实了当甘氨酸作为唯一碳源投加时, T菌体内并不会以糖原作为储能物质, 而可能以游离碳化合物(甘氨酸)形式作为储能物质用于好氧吸磷.
Marques等(2017)为进一步调查厌氧时T菌体内潜在的储能物质, 在Nguyen等(2015)的实验基础上又对T菌体内代谢物质进行了鉴定.他们用酪蛋白水解物培养T菌, 检测到了复杂的体内代谢产物; 除甘氨酸外, 厌氧条件下其它氨基酸(缬氨酸、苏氨酸、天冬氨酸、脯氨酸、谷氨酰胺、苯丙氨酸、赖氨酸、鸟氨酸)也可以游离形式存在于T菌体内, 糖类物质(如葡萄糖和松二糖等)也被检测到以游离形式存在于体内.这些结果表明除甘氨酸外, 其它氨基酸水解产物也可以游离形式作为潜在储能物质.
4.3.3 厌氧吸磷代谢Margues等(2017)对一个PAOs富集反应器(T菌占60%, A菌占20%)进行除磷代谢分析时发现, 当使用葡萄糖、天冬氨酸、谷氨酸或甘氨酸分别作为唯一碳源时, T菌在厌氧环境下表现出对PO43-的吸收, 而不是释放.对此他们提出, T菌在以上述有机物作为唯一碳源时, 可利用其进行发酵代谢, 该代谢途径产生的ATP可满足糖原合成和细胞维持的需要, 甚至富余推动对PO43-的吸收, 据此提出了T菌厌氧吸磷代谢模型(图 4).
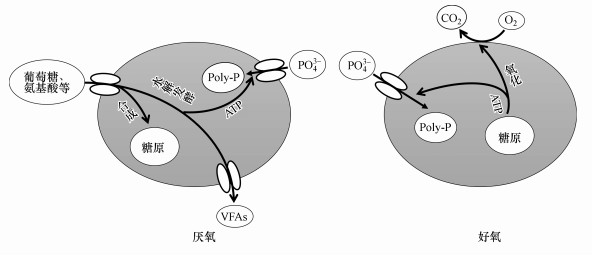 |
| 图 4 T菌厌氧吸磷代谢模型 Fig. 4 Model of P-uptake by Tetrasphaera under anaerobic condition |
尽管该代谢模型中T菌在厌氧和好氧环境下均可吸磷, 但这一代谢模型明显不符合生物除磷的动态循环要求, 即存在吸磷饱和现象, 这也是部分学者对T菌能否稳定发挥除磷代谢功能质疑所在.结合4.1节讨论内容, T菌的发酵能力是导致其丰度较高的可能原因, 可使其适应不同的环境变化并存活, 但同时也可能对T菌除磷代谢构成较大威胁.如果T菌的生长代谢依赖于发酵作用, 很可能形成其对Poly-P分解功能显得多余而被搁置, 况且, T菌又不能无限制吸磷, 这可能会导致T菌达到吸磷饱和状态而最终丧失除磷能力.
4.3.4 反硝化代谢Hanada等(2002)发现T. elongata菌可以将硝酸盐(NO3-)还原至亚硝酸盐(NO2-), 但并不能完全反硝化至氮气(N2).Kong等(2005)同样发现球状Tetrasphaera菌(T. australiensis、T. japonica)可将NO3-还原至NO2-, 并可以从中获取能量用于自身生长.Kristiansen等(2013)通过宏基因组学分析发现, T菌体内具有控制反硝化相关表达酶的基因(nirK), 即T菌都具有利用NO3-和NO2-作为反硝化终极电子受体的潜力.但在T菌体内没有发现一套控制完整反硝化路径的基因组, 即T菌并不能将NO3-完全还原至N2.但在T. japonica菌基因组中发现了能够将NO3-还原至氨态氮的相关表达酶的基因(nirB、nirD), 表明该菌可能通过将NO3-异化还原为氨氮的形式还原NO3-.
Marques等(2018)在一个PAOs富集反应器(T菌占80%, A菌 < 2%)中测试了T菌的反硝化能力, 结果显示, T菌对系统中氮去除的贡献率达到80%, 同时检测到少量缺氧磷吸收现象.但在缺氧条件下, T菌的除磷量仅为0.09 mmol·g-1·h-1, 而A菌为0.13~1.19 mmol·g-1·h-1.虽然T菌总的脱氮能力与A菌类似(0.7 mmol·g-1·h-1), 但缺氧时T菌的P去除/N去除值只有A菌的1/7, 即T菌的反硝化除磷能力远远不及A菌.进一步深入研究表明, T菌厌氧吸收有机碳后为后续缺氧、好氧段提供了足够的能量, 可以实现缺氧反硝化与好氧磷吸收, 但几乎不能像反硝化除磷菌(DPB)那样同步进行反硝化与缺氧吸磷.
5 T菌除磷代谢影响因素(Factors influencing phosphorus removal metabolism of Tetrasphaera) 5.1 氧化还原电位(ORP)基于对传统EBPR过程的认知, 厌氧段ORP是维持A菌与其它异养细菌对碳源竞争优势及其除磷性能的关键因素.因此, 为了保证其高效的释磷及VFAs吸收, 厌氧段ORP值需尽量保持在-200 mV以下(Barnard et al., 2017), 同时, 厌氧停留时间应>2.4 h, 则可维持稳定的EBPR运行(Yu et al., 1997).目前, 关于厌氧段ORP值对T菌除磷影响的研究并不多见, 有限的T菌研究报道大都没有提及实验中厌氧段具体的ORP值, 这就给讨论ORP值对T菌除磷的影响带来了疑惑, 也是今后有必要研究的内容之一.
Dunlap等(2014)在用传统EBPR数学模型拟合侧流强化生物除磷(S2EBPR)过程时发现, 需将A菌的部分动力学参数进行较大幅度调整后才可符合实际除磷的表现, 而调整后的动力学参数与A菌实测值出入较大.在ASM标准模型(ASM2d、ASM2d+TUD、ASM3+bio-P、Barker-Dold、UCTPHO+)中只考虑到A菌一种PAOs菌属(Varga et al., 2018), 研究者结合已发现和报道的T菌, 提出了基于A菌和T菌的双PAOs生物除磷模型, 将T菌的发酵能力及除磷能力也包括到除磷模型之中; 同时, 将T菌在不同ORP下的活性变化作为“开关”函数来控制T菌除磷作用大小, 对T菌的碳源摄取/发酵速率方程进行基于ORP的控制.如图 5所示, 当厌氧段ORP保持在-300 mV时, T菌对碳源的摄取/发酵速率因子为“1”; 当ORP≥-200 mV时, T菌对碳源的摄取/发酵速率因子几乎降为“0”, 即失去生物除磷能力(Barnard et al., 2017).尽管以ORP为控制开关的双PAOs模型仍未得到广泛证明, 但其作为将T菌包括在既有生物除磷模型中的一次新的尝试, 为解释新发现的T菌生物除磷现象与工艺提供了启示.
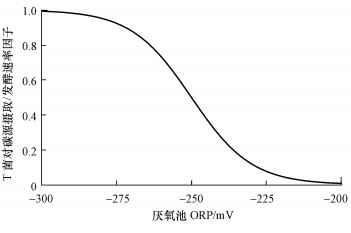 |
| 图 5 厌氧时T菌对碳源摄取/发酵活性与ORP的关系 Fig. 5 Relationship between carbon source uptake/fermentation activity of Tetrasphaera and ORP during anaerobic period |
近年来, 世界各地的侧流发酵S2EBPR工艺引起了一定关注, 该工艺中侧流水解发酵池经历长SRT(12~48 h)后形成深度厌氧环境(ORP < -400 mV), 相比传统EBPR工艺具有更好的生物除磷效果, 由此推测可能是深度厌氧环境刺激了T菌的发酵活性, 为系统增加了额外碳源(Onnis-Hayden et al., 2018; Wang et al., 2018).但目前对T菌生理生化研究中有关厌氧ORP值的关注确实较少, 而实际EBPR工艺中厌氧池一般难以达到ORP < -200 mV这样的状态(Barnard et al., 2017), 因此, 厌氧环境对T菌活性的影响有待进一步研究.
5.2 温度如表 2所示, 在丹麦等北欧国家的污水处理厂中, 污水水温常年处于 < 20 ℃, 所检测到的T菌丰度普遍高于A菌.而地处热带地区的新加坡, 污水水温常年稳定在30 ℃左右, 所检测的3个EBPR工艺中T菌丰度远小于A菌.同时, Barnard等(2017)的研究也表明, 当污水水温>30 ℃时, A菌在与T菌的竞争中处于优势地位, 即污水水温过高对T菌生存会有不利影响.然而, 目前对T菌的研究中对水温的关注较少, 因此, 不同水温下两种PAOs的丰度变化有待进一步研究.
5.3 进水组分的影响除ORP、水温外, 进水中生活和工业废水的比例对T菌丰度也有影响.Mielczarek等(2013)对丹麦EBPR工艺中微生物群落结构进行了连续3年的检测, 并将T菌丰度信息与部分运行环境条件进行了相关性分析, 结果显示, T菌丰度大小与进水中工业废水占比有一定关系, 即进水中工业废水比例越大, T菌丰度则会越高, 其它国家污水处理厂中两种PAOs丰度与进水组分的关系也可证明这一点(表 2).Kong等(2005)调查了丹麦10座分别以生活废水和工业废水为主的污水处理厂, 其中在以工业废水为主的污水处理厂中T菌平均丰度为17%~35%, 而以生活污水为主的污水处理厂中T菌丰度仅为3%~16%, 特别是在一座处理乳制品废水的污水处理厂中甚至只检测到了T菌而没有发现A菌, 充分说明进水组分对两种PAOs丰度影响很大.工业废水中往往富含大量蛋白质等大分子有机物(Kong et al., 2005; Muszyński et al., 2015), 这无疑为T菌在与A菌的竞争中提供了底物优势.由此可见, 进水中大分子有机物浓度是刺激T菌丰度升高的原因之一, 即工业废水在进水中比例越大, 越有利于T菌在活性污泥中形成竞争优势.
6 T菌对生物除磷贡献分析(Contribution of Tetrasphaera to biological phosphorus removal)T菌在EBPR工艺中的高丰度是引起人们对其研究兴趣的根源, 但有丰度并不足以表明有足够的除磷贡献.目前对T菌的研究多局限于实验室小试水平, 在实际污水处理厂中还没有完全证实T菌在高动态环境中的除磷能力, 直到将Raman光谱技术用于原位定量细胞内聚物含量(Poly-P和糖原).最近Fernando等(2019)运用FISH+Raman技术对丹麦8个污水处理厂进行检测, 发现T菌丰度在5个污水处理厂中相比A菌占优势, 在6个污水处理厂中除磷贡献高于A菌, 具体如表 3所示.
| 表 3 丹麦实际污水处理厂中A菌与T菌对系统生物除磷的贡献 Table 3 Contributions of Accumulibacter and Tetrasphaera to biological phosphorus removal in full scale WWTPs in Denmark |
Fernando等(2019)对丹麦8个EBPR工艺中两种PAOs对系统生物除磷的贡献进行了检测计算(表 3).以Hj∅rring污水处理厂为例, 在单位污泥质量中, T菌除磷量为6.7 mg·g-1, 而A菌除磷量为2.07 mg·g-1, 即该厂中T菌对系统的除磷贡献是A菌的3倍.然而, 表 3中显示的其它污水处理厂中两种PAOs的除磷贡献率却说明A菌和T菌在实际EBPR工艺中都是重要的PAOs, 两种PAOs贡献了系统24%~70%的磷去除.值得注意的是, 研究者在实际工艺中所检测到的两种PAOs各项代谢数据均小于实验室所得数据, 说明实验室中所测的代谢数据并不能完全代表真实动态环境中的T菌活性.所以, 未来对T菌的代谢及除磷贡献研究应以实际工艺为主.
然而, Fernando等的研究结果目前显得较为孤单, 只能说明在该实验环境下T菌具有与A菌相当的除磷贡献能力.通过上述对T菌生理学的讨论可知其代谢路径较为多样, 而随着环境、运行等条件的变化, 可能也会导致T菌改变代谢路径, 甚至由除磷代谢转变至非除磷代谢, 即T菌在某些环境下可能并不会发挥其除磷能力.目前对T菌研究的知识还不能完全概括出全部控制T菌除磷代谢途径的影响因素, 因此, 对于T菌在EBPR中的角色和重要性仍需慎重看待.
7 结论(Conclusions)1) T菌作为新型除磷细菌(PAOs)其作用已被实验证实.目前, 已发现7个T菌菌株, 归属于3个分支.已报道的T菌在一些污水处理厂的丰度(1%~30.5%)明显高于A菌(1%~18%).
2) T菌具有区别于A菌之生理学特性:①T菌具有发酵能力, 可以依靠发酵葡萄糖等大分子有机物获得能量进行细胞维持或增殖; ②实际污水处理厂中大多数T菌(除T. japanica和部分丝状菌外)在除磷代谢时无法合成PHA作为储能物质, 其厌氧储能替代物质存在争议.
3) T菌的代谢途径存在多样性, 可利用不同底物进行不同途径除磷代谢; 糖原和游离氨基酸被认为是最有可能的代谢内聚物; T菌也被观察到可以进行厌氧吸磷代谢和反硝化代谢.
4) T菌生存及代谢受环境因素影响很大, 深度厌氧环境(低ORP)有利于T菌生存与代谢; 水温过高不利于T菌的存活; 进水中工业(含大分子有机物)废水比例越高, T菌丰度越高.
8 展望(Outlook)1) 除目前已知环境因素外, 其它环境因素(如pH等)对T菌生存及代谢的影响应是未来需要研究的方向.
2) 因T菌代谢途径的多样导致其难以稳定实现除磷代谢.T菌不同代谢途径下的获能方式决定着其是否可以实现持续、稳定除磷.T菌如果不需要胞内Poly-P水解供能, 那就需要了解其它代谢途径下的能量利用水平.能量平衡计算可以确定T菌在各个代谢途径下的能量利用水平, 这决定着其是否可以稳定发挥释磷/吸磷作用.这显然应该是未来研究的重点.
3) 尽管在丹麦一些实际污水处理厂中发现T菌具有与A菌相当的除磷贡献, 但类似结果的报道并不是非常普遍, 且目前对T菌的研究多处于实验室水平, 因此, 今后需要对T菌在实际动态环境下的动力学开展研究.
Barnard J, Dunlap P, Steichen M. 2017. Rethinking the mechanisms of biological phosphorus removal[J]. Water Environment Research, 89(11): 2043-2054. DOI:10.2175/106143017X15051465919010 |
Beer M, Stratton H M, Griffiths P C, et al. 2006. Which are the polyphosphate accumulating organisms in full-scale activated sludge enhanced biological phosphate removal systems in Australia[J]. Journal of Applied Microbiology, 100(2): 233-243. |
北京市环境保护局, 北京市质量技术监督局.2012.城镇污水处理厂水污染物排放标准: DB11/890-2012[S].北京: 中国建筑工业出版社
|
Blackall L L, Crocetti G R, Saunders A M, et al. 2002. A review and update of the microbiology of enhanced biological phosphorus removal in wastewater treatment plants[J]. Antonie van Leeuwenhoek, 81(1/4): 681-691. DOI:10.1023/A:1020538429009 |
Blackall L L, Seviour E M, Bradford D, et al. 2000. 'Candidatus Nostocoida limicola', a filamentous bacterium from activated sludge[J]. International Journal of Systematic & Evolutionary Microbiology, 50(2): 703-709. |
蔡健明, 操家顺, Cai J M, 等. 2009. 芦村污水处理厂进水组分分析[J]. 环境科技, 22(3): 30-32. |
Dunlap P, Shaw A, Barnard J, et al.2014.Innovative Modelling in the Design of the Sacramento Regional Wastewater Treatment Plant for Biological Nutrient Removal[C].4th IWA/WEF Wastewater Treatment Modeling Seminar.270-277
|
Eschenhagen M, Schuppler M, Röske I. 2003. Molecular characterization of the microbial community structure in two activated sludge systems for the advanced treatment of domestic effluents[J]. Water Research, 37(13): 3224-3232. DOI:10.1016/S0043-1354(03)00136-2 |
Fernando E Y, Mcilroy S J, Nierychlo M, et al. 2019. Resolving the individual contribution of key microbial populations to enhanced biological phosphorus removal with Raman-FISH[J]. The ISME Journal, 57: 111-118. |
国务院. 2015. 水污染防治行动计划[M]. 北京: 人民出版社.
|
郝晓地. 2006. 可持续污水-废物处理技术[M]. 北京: 中国建筑工业出版社.
|
郝晓地, 方晓敏, 李天宇, 等. 2018. 污水处理厂升级改造中的认识误区[J]. 中国给水排水, (4): 10-15. |
Hanada S, Liu W T, Shintani T, et al. 2002. Tetrasphaera elongata sp.nov, a polyphosphate-accumulating bacterium isolated from activated sludge[J]. International Journal of Systematic and Evolutionary Microbiology, 52(3): 883-887. |
Hesselmann R, Rummell R, Resnick S, et al. 2000. Anaerobic metabolism of bacteria performing enhanced biological phosphate removal[J]. Water Research, 34(14): 3487-3494. DOI:10.1016/S0043-1354(00)00092-0 |
Ishikawa T, Yokota A. 2006. Reclassification of Arthrobacter duodecadis Lochhead 1958 as Tetrasphaera duodecadis comb.nov.and emended description of the genus Tetrasphaera[J]. International Journal of Systematic & Evolutionary Microbiology, 56(6): 1369-1373. |
Kataoka N, Tokiwa Y, Tanaka Y, et al. 1996. Enrichment culture and isolation of slow-growing bacteria[J]. Applied Microbiology and Biotechnology, 45(6): 771-777. DOI:10.1007/s002530050761 |
Kong Y, Nielsen J L, Nielsen P H. 2004. Microautoradiographic study of Rhodocyclus-related polyphosphate-accumulating bacteria in full-scale enhanced biological phosphorus removal plants[J]. Applied and Environmental Microbiology, 70(9): 5383-5390. DOI:10.1128/AEM.70.9.5383-5390.2004 |
Kong Y, Nielsen J L, Nielsen P H. 2005. Identity and ecophysiology of uncultured actinobacterial polyphosphate-accumulating organisms in full-scale enhanced biological phosphorus removal plants[J]. Applied and Environmental Microbiology, 71(7): 4076-4085. DOI:10.1128/AEM.71.7.4076-4085.2005 |
Kong Y, Xia Y, Nielsen P H. 2008. Activity and identity of fermenting microorganisms in full-scale biological nutrient removing wastewater treatment plants[J]. Environmental Microbiology, 10(8): 2008-2019. DOI:10.1111/j.1462-2920.2008.01617.x |
Kristiansen R, Nguyen H T T, Saunders A M, et al. 2013. A metabolic model for members of the genus Tetrasphaera involved in enhanced biological phosphorus removal[J]. The ISME Journal, 7(3): 543-554. DOI:10.1038/ismej.2012.136 |
Lanham A B, Oehmen A, Saunders A M, et al. 2013. Metabolic versatility in full-scale wastewater treatment plants performing enhanced biological phosphorus removal[J]. Water Research, 47(19): 7032-7041. DOI:10.1016/j.watres.2013.08.042 |
Mads A, Mcilroy S J, Mikkel S B, et al. 2016. "Candidatus Propionivibrio aalborgensis":A novel glycogen accumulating organism abundant in full-scale enhanced biological phosphorus removal plants[J]. Frontiers in Microbiology, 7: 1033. |
Marques R, Ribera-Guardia A, Santos J, et al. 2018. Denitrifying capabilities of Tetrasphaera and their contribution towards nitrous oxide production in enhanced biological phosphorus removal processes[J]. Water Research, 137: 262-272. DOI:10.1016/j.watres.2018.03.010 |
Marques R, Santos J, Nguyen H, et al. 2017. Metabolism and ecological niche of Tetrasphaera and Ca.Accumulibacter in enhanced biological phosphorus removal[J]. Water Research, 122: 159-171. DOI:10.1016/j.watres.2017.04.072 |
Martin H G, Ivanova N, Kunin V, et al. 2006. Metagenomic analysis of two enhanced biological phosphorus removal (EBPR) sludge communities[J]. Nature Biotechnology, 24(10): 1263-1269. DOI:10.1038/nbt1247 |
Maszenan A M, Seviour R J, Patel B K, et al. 2000. Three isolates of novel polyphosphate-accumulating gram-positive cocci, obtained from activated sludge, belong to a new genus, Tetrasphaera gen.nov.and description of two new species, Tetrasphaera japonica sp.nov.and Tetrasphaera australiensis sp.nov[J]. International Journal of Systematic and Evolutionary Microbiology, 50(2): 593-603. DOI:10.1099/00207713-50-2-593 |
Mckenzie C M, Seviour E M, Schumann P, et al. 2006. Isolates of 'Candidatus Nostocoida limicola' Blackall et al.2000 should be described as three novel species of the genus Tetrasphaera, as Tetrasphaera jenkinsii sp.nov.Tetrasphaera vanveenii sp.nov.and Tetrasphaera veronensis sp.nov[J]. International Journal of Systematic and Evolutionary Microbiology, 56(10): 2279-2290. DOI:10.1099/ijs.0.63978-0 |
Melia P M, Cundy A B, Sohi S P, et al. 2017. Trends in the recovery of phosphorus in bioavailable forms from wastewater[J]. Chemosphere, 186: 381-395. DOI:10.1016/j.chemosphere.2017.07.089 |
Mielczarek A T, Nguyen H T T, Nielsen J L, et al. 2013. Population dynamics of bacteria involved in enhanced biological phosphorus removal in Danish wastewater treatment plants[J]. Water Research, 47(4): 1529-1544. DOI:10.1016/j.watres.2012.12.003 |
Muszyński A, Załęska-Radziwiłł M. 2015. Polyphosphate accumulating organisms in treatment plants with different wastewater composition[J]. Architecture Civil Engineering Environment, 4: 605-616. |
Nguyen H T T, Le V Q, Hansen A A, et al. 2011. High diversity and abundance of putative polyphosphate-accumulating Tetrasphaera-related bacteria in activated sludge systems[J]. FEMS Microbiology Ecology, 76(2): 256-267. DOI:10.1111/j.1574-6941.2011.01049.x |
Nguyen H T T, Kristiansen R, Vestergaard M, et al. 2015. Intracellular accumulation of glycine in polyphosphate-accumulating organisms in activated sludge, a novel storage mechanism under dynamic anaerobic-aerobic conditions[J]. Applied & Environmental Microbiology, 81(14): 4809-4818. |
Nielsen P H, Mcilroy S J, Albertsen M, et al. 2019. Re-evaluating the microbiology of the enhanced biological phosphorus removal process[J]. Current Opinion in Biotechnology, 57: 111-118. DOI:10.1016/j.copbio.2019.03.008 |
Onnis-Hayden A, Srinivasan V, Tooker N B, et al. 2018. Survey of full scale side-stream EBPR facilities and comparison with conventional EBPR:Process stability, kinetics and microbial ecology[J]. Preprints. DOI:10.20944/preprints201808.0241.v1 |
Park J H, Kang H, Kim H S, et al. 2019. Effects of alkali-treated sludge supplementation for enhanced biological phosphorus removal in a membrane bioreactor[J]. Fuel, 254: 115588. DOI:10.1016/j.fuel.2019.05.171 |
Qiu G, Zuniga-Montanez R, Law Y, et al. 2019. Polyphosphate-accumulating organisms in full-scale tropical wastewater treatment plants use diverse carbon sources[J]. Water Research, 149: 496-510. DOI:10.1016/j.watres.2018.11.011 |
Rubio-Rincón F J, Welles L, Lopez-Vazquez C M, et al. 2019. Effect of Lactate on the microbial community and process performance of an EBPR system[J]. Frontiers in Microbiology, 10: 1-11. DOI:10.3389/fmicb.2019.00001 |
Silva A F, Carvalho G, Oehmen A, et al. 2012. Microbial population analysis of nutrient removal-related organisms in membrane bioreactors[J]. Applied Microbiology and Biotechnology, 93(5): 2171-2180. DOI:10.1007/s00253-011-3499-5 |
Valverde-Pérez B, Wágner D S, Lóránt B, et al. 2016. Short-sludge age EBPR process-Microbial and biochemical process characterisation during reactor start-up and operation[J]. Water Research, 104: 320-329. DOI:10.1016/j.watres.2016.08.026 |
Varga E, Hauduc H, Barnard J, et al. 2018. Recent advances in bio-P modelling-a new approach verified by full-scale observations[J]. Water Science and Technology, 78(10): 2119-2130. DOI:10.2166/wst.2018.490 |
Wagner M, Erhart R, Manz W, et al. 1994. Development of an rRNA-targeted oligonucleotide probe specific for the genus Acinetobacter and its application for in situ monitoring in activated sludge[J]. Applied & Environmental Microbiology, 60(3): 792. |
Wang D, Tooker N B, Srinivasan V, et al. 2018. A full-scale comparative study of conventional and side-stream enhanced biological phosphorus removal processes[J]. Preprints. DOI:10.20944/preprints201808.0250.v1 |
Wong M T, Mino T, Seviour R J, et al. 2005. In situ identification and characterization of the microbial community structure of full-scale enhanced biological phosphorous removal plants in Japan[J]. Water Research, 39(13): 2901-2914. DOI:10.1016/j.watres.2005.05.015 |
Yu R F, Liaw S L, Chang C N, et al. 1997. Monitoring and control using on-line ORP on the continuous-flow activated sludge batch reactor system[J]. Water Science and Technology, 35(1): 57-66. DOI:10.2166/wst.1997.0012 |
 2020, Vol. 40
2020, Vol. 40


