2. 江西农业大学食品科学与工程学院, 南昌 330045
2. College of Food Science and Engineering, Jiangxi Agricultural University, Nanchang 330045
嘧草醚(pyriminobac-methyl)是日本组合化学研发的内吸传导型专业除稗剂, 属嘧啶(氧)硫苯甲酸类除草剂, IUPAC化学名称为2-(4, 6-二甲氧基-2-嘧啶氧基)-6-(1-甲氧亚氨基乙基)苯甲酸甲酯.其作用机理为通过杂草的茎叶和根的吸收迅速传导至全株, 抑制乙酰乳酸合成酶(ALS)和氨基酸的生物合成, 从而抑制和阻碍杂草体内的细胞分裂, 使杂草停止生长, 最终导致杂草白化而枯死(程志明, 2003;张特等, 2018).嘧草醚因对稻田稗草具有施用期宽广, 持效期长, 对哺乳动物和生态低毒, 对水稻具有高选择性和高安全性等特点而日益受到关注.现有文献报道主要集中在嘧草醚原药液相分析(刘淑杰等, 2011)、嘧草醚在水稻及其环境中的残留分析(秦美玲等, 2017;贾浩然等, 2019)及嘧草醚防除稻田稗草及安全性研究(沈国辉, 2001;吴雄哲, 2010), 对于嘧草醚在水稻及其环境中的消解动态和膳食暴露风险评估的研究未见报道.
农药的使用在保障农业生产的高产和稳产中起到很大作用, 但农药的不合理施用会导致农产品和谷田生态系统中的农药残留超标, 对人类健康和生态环境具有潜在毒害, 并对后茬作物产生药害(王大宁, 2006).近年来, 农药的大面积、多种类、高剂量使用造成的环境污染和食品安全问题得到了空前的关注.在当前大力提倡减肥减药和高度重视食品安全的大前提下, 研究除草剂在稻田生态系统中的残留消解动态, 可以为稻田除草剂的合理施用、稻谷系列产品的安全食用及稻田生态系统的可持续发展提供一定的理论依据.
本文在已建立的嘧草醚残留分析方法基础上, 在黑龙江佳木斯、山东济宁、浙江宁波和江西南昌4地分别进行为期2年的残留消解和残留试验观测, 通过风险商值(RQ)对最终残留量进行评估以确定其摄入风险.以期为嘧草醚在水稻田中的安全使用和农药的安全风险评估提供参考.
2 材料与方法(Materials and methods) 2.1 试验材料仪器:Agilent 1260高效液相色谱仪, 配自动进样装置(美国Agilent公司);Agilent 6120质谱仪, 配单级四极杆液质联用仪(美国Agilent公司);ZORBAX Eclipse XDB-C18 (4.6 mm × 150 mm, 5 μm)色谱柱(美国Agilent公司);分析天平(梅特勒ME 204);Eppendorf 5805GG769152高速大容量冷冻离心机(德国艾本德股份有限公司);FW80高速万能粉碎机(北京市永光明医疗仪器厂);XH-C旋涡混合器(常州越新仪器制造有限公司);过滤器(过滤膜孔径约0.22 μm).
试剂:99% (E)-嘧草醚(pyriminobac-methyl)标准品(CAS No:147411-69-6)(上海甄准生物科技有限公司);10%嘧草醚可湿性粉剂(北京新禾丰有限公司), 制剂已进行标定(贾浩然等, 2019), 精密度和准确度可参考;尿素(灵谷化工有限公司);氯化钾(广东天禾农资股份有限公司);88%甲酸(色谱纯, 天津市科密欧化学试剂有限公司), 乙腈和甲醇(色谱纯)及其他分析纯试剂(西陇科学股份有限公司);C18吸附剂和PSA吸附剂(Agela Technologies);纯水.
2.2 田间试验及方法试验设计参照农业部NY/T 788—2004《农药残留试验准则》和《农药登记残留田间试验标准操作规程》进行, 2018—2019年分别于黑龙江省佳木斯市、山东省济宁市、浙江省宁波市和江西省南昌市开展嘧草醚田间消解动态试验和残留检测研究.供试药剂为10%嘧草醚可湿性粉剂, 试验分为消解动态试验区、最终残留试验区和空白对照试验区.消解动态和最终残留均采用推荐用量60 g·hm-2 (以有效成分计, 下同)的1.5倍(90 g·hm-2)和2倍(120 g·hm-2).每个剂量设置3个重复, 每个重复小区面积为30 m2, 同时设置空白对照.佳木斯、济宁、宁波和南昌4地试验田的地理位置、土壤性质和气候条件见表 1.
| 表 1 佳木斯、济宁、宁波和南昌试验稻田土壤性质和气候条件 Table 1 Soil properties and the climate in experiment field in Jiamusi, Jining, Ningbo and Nanchang |
采用1次施药多次采样的方法, 在供试水稻田内设置面积为30 m2的试验小区, 共6个.小区之间设立保护带, 独立排灌, 以防处理间相互影响.在水稻移栽7 d后采用药土法分别拌土撒施剂量为90和120 g·hm-2的10%嘧草醚可湿性粉剂, 每个剂量3个重复.施药时田间应保持3~5 cm水层, 保水5~7 d, 并只灌不排, 任其自然落干, 之后正常田间管理.
于施药后2 h、1、3、5、7、10、15、30和45 d, 随机多点采集0~10 cm地表土壤, 采集样品不少于1 kg, 混匀后晾干, 过20目筛(孔径0.9 mm), 四分法缩分留样500 g;田水样品不少于1 L, 混匀后抽滤, 留样500 mL;水稻根部以上稻秆样品不少于1 kg, 去除残叶后, 剪成1 cm左右小段, 混匀后捣碎, 四分法缩分留样500 g.全部样品密封后贴好标签, 于-20 ℃冰箱冷冻保存.
2.2.2 最终残留试验10%嘧草醚可湿性粉剂于水稻移栽7 d后进行施药, 每个小区嘧草醚低浓度的处理剂量为90 g·hm-2, 高浓度的处理剂量为120 g·hm-2, 小区设置和田间管理同2.2.1节消解动态试验.
于水稻成熟收获期随机多点采集根部以上水稻样品, 采集量不少于3 kg.稻株经脱粒处理将稻秆和稻谷分开, 稻秆晒干后剪碎, 混匀缩分留样500 g;稻谷晒干后用砻谷机将稻壳和稻米分开, 然后将稻壳和稻米分别粉碎, 留样均不少于500 g.全部样品密封后贴好标签, 于-20 ℃冰箱冷冻保存.
2.2.3 空白对照小区在距离试验区30 m以外的田地作为空白对照试验小区, 不进行施药处理, 在消解动态试验期取田水、土壤和稻秆样品, 在最终残留试验期取水稻稻秆、稻米和稻壳样品, 样品制备及保存方法同2.2.1和2.2.2节.
2.3 分析方法样品提取、净化及检测方法(贾浩然, 2019)已建立, 可进行参考.嘧草醚采用HPLC-MS检测, 色谱条件:流动相为V (乙腈):V (0.1%甲酸水溶液)=70:30的混合溶液;流速0.8 mL·min-1;柱温35 ℃;进样量10 μL.质谱条件:正离子扫描;SIM m/z 384.4;毛细管电压± 3000 V;干燥气(氮气)流速12.0 L·min-1;雾化气压力35~45 kPa;干燥气温度350 ℃;碰撞诱导解离电压152 V;增益10.00;驻留590;相对驻留100%.
2.4 膳食风险评估方法采用风险商值(RQ)进行嘧草醚的膳食风险评估, 分别由式(1)和(2) (中国农业科学院农业产品质量标准与检测技术研究所, 2007;吕竹岱等, 2011;邵建果等, 2013)计算得出膳食暴露和风险评估结果.
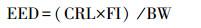
|
(1) |
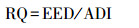
|
(2) |
式中, EED为估计暴露量(mg·kg-1), CRL为理论残留量(mg·kg-1), FI为食物摄入量(kg), BW为体重(kg), RQ为风险商值, ADI为每日允许摄入量(mg·kg-1).当RQ>1时, 表示存在不可接受的较大风险;当RQ<1时, 表示风险是可以接受的.
3 结果(Results) 3.1 嘧草醚在田水、土壤和稻株中的初始残留量以施药2 h后测得的嘧草醚残留量为初始残留量, 2年的测定结果基本一致, 见表 2.嘧草醚在稻株中的初始残留量最大, 2018年为1.4461~2.1260 mg·kg-1, 2019年为1.6472~3.3939 mg·kg-1;其次是土壤中, 2018年为0.1696~0.5326 mg·kg-1, 2019年为0.1616~0.4841 mg·kg-1;最后是水中, 2018年为0.0460~0.1462 mg·kg-1, 2019年为0.0399~0.1698 mg·kg-1.由于施药方式是拌土撒施, 且嘧草醚水溶性好, 本身是内吸传导型除草剂, 嘧草醚在被施用时, 一部分经接触的稻株叶片吸收传导, 一部分残留在土壤中, 经水稻根部吸收传导, 因此稻株中嘧草醚的初始残留量最高.
| 表 2 嘧草醚在田水、土壤和稻株中的初始残留量 Table 2 Initial residual levels of pyriminobac-methyl in paddy water, paddy soil, and rice plants |
由表 3可见, 嘧草醚在田水和土壤中的消解动态均符合一级动力学方程.施药后1 d, 4地田水中嘧草醚浓度下降了20.3%~57.8%, 至第7 d, 残留消解率达70.2%~98.7%. 2018年嘧草醚在4地田水中的消解半衰期在1.07~3.19之间, 最低为南昌(1.07~1.11), 最高为佳木斯(2.45~3.19);2019年在1.99~3.48之间, 最低为南昌(1.99~2.12), 最高为佳木斯(3.04~3.48).
| 表 3 嘧草醚在田水、土壤及植株中的消解动态 Table 3 Dissipation of pyriminobac-methyl in field water, soil and rice plant |
施药后1 d, 4地土壤中嘧草醚浓度下降了8.2%~31.9%, 至第7 d, 残留消解率达59.1%~82.5%. 2018年嘧草醚在4地土壤中的消解半衰期在3.14~4.47之间, 最低为宁波(3.14~3.40), 最高为佳木斯(4.16~4.17). 2019年在3.21~5.42之间, 最低为宁波(3.21~3.93), 最高为佳木斯(4.87~5.42).
3.3 嘧草醚在水稻植株中的消解动态嘧草醚在水稻植株中的消解动态符合一级动力学方程(表 3).施药后1 d, 4地稻株中嘧草醚浓度下降了4.3%~14.3%, 至第7 d, 残留消解率达40.9%~69.0%. 2018年嘧草醚在4地稻株中的消解半衰期在4.47~7.89之间, 最低为南昌(4.47~4.89), 最高为佳木斯(7.63~7.89), 2019年在4.48~8.31之间, 最低为南昌(4.48~5.18), 最高为佳木斯(8.08~8.31).
3.4 稻米的药剂残留量及膳食风险评估最终残留的检测对于嘧草醚在水稻上使用的安全性评估有着重要的意义.按照已建立的残留分析方法对4地收获期样品进行最终残留测定, 测得嘧草醚在稻米、稻壳和稻杆中的最终残留量, 结果见表 4.
| 表 4 2018和2019年嘧草醚在水稻中的最终残留量 Table 4 Final residues of pyriminobac-methyl in rice during 2018 and 2019 |
从佳木斯、济宁、宁波和南昌2年4地的最终残留结果来看, 嘧草醚在稻米中的最终残留量为ND~0.0092 mg·kg-1, 在稻壳中最终残留量为0.0029~0.0112 mg·kg-1, 在稻杆中最终残留量为0.0024~0.0100 mg·kg-1.由此可见, 嘧草醚在稻壳中的最终残留量最高, 其次是稻杆中, 最后是稻米中.我国目前暂未制定水稻上嘧草醚的最大残留限量值, 在收获的稻米中测定嘧草醚的最大残留量未超过日本和韩国规定的MRL值(0.05 mg·kg-1) (秦美玲, 2017;http://202.127.42.84/tbt-sps/mrlsdb/queryMrlsdb.do).
根据我国国家相关标准的规定(Chaisson et al., 1987; Petersen et al., 1994;高仁君等, 2004), 嘧草醚人体每千克体重每日允许摄入量(ADI)为0.02 mg(GB 26130—2010), 按照我国人均体重65 kg计算, 则人均日允许摄入量为1.30 mg.根据《中国居民膳食指南》(2011年全新修订), 我国人均膳食结构中谷类食物及其制品的每日摄入量成年人一般为250~400 g, 结合本文研究测得的稻米中嘧草醚的最终残留量最高为0.0092 mg·kg-1, 可以推断我国每人每天通过谷类食物及其制品所摄入的嘧草醚最大量为0.0037 mg, 远低于嘧草醚人均日允许摄入量1.30 mg, 风险商值(RQ)仅为0.0028, 远小于1, 膳食暴露风险较低, 处于可接受的安全水平.此外, 嘧草醚残留量主要存在于稻壳中, 当稻壳用作饲料、糠时也存在着一定的风险.
4 讨论(Discussion)2018—2019年嘧草醚在4地田水、土壤和稻株中的消解动态曲线分别见图 1和图 2.因嘧草醚水溶性较好, 施药后快速溶解在水里并沉积在土壤中, 一部分被稻株根部吸收.且因施药方式为拌土撒施, 撒施后粘附在叶片上的嘧草醚较多, 部分内吸之后在稻株内部消解较慢, 因此嘧草醚在4地不同样品中的初始残留量大小为:稻株>土壤>田水.
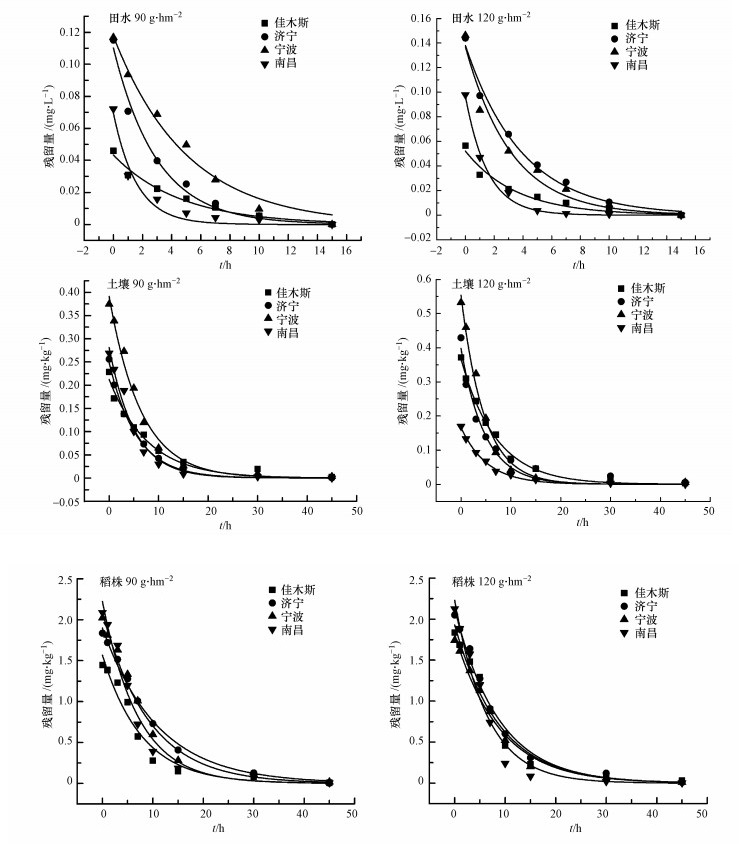 |
| 图 1 嘧草醚在田水、土壤和植株上的消解动态(2018年) Fig. 1 The residual dynamic of pyriminobac-methyl in field water, soil and rice plant(2018 year) |
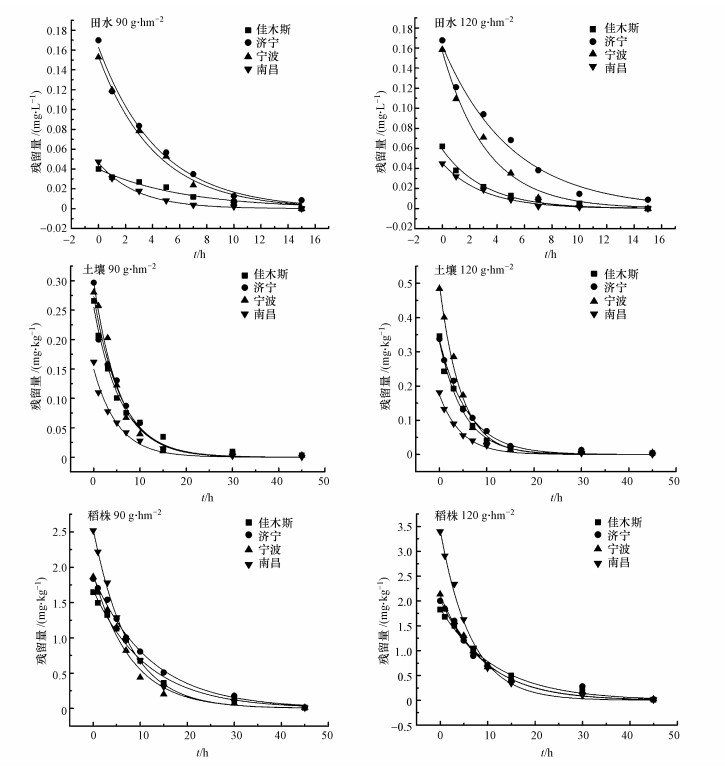 |
| 图 2 嘧草醚在田水、土壤和植株上的消解动态(2019年) Fig. 2 The residual dynamic of pyriminobac-methyl in field water, soil and rice plant(2019 year) |
不同土壤性质和气候条件对嘧草醚在田水、土壤和稻株中的消解半衰期的影响见表 5.农药的消解过程取决于当地的气候环境、土壤类型和作物种类等多种因素(Liu et al., 2016).水中的农药降解与周围土壤和植株等的热力学扩散有关, 受光、热、pH值等因素影响.在本研究中, 将田水消解半衰期与土壤有机质含量、土壤pH值、总降雨量和平均气温作线性回归分析, 发现田水中嘧草醚的消解半衰期与土壤有机质含量和土壤pH呈正相关, 即土壤有机质含量越高, 田水中嘧草醚消解速率越快.这可能由于土壤有机质含量越高, 吸附能力越好, 土壤吸附水中的嘧草醚越多, 导致田水中嘧草醚的浓度下降.同时与平均气温呈负相关, 且相关性较强, 温度对田水中的悬浊沉淀、土壤的吸附渗透和植株的根部吸收等热力学过程影响显著, 即年平均气温越低, 其消解半衰期越长.而总降水量与田水中嘧草醚的消解速率的相关性不大.但由于4地土壤有机质含量和土壤pH差别不大, 所以说平均气温对其影响较大更合理.这与嘧草醚在年平均气温高的南昌田水中消解较快相符合.
| 表 5 嘧草醚在田水、土壤和稻株中消解t1/2与不同土壤性质和气候条件的线性回归分析 Table 5 Linear regression Analysis of the digestion of t1 / 2 in paddy water, soil and rice plants with different soil properties and climate conditions |
在土壤中, 农药消解主要由淋溶、吸附和微生物降解等行为影响, 是温度、pH值、有机质含量和微生物组成等多方面作用的结果(Kumar et al., 2005;Dhananjay et al., 2005;Pateiro Moure et al., 2008;许迪等, 2013).线性回归分析结果发现土壤中嘧草醚的消解半衰期与土壤有机质含量和土壤pH呈正相关, 且有较强相关性, 即土壤有机质含量和土壤pH值越高, 土壤中嘧草醚消解速率越快.土壤有机质含量高, 一方面易于吸收水中的农药成分, 增加土壤中嘧草醚的浓度, 另一方面也有助于产生高的土壤微生物活性, 利于微生物降解, 降低嘧草醚含量.同时与总降雨量和平均气温均呈负相关, 且与平均气温有显著相关性, 随着纬度降低, 年平均气温增加, 土壤中嘧草醚的消解速度越快.多因素综合显示, 嘧草醚在年平均气温较高、降雨较多的宁波土壤中消解最快.
在稻株中, 农药的消解与施药方式、农药本身的性质、降雨量和气温有很大关系(伍一红等, 2012).线性回归分析结果发现稻株中嘧草醚的消解半衰期与土壤有机质含量和土壤pH呈正相关, 且有较强相关性, 即土壤有机质含量越高, 土壤pH值越大, 消解半衰期越长.本研究使用的除草剂为10%可湿性粉剂, 是一种选择内吸传导型农药, 施药方式为拌细土撒施, 土壤有机质含量高, 导致稻株根部可吸收土壤中的嘧草醚浓度高, 这也是一开始检测稻株中嘧草醚的初始残留量最高的原因.同时与总降雨量和平均气温均呈负相关, 即降雨量越大, 年平均温度越低, 嘧草醚消解半衰期越长.综合来看土壤有机质含量和平均气温对稻株中嘧草醚的消解起到比较大的作用.
5 结论(Conclusions)1) 2年4地的消解动态试验结果表明, 嘧草醚在田水、土壤和稻株中的消解均符合一级动力学方程.从嘧草醚在田水、土壤和稻株的消解动态和消解半衰期来看, 嘧草醚属于易降解农药(t1 /2 < 30 d)(国家环境保护总局, 2003).在田水中的消解半衰期为1.07~3.48 d, 土壤中为3.14~5.42 d, 稻株中为4.47~8.31 d.
2) 经过线性回归分析, 综合土壤有机质含量、土壤pH、总降水量和平均气温等因素来看, 嘧草醚在年平均气温低, 降雨少, 土壤有机质含量较高的佳木斯试验点的消解速率较低, 半衰期较长;相反, 在年平均气温高的南昌和宁波消解速率高.
3) 最终残留试验结果表明, 嘧草醚在稻米中的最终残留量为ND~0.0092 mg·kg-1, 参考日本和韩国规定的MRL值(0.05 mg·kg-1), 残留浓度处于安全水平.
4) 风险评估结果显示, 嘧草醚在水稻中的风险商值仅为0.0028, 远小于1, 处于安全水平, 但由于本研究仅估算了水稻中残留的嘧草醚, 尚未考虑通过其他途径可能摄入的嘧草醚对人体的影响, 因此, 其安全风险需进一步确定.
Chaisson C F, Petersen B J, Waylett J C. 1987. Pesticide in Our Food: Facts, Issues, Debates and Perceptions[M]. Washington, DC: Technical Assessment System
|
Castillo-Sánchez J, Aguilera-del Real A, Rodriguez-Sánchez M, et al. 2000. Residue levels, decline curves, and plantation distribution of procymidone in green beans grown in greenhouse[J]. Journal of Agricultural Food and Chemistry, 48(7): 2991-2994. DOI:10.1021/jf990770y |
程志明. 2003. 除草剂嘧草醚的开发[J]. 世界农药, 25(1): 1-6, 23. DOI:10.3969/j.issn.1009-6485.2003.01.001 |
Dhananjay K T, Vipin K, Ravindranath S D, et al. 2005. Dissipation behavior of bifenthrin residues in tea and its brew[J]. Food Control, 16: 231-237. DOI:10.1016/j.foodcont.2004.02.004 |
国家环境保护总局. 2003.化学农药环境安全评价试验准则[M].北京: 国家环境保护总局
|
贾浩然, 张月, 李卫, 等. 2019. 嘧草醚在水稻及其环境中的残留[J]. 农药学学报, 21(2): 250-254. |
贾浩然, 张月, 李卫, 等. 2019. 10%嘧草醚可湿性粉剂的高效液相色谱-串联质谱分析[J]. 农药, 58(2): 106-108. |
Kumar V, Sood C, Jaggi S, et al. 2005. Dissipation behavior of propargite-an acaricide residues in soil, apple (Malus pumila) and tea (Camellia sinensis)[J]. Chemosphere, 58: 837-843. DOI:10.1016/j.chemosphere.2004.06.032 |
吕竹岱, 林勇, 李建国, 等. 2011. 壬基酚聚氧乙烯醚及其降解产物壬基酚在香蕉和土壤中的消解动态及风险评估[J]. 农药学学报, 13(6): 627-631. DOI:10.3969/j.issn.1008-7303.2011.06.12 |
刘淑杰, 吴公信, 梁敏. 2011. 嘧草醚原药的高效液相色谱分析[J]. 农药, 50(9): 659-660. DOI:10.3969/j.issn.1006-0413.2011.09.011 |
Liu J, Rashid M, Qi J, et al. 2016. Dissipation and metabolism of tebufenozide in cabbage and soil under open field conditions in South China[J]. Ecotoxicology and Environmental Safety, 134(1): 204-212. |
Omirou M, Vryzas Z, Papadopoulou-Mourkidou E, et al. 2009. Dissipation rates of iprodione and thiacloprid during tomato production in greenhouse[J]. Food Chemistry, 116(2): 499-504. DOI:10.1016/j.foodchem.2009.03.007 |
Petersen B J, Barraj L M, Muenz L R, et al. 1994. Analternative approach to dietary exposure assessment[J]. Risk Analysis, 14(6): 913-916. DOI:10.1111/j.1539-6924.1994.tb00060.x |
Pateiro-Moure M, Arias-Estévez M, López-Periago E, et al. 2008. Occurrence and downslope mobilization of quaternary herbicide residues in vineyard-devoted soils[J]. Bulletin of Environmental Contamination and Toxicology, 80: 407-411. DOI:10.1007/s00128-008-9403-z |
Pyriminobac-Methyl and Bispyribac-Sodium in Rice[OL]. 2012-05-29. http://202.127.42.84/tbt-sps/mrlsdb/queryMrlsdb.do
|
秦美玲, 柴爽爽, 马有宁, 等. 2017. 基于QuEChERS-液相色谱-串联质谱法测定稻米中嘧草醚和双草醚残留[J]. 色谱, 35(7): 719-723. |
沈国辉, 杨烈. 2001. 嘧草醚(pyriminobac-methyl)防除稻田稗草试验[J]. 世界农药, 23(2): 51-53. DOI:10.3969/j.issn.1009-6485.2001.02.015 |
邵建果, 杨俊柱, 王军. 2013. 噻虫嗪在小麦中的残留消解动态及风险评估[J]. 农药学学报, 15(1): 98-102. DOI:10.3969/j.issn.1008-7303.2013.01.14 |
王大宁, 董益阳, 邹明强. 2006. 农药残留检测与监控技术[M]. 北京: 化学工业出版社.
|
吴雄哲, 杨玉廷, 金春兰. 2010. 嘧草醚对大叶龄稗草的室内防除效果及对水稻的安全性研究[J]. 现代农药, 9(4): 46-47. DOI:10.3969/j.issn.1671-5284.2010.04.013 |
伍一红, 龚道新, 张素芳, 等. 2012. 杀螺胺乙醇胺盐在水稻和稻田中的残留及消解动态[J]. 农业环境科学学报, 31(2): 278-283. |
许迪, 于丁一, 田国芳, 等. 2013. 吡嘧磺隆在水稻、土壤和田水中的消解和残留[J]. 环境化学, 32(1): 150-155. |
张特, 赵强, 康正华, 等. 2018. 嘧啶(氧)硫苯甲酸类除草剂研究进展[J]. 植物保护, 44(2): 22-28. |
 2020, Vol. 40
2020, Vol. 40


