砷(As)是一种高毒类金属, 具有很强的致畸、致癌作用, 其致癌性被国际癌症研究机构列为一级(佟俊婷等, 2013).近年来, 随着含砷金属矿产的开采与冶炼、化石燃料的燃烧、含砷化学制品及农药的使用、木材防腐及工业废水的排放和非法倾倒等, 导致土壤中砷浓度日益增加, 引起了不同程度的土壤砷污染(纪冬丽等, 2016).土壤中砷主要以无机的亚砷酸盐(三价砷)和砷酸盐(五价砷)形式存在.土壤中的砷进入食物链会对人类健康造成潜在的致病威胁(Rasheed et al., 2016;Rai et al., 2019), 因此, 砷污染土壤的修复至关重要.
目前应用于砷污染土壤的物理-化学修复技术主要有固化/稳定化、土壤淋洗、玻璃化和原位电动修复技术等(Parihar et al., 2014;莫小荣等, 2017).化学稳定化技术是一种效率高且经济可行的修复措施, 是砷和重金属污染土壤修复的常用方法, 该方法主要通过离子交换、络合/螯合、氧化-还原、共沉淀等作用, 使土壤中的砷从易溶态转换为难溶态, 从而降低砷的生物有效性和毒性.氧化锰材料(主要指MnO2)因具有比表面积大、表面活性强、电荷零点低、负电荷量高等特点, 能氧化变价金属(如As(Ⅲ))而减弱其毒性(刘凡等, 2008;Wang et al., 2015), 是常用的稳定药剂之一.生物氧化锰(biogenic Mn oxides, BMO)是纳米颗粒的隐晶质材料, 与化学合成的锰氧化物矿物具有明显不同的特征:如结晶弱、粒径小、Mn价态高, 结构中八面体空穴多, 更大的比表面积等, 从而对重金属具有更强的吸附作用、氧化能力和表面活性(Tebo et al., 2004;Estes et al., 2017), 因此在土壤修复方面具有巨大的应用潜力.
前期研究发现, BMO对三价砷具有较强的亲和能力, 能够快速氧化和固定土壤中的三价砷, 将三价砷转化成为不活泼的五价砷, 从而降低砷的毒害程度(Wang et al., 2020), 但BMO对土壤中砷的稳定化效果受到诸多因素影响, 如稳定剂性质、土壤有机质、氧化还原电位(Eh)、pH以及共存离子等(Masschelevn. et al., 1991;He et al., 2019).研究表明, 三价铁离子的存在可以与As(Ⅲ/Ⅴ)形成铁砷共沉淀, 促进砷的稳定化作用, 但三价铁离子的水解作用可能会改变土壤胶体性质(如pH和表面电荷), 影响砷的赋存形态(Moore et al., 2000)以及改变BMO表面结构和活性点位, 从而影响BMO对土壤中砷的稳定化效率.但目前关于三价铁影响BMO稳定化土壤砷效果的研究相对较少.因此, 本文通过室内模拟实验, 向BMO稳定化砷污染土壤中添加不同含量的三价铁, 研究三价铁对BMO稳定土壤中砷的影响效应, 并通过连续形态提取、风险分级及微观分析等方法探讨三价铁存在时BMO对土壤砷稳定化机制、矿物结构和环境风险的影响, 以期为BMO稳定化修复实际砷污染土壤提供科学指导.
2 材料与方法(Materials and methods) 2.1 污染土壤本实验所用的砷污染土壤取自青岛某表层(0~20 cm)农田土, 采集的土壤样品经过自然风干后, 研磨过100目尼龙筛, 混合均匀后储存备用.供试土壤基本理化性质为:土壤类型为黄色黏土, pH 4.93, 有机质百分含量为2.95%, 电导率为57.00 μS·cm-1, 全氮含量为108.23 mg·kg-1, 速效磷含量为30.51 mg·kg-1, 速效钾含量为75.42 mg·kg-1, 土壤中总砷含量为25.53 mg·kg-1.
2.2 供试材料生物氧化锰的制备所用菌株为恶臭假单胞菌MnB1, 购买于美国模式培养物保藏所(ATCC).所用的培养基组成为:硫酸亚铁铵, 0.15 g·L-1;酵母浸粉, 0.075 g·L-1;柠檬酸钠, 0.15 g·L-1;焦磷酸钠, 0.05 g·L-1;碳酸锰1 g·L-1, pH=6.8.将预先培养好的菌株按体积比为2%的接种量接种于上述培养基中, 于130 r·min-1 (30 ℃)条件下培养48 h, 即制得生物氧化锰悬浊液.经测定, 生物氧化锰初始浓度为0.64 g·L-1.制备好的BMO于4 ℃无光储存备用.对BMO特性分析可知, BMO中锰的价态主要为四价(Wang et al., 2019);扫描电镜(SEM)和透射电镜(TEM)分析表明新生成的氧化锰为层状矿物聚合体(图 1a, 1b);X射线衍射(XRD)结果表明(图 1c), 在12.5°和22°附近有2个衍射峰, 氧化锰的晶体结构主要为δ-MnO2, 与之前的研究结果一致(Villalobos et al., 2003).
 |
| 图 1 生物氧化锰的SEM(a)、TEM图像(b)和XRD (c) Fig. 1 SEM image (a), TEM image (b) and XRD pattern (c) of BMO |
供试土壤样品50.00 g于200 mL烧杯中, 加入50 mL生物氧化锰悬浊液, 分别按质量百分比0%(对照组)、0.5%、1%、2%、4%(以Fe计)加入三氯化铁, 各实验组分别记为BMO、BMO-0.5、BMO-1、BMO-2、BMO-4.将上述各组土壤样品于搅拌器800 r·min-1搅拌30 min, 置于人工气候培养箱(30℃, 相对湿度50%)中进行培养.培养5 d后取样, 土壤样品在室外风干、研磨, 过筛备用.对上述处理后土壤进行TCLP毒性浸出实验(Toxicity characteristic leaching procedure, HJ/T 300—2007), 采用1#浸提剂(醋酸、醋酸钠缓冲液, pH=4.93 ± 0.05), 按固液比1:20 (L·kg-1)加入浸提剂, 置于翻转振荡浸提18 h (转速(30 ± 2) r·min-1), 4000 r·min-1离心10 min, 收集上清液, 测定浸出液中砷的浓度, 计算砷的稳定化效率η(缪德仁等, 2010), 按照公式(1)进行计算:
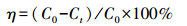
|
(1) |
式中, C0、Ct分别表示对照组、不同处理组TCLP毒性浸出液中砷的浓度.
采用五步连续提取法分析土壤中砷的结合形态(Wenzel et al., 2001).砷的结合形态分为可交换态(F1)、专属吸附态(F2)、无定型铁锰结合态(F3)、结晶型铁锰结合态(F4)和残渣态(F5).风险评价指数(RAC)模型作为一种相对简便的砷环境毒性评估方法, 被广泛应用于土壤中砷的环境风险评价.RAC数值按照下列公式计算(Sundaray et al., 2011):
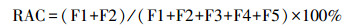
|
(2) |
式中, F1、F2、F3、F4和F5分别表示可交换态、专属吸附态、无定型铁锰结合态、结晶型铁锰结合态和残渣态的砷含量.
2.4 分析方法各处理土壤样品稳定化结束后, 取20 g于冷冻干燥机(FD-2B型, 上海比朗)中, 在-60 ℃冻干24 h, 玛瑙研磨后进行土壤性质分析.土壤基本理化性质按照土壤农化分析方法测定(杨剑虹等, 2008);土壤矿物物相组成分析采用X射线衍射仪(D8 advance, Bruker)测定;土壤矿物化学组成采用X射线荧光光谱仪(S4 Pioneer, Bruker)测定;pH值和电导率分别采用pH计(PHS-3C, 上海雷磁)和电导率仪(DDS-307A, 上海雷磁)测定;土壤中总砷浓度采用王水微波消解(XT-9912, 上海新拓)—原子荧光光度计(AFS-830, 北京吉天)进行测定.此外, 生物氧化锰的表面形貌采用SEM(Merlin compact, Zeiss)和TEM(Tecnai G2 F20, FEI)分析.
3 结果与讨论(Results and discussion) 3.1 土壤基本理化性质变化通过X射线荧光光谱对污染原土和各处理土壤进行化学组成分析(表 1).从表 1可知, 污染原土主要化学组成为SiO2(61.50%)、Fe2O3(12.43%)、Al2O3(14.91%).BMO处理后的土壤各化学组成并未发生明显改变.当添加质量百分比为1%~4%的三价铁时, 三价铁离子的水解作用形成铁(氢)氧化物, 导致Fe2O3含量逐渐增加, 而碱性氧化物CaO、K2O、MgO等含量逐渐减少.
| 表 1 土壤中化学组成变化 Table 1 The changes of chemical fraction in soils |
土壤pH是影响砷在土壤中稳定化效果的重要因素之一.图 2为施加三价铁对BMO稳定化土壤中pH的变化情况.污染土壤pH为4.93, 当BMO处理后土壤pH升高至6.16.前期研究表明, 污染土壤主要以三价砷为主, BMO的添加会氧化土壤中As(Ⅲ)而转化形成As(Ⅴ), 同时伴随着质子(H+)的消耗(式(3))(Masscheleyn et al., 1991; Wang et al., 2020).三价铁存在的环境下土壤pH明显降低, 添加三价铁后土壤pH较单独BMO下降3.16~4.08, 各处理组之间存在显著差异(p<0.05);随着三价铁添加量的增加, pH呈逐渐下降趋势.当三价铁添加量为0.5%、1%、2%和4%时, 土壤pH由6.16分别降至3.00、2.46、2.24和2.08.Kim等(2003)研究发现, 施用三价铁能够对污染土壤中砷有良好的稳定化作用, 但三价铁离子的水解作用会导致土壤pH降低(式(4)).此外, 由表 1可知, 土壤中CaO等碱性氧化物的相对含量减少也是土壤pH下降的原因之一.因此, 在后续工程应用过程中, 可通过添加CaO等碱性物质来调理土壤pH, 避免三价铁过量投加时造成的土壤酸化问题.
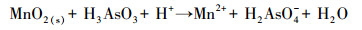
|
(3) |
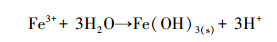
|
(4) |
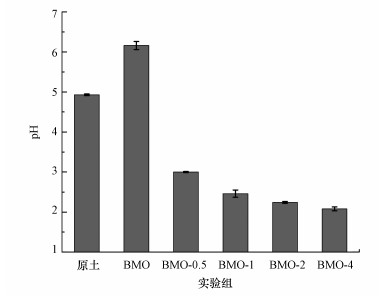 |
| 图 2 土壤pH变化 Fig. 2 The changes of soil pH |
图 3为施加三价铁对BMO稳定化土壤中砷效率的影响.从图 3可以看出, 添加三价铁离子会提高BMO对土壤中砷的稳定化效率;在1%~4%范围内随着三价铁添加量的增加, 砷的稳定化效率逐渐升高.与对照组BMO相比, 以0.5%、1%、2%、4%质量百分比添加三价铁时, 砷的稳定化效率由63.02%分别升高至86.04%、93.86%、96.56%、97.98%.整体而言, 添加三价铁时土壤中砷的稳定化效率均达到80%以上, 说明三价铁的存在能够提升BMO对土壤中砷的稳定化效率.研究表明, 添加FeCl3能够有效降低土壤中水溶性砷和三价砷含量, 植物的生长情况更好(Xie et al., 1998).此外, 三价铁离子能够通过水解作用在碳酸钙矿物表面原位形成水合铁氧化物, 并通过共沉淀的方式吸附固定水中的三价砷;且当As/Fe的摩尔比在4.5:1时, 三价砷的去除效率可达到95%以上(Zhang et al., 2019).
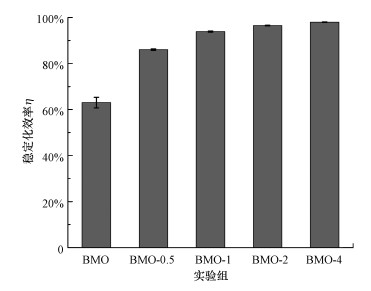 |
| 图 3 土壤中砷的稳定化效率 Fig. 3 The changes of As stabilization efficiency in soils |
利用XRD对土壤样品进行物相组成分析, 结果如图 4所示.从图 4a可以看出, 污染原土主要矿物成分为石英(SiO2)、硬水铝石(Al2O3·H2O)以及针铁矿(α-FeOOH).由图 4b可知, BMO处理后的土壤矿物结构并未发生明显改变.由于BMO主要以弱晶型的δ-MnO2存在, 因此, XRD可能无法检测出BMO矿物结构.由图 4c~4f可以看出, 经三价铁处理后的土壤新增了水铁矿(5Fe2O3·9H2O)和四方纤铁矿(β-FeOOH)等矿物, 这些铁氧化物是三价铁离子在水解过程中产生的次级氧化物或氢氧化物.
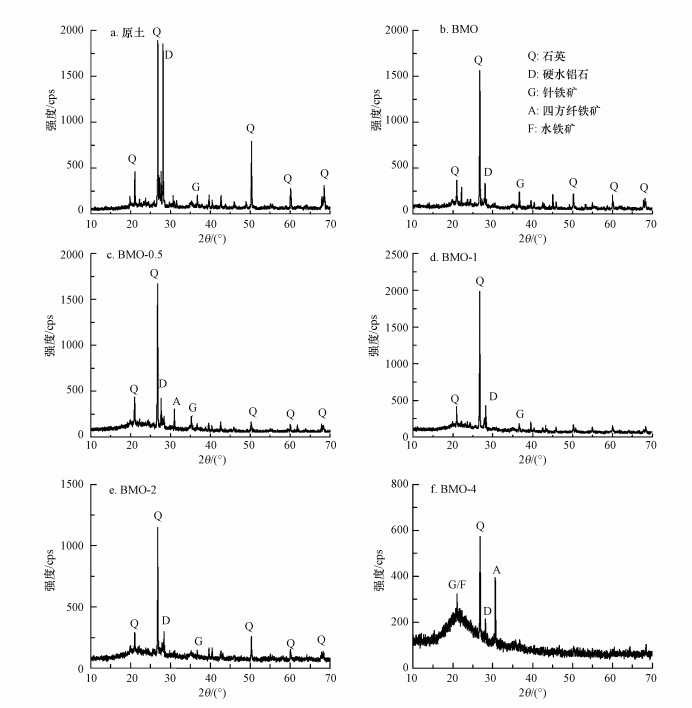 |
| 图 4 污染土壤物相分析图 Fig. 4 Phase composition of the contaminated soils |
Moore等(2000)指出铁氧化物的存在可以有效降低土壤中砷的移动性和生物有效性.水铁矿是三价铁离子水解过程中最先出现的沉淀物, 其结构不稳定, 很容易向更稳定的针铁矿或赤铁矿转化.水铁矿具有极大的比表面积和高表面活性, 可以通过吸附和共沉淀作用稳定化土壤中的砷(Wang et al., 2018).Jiang等(2015)研究了水铁矿对砷的吸附机制, 结果表明, 水铁矿对砷的吸附首先是通过表面螯合进行的, 而溶液中Fe3+与吸附在水铁矿表面砷的结合可以使溶液中砷再次通过表面螯合而被吸附, 因而溶解性三价铁离子的存在有利于水铁矿对砷的稳定化.四方纤铁矿系非晶态的铁的水合氧化物脱水而成.Pepper等(2018)研究表明, 利用赤泥制备的四方纤铁矿能够有效吸附去除水中的五价砷, 最大吸附量可以达到27.8 mg ·g-1.
此外, 三价铁离子在水解过程中产生的次级氧化物会与三价砷或五价砷离子发生表面共沉淀反应, 生成稳定性更强的砷酸铁矿物(FeAsO4·H2O、FeAsO4·2H2O或Fe3(AsO4)2)(Kumoiene et al., 2008).Carlson等(2002)发现五价砷和三价铁可以形成砷酸铁矿物.Porter等(2004)研究发现, 在低pH和强氧化性条件下, 砷和三价铁可以形成臭葱石(FeAsO4·2H2O), 而在pH 5.0和适当的氧化条件下可能生成溶解性更低的Fe3(AsO4)2.本研究中各处理土壤均未检测出砷酸铁矿物, 可能由于该矿物的相对含量低于XRD的检出限.有研究表明(Miretzky et al., 2010;Komárek et al., 2013), 在砷污染土壤的稳定化过程中, 难溶性的Fe(Ⅲ)-As(Ⅴ)矿物的形成降低了As的移动性和生物有效性.总而言之, BMO可以氧化土壤中三价砷为低毒的五价砷;当添加三价铁后, 土壤中出现水铁矿、纤铁矿等次生铁氧化物, 这些铁氧化物一方面能够直接吸附固定三价和五价砷, 还能够以共沉淀等方式固定土壤中的砷于矿物晶格, 进而提高了土壤中砷的稳定化效率.
3.4 砷的赋存形态分析和风险评价指数根据Wenzel连续提取方法, 土壤中砷的结合形态可分可交换态(F1)、专属吸附态(F2)、无定型铁锰结合态(F3)、结晶型铁锰结合态(F4)和残渣态(F5)等5种, F1~F5形态砷的化学稳定性依次增高.从图 5a可以看出, 污染原土和BMO处理后土壤中砷主要以残渣态为主, 占总砷含量的60%左右.施加三价铁对土壤中砷的结合形态影响较大, 土壤中砷由交换态、专属吸附态向更稳定的无定型铁锰结合态和结晶型铁锰结合态转化.三价铁添加量为0.5%、1%、2%和4%时, 专属吸附态的砷由单独BMO的10.68%降至9.39%、5.51%、6.14%和5.39%, 而无定型铁锰结合态由19.67%增加至22.08%、23.41%、24.75%和24.54%, 同时结晶型铁锰结合态由对照组的7.16%升高至10.36%、13.51%、16.12%和15.92%.三价铁添加后残渣态砷的比例在土壤中无显著变化规律.由图 4可知, 三价铁离子在土壤中发生水解氧化, 形成水铁矿、纤铁矿、赤铁矿等矿物, 这些带正电荷的铁(氢)氧化物能够吸附固定亚砷酸根和砷酸根离子, 形成单齿单核或双齿双核的化合物以及难溶的铁砷共沉淀, 降低土壤砷的活性和生物有效性(胡立琼等, 2014).此外, 费杨等(2017)研究也表明, 人工合成的铁锰双金属材料对土壤中砷起到良好的稳定化作用, 这些铁锰双金属氧化物材料能够使土壤中的砷由酸可提取态向可还原态转变, 增强其化学稳定性.
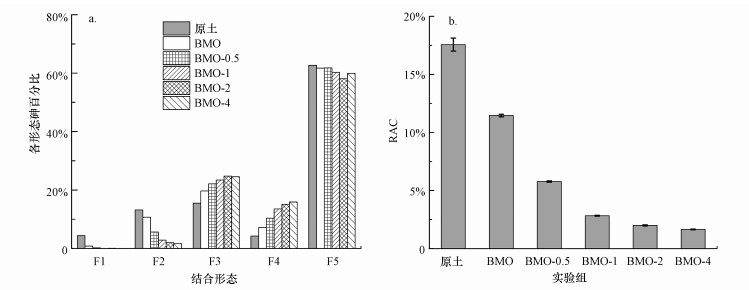 |
| 图 5 土壤中砷的稳定化效率(a)和风险评价指数(b)变化 Fig. 5 The changes of As stabilization efficiency (a) and RAC (b) in soils |
基于风险指数RAC数值的变化可表征砷在土壤中的环境风险.根据RAC文献参考(Liu et al., 2008), 可将砷的RAC值划分为5个不同的等级, 分别代表 5种不同的环境风险水平:RAC>50%, 非常高风险;30%<RAC≤50%, 高风险;10%<RAC≤30%, 中风险;1%<RAC≤10%, 低风险;RAC≤1%, 安全.由图 5b可以看出, 污染原土砷的RAC值为17.56%, 属于中风险.经BMO处理后RAC值降至11.46%.随着三价铁添加量的增加, 砷的RAC值逐渐减小.当三价铁以0.5%、1%、2%和4%添加时, RAC值由BMO组的11.47%降至5.78%、2.83%、1.99%和1.65%.可见, 添加三价铁后砷的环境风险由中风险转变为低风险.研究表明, 砷的RAC变化与砷的赋存形态变化密切相关.对比稳定化前后土壤中砷的赋存形态和风险指数变化, 添加三价铁会显著提高BMO对土壤中砷的稳定性, 砷的结合形态由表面吸附态向稳定性更高的铁铝结合态和酸提取态转化, 表明土壤中活性较高的砷会与铁、锰氧化物相结合, 形成更稳定的铁、锰氧化物复合物存在, 因而降低砷的浸出浓度和环境风险指数.
4 结论(Conclusions)1) 添加三价铁提高了BMO对土壤中砷的稳定化效率, 由对照组的63.02%提升至86.04%~97.98%, 但添加量过高会引起土壤酸化.
2) 添加三价铁后, 其水解过程中产生的水铁矿和四方纤铁矿等次生铁氧化物能够有效吸附固定土壤中的砷, 进而显著提高砷的稳定化效率.
3) 添加三价铁能够促进土壤中砷由可交换态、专属吸附态向无定型铁锰结合态和结晶型铁锰结合态转变, 环境风险由中风险转变为低风险, 土壤中砷的化学稳定化增强.
4) 综合本研究结果, 建议三价铁的添加量为1%~2%.
Carlson L, Bigham J M, Schwertmann U, et al. 2002. Scavenging of As from acid mine drainage by schwertmannite and ferrihydrite:A comparison with synthetic analogues[J]. Environmental Science & Technology, 36(8): 1712-1719. |
Estes E R, Andeer P F, Nordlund D, et al. 2017. Biogenic manganese oxides as reservoirs of organic carbon and proteins in terrestrial and marine environments[J]. Geobiology, 15(1): 158-172. DOI:10.1111/gbi.12195 |
费杨, 阎秀兰, 廖晓勇, 等. 2017. 铁锰双金属材料对As和重金属复合污染土壤钝化修复及其生态效应的影响[J]. 农业环境科学学报, 36(1): 57-65. |
He Z F, Li Z Y, Zhang Q Y, et al. 2019. Simultaneous remediation of As(Ⅲ) and dibutyl phthalate (DBP) in soil by a manganese-oxidizing bacterium and its mechanisms[J]. Chemosphere, 220: 837-844. DOI:10.1016/j.chemosphere.2018.12.213 |
胡立琼, 曾敏, 雷鸣, 等. 2014. 含铁材料对污染水稻土中砷的稳定化效果[J]. 环境工程学报, 8(4): 1599-1604. |
纪冬丽, 孟凡生, 薛浩, 等. 2016. 国内外土壤砷污染及其修复技术现状与展望[J]. 环境工程技术学报, 6(01): 90-99. |
Jiang X L, Peng C J, Fu D, et al. 2015. Removal of arsenate by ferrihydrite via surface complexation and surface precipitation. Applied Surface Science[J].Applied Surface Science, 353: 1087-1094
|
Kim J Y, Davis A P, Kim K W. 2003. Stabilization of available arsenic in highly contaminated mine tailings using iron[J]. Environmental Science & Technology, 37(1): 189-195. |
Komárek M, Vaněk A, Ettler V. 2013. Chemical stabilization of metals and arsenic in contaminated soils using oxides:a review[J]. Environmental Pollution, 172: 9-22. DOI:10.1016/j.envpol.2012.07.045 |
Kumpiene J, Lagerkvist A, Maurice C. 2008. Stabilization of As, Cr, Cu, Pb and Zn in soil using amendments:a review[J]. Waste Management, 28(1): 215-225. DOI:10.1016/j.wasman.2006.12.012 |
刘凡, 冯雄汉, 陈秀华, 等. 2008. 氧化锰矿物的生物成因及其性质的研究进展[J]. 地学前缘, 15(06): 66-73. |
Liu H L, Li L Q, Yin C Q, et al. 2008. Fraction distribution and risk assessment of heavy metals in sediments of Moshui Lake[J]. Journal of Environmental Sciences, 20(4): 390-397. |
Masscheleyn P H, Delaune R D, Jr W H P. 1991. Effect of redox potential and pH on arsenic speciation and solubility in a contaminated soil[J]. Environmental Science & Technology, 25(8): 1414-1419. |
缪德仁. 2010.重金属复合污染土壤原位化学稳定化试验研究[D].北京: 中国地质大学(北京)
|
Miretzky P, Cirelli A F. 2010. Remediation of arsenic-contaminated soils by iron amendments:a review[J]. Critical Reviews in Environmental Science and Technology, 40(2): 93-115. DOI:10.1080/10643380802202059 |
莫小荣, 吴烈善, 王芸, 等. 2017. 复合材料对砷污染土壤稳定化处理及机理研究[J]. 环境科学学报, 37(3): 1115-1121. |
Moore T J, Rightmire C M, Vempati R K. 2000. Ferrous iron treatment of soils contaminated with arsenic-containing wood-preserving solution[J]. Journal of Soil Contamination, 9(4): 375-405. |
Parihar P. 2014. Arsenic contamination, consequences and remediation techniques:A review[J]. Ecotoxicology and Environmental Safety, 112: 247-270. |
Pepper, R A, Couperthwaite S J, Millar G J. 2018. A novel akaganeite sorbent synthesised from waste red mud:Application for treatment of arsenate in aqueous solutions[J]. Journal of Environmental Chemical Engineering, 6(5): 6308-6316. DOI:10.1016/j.jece.2018.09.036 |
Porter S K, Scheckel K G, Impellitteri C A, et al. 2004. Toxic metals in the environment:thermodynamic considerations for possible immobilization strategies for Pb, Cd, As, and Hg[J]. Critical Reviews in Environmental Science and Technology, 34(6): 495-604. DOI:10.1080/10643380490492412 |
Rai P K, Lee S S, Zhang M, et al. 2019. Heavy metals in food crops:Health risks, fate, mechanisms, and management[J]. Environment International, 125: 365-385. DOI:10.1016/j.envint.2019.01.067 |
Rasheed H, Slack R, Kay P. 2016. Human health risk assessment for arsenic:A critical review[J]. Critical Reviews in Environmental Science and Technology, 46(19/20): 1529-1583. |
Sundaray S K, Nayak B B, Lin S, et al. 2011. Geochemical speciation and risk assessment of heavy metals in the river estuarine sediments-A case study:Mahanadi basin, India[J]. Journal of Hazardous Materials, 186(2/3): 1837-1846. |
Tebo B M, Bargar J R, Clement B G, et al. 2004. Biogenic manganese oxides:Properties and mechanisms of formation[J]. Annual Review of Earth and Planetary Sciences, 32(1): 287-328. DOI:10.1146/annurev.earth.32.101802.120213 |
佟俊婷, 韦超, 郭华明. 2013. 内蒙古自治区河套平原砷中毒高发区作物中砷的检测及健康风险评价[J]. 生态毒理学报, 8(3): 426-434. |
Villalobos M, Toner B, Bargar J, et al. 2003. Characterization of the manganese oxide produced by Pseudomonas putida strain MnB1[J]. Geochimica et Cosmochimica Acta, 67(14): 2649-2662. DOI:10.1016/S0016-7037(03)00217-5 |
Wang H W, Zhang D Y, Mou S Y, et al. 2015. Simultaneous removal of tetracycline hydrochloride and As(Ⅲ) using poorly-crystalline manganese dioxide[J]. Chemosphere, 136: 102-110. DOI:10.1016/j.chemosphere.2015.04.070 |
Wang H W, Tsang Y F, Wang Y N., et al. 2018. Adsorption capacities of poorly crystalline Fe minerals for antimonate and arsenate removal from water:Adsorption properties and effects of environmental and chemical conditions[J]. Clean Technologies and Environmental Policy, 20(10): 2169-2179. DOI:10.1007/s10098-018-1552-0 |
Wang H W, Lv Z J, Song Y J, et al. 2019. Adsorptive removal of Sb(Ⅲ) from wastewater by environmentally-friendly biogenic manganese oxide (BMO) materials:Efficiency and mechanisms[J]. Process Safety and Environmental Protection, 258: 223-230. |
Wang Y N, Tsang Y F, Wang H W, et al. 2020. Effective stabilization of arsenic in contaminated soils with biogenic manganese oxide (BMO) materials[J]. Environmental Pollution: 113481. |
王小明, 杨凯光, 孙世发, 等. 2011. 水铁矿的结构、组成及环境地球化学行为[J]. 地学前缘, 18(2): 339-347. |
Wenzel W W., Kirchbaumer N, Prohaska T, et al. 2001. Arsenic fractionation in soils using an improved sequential extraction procedure[J]. Analytica Chimica Acta, 436(2): 309-323. DOI:10.1016/S0003-2670(01)00924-2 |
Xie Z M, Huang C Y. 1998. Control of arsenic toxicity in rice plants grown on an arsenic-polluted paddy soil[J]. Communications in Soil Science and Plant Analysis, 29(15/16): 2471-2477. |
杨剑虹, 王成林, 代亨林. 2008. 土壤农化分析与环境监测[M]. .
|
Zhang T T, Zhao Y L, Bai H Y, et al. 2019. Efficient As (Ⅲ) removal directly as basic iron arsenite by in-situ generated Fe(Ⅲ) hydroxide from ferrous sulfate on the surface of CaCO3[J]. Applied Surface Science, 493: 569-576. DOI:10.1016/j.apsusc.2019.07.048 |
 2020, Vol. 40
2020, Vol. 40


