2. 上海市环境保护化学污染物环境标准与风险管理重点实验室, 华东理工大学资源与环境工程学院, 上海 200237;
3. 上海污染控制与生态安全研究院, 上海 200092
2. Shanghai Key Laboratory of Environmental Standards and Risk Management of Chemical Pollutants, School of Resources and Environmental Engineering, East China University of Science and Technology, Shanghai 200237;
3. Shanghai Institute of Pollution Control and Ecological Security, Shanghai 200092
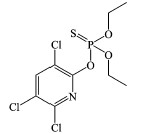
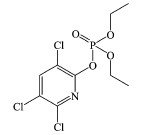
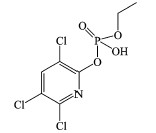
毒死蜱的有效成分为O, O-二乙基—O-(3, 5, 6-三氯-2-吡啶基)硫代磷酸酯, 自1965年发明以来广泛应用于农业和公共健康领域(Richardson, 1995).随着毒死蜱的广泛使用, 其环境毒性逐渐显露并受到人们广泛关注.水体中残留的毒死蜱可以通过食物链富集, 对水生生物和水体循环产生不利影响(王川等, 2011).毒死蜱的急性毒性主要表现在对神经系统乙酰胆碱酯酶的抑制方面(Deb et al., 2013).当聚乙二醇与毒死蜱同时存在时, 毒死蜱的毒性会被减弱, 而聚乙二醇的毒性则被加强(Hatami et al., 2019), 这表明毒死蜱在不同条件下会呈现出不同的环境毒性.鉴于毒死蜱的环境持久性及其潜在的生态危害, 其在环境中的去除方法受到人们的热切关注.
水体中毒死蜱的去除方法主要有物理法、生物法和化学氧化法(Ikehata et al., 2006).物理法只是将污染物转移, 并未从本质上消除污染物.生物法中微生物对分子量较大的污染物降解效果较差, 且生物降解菌的性能受环境影响较大, 在实验室和自然生态中的降解效果相差较大, 不利于其实际的应用(Singh et al., 2003; Jin et al., 2013; 刘丽洁等, 2013).化学氧化因其高效的降解效果成为首选的降解方式.已有文献证明, 毒死蜱可以被热活化的过硫酸盐有效降解, P=S的氧化、去乙基化和脱氯羟基化是其主要的降解途径(Zhou et al., 2017).但过硫酸盐的价格较高, 不利于其在工业上的实际应用.
最近的研究表明, 过一硫酸盐(PMS)有望作为一种廉价的氧化剂用于废水处理(Yang et al., 2018; Ruiz et al., 2019).PMS的标准氧化还原电位为1.82 V, 其氧化性强于过氧化氢(Betterton et al., 1990).PMS可作为造纸和纸浆工业中氯基漂白剂的替代品(Springer, 1992), 还可以作为化学杀菌剂与氯一起参与泳池和温泉的消毒过程(Jang et al., 2010; Teo et al., 2015).已有研究发现PMS可以降解磺胺类药物(Ji et al., 2018)、亚砷酸盐(Wang et al., 2014)和β-内酰胺抗生素(Chen et al., 2018)等.pH在5~10的范围内, PMS降解环丙沙星和恩诺沙星(Zhou et al., 2018)的速率常数分别为0.10~3.05 L·mol-1·s-1和0.51~33.17 L·mol-1·s-1.与活化的PMS技术相比, PMS的直接氧化技术在能耗、便利性等方面有着明显的优势.相比于活化方式, PMS直接降解有机污染物受水体基质的影响较小, 为去除水中有机污染物提供了良好的前景.此外, 活化的PMS对有机污染物的降解不是即时的(Yang et al., 2018), 但现有活化PMS的氧化研究中PMS与目标污染物或副产物直接相互作用的背景反应经常被忽略.因此, 辨别整个降解过程背后的PMS直接氧化过程的水相化学性质至关重要, 所以有必要对直接PMS降解技术开展系统的研究.
本研究拟选取毒死蜱作为目标污染物, 综合评估PMS技术对水体中毒死蜱的降解动力学、机制以及潜在的毒性变化.系统考察PMS剂量、溶液pH、离子强度和腐殖酸对PMS降解毒死蜱的影响.在此基础上, 通过质谱分析对毒死蜱降解产物进行鉴定, 阐明其基本的降解机理和途径.并通过ECOSAR生态毒性预测模型评估毒死蜱降解的中间产物对鱼、水蚤和绿藻的生物毒性, 评估使用PMS降解毒死蜱的潜在风险.本研究可为PMS直接氧化体系用于修复环境中的农药污染(如毒死蜱)提供科学依据.
2 材料与方法(Materials and methods) 2.1 试剂与材料毒死蜱(C9H11Cl3NO3PS, 99%)、过一硫酸盐(KHSO5·0.5KHSO4·0.5K2SO4, ≥ 47%KHSO5 basis)、碘化钠(NaI, 99.5%)、醋酸(CH3COOH, 2.0 mol·L-1)和磷酸二氢钾(KH2PO4, ≥ 99%)购自上海阿拉丁生化科技股份有限公司;甲醇(CH3OH, 99.9%, HPLC级)和乙腈(C2H3N, 99.9%, HPLC级)购自北京百灵威科技有限公司;硫代硫酸钠(Na2O3S2, 99%)购自九鼎化学(上海)科技有限公司;叔丁醇(C4H10O, 99.5%)购自上海麦克林生化科技有限公司;腐殖酸购自Sigma-Aldrich公司;磷酸氢二钾(HK2O4P, 99%)购自上海迈瑞尔化学技术有限公司;磷酸钾(K3PO4, 98%)购自萨恩化学技术(上海)有限公司;2, 2′-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS, C18H24N6O6S4, 99.91%)购自毕得药业;氢氧化钠(NaOH, ≥96.0%)购自上海泰坦化学有限公司.所有实验均使用超纯水.
2.2 降解实验所有反应均在室温下100 mL的螺纹口透明玻璃瓶中进行.样品的总反应体积为50 mL, 反应液中毒死蜱的初始浓度为1 mg·L-1, PMS初始浓度为2 mmol·L-1, 溶液的pH通过10 mmol·L-1的磷酸缓冲溶液调节, 反应前后pH无明显变化, 加超纯水定容后振荡摇匀, 分别在0、15、30、60、90、120、180 min, 取1 mL反应液和20 μL的硫代硫酸钠溶液(1 mol·L-1)混合以终止反应(Anipsitakis et al., 2006;Ji et al., 2018), 待高效液相色谱仪(HPLC)分析.在上述反应体系中, 分别考查自由基猝灭剂(甲醇、叔丁醇, 0.2 mol·L-1), PMS初始浓度(0.5、1、2、3 mmol·L-1), 溶液pH值(4.66、6.06、7.02、8.10、9.13、10.18), 离子强度(0.008、0.02、0.04、0.06、0.08), 腐殖酸浓度(0、1、5、10、20 mg·L-1)对毒死蜱降解的影响.其中, 磷酸缓冲溶液是由磷酸二氢钾、磷酸氢二钾和磷酸钾组成的混合溶液.在不改变磷酸缓冲液浓度的前提下, 溶液pH的变化通过改变磷酸二氢钾、磷酸氢二钾和磷酸钾3种磷酸缓冲盐的配比来实现;在不改变3种缓冲盐比例的前提下, 溶液中离子强度的变化通过改变磷酸缓冲盐的总浓度来实现.
降解过程中PMS的消耗通过ABTS方法测量(Yang et al., 2018), 配置100 mL反应液于螺纹口透明玻璃瓶中, 其中毒死蜱的浓度为1 mg·L-1, PMS浓度为1 mmol·L-1, 磷酸缓冲盐浓度10 mmol·L-1(磷酸二氢钾和磷酸氢二钾的比例为1:1).分别在0、15、30、60、90、120、180 min时取50 μL反应液与1 mL的ABTS溶液混合, 加入1 mL的醋酸溶液和20 μL碘化钠溶液, 加超纯水稀释至5 mL, 放暗处静置15 min, 于415 nm处测量吸光度.
2.3 分析方法毒死蜱的浓度分析使用Waters 2998型高效液相色谱仪, 采用Agilent Zorbax Eclipse C18反相色谱柱(250 mm × 4.6 mm, 5 μm), 分析条件如下:流动相为乙腈和超纯水(体积比为9:1);流速为1 mL·min-1;进样体积为20 μL;检测波长为229 nm;柱温为30.0 ℃.
毒死蜱及其氧化产物对鱼(96h LC50)、水蚤(48h LC50)和绿藻(96h EC50)的急性毒性预测通过美国环保署开发的ECOSAR(Ecological Structure Activity Relationships)程序(1.11版)(https://www.epa.gov/tsca-screening-tools/ecological-structure-activity-relationships-ecosar-predictive-model)实现(Feng et al., 2016).
2.4 产物鉴定使用固相微萃取-高分辨液质联用仪(SPE-HRMS)对毒死蜱降解产物进行鉴定.降解150 min时使用1 mL硫代硫酸钠溶液(1 mol·L-1)终止反应.所得反应液通过SPE方法使用HLB-C18柱(6 CC/200 mg, Waters Oasis)进行浓缩.在提取之前, 依次用10 mL甲醇和10mL超纯水活化和平衡HLB-C18柱.随后, 以0.5 mL ·min-1的流速将51 mL反应液通过HLB-C18柱.最后使用0.5 mL甲醇连续洗脱2次, 通过HRMS分析最终提取的降解产物.
采用高分辨液质联用仪对反应产物进行鉴定, 采用正离子全扫描模式, 扫描范围100~500 m/z, 化合物的分离使用2695模块和2998光电二极管阵列检测器组成的HPLC Alliance系统.色谱柱为KinetexTM C18, 100 mm × 2.1 mm, 粒径2.1 μm, 孔径100 Å.流动相为乙腈和超纯水(体积比为7:3), 流速为0.2 mL·min-1, 进样量为5 μL.
3 结果与讨论(Results and discussion)预实验结果表明, PMS可有效降解毒死蜱.在[Chlorpyrifos]0 = 1 mg·L-1、[PMS]0 = 2 mmol·L-1、T = 298 K、pH = 6.82时, 反应3 h后毒死蜱的降解率为80.75%.随着降解反应的进行, PMS的浓度也在不断降低.PMS剩余量实验发现在[Chlorpyrifos]0= 1 mg·L-1、[PMS]0= 1 mmol·L-1、T = 298 K时, 反应3 h后PMS剩余量为72.42%.
3.1 PMS降解毒死蜱机制已有文献研究表明硫酸根自由基(SO4·-)、羟基自由基(·OH)和1O2是PMS氧化降解污染物的活性物质(Anipsitakis et al., 2004; Zhou et al., 2017; Ji et al., 2018; Yang et al., 2018; Liu et al., 2019).为确定毒死蜱的氧化机制, 本研究选取甲醇和叔丁醇作为自由基清除剂, 验证活性自由基(SO4·-和·OH)是否参与PMS降解毒死蜱的过程.其中, 甲醇是常用的SO4·-和·OH的淬灭剂, 其与SO4·-和·OH反应的速率常数分别为2.5 × 107 L·mol-1·s-1和9.7 ×108 L·mol-1·s-1(Neta et al., 1977; Liang et al., 2009; Ji et al., 2018);叔丁醇则是常用·OH的淬灭剂, 其与·OH反应的速率常数为(3.8~7.6) × 108 L·mol-1·s-1(Anipsitakis et al., 2004).加入过量(0.2 mol·L-1)的自由基清除剂对毒死蜱降解无明显影响, 这表明SO4·-和·OH均未参与PMS对毒死蜱的直接降解.虽然PMS可以自分解产生1O2, 但其自分解速度非常缓慢, 并且水对1O2的淬灭效果很强, 所以在PMS氧化毒死蜱中1O2的作用可以忽略不计(Haag et al., 1984; Evans et al., 1985; Zhou et al., 2013; Zhou et al., 2018).因此, PMS降解毒死蜱的机制并非是自由基机制, 氧化过程起作用的是PMS本身, 而不是SO4·-、·OH等活化产物.
3.2 PMS投加量的影响不同PMS投加量对毒死蜱降解效果的影响如图 1所示.当PMS投加量由0.5 mmol·L-1提高到3 mmol·L-1时, 反应3 h后毒死蜱的降解率从49.39%逐渐提高到92.18%.从图 1b可知, kobs与PMS浓度之间存在线性关系, 这表明毒死蜱的降解速率与PMS总量密切相关.因此, 整体的反应动力学遵循式(1):
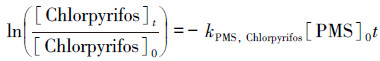
|
(1) |
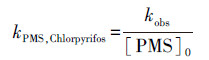
|
(2) |
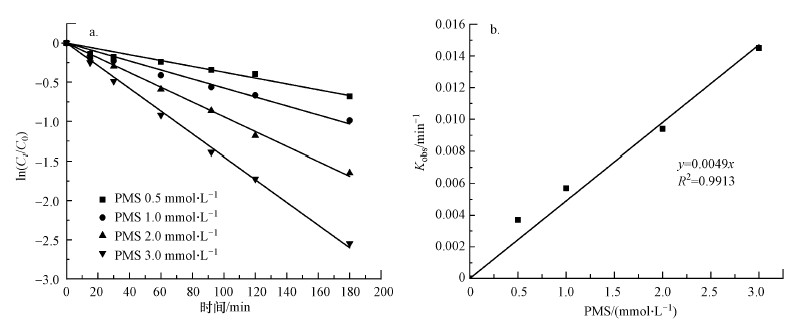 |
| 图 1 PMS投加量对毒死蜱降解的影响(a)及表观一级反应动力学常数Kobs和PMS浓度的关系(b)([Chlorpyrifos]0= 1 mg·L-1;T = 298 K;pH = 6.90;t = 180 min) Fig. 1 Effects of PMS concentration on the degradation of chlorpyrifos(a) and Pseudo-first-order reaction kinetic constants of chlorpyrifos degradation at different PMS concentration(b) |
由式(2)得到PMS与毒死蜱反应的速率常数为(0.082 ± 0.003) L·mol-1·s-1, 该值低于PMS与磺胺甲恶唑的反应速率常数0.23 L·mol-1·s-1(Ji et al., 2018), 更低于PMS与头孢氨芐的反应速率常数71.7 L·mol-1·s-1(Chen et al., 2018), 说明PMS对不同物质的具有不同的降解特性.同时, 该值也低于高铁酸盐降解毒死蜱时的523.6 L·mol-1·s-1(Liu et al., 2019), 说明相比于高铁酸盐, PMS的氧化性更温和.虽然PMS的氧化比较温和, 但其受水体成分影响更小, 且对特定有机物具有更好的选择性(Chen et al., 2018; Ji et al., 2018).
3.3 溶液pH的影响pH是影响化学反应速率的主要因素之一, 其可以改变溶液中物质的存在形态和组成比例, 进而影响污染物的降解效率(Ji et al., 2015; Zhou et al., 2017).因此, 本研究以毒死蜱为目标污染物探究不同pH对毒死蜱降解的影响, 结果见图 2.在4.66~10.18的pH范围内, 反应3 h后毒死蜱的降解率均大于80.00%, 表明PMS降解毒死蜱的活性可以维持在较宽的pH范围内.不同pH条件下毒死蜱的降解效果差异很大.随着pH的提高, 毒死蜱的kobs从0.010 min-1(pH = 4.66)逐渐增加至0.017 min-1(pH = 10.18), 这主要是因为不同形态下PMS的氧化能力存在差异.PMS有两个pKa值, pKa1 < 0, pKa2= 9.4(Guan et al., 2011; Ji et al., 2015; Chen et al., 2018).pH < 8时, PMS主要以HSO5-的形式存在, SO52-的含量极少, 随着pH的增加SO52-比例不断增加.PMS降解毒死蜱的速率常数随SO52-比例的上升而增加说明SO52-相比于HSO5-有较强的氧化毒死蜱的能力.这与之前研究中HSO5-相比于SO52-有较强的氧化能力不同(Lente et al., 2009; Zhou et al., 2018), 体现出PMS较强的选择性, 也体现出PMS对pH强烈的依赖性.
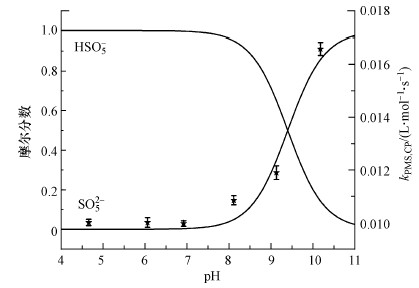 |
| 图 2 pH值对PMS降解毒死蜱的二阶速率常数的影响 ([Chlorpyrifos]0= 1 mg·L-1;[PMS]0= 2 mmol·L-1;T = 25 ℃;t = 180 min;实线分别为PMS不同离子种类的摩尔分数) Fig. 2 Effects of pH on the degradation of chlorpyrifos by PMS |
离子强度(I)可以影响反应物的活度, 进而影响离子的反应速率(许越, 2005).为探究PMS直接降解机制下离子强度的影响, 本研究选择5种不同的离子强度观察其对毒死蜱降解的影响, 结果见图 3a.在I = 0.008时, 反应3 h后毒死蜱的降解率为85.19%, 随着离子强度的不断增大, 毒死蜱的降解率逐渐降低至77.48%(I = 0.08).结果说明高离子强度会抑制毒死蜱的降解.这与预期的结果一致, 因为离子的存在可以改变反应物的活度系数, 从而降低毒死蜱的降解速率.活度系数是对实际溶液浓度的修正因子, 它代表实际溶液浓度和理想液态混合物或稀溶液的偏差程度(魏玉静等, 2011).若不考虑静电因素的影响, 在溶液中满足式(3), 式中k0为标准溶液中的反应速率常数, k为实际的反应速率常数, zAzB的值和符号与反应物的性质有关(许越, 2005).在PMS降解毒死蜱的反应中有阴阳离子的同时存在, zAzB < 0, 因此, 离子强度的增大会降低毒死蜱的降解速率.
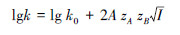
|
(3) |
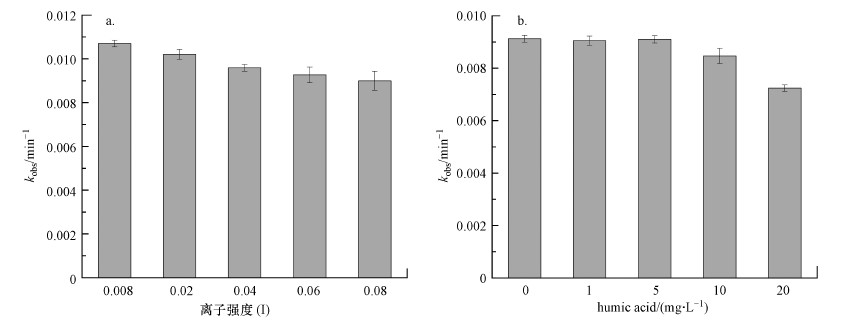 |
| 图 3 离子强度对PMS降解毒死蜱的影响(a)及腐殖酸对PMS降解毒死蜱的影响(b) ([Chlorpyrifos]0= 1 mg·L-1;[PMS]0= 2 mmol·L-1;T = 298K;t = 180 min) Fig. 3 Effects of ionic strength (a) and humic acid (b) on the degradation of chlorpyrifos by PMS |
腐殖酸是自然界中的一类高分子有机物质, 广泛存在于水体、底泥与土壤中, 已有研究显示其对高级氧化过程有显著影响(Deng et al., 2017).图 3b给出了在保持其他试剂浓度和反应条件不变的情况下, 不同腐殖酸浓度对毒死蜱降解的表观速率常数的影响情况.结果表明, 在腐殖酸浓度较低(≤ 5 mg)时, 其对毒死蜱的降解基本没有影响, 但随着腐殖酸浓度的进一步增加, 其对毒死蜱的降解表现出明显的抑制效应.这与之前研究中使用高铁酸盐降解氟喹诺酮类抗生素(Feng et al., 2016)和毒死蜱(Liu et al., 2019)的结果相似.这是因为高浓度的腐殖酸可以与毒死蜱竞争体系中的PMS, 从而抑制毒死蜱的降解.因此, PMS降解在投入实际运用时需要考虑天然水体有机质的影响.
3.6 毒死蜱降解的产物和路径为了确定毒死蜱的降解产物与反应路径, 本研究采用固相微萃取-高分辨液质联用仪(SPE-HRMS)对毒死蜱的降解产物进行鉴定.根据物质的分子离子峰和碎片离子峰信息, 推测其结构.在反应液中共检出7种产物, 分别以TP1~TP7表示, 它们的质谱信息和推测结构见表 1.质子化毒死蜱在m/z =349.9336时表现出分子离子峰.m/z值为321.9023、293.8710和197.9275相当于质子化毒死蜱连续减少了28、28和96 Da, 分别对应于C2H4、C2H4和HPO2S的损失.相应地, TP4相较于质子化的毒死蜱少了16 Da, 可能是由于PMS攻击了毒死蜱的P=S结构, O原子取代了S原子形成P=O结构, 而TP5相较于TP4少了28 Da可能是因为C2H4的损失.
| 表 1 毒死蜱降解产物的推测结构和质谱信息 Table 1 Proposed structure and mass spectrometry data of chlorpyrifos degradation products |
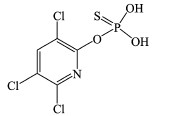
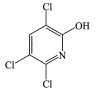
基于检测出的7种降解产物, 进一步推断PMS降解毒死蜱的反应路径, 结果见图 4.比较毒死蜱及其降解产物的分子结构可知, PMS降解毒死蜱的主要方式是去乙基化、P=S的氧化和C—O的断裂.毒死蜱的降解分为两种路径.路径1中, PMS可以与毒死蜱的P—O发生反应, 连续失去乙基分别生成TP1和TP2, 先前的报道中使用热活化过硫酸盐(Zhou et al., 2017)和高铁酸盐(Liu et al., 2019)降解毒死蜱的研究中均涉及此类反应.同时, 毒死蜱也可以发生含氮杂环和含磷主链间的P—O的断裂反应, 生成TP3和TP6.在路径2中, PMS首先与毒死蜱中含P主链的P=S发生反应, P=S被氧化为P=O, 生成TP4.PMS可以进一步氧化TP4.PMS可以与TP4的P—O发生反应, TP4失去一个乙基生成TP5, PMS也可以使TP4的含氮杂环和含磷主链间的P—O断裂, 生成TP3和TP7.从两条降解路径中发现TP3两种可能的降解路径中都可以产生, 是PMS降解毒死蜱的主要产物.同时, TP3在其他方式降解毒死蜱的研究中也均有提及(Pinto et al., 2015; Zhou et al., 2017; Liu et al., 2019).相较于热活化过硫酸盐(Zhou et al., 2017)对毒死蜱的降解, PMS直接降解毒死蜱的方式相对简单, 未发生脱氯羟基化的反应, 表明PMS是一种比较温和的氧化剂, 可以氧化一些有机污染物, 但其氧化性低于其活化产物的氧化性, 同时也避免了生成氯代消毒副产物这种高生物毒性产物的风险.而随着毒死蜱的降解及其降解产物的生成, 也预示着其生态毒性可能发生了改变.
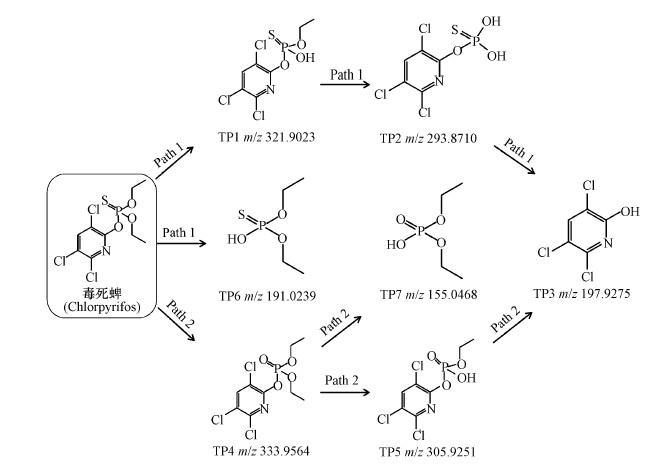 |
| 图 4 PMS降解毒死蜱的反应路径 Fig. 4 Proposed transformation pathways for chlorpyrifios degradation by PMS |
ECOSAR生态毒性模型利用SARs和QSARs预测化学物质的急性毒性和慢性毒性, 常用于水中有机污染物转化产物的毒性预测(Gao et al., 2014; Tay et al., 2015).Liu等(2019)在利用高铁酸盐氧化毒死蜱的研究中使用ECOSAR模型预测了毒死蜱及其降解产物的急性和慢性毒性变化, Gornik等(2019)在舍曲林光降解的研究中使用ECOSAR毒性模型预测其转化产物的毒性.本研究采用ECOSAR生态毒性模型对毒死蜱及其降解产物对鱼、水蚤和绿藻的急性毒性进行预测, 并根据GHS的毒性分类(Tay et al., 2015; Liu et al., 2019)绘制两种降解途径的毒性演变图, 结果见图 5.结果表明7种降解产物对鱼、水蚤和绿藻的急性毒性均低于毒死蜱母体.毒死蜱母体对鱼(96h LC50)、水蚤(48h LC50)和绿藻(96h EC50)的急性毒性分别为0.059、0.00033和0.26 mg·L-1.TP1~TP6对应的急性毒性值均高于毒死蜱母体的急性毒性值, 这表示其急性毒性均小于毒死蜱母体, TP7未检测出急性毒性.毒死蜱的两种降解路径均可以有效降低其环境毒性, 其中途径2的产物毒性更低, 表明P=S的氧化可以有效降低其在环境中的潜在毒性.因此, PMS可以作为消除水体中毒死蜱污染的有效手段.
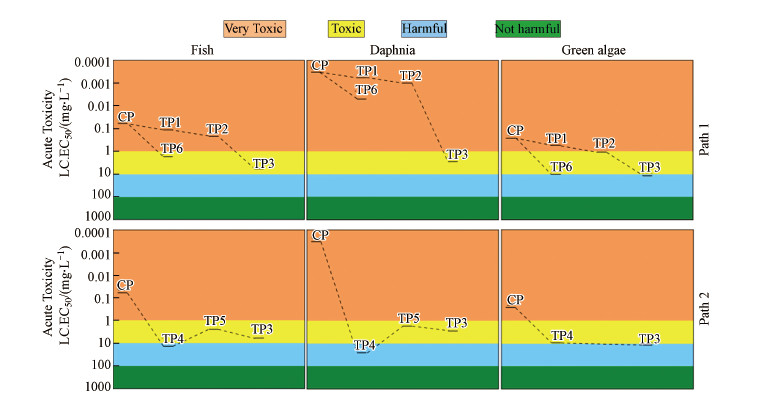 |
| 图 5 ECOSAR模型预测的毒死蜱及其降解产物的急性毒性 Fig. 5 Acute toxicity of chlorpyrifos and its degradation products predicted using the ECOSAR program |
1) PMS氧化降解毒死蜱的效果良好, 自由基鉴定实验证明PMS氧化降解毒死蜱过程中活性自由基(SO4·-和·OH)并未参与反应, 起作用的是PMS本身.
2) 随着PMS投加量的不断增加, 毒死蜱的降解速率也随之加快.高的离子强度和腐殖酸浓度均会抑制毒死蜱的降解.碱性条件下PMS主要以SO52-的形态存在, SO52-相比于HSO5-对毒死蜱有较强的氧化毒死蜱的能力, 从而加快了毒死蜱的降解速率.
3) 通过对产物的SPE-HRMS分析可知, 降解过程中毒死蜱分子中的P=S结构和磷酸二乙基支链在一定程度上被破坏, 从而达到降解的目的.
4) 根据检测出的7种降解产物, 推断出毒死蜱存在两条主要降解路径.经ECOSAR生态毒性模型预测发现两种降解路径下毒死蜱降解的产物对鱼、水蚤和绿藻的生物毒性均低于毒死蜱母体, 表明PMS可以作为消除水体毒死蜱污染的有效手段.
Anipsitakis G P, Dionysiou D D. 2004. Radical generation by the interaction of transition metals with common oxidants[J]. Environmental Science & Technology, 38: 3705-3712. |
Anipsitakis G P, Dionysiou D D, Gonzalez M A. 2006. Cobalt-mediated activation of peroxymonosulfate and sulfate radical attack on phenolic compounds. Implications of chloride ions[J]. Environmental Science & Technology, 40: 1000-1007. |
Betterton E A, Hoffmann M R. 1990. Kinetics and mechanism of the oxidation of aqueous hydrogen sulfide by peroxymonosulfate[J]. Environmental Science & Technology, 24: 1819-1824. |
Chen J, Fang C, Xia W, et al. 2018. Selective transformation of β-Lactam antibiotics by peroxymonosulfate:Reaction kinetics and nonradical mechanism[J]. Environmental Science & Technology, 52: 1461-1470. |
Deb N, Das S. 2013. Chlorpyrifos toxicity in fish:a review[J]. Current World Environment, 8: 77-84. |
Deng J, Ge Y, Tan C, et al. 2017. Degradation of ciprofloxacin using α-MnO2 activated peroxymonosulfate process:effect of water constituents, degradation intermediates and toxicity evaluation[J]. Chemical Engineering Journal, 330: 1390-1400. DOI:10.1016/j.cej.2017.07.137 |
Evans D F, Upton M W. 1985. Studies on singlet oxygen in aqueous solution. Part 3. The decomposition of peroxy-acids[J]. Journal of the Chemical Society, Dalton Transactions, 6: 1151-1153. |
Feng M, Wang X, Chen J, et al. 2016. Degradation of fluoroquinolone antibiotics by ferrate (Ⅵ):effects of water constituents and oxidized products[J]. Water Research, 103: 48-57. DOI:10.1016/j.watres.2016.07.014 |
Gao Y, Ji Y, Li G, et al. 2014. Mechanism, kinetics and toxicity assessment of OH-initiated transformation of triclosan in aquatic environments[J]. Water Research, 49: 360-370. DOI:10.1016/j.watres.2013.10.027 |
Gornik T, Vozic A, Heath E, et al. 2019. Determination and photodegradation of sertraline residues in aqueous environment[J]. Environmental Pollution: 113431. |
Guan Y, Ma J, Li X, et al. 2011. Influence of pH on the formation of sulfate and hydroxyl radicals in the UV/peroxymonosulfate system[J]. Environmental Science & Technology, 45: 9308-9314. |
Haag W R, Hoigne J, Gassman E, et al. 1984. Singlet oxygen in surface waters-Part Ⅰ:Furfuryl alcohol as a trapping agent[J]. Chemosphere, 13: 631-640. DOI:10.1016/0045-6535(84)90199-1 |
Hatami M, Banaee M, Haghi B. 2019. Sub-lethal toxicity of chlorpyrifos alone and in combination with polyethylene glycol to common carp (Cyprinus carpio)[J]. Chemosphere, 219: 981-988. DOI:10.1016/j.chemosphere.2018.12.077 |
Ikehata K, El-Din M G. 2006. Aqueous pesticide degradation by hydrogen peroxide/ultraviolet irradiation and Fenton-type advanced oxidation processes:A review[J]. Journal of Environmental Engineering and Science, 5: 81-135. DOI:10.1139/s05-046 |
Jang J, Jang M, Mui W, et al. 2010. Formation of active chlorine oxidants in saline-oxone aerosol[J]. Aerosol Science and Technology, 44: 1018-1026. DOI:10.1080/02786826.2010.507612 |
Ji Y, Fan Y, Liu K, et al. 2015. Thermo activated persulfate oxidation of antibiotic sulfamethoxazole and structurally related compounds[J]. Water Research, 87: 1-9. DOI:10.1016/j.watres.2015.09.005 |
Ji Y, Lu J, Wang L, et al. 2018. Non-activated peroxymonosulfate oxidation of sulfonamide antibiotics in water:Kinetics, mechanisms, and implications for water treatment[J]. Water Research, 147: 82-90. DOI:10.1016/j.watres.2018.09.037 |
Jin D, Kong X, Cui B, et al. 2013. Biodegradation of di-n-butyl phthalate by a newly isolated halotolerant Sphingobium sp[J]. International Journal of Molecular Sciences, 14: 24046-24054. DOI:10.3390/ijms141224046 |
Lente G, Kalmár J, Baranyai Z, et al. 2009. One-versus two-electron oxidation with peroxomonosulfate ion:reactions with iron (Ⅱ), vanadium (Ⅳ), halide ions, and photoreaction with cerium (Ⅲ)[J]. Inorganic Chemistry, 48: 1763-1773. DOI:10.1021/ic801569k |
Liang C, Su H. 2009. Identification of sulfate and hydroxyl radicals in thermally activated persulfate[J]. Industrial & Engineering Chemistry Research, 48: 5558-5562. |
Liu H, Chen J, Wu N, et al. 2019. Oxidative degradation of chlorpyrifos using ferrate (Ⅵ):Kinetics and reaction mechanism[J]. Ecotoxicology and Environmental Safety, 170: 259-266. DOI:10.1016/j.ecoenv.2018.11.132 |
刘丽洁, 秦德志, 靳荣, 等. 2013. 微生物降解有机农药的研究进展[J]. 内蒙古林业科技, 39: 34-36. DOI:10.3969/j.issn.1007-4066.2013.04.010 |
Neta P, Madhavan V, Zemel H, et al. 1977. Rate constants and mechanism of reaction of sulfate radical anion with aromatic compounds[J]. Journal of the American Chemical Society, 99: 163-164. DOI:10.1021/ja00443a030 |
Pinto M I, Salgado R, Cottrell BA, et al. 2015. Influence of dissolved organic matter on the photodegradation and volatilization kinetics of chlorpyrifos in coastal waters[J]. Journal of Photochemistry and Photobiology A:Chemistry, 310: 189-196. DOI:10.1016/j.jphotochem.2015.05.024 |
Richardson R J. 1995. Assessment of the neurotoxic potential of chlorpyrifos relative to other organophosphorus compounds:A critical review of the literature[J]. Journal of Toxicology and Environmental Health, Part A Current Issues, 44: 135-165. |
Ruiz M, Yang Y, Lochbaum C A, et al. 2019. Peroxymonosulfate oxidizes amino acids in water without activation[J]. Environmental Science & Technology, 53: 10845-10854. |
Singh B K, Walker A, Morgan J A W, et al. 2003. Effects of soil pH on the biodegradation of chlorpyrifos and isolation of a chlorpyrifos-degrading bacterium[J]. Appllied Environmental Microbiology, 69: 5198-5206. DOI:10.1128/AEM.69.9.5198-5206.2003 |
Springer E L. 1992. Potential uses for peroxymonosulfate in pulping and bleaching[J]. In Proceedings of the 1989 and 1990 AIChe Forest Products Symposium: November 5-10, 1989, San Francisco, California; November 11-16, 1990, Chicago, Illinois. Atlanta, GA: TAPPI Press, 1992: pages 113-120
|
Tay K S, Madehi N. 2015. Ozonation of ofloxacin in water:by-products, degradation pathway and ecotoxicity assessment[J]. Science of the Total Environment, 520: 23-31. DOI:10.1016/j.scitotenv.2015.03.033 |
Teo T L, Coleman H M, Khan S J. 2015. Chemical contaminants in swimming pools:Occurrence, implications and control[J]. Environment International, 76: 16-31. DOI:10.1016/j.envint.2014.11.012 |
王川, 周巧红, 吴振斌. 2011. 有机磷农药毒死蜱研究进展[J]. 环境科学与技术, 34: 123-127. |
Wang Z, Bush R T, Sullivan L A, et al. 2014. Selective oxidation of arsenite by peroxymonosulfate with high utilization efficiency of oxidant[J]. Environmental Science & Technology, 48: 3978-3985. |
魏玉静, 张洪浩, 马晶晶, 等. 2011. 咪唑氯盐离子液体在水溶液中单个离子活度系数[J]. 河南师范大学学报:自然科学版, 39: 179-179. |
许越. 2005. 化学反应动力学[M]. 北京: 化学工业出版社, 1-238.
|
Yang Y, Banerjee G, Brudvig G W, et al. 2018. Oxidation of organic compounds in water by unactivated peroxymonosulfate[J]. Environmental Science & Technology, 52: 5911-5919. |
Zhou L, Ji Y, Zeng C, et al. 2013. Aquatic photodegradation of sunscreen agent p-aminobenzoic acid in the presence of dissolved organic matter[J]. Water Research, 47: 153-162. DOI:10.1016/j.watres.2012.09.045 |
Zhou L, Zhang Y, Ying R, et al. 2017. Thermoactivated persulfate oxidation of pesticide chlorpyrifos in aquatic system:kinetic and mechanistic investigations[J]. Environmental Science and Pollution Research, 24: 11549-11558. DOI:10.1007/s11356-017-8672-7 |
Zhou Y, Gao Y, Pang S, et al. 2018. Oxidation of fluoroquinolone antibiotics by peroxymonosulfate without activation:Kinetics, products, and antibacterial deactivation[J]. Water Research, 145: 210-219. DOI:10.1016/j.watres.2018.08.026 |
 2020, Vol. 40
2020, Vol. 40