2. 河北省农田生态环境重点实验室, 保定 071000
2. Key Laboratory for Farmland Eco-Environment of Hebei Province, Baoding 071000
氨(NH3)是大气中唯一的碱性气体, 其能够与大气中的氮氧化物(NOx)、二氧化硫(SO2)等发生反应, 是形成细颗粒物(PM2.5)的重要前体物, 在雾霾形成中扮演着非常重要的角色(薛俊红, 2017; Sun et al., 2018).畜禽养殖是大气中NH3的重要人为排放源, 据统计, 美国和欧盟畜禽养殖业NH3排放分别占其总排放量的56%和74%(Faulkner et al., 2008; Roland et al., 2009), 我国畜禽养殖业NH3排放占大气NH3总排放量的54%(Gu et al., 2017).因此, 控制畜禽养殖行业NH3排放对于削减人为源NH3排放至关重要.
目前, 生物法由于建设及运行成本低且工艺运行维护简单而被广泛应用到恶臭和VOCs等废气的治理领域(Dobslaw et al., 2010; 刘春敬等, 2012; 任爱玲等, 2013).规模化畜禽养殖场(猪、鸡)饲舍多采用机械通风, 饲舍内产生的含NH3废气浓度低、气量大, 亦适合采用此技术进行处理(梁美生等, 2013; 卢仁钵等, 2016).采用生物法净化含NH3废气时, NH3溶于水后首先被硝化细菌在有氧条件下氧化为硝酸盐, 然后硝酸盐被反硝化菌在缺氧/厌氧环境下还原为N2.Raboni等(2016)采用改进的生物滴滤塔进行了含NH3废气的中试试验, 当停留时间(EBRT)大于30 s, 且体积负荷低于200 g·m-3·d-1时, NH3去除效率可达90%以上.从进、出气浓度来看, 生物法除NH3效率虽然可高达90%以上, 但由于进气中氧浓度高和碳源不足等问题, 抑制了厌氧反硝化过程, 使得去除的NH3大部分以NO3-或NO2-形式累积在营养液中, 并不能做到氮素污染物的完全去除(Zápotock ý et al., 2012; Roland et al., 2012).
与厌氧反硝化菌相比, 好氧反硝化菌是具有一定氧耐受能力, 能够在有氧环境下以有机物为碳源进行硝酸盐还原的微生物(Zheng et al., 2014).好氧反硝化现象最早由Robertson(1984)提出, 随后研究者相继从活性污泥、水库、垃圾渗滤液和养殖废水中分离鉴定出多株好氧反硝化细菌(孙庆花等, 2016;Barman et al., 2017).好氧反硝化菌的氧耐受性使其能够与好氧的硝化细菌共同培养, 从而使同步硝化反硝化(SND)成为可能.刘春敬等(2018)将包埋固定化的好氧反硝化菌投加到处理生活污水的地下渗滤系统中, 能够显著提高系统脱氮能力, 使出水NO3--N维持在10 mg·L-1以下.Du等(2017)构建了基于Pseudomonas sp. T13强化的好氧反硝化系统并研究其脱氮性能, 同时采用高通量测序技术解析了强化生物流化床系统的微生物演替规律, 揭示了好氧反硝化菌株与其他微生物菌群的相互作用关系.
上述关于好氧反硝化/同步硝化反硝化的研究多集中在污水处理领域, 很少有研究将其应用到生物除氨领域.本研究基于好氧反硝化理论, 构建SND生物除氨滴滤塔, 通过与传统生物滴滤塔对比分析, 探索SND生物滴滤塔除氨时的氮转化规律, 并结合高通量测序技术解析微生物种群结构.以期为同步硝化反硝化在生物法处理废气领域的应用提供理论基础和技术支持.
2 材料与方法(Materials and methods) 2.1 SND复合菌群的富集与培养本研究以保定市鲁岗污水处理厂A2/OAO工艺曝气池活性污泥为菌源, 进行硝化细菌和好氧反硝化细菌的富集驯化.
硝化细菌富集培养(章正勇等, 2007):将5 L活性污泥与硝化细菌驯化培养基混合液(V:V=1:1)接入有机玻璃箱中进行培养, 温度控制在(30±1) ℃, pH控制在7.5~9.0, DO保持在4.0 mg·L-1左右, 每隔24 h更换一次营养液, 方法如下:培养液静置后, 倒掉上清液, 并补充新鲜的营养液, 初始NH4+-N浓度控制在80~100 mg·L-1, 培养初期NH4+-N去除率为12%左右, 富集培养1周后, NH4+-N去除效率达到95%, 为了保证富集足够的硝化细菌和保证其硝化能力的稳定性, 富集驯化培养过程共计30 d.
好氧反硝化菌富集培养(杜丛, 2017):将5 L活性污泥与好氧反硝化菌驯化培养基混合液(V:V=1:1)接入有机玻璃箱中, 培养液NO3--N浓度控制在180~200 mg·L-1, 采用间歇曝气培养(曝气8 h, 缺氧搅拌4 h, 曝气10 h, 沉淀2 h)的方式富集驯化好氧反硝化菌.曝气阶段DO浓度维持在3.0 mg·L-1左右, 温度控制在(30±2) ℃, pH控制在7.0~8.0.每天静置后取曝气混合液的上清液分析NH4+-N和NO3--N等浓度, 计算反硝化效率, 培养液每隔24 h更换一次.培养初期反硝化效率约为21%, 富集培养约2周后, 反硝化效率提高到90%, 为了保证富集足够的反硝化细菌和保证反硝化能力的稳定性, 富集驯化培养过程共计30 d.
富集培养结束后, 硝化细菌和好氧反硝化细菌富集培养液按照体积比为1:1混合, 构成SND复合菌群, 用于SND生物滴滤塔的挂膜启动.
2.2 培养基硝化细菌驯化培养基(李焕等, 2012)(g·L-1):(NH4)2SO4 2.0, K2HPO4 0.1, NaHCO3 1.6, MgSO4·7H2O 0.03, NaCl 0.3, FeSO4·7H2O 0.03.
好氧反硝化菌驯化培养基(张瑞, 2013)(g·L-1):CH3COONa 3.0, KNO3 1.0, K2HPO4 0.1, KH2PO4 0.1, MgSO4·7H2O 0.6, CaCl2·2H2O 0.07;微量元素溶液2 mL.
微量元素:FeCl3·6H2O 1.5 g, CuSO4·5H2O 0.03 g, MnCl2·4H2O 0.12 g, ZnSO4·7H2O 0.12 g, Na2MoO4·2H2O 0.06 g, H3BO3 0.15 g, KI 0.03 g, CoCl2·6H2O 0.15 g, 蒸馏水1 L, pH=7.0.
2.3 生物滴滤塔净化氨气工艺流程本研究共采用生物滴滤塔2座(图 1), 其中, 生物滴滤塔A为SND生物滴滤塔, 采用SND复合菌群进行挂膜启动, 生物滴滤塔B为对照生物滴滤塔, 采用活性污泥直接挂膜.两个生物滴滤塔均采用有机玻璃制成, 塔内径为100 mm, 塔高为800 mm, 以直径为8~10 mm的陶粒为填料, 分上、下两层, 每层填料高度为300 mm.试验用气为模拟含NH3废气, 由10%的含NH3钢瓶气减压后与压缩空气混合而成, 含NH3废气由生物滴滤塔底部进入, 经填料层从生物滴滤塔顶部排出.生物滴滤塔所需营养液由蠕动泵输送至滴滤塔, 从顶部喷淋至填料表面, 最终从滴滤塔底部流入循环液箱中.
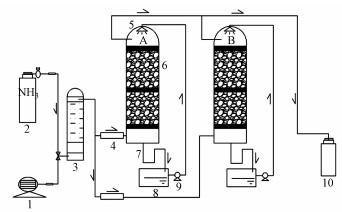 |
| 图 1 生物滴滤法净化氨气工艺流程图 (1.空气压缩机;2.10% NH3钢瓶气;3.混气室;4.流量计;5.布液装置;6.生物滴滤塔;7.U型液封管;8.循环液槽;9.蠕动泵;10.尾气收集瓶) Fig. 1 Schematic diagram of bio-trickling filter for NH3 purification |
综合考虑生物除氨过程硝化细菌和反硝细菌的营养需求, 生物滴滤塔营养液配方参考硝化细菌驯化培养基和好氧反硝化驯化培养基确定(李焕等, 2012; 张瑞, 2013), 营养液配方如下(g·L-1):CH3COONa 1.0, K2HPO4 0.1, NaHCO3 1.6, MgSO4·7H2O 0.03, FeSO4·7H2O 0.03, NaCl 0.3.生物滴滤塔营养液初始pH为7.5左右, 在生物滴滤塔运行过程中喷淋液pH不进行调节, pH值一般在7.5~9.5左右, 每5~7 d定期更换一次.
2.4 分析测定方法本研究测试指标主要包括:营养液中NH4+-N、NO3--N、NO2--N和TOC浓度, 以及生物滴滤塔进、出气中NH3和N2O浓度.其中, NO3--N测定采用紫外分光光度法, NO2--N测定采用N-(1-萘基)-乙二胺光度法, NH4+-N测定采用纳氏试剂分光光度法, TOC浓度由日本Liqui TOC分析仪测定.进、出气NH3浓度采用氨气测定仪(上海科尔诺复合气体检测仪)测定, N2O采用气相色谱(Agilent 6820)进行测定, 测定条件为:以N2为载气, ECD检测器, 柱箱温度为55 ℃, 前检测器温度为250 ℃, 后检测器温度为330 ℃.生物滴滤塔压力降采用U形管压力计测定.
2.5 生物滴滤塔微生物种群结构分析在生物滴滤塔稳定运行期, 从A、B两个生物滴滤塔上、下填料层中取填料25 g, 加入30 mL无菌水, 恒温振荡20 min(温度20 ℃、转速120 r·min-1), 取振荡液在15000 r·min-1高速离心机中离心5 min, 收集微生物絮体, 保存于-80 ℃冰箱中, 用于DNA抽提.
采用OMEGA Soil DNA试剂盒提取生物陶粒样品DNA后, 利用1%琼脂糖凝胶电泳检测抽提基因组DNA.采用细菌引物338F(5′-ACTCCTACGGG AGGCAGCAG-3′)和806R(5′-GGACTACHVGGG TWTCTAAT-3′)(V3~V4可变区)对提取的DNA进行PCR扩增.PCR扩增程序为:95 ℃(30 s)初始变性, 然后进行27个循环, 95 ℃变性30 s, 55 ℃退火30 s, 72 ℃延伸45 s, 最后10 min延伸至72 ℃.将PCR产物混合后用2%琼脂糖凝胶电泳检测, 使用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司)切胶回收PCR产物, 采用Tris_HCl洗脱, 2%琼脂糖电泳检测.高通量测序工作由上海美吉生物完成, 采用Majorbio I-Sanger平台在线分析数据.
MiSeq测序得到的是双端序列数据, 首先根据PE reads之间的overlap关系, 将成对的reads拼接(merge)成一条序列, 同时对reads的质量和merge的效果进行质控过滤, 根据序列首尾两端的barcode和引物序列区分样品得到有效序列.为得到每个OTU对应的物种分类信息, 采用RDP classifier贝叶斯算法对97%相似水平的OTU代表序列进行分类学分析.
3 结果与讨论(Results and discussion) 3.1 SND生物滴滤塔挂膜启动维持生物滴滤塔进气NH3浓度在65 mg·m-3左右, 营养液喷淋量为300 mL·min-1, 停留时间为67 s, 每隔5 d更换一次营养液, 通过监测进、出口NH3浓度及营养液中NH4+-N和NO3--N浓度, 比较两个生物滴滤塔的启动性能(图 2).在试验初期, SND生物滴滤塔A和生物滴滤塔B的NH3去除效率均在95%以上, 但在运行17 d以后, 生物滴滤塔B的NH3去除效率开始下降至90%左右, 而SND生物滴滤塔A的NH3去除效率仍能够维持在95%以上.值得关注的是, 在近30 d的挂膜启动运行期间, SND生物滴滤塔A营养液中的NH4+-N和NO3--N浓度均显著低于生物滴滤塔B(p < 0.05), SND生物滴滤塔A营养液中的NH4+-N和NO3--N浓度最高分别为3.7 mg·L-1和35.0 mg·L-1, 而生物滴滤塔B的NH4+-N和NO3--N浓度则分别高达20.0 mg·L-1和55.0 mg·L-1.因此, 本研究构建的SND生物滴滤塔可快速挂膜启动, NH3去除效率高且具有较低的硝酸盐累积特征.
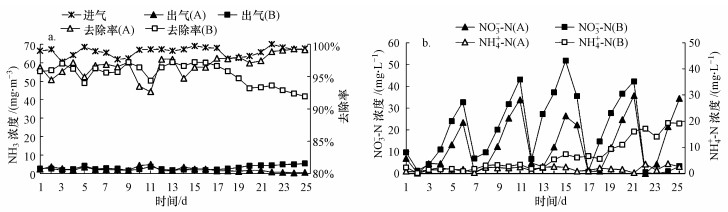 |
| 图 2 生物除氨滴滤塔挂膜启动性能变化图 (a.NH3去除效率, b.NH4+-N、NO3--N累积规律) Fig. 2 Removal performance of the bio-trickling filter during start-up period |
停留时间(EBRT)是生物滴滤塔运行的一个重要参数, EBRT的取值与生物滴滤塔的体积相关.维持生物滴滤塔进气NH3浓度为50~70 mg·m-3, 营养液喷淋量为50 mL·min-1, 考察不同EBRT(67、42、30、22、16、8 s)对SND生物滴滤塔NH3去除效率的影响.试验期间, 每个停留时间运行5 d.由图 3可见, 在EBRT为16~67 s时, SND生物滴滤塔A的NH3去除效率一直维持在95%以上, 当EBRT缩短为8 s时, 其NH3去除效率下降至70%左右.生物滴滤塔B的NH3去除效率较生物滴滤塔A低, 且稳定性较差, 当停留时间为22 s时, NH3去除效率在90%左右, 当EBRT缩短为8 s时, 生物滴滤塔B的NH3去除效率仅有60%.Raboni等(2016)研究采用改进的生物滴滤塔中试装置处理含NH3废气, 停留时间为36 s时, NH3去除效率达到92.4%.因此, 本研究构建的SND生物滴滤塔在具有较高除氨效率的同时, 具有更短的停留时间, 可以有效降低生物滴滤塔的占地面积, 降低生物除氨的建设费用和运行费用.
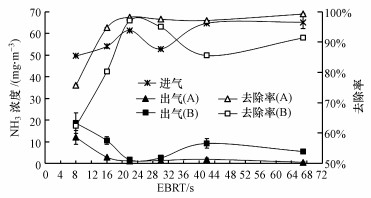 |
| 图 3 停留时间(EBRT)对SND生物滴滤塔NH3去除效率的影响 Fig. 3 The effect of empty bed resident time (EBRT) on NH3 removal efficiency of SND bio-trickling filter |
维持生物滴滤塔EBRT为16 s, 循环营养液喷淋量为50 mL·min-1, 考察进气NH3浓度对SND生物滴滤塔NH3去除效率的影响(图 4).由图可知, 在NH3进气浓度为35~65 mg·m-3时, SND生物滴滤塔A的NH3去除率均能够保持在90%以上, 而生物滴滤塔B的NH3去除率较生物滴滤塔A低, 维持在80%左右, 且波动较大.生物除氨主要包括NH3的溶解、NH3向生物膜的迁移和NH3的微生物代谢(硝化、反硝化)3个过程.与SND生物滴滤塔A相比, 生物滴滤塔B同步硝化反硝化能力不足, 使得微生物代谢过程成为其生物除氨的限速步骤, 进而导致其较低NH3去除效率.此外, 当进气浓度降低为20 mg·m-3时, 两个生物滴滤塔的NH3去除效率均有所下降, 此时SND生物滴滤塔A的NH3去除效率由95%降低为90%, 而生物滴滤塔B的NH3去除效率则下降至70%左右.这是由于当进气浓度非常低且停留时间较短时, 根据双膜理论, 此时由气相向液相的传质过程受限, 导致两个生物滴滤塔的NH3去除效率均会下降.综合来看, 与对照生物滴滤塔B相比, 在NH3进气浓度为35~65 mg·m-3时, SND生物滴滤塔均表现出较好的除氨性能.
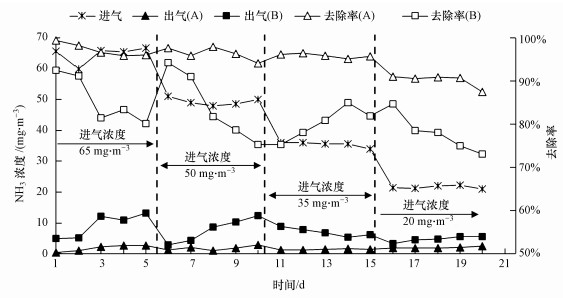 |
| 图 4 进气NH3浓度对SND生物滴滤塔除氨效率的影响 Fig. 4 The effect of inlet NH3 concentration on NH3 removal efficiency of SND bio-trickling filter |
以SND生物滴滤塔A和生物滴滤塔B为研究对象, 在EBRT为16 s, 循环营养液喷淋量为50 mL·min-1, 进气NH3浓度为60 mg·m-3的条件下, 每隔6 h取样一次, 分析测定生物滴滤塔进、出气NH3和N2O浓度, 以及营养液中NH4+-N、NO3--N、NO2--N和TOC浓度, 探究生物除氨过程的氮转化规律(图 5).
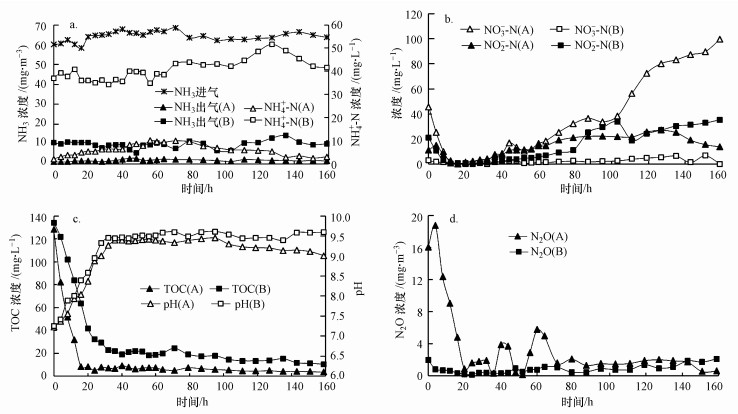 |
| 图 5 生物滴滤塔除氨过程各氮素形态和TOC浓度变化规律 (a.NH3和NH4+-N, b.NO3--N和NO2--N, c.TOC和pH, d.N2O) Fig. 5 Variation of nitrogen species and TOC during NH3 removal in bio-trickling filter |
在近160 h的试验周期内, SND生物滴滤塔A的去除效率一直维持在95%以上, 其营养液中的NH4+-N浓度一直维持在较低水平, 且具有较低的pH值, 而生物滴滤塔B的NH3去除率波动较大, 维持在85%左右.两个生物滴滤塔营养液中NO3--N和NO2--N浓度均呈先下降后上升的变化规律.在最初16 h内, SND生物滴滤塔A的TOC消耗速率要远远高于生物滴滤塔B, 由128.2 mg·L-1迅速降至8.2 mg·L-1, 营养液中NO3--N和NO2--N浓度也相应迅速降低.
导致生物滴滤塔除氨过程营养液pH变化的原因主要有3点:①NH3的溶解导致pH升高;②硝化过程导致pH降低;③反硝化过程导致pH升高.对比两个生物滴滤塔, 由于两个生物滴滤塔初始营养液配方和pH完全相同, 可以推测两个生物滴滤塔营养液pH的不同主要由硝化和反硝化过程引起.在一个运行周期内, 生物滴滤塔A的有机物(TOC)消耗速率高于生物滴滤塔B, 可以推断生物滴滤塔A的反硝化速率高于生物滴滤塔B;此外, 由于反硝化过程会产生碱度, 假设两个生物滴滤塔硝化能力相同的情况下, 生物滴滤塔A营养液的pH理论上应高于生物滴滤塔B, 但实际上生物滴滤塔A营养液的pH(9.0)一直低于生物滴滤塔B(9.5), 可以推断生物滴滤塔A的硝化速率亦高于生物滴滤塔B.因此, 构建的SND生物滴滤塔A的较高脱氮能力归因于其具有较高的硝化能力和反硝化能力.
此外, 通过对比分析生物滴滤塔进、出气中N2O浓度可以发现, SND生物滴滤塔A在具有较高反硝化速率的同时, 伴随着较高浓度的N2O排放, 尤其是在最初的16 h内, N2O生成量可高达18 mg·m-3, 产生量远远高于对照生物滴滤塔B.由此, SND生物滴滤塔A虽然具有较高的脱氮能力, 但也具有相对较高的N2O排放, 因此, 需进一步开展研究明确SND生物滴滤塔的N2O生成机制, 并进一步开展N2O排放调控研究.
3.5 SND生物滴滤塔微生物种群结构分析为了比较分析两个生物滴滤塔的微生物多样性, 采用16S rRNA高通量测序技术分析不同生物滴滤塔的微生物种群组成, 发现两个生物滴滤塔微生物样品测序结果中样本文库覆盖率(coverage)均大于0.98, 说明此次测序能够检测出生物样品的大多数微生物, 能够充分覆盖细菌多样性.在微生物多样性研究中, Alpha多样性可用来描述生物滴滤塔内部的物种多样性程度, 常用的评价指数有Shannon、ACE、Chao和Simpson指数等, 其中, Shannon、ACE和Chao指数值越大, 说明微生物群落多样性越多, 而Simpson指数越大, 说明微生物群落多样性越少.两个生物滴滤塔上、下层陶粒样品的Alpha多样性分析结果见表 1.由表可知, 生物滴滤塔A上、下两层的Shannon指数值分别为3.52和3.48, 均显著高于生物滴滤塔B(p < 0.05), 说明构建的SND生物滴滤塔具有更高的微生物多样性.同样, Simpson指数分析结果亦能证明这一结论.
| 表 1 生物滴滤塔微生物多样性指数分析结果 Table 1 Microbial diversity index of the bio-trickling filters |
对所有生物样本进行均一化处理绘制PCA图(图 6), 图中每个点代表一个生物样品, 其中, 圆点代表同步硝化反硝化生物滴滤塔A, 三角代表生物滴滤塔B, 两样本点越接近, 表明两样本物种组成越相似.由图可以看出, 两个生物滴滤塔样品的分布差异大, 明显分离, 其中, 第一主成分PC1的贡献率为46.21%, 第二主成分PC2的贡献率为18.31%.
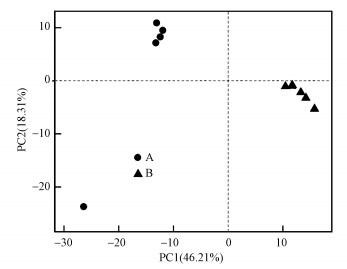 |
| 图 6 生物滴滤塔种群结构PCA分析图 Fig. 6 The PCA analysis of the microbiol structure between two bio-trickling filters |
基于16S rRNA的高通量测序结果, 对比分析两个生物滴滤塔的微生物种群结构及微生物空间分布规律(图 7).SND和对照生物滴滤塔的优势微生物均以变形菌门(Proteobacteria)为主, 所占比例为47.63%~56.69%.SND生物滴滤塔A中的优势菌属主要为拟杆菌门(Bacteroidetes), 其在上、下两层的相对丰度分别为20.30%和28.59%, 显著高于生物滴滤塔B(8.93%和9.16%), 厚壁菌门(Firmicutes)在SND生物滴滤塔上层的相对丰度较高, 为19.31%.对照生物滴滤塔B中的优势菌主要为酸杆菌(Acidobacteria), 其上、下两层的相对丰度分别为13.05%和14.11%, 此外, 拟杆菌门(Bacteroidetes)在对照生物滴滤塔B上、下两层的相对丰度也较高, 分别为8.93%和9.16%.
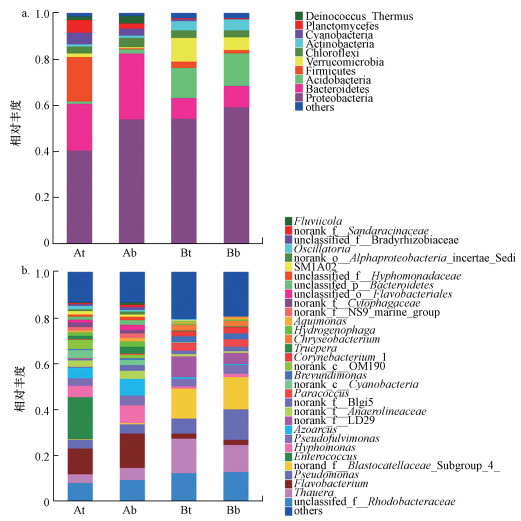 |
| 图 7 生物滴滤塔微生物种群结构对比分析 (a.门水平, b.属水平) Fig. 7 Comparison of the microbial community structure of bio-trickling filters |
属水平上, SND生物滴滤塔A和对照生物滴滤塔B的物种组成有明显不同.SND生物滴滤塔A上、下两层的优势菌属为黄杆菌属(Flavobacterium), 其所占比例分别为11.53%和15.26%, 显著高于生物滴滤塔B(2.12%和2.17%).SND生物滴滤塔上、下层的微生物分级非常明显, 其中, 肠球菌属(Enterococcus)为SND生物滴滤塔A上层的特有菌种, 其相对丰度为18.26%.生物滴滤塔B的优势菌属为陶厄氏菌属(Thauera), 上、下两层的相对丰度分别为15.10%和11.15%.值得注意的是, 在SND生物滴滤塔中检测到许多尚未被充分研究或者没有明确分类信息的物种, 如norank NS9 marine group、norank Cytophagaceae、unclassified Flavobacteriales、unclassified Bacteroidetes、unclassified Hyphomonadaceae等, 上述物种在对照生物滴滤塔B的相对丰度极低或没有.Wittebolle等(2005)也研究发现, 在脱氮过程中某些数量不多的物种的RNA信号却很很活跃.因此, 推测SND生物滴滤塔具有的上述稀有物种是在SND复合菌群富集驯化过程获得的, 有可能与SND生物滴滤塔较高的脱氮能力有关.
4 结论(Conclusions)1) 与对照生物滴滤塔相比, 基于好氧反硝化构建的SND生物滴滤塔挂膜启动速度快, 运行稳定, NH3去除效率高达95%, 反硝化能力强, 具有较低的NO3--N累积特征.
2) SND生物滴滤塔的除氨性能优于对照生物滴滤塔B, 当停留时间为16 s时, SND生物滴滤塔的NH3去除效率仍可达到90%以上, 而对照生物滴滤塔的NH3去除效率要低于80%.此外, SND生物滴滤塔在低进气NH3浓度时(20 mg·m-3), 也能够维持90%以上的NH3去除效率.
3) SND生物滴滤塔具有较高的微生物多样性, 其优势菌属为黄杆菌属(Flavobacterium), 且具有丰富的稀有菌属.
Barman P, Bandyopadhyay P, Kati A, et al. 2017. Characterization and strain improvement of aerobic denitrifying EPS producing bacterium Bacillus cereus PB88 for shrimp water quality management[J]. Waste & Biomass Valorization, (3): 1-12. |
Dobslaw D, Woiski C, Engesser K H. 2010. Implementation of TA Luft 2002 in existing plants:a bioscrubber for combined waste air and waste water treatment[J]. Chemie Ingenieur Technik, 82(12): 2161-2170. DOI:10.1002/cite.201000030 |
Du C, Cui C W, Qiu S, et al. 2017. Nitrogen removal and microbial community shift in aerobic denitrification reactor bioaugmented initially with Pseudomonas strain for coal-based ethylene glycol industry wastewater treatment[J]. Environmental Science & Pollution Research, 24(12): 11435-11445. |
杜丛.2017.基于Pseudomonas sp.T13强化的好氧反硝化系统构建及脱氮效能研究[D].哈尔滨: 哈尔滨工业大学 http://cdmd.cnki.com.cn/Article/CDMD-10213-1017862098.htm
|
Faulkner W B, Shaw B W. 2008. Review of ammonia emission factors for United States animal agriculture[J]. Atmospheric Environment, 42(27): 6567-6574. DOI:10.1016/j.atmosenv.2008.04.021 |
Gu B J, Ju X T, Chang S X, et al. 2017. Nitrogen use efficiencies in Chinese agricultural systems and implications for food security and environmental protection[J]. Regional Environmental Change, 17(4): 1217-1227. DOI:10.1007/s10113-016-1101-5 |
卢仁钵, 杜青平, 许燕滨, 等. 2016. 降解乙苯生物滴滤塔稳定运行期生物膜特征及微生物多样性研究[J]. 环境科学学报, 36(10): 3561-3568. |
梁美生, 冯珂, 高改凤. 2013. 生物滴滤塔去除氨气的两种反应器启动方法对比[J]. 太原理工大学学报, 44(1): 89-93. DOI:10.3969/j.issn.1007-9432.2013.01.022 |
刘春敬, 李坚, 刘佳, 等. 2012. 分期布液生物滴滤床净化H2S废气性能研究[J]. 环境科学, 33(9): 2987-2992. |
Liu C, Xie J, Song M, et al. 2018. Nitrogen removal performance and microbial community changes in subsurface wastewater infiltration systems (SWISs) at low temperature with different bioaugmentation strategies[J]. Bioresource Technology, 250: 603-610. DOI:10.1016/j.biortech.2017.11.089 |
李焕, 汪群慧, 孙晓红, 等. 2012. 高效氨氧化菌群富集、驯化及其动态变化规律分析[J]. 环境工程学报, 6(5): 1548-1552. |
任爱玲, 赫环环, 郭斌, 等. 2013. 生物滴滤塔净化含低浓度苯乙烯废气的研究[J]. 环境科学学报, 33(7): 1840-1848. |
Melse R W, Ogink N W M, Rulkens W H. 2009. Overview of European and Netherlands' regulations on airborne emissions from intensive livestock production with a focus on the application of air scrubbers[J]. Biosystems Engineering, 104(3): 289-298. DOI:10.1016/j.biosystemseng.2009.07.009 |
Melse R W, Ploegaert J P M, Ogink N W M. 2012. Biotrickling filter for the treatment of exhaust air from a pig rearing building:Ammonia removal performance and its fluctuations[J]. Biosystems Engineering, 113(3): 242-252. DOI:10.1016/j.biosystemseng.2012.08.010 |
Raboni M, Torretta V. 2016. A modified biotrickling filter for nitrification-denitrification in the treatment of an ammonia-contaminated air stream[J]. Environmental Science & Pollution Research, 23(23): 24256-24264. |
Robertson L A, Kuenen J G. 1984. Aerobic denitrification:a controversy revived[J]. Arch Microbiol, 139(5): 351-354. |
Sun J, Liu L, Xu L, et al. 2018. Key role of nitrate in phase transitions of urban particles:implications of important reactive surfaces for secondary aerosol formation[J]. Journal of Geophysical Research Atmospheres, 123(16): 1234-1243. |
孙庆花, 于德爽, 张培玉, 等. 2016. 1株海洋异养硝化-好氧反硝化菌的分离鉴定及其脱氮特性[J]. 环境科学, 37(2): 647-654. |
Wittebolle L, Boon N, Vanparys B, et al. 2005. Failure of the ammonia oxidation process in two pharmaceutical wastewater treatment plants is linked to shifts in the bacterial communities[J]. Applied Microbiology, 99(5): 997-1006. DOI:10.1111/j.1365-2672.2005.02731.x |
薛俊红. 2017. 浅谈环境空气中氨的来源及污染现状[J]. 山西科技, 32(1): 139-141. DOI:10.3969/j.issn.1004-6429.2017.01.042 |
Zápotocký L, Šváb M. 2012. Removal of ammonia emissions from waste air in a biotrickling filter:pilot-scale demonstration in real conditions[J]. Central European Journal of Chemistry, 10(4): 1049-1058. |
Zheng M, He D, Ma T, et al. 2014. Reducing NO and N2O emission during aerobic denitrification by newly isolated Pseudomonas stutzeri PCN-1[J]. Bioresource Technology, 162(6): 80-88. |
章正勇, 陈旭, 安立超. 2007. 氨氧化细菌富集培养的实验研究[J]. 化学与生物工程, (7): 63-67. DOI:10.3969/j.issn.1672-5425.2007.07.020 |
张瑞.2013.耐低温反硝化菌的选育及其脱氮特性研究[D].成都: 四川师范大学 http://cdmd.cnki.com.cn/Article/CDMD-10636-1014114975.htm
|
 2020, Vol. 40
2020, Vol. 40


