近年来, 由于化石燃料燃烧导致CO2排放量迅速升高, 从而引起了人们越来越多的关注.考虑到人类生存的环境, 124个国家已签署了《巴黎协议》, 旨在减少CO2排放, 缓解温室效应.此外, CO2作为一种宝贵的碳资源, 已广泛应用于多个领域.基于以上考虑, 世界各国特别是发达国家已对排放的CO2进行回收和利用, 其中, 富集并安全封存烟气中CO2是一种迅速大量削减其排放量的有效手段(项菲等, 2003).
目前, 电厂燃烧后捕集技术主要有:化学吸收法(晏水平等, 2006; Qing et al., 2010; Zhang et al., 2015)、膜法(Lv et al., 2013; Ansaripour et al., 2017)、吸附分离法(徐冬等, 2010; Yin et al., 2012)、低温蒸馏法(Aaron et al., 2005; Maqsood et al., 2016), 其中, 化学吸收法应用最为广泛.化学吸收法能高效地从烟气中去除CO2, 去除效率可达99%, 是目前最成熟的方法之一(马双忱等, 2009).但该法存在溶剂容易降解、再生能耗高、腐蚀性强等缺点, 这也极大地限制了化学吸收法的更广泛应用(马双忱等, 2012; Kenarsari et al., 2013; 王昊等, 2015).例如, 将目前的以乙醇胺(MEA)为吸收剂的CO2捕集工艺应用在燃煤电厂中会导致电厂整体热效率下降25%~40%, 电力成本上升70%~100%(Manzolini et al., 2015).此外, 捕集后的CO2需要被压缩并运输到封存地点封存, 这会进一步导致能量消耗及成本增加(Munkejord et al., 2016).针对以上问题, 开发出新型的再生技术来解决传统化学吸收法的不足是非常有意义的.
考虑到醇胺溶液可以快速吸收CO2和CO2矿化反应具有较低的能量消耗, 有研究者已致力于使用醇胺溶液的CO2解吸与矿化封存新工艺来代替传统醇胺溶液CO2捕集工艺中的热解吸, 并取得了一定的进展.其中, 在醇胺富液再生方面, Arti等(2017)提出在醇胺富液中加入氯化钙(CaCl2), CaCl2与富液之间发生碳酸化反应, 从而使CO2被化学解吸出来.Kang等(2018)提出在2-氨基-2-甲基-1-丙醇(AMP)富液中加入氧化钙(CaO), CaO与AMP富液之间发生碳酸化反应, 使CO2从AMP溶液中解吸出来, 而AMP溶液在没有额外输入能量条件下得到再生.Li等(2016)研究了MEA富液与硅灰石(CaSiO3)之间的碳酸化反应, 发现MEA溶液可在碳酸化反应后再生.此外, 国内学者也对化学再生工艺开展了试验研究.例如, 潘丹萍等(2013)提出了一种基于氨循环的碳酸化固定燃煤烟气中CO2的技术方法, 以氨水为吸收剂、电石渣为再生剂, 直接将燃煤烟气中的CO2在常温常压下转化为CaCO3, 同时生成的氨水溶液循环利用.叶龙泼等(2015)提出一种溶剂萃取与Ca2+碳酸化的耦合反应工艺, 以三丁胺为萃取剂将HCl从水相萃取到有机相, 在固定CO2的同时还实现了CaCl2的碳酸化;该工艺不涉及CO2捕集费用及热量输入, 缓解了传统的CO2捕集封存技术高成本的难题.马伟春等(2018)提出在CO2负载的MEA溶液中加入氢氧化钙(Ca(OH)2), Ca(OH)2与富液之间发生碳酸化反应, 从而使富液中的CO2被解吸出来, 同时CO2得到矿化固定.
由于单一吸收剂存在吸收速率差、吸收量低、再生负荷高、易被氧化生成热稳定性盐等缺点(Yan et al., 2009; Martin et al., 2012; 高红霞等, 2015), 因此, 本文以N-甲基二乙醇胺(MDEA)为主体, 添加少量的哌嗪(PZ)组成的混合胺溶液为CO2吸收剂, 对钙法解吸固定富液中CO2进行试验, 用单因素实验分析法探究富液解吸过程中负荷、Ca(OH)2投加量、pH、解吸温度及搅拌速率对解吸率的影响.在此基础上考察再生液的循环稳定性, 并对碳酸化反应特性进行实验研究, 以期为后续研究提供实验与理论基础.
2 解吸机理(Desorption mechanism)Ca(OH)2粉末微溶于水, 因而不能直接用作CO2的吸收剂, 但其在醇胺类物质中溶解度较大, 且可与CO2反应生成对应的钙盐.首先, 在CO2吸收阶段, MDEA与CO2通过反应(1)生成中间化合物, 其在吸收过程中扮演CO2水解时的催化剂.
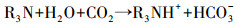
|
(1) |
由于MDEA没有多余的H原子, 因此与CO2反应生成HCO3-而不是氨基甲酸根, 吸收容量很大, 但反应速率很慢, 是反应的控制步骤;加入活化剂PZ后改变了反应历程, MDEA与中间产物H+直接发生反应, 大大加快了反应速率(式(2)~(4)).
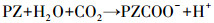
|
(2) |
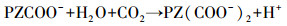
|
(3) |
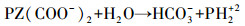
|
(4) |
随后HCO3-电离水解为CO3-, 加入Ca(OH)2后, Ca2+与CO32-结合生成CaCO3沉淀并与上清液分离, 从而完成对CO2的解吸-矿化, 上清液即为解吸后的吸收贫液, 可再吸收利用(式(5)~(8)).
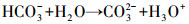
|
(5) |
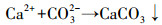
|
(6) |
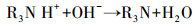
|
(7) |

|
(8) |
仪器:电子分析天平(AL204型)、二联磁力搅拌器(HJ-2型)、恒温油浴箱(HH-S型)、气体流量计(LZB-2型)、孟氏洗气瓶(500 mL)、碱式滴定管(50 mL)、温度计等.
试剂:N-甲基二乙醇胺、哌嗪、氢氧化钙均为分析纯, 浓硫酸(质量分数98.0%), CO2瓶气(纯度≥99.9%), 自制蒸馏水.
3.2 实验方法图 1为本实验使用的CO2吸收装置.实验中以MDEA为主体, 添加少量的PZ, 两者构成不同物质的量比(2:0、1.8:0.2、1.6:0.4和1.2:0.8, mol:mol)的MDEA/PZ混合吸收剂.然后将配制好的MDEA/PZ混合溶液(总浓度为2 mol·L-1)置于1 L三口烧瓶中, 在常压下利用磁力搅拌器搅拌均匀, 以150 mL·min-1的流速通入CO2瓶气, 流量由转子流量计控制, 制得某一CO2负荷(每mol胺捕获的CO2物质的量)的吸收液作为解吸富液.将制备好的富液转移到如图 2所示的胺溶液再生试验系统中.调节实验参数(CO2负荷、Ca(OH)2投加量、pH、温度、搅拌速率), 待反应结束后静置沉淀.在整个实验过程中, 反应器内保持常压.反应期间, 等时间间隔对上清液采样(2 mL).Ca(OH)2添加量(mol·mol-1)定义为CO2与添加的Ca(OH)2物质的量比.利用CO2负荷测定装置检测解吸前后的负荷, 通过公式(6)计算解吸率(η)(Crooks et al., 1989; Aroonwilas et al., 1998).
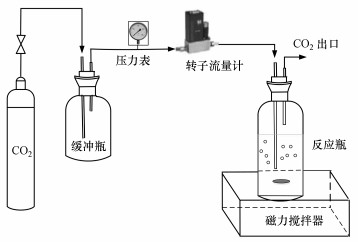 |
| 图 1 CO2吸收实验装置 Fig. 1 Absorbent CO2 absorption experiment system |
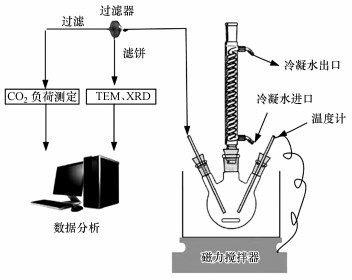 |
| 图 2 胺溶液再生实验装置 Fig. 2 Absorbent rich liquid regeneration and regeneration device |

|
(9) |
式中, η为解吸率, C0为富液初始的CO2负荷, Ct为富液t时刻的CO2负荷.
3.3 分析设备采用Bruker D2 pHASER型X射线衍射仪(X-ray diffraction, XRD)测定碳酸化后固体产物的组成.采用日本电子公司Hitachi8100Ⅳ型透射电镜(Transmission Electron Microscope, TEM)观察碳酸化产物的微观形貌.
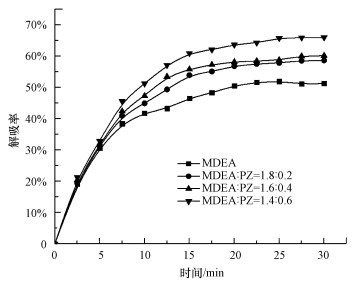
4 结果与讨论(Results and discussion) 4.1 MDEA/PZ富液再生CO2的过程分析图 3所示为MDEA/PZ富液再生CO2的反应过程.试验采用总浓度为2 mol·L-1、负荷为0.6 mol·L-1的MDEA/PZ富液, 在常压、温度20 ℃和搅拌转速600 r·min-1条件下再生.如图 3所示, 在试验解吸前期, 由于Ca(OH)2与CO2充分反应, CO2的解吸率逐渐升高.随着试验的进行, 以MDEA单组分吸收为主, 且随着PZ的消耗, 溶液中的H+浓度逐渐降低, 导致HCO3-浓度降低, 使得CO2解吸率逐渐趋于平稳.在反应30 min之后, 开始进入CO2固定阶段, 在经历快速上升到缓慢上升再到逐步稳定3个阶段后, CO2解吸率最终保持在一定的稳定值.
 |
| 图 3 MDEA/PZ富液再生CO2的典型反应历程 Fig. 3 Typical reaction process of CO2 regeneration from MDEA/PZ rich solution |
从吸收剂配比来看, MDEA作为常用的三级胺, 对CO2的吸收容量大, 但吸收速率较低, 而PZ相对于常规吸收剂有较高的吸收速率.因此, 在MDEA中添加PZ改变了MDEA的反应历程, 从而大大提高了反应速率, 理论上有助于综合两者的优势.由图 3可知, 在相同负荷下, PZ相对比例越高, 混合富液的CO2解吸率越高.在负荷为0.6 mol·L-1条件下, PZ添加比例为0时(即单一MDEA溶液)的解吸率为51.23%, 而MDEA:PZ分别为1.8:0.2、1.6:0.4、1.4:0.6的混合富液的CO2解吸率分别为56.62%、58.63%和61.93%, 分别提高了5.39%、7.4%和10.7%.出现上述现象的原因可由富液解吸机理说明:当在MDEA中添加少量PZ时, 吸收以MDEA为主导, MDEA与CO2的反应速率慢, 溶液中的HCO3-浓度偏低, 不利于矿化反应进行;PZ添加比例增大时, PZ与CO2快速反应, H+浓度迅速上升, 为MDEA提供了大量的H+, HCO3-浓度升高, HCO3-经水解产生CO32-, 进而促进矿化反应.因此, 提高PZ浓度有助于富液再生, 从而达到一个较优的再生效果.
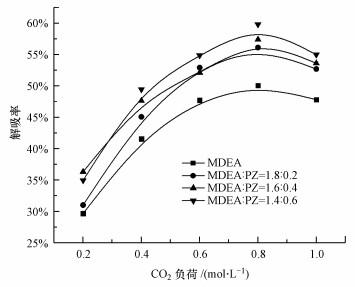
4.2 CO2负荷对碳酸化反应的影响在Ca(OH)2投加量为1:1, 温度为20 ℃, 搅拌速率为600 r·min-1的条件下, 考察了CO2负荷对解吸率的影响, 结果如图 4所示.由图可知, 随着CO2负荷的升高, 解吸率呈先升高后降低的趋势.以MDEA/PZ=1.4:0.6的混合富液为例, 当CO2负荷从0.2 mol·L-1增加到0.8 mol·L-1, 解吸率从34.99%增加到59.79%, 而当CO2负荷进一步增加到1.0 mol·L-1时, 解吸率则下降到54.99%.这是由于PZ吸收CO2后可形成不稳定的二胺基甲酸酯(PZ(COO-)2), 这有利于在胺溶液中形成较高的HCO3-浓度从而促进CO2的矿化.HCO3-进一步水解转化为CO32-, 所以更多的CO32-被Ca2+固定下来.但当CO2负荷继续增加时, 溶液pH值降低, 低pH值使PZ(COO-)2变得不稳定, 从而通过反应(4)分解为碳酸氢根(HCO3-)和PH2+2(Bishnoi et al., 2002).随着CO2负荷进一步升高, 低pH值会使反应(5)的平衡反向移动, 从而降低了溶液中的CO32-浓度, 阻碍了CaCO3的沉淀.因此, 在实际工程中采用MDEA/PZ作为吸收剂循环使用时, 建议当MDEA/PZ富液的CO2负荷最高达到0.8 mol·L-1时即进行解吸, 使再生过程中更多地发生反应(2)和(3), 从而达到降低能耗的效果.
 |
| 图 4 不同CO2负荷对CO2解吸率的影响 Fig. 4 Effect of different CO2 loading on CO2 desorption rate |
在CO2负荷为0.6 mol·L-1, 温度为20 ℃, 搅拌速率为600 r·min-1的条件下, 考察了Ca(OH)2投加量对解吸率的影响, 结果如图 5所示.由图可知, 随着Ca(OH)2投加量的增加, CO2解吸率先迅速增加, Ca(OH)2投加量为1:1时, 4种吸收富液的解吸率分别为45.79%、50.92%、53.12和57.87%.其主要原因是溶液中引入了大量的OH-, 促进了反应(2)和(3)正向进行, 从而强化了水解反应, 起到了加速矿化反应的作用(Zhang et al., 2012).随着Ca(OH)2投加量的进一步增加, 解吸率逐渐趋于平稳.原因可能与Ca(OH)2在富液中的溶解度有关, Ca(OH)2投加过量后, 并不能使所能解离出的Ca2+和OH-量相应的增加, 从而导致矿化产物量开始趋于平衡.同时, 考虑到Ca(OH)2投加过量可导致再生后的贫液中可能存在一定浓度的Ca2+, 从而影响贫液的二次吸收效果, 因而需要将Ca(OH)2投加量控制在合理范围, 推荐Ca(OH)2的最佳投加量为1:1.
 |
| 图 5 不同Ca(OH)2投加量对CO2解吸率的影响 Fig. 5 Effect of Ca(OH)2 dosage on CO2 desorption rate |
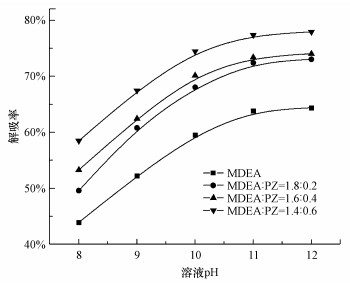
在CO2负荷为0.6 mol·L-1, Ca(OH)2投加量为1:1, 温度为20 ℃, 搅拌速率为600 r·min-1的条件下, 考察了pH对解吸率的影响, 结果如图 6所示.随着溶液pH增加, CO2解吸率先增加后逐渐趋于稳定.以MDEA/PZ=1.4:0.6的混合富液为例, 随着pH从8.0增加至10.0, CO2解吸率从58.49%增加到74.48%, 然而当pH从10.0增加到12.0, CO2解吸率逐渐趋于平稳, pH为12.0时CO2解吸率达到最大值77.95%.这是由于增大pH会增强两性离子去质子化反应, 使中间产物PZ(COO-)2增加, 溶液中HCO3-量增多, 从而有利于Ca(OH)2对CO2的固定, 同时也使OH-可以中和质子化的MDEA/PZ, 从而大大强化了富液再生;另一方面, 在强碱环境下, 溶液中主要以PZCOO-为主, 只存在少量的PZ(COO-)2, 使参与固碳反应的CO32-量减少, 不利于矿化反应的进行, 同时在强碱环境下将会加剧设备腐蚀, 增加投资成本.综合实验结果可知, pH的增加能促进CO2解吸-矿化反应, 但这种促进作用是有限的, 因此, 确定最佳pH为10.0.
 |
| 图 6 不同pH值对CO2解吸率的影响 Fig. 6 Effect of different pH on CO2 desorption rate |
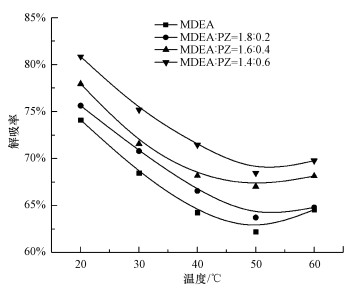
在CO2负荷为0.6 mol·L-1, Ca(OH)2投加量为1:1, 搅拌速率为600 r·min-1的条件下, 考察了温度对解吸率的影响, 结果如图 7所示.在20~50 ℃时, CO2解吸率随温度的升高而降低, 这可能是因为随着温度升高, Ca(OH)2的溶解度随之降低, 从而降低了可参与再生反应的Ca+浓度, 且Ca(OH)2与CO2反应为放热反应, 因此, 高温不利于解吸和矿化反应的正向进行.随着温度的进一步升高(<60 ℃), CO2解吸率反而开始升高, 但沉淀的量并未增加.说明被混合胺溶液吸收的CO2在高温下以热解吸的形式释放出来.为达到Ca(OH)2碳酸化固定CO2的目的, 在保证CO2被Ca2+矿化固定的同时, 考虑混合吸收剂对CO2吸收性能的提高效果及对整个工艺能耗的增加, 认为20 ℃为最佳再生温度条件.
 |
| 图 7 不同温度对CO2解吸率的影响 Fig. 7 Effect of different temperatures on CO2 desorption rate |
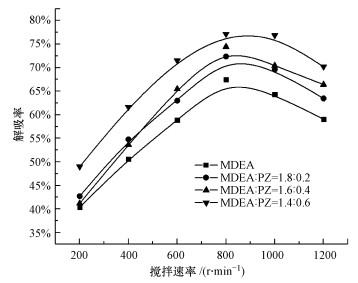
在CO2负荷为0.6 mol·L-1, Ca(OH)2投加量为1:1, 温度为20 ℃的条件下, 考察了搅拌速率对解吸率的影响, 结果如图 8所示.由图可知, 随着搅拌速率的增加, CO2解吸率呈先增加后降低的趋势.以MDEA/PZ=1.4:0.6的混合富液为例, 当搅拌速率从200 r·min-1增加到800 r·min-1时, CO2解吸率从48.98%增加到77.13%.然而当搅拌速率进一步增加时, CO2解吸率开始下降至70.19%(1200 r·min-1).理论上, 在Ca(OH)2投加量一定的条件下, 搅拌速率增大, 单位时间内溶液中的传质过程得到强化, 固/液传质速率加大, 从而促进了Ca(OH)2的溶解, Ca2+被矿化固定、沉淀后, 上清液用于下一轮矿化反应.但搅拌速率过高时, 会扰动整个反应体系.从实验结果来看, 800 r·min-1便足已保证Ca(OH)2与CO2充分反应, 因此, 选择搅拌速率为800 r·min-1.
 |
| 图 8 不同搅拌速率对CO2解吸率的影响 Fig. 8 Effect of different stirring rates on CO2 desorption rate |
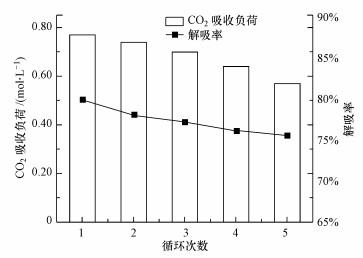
在实际应用中, 理想的吸收剂应具有高CO2吸收能力、高循环负荷和高再生效率.化学再生可在短时间内实现再生, 从而降低再生设备尺寸、降低投资成本.在CO2负荷为0.8 mol·L-1, Ca(OH)2投加量为1:1, 温度为20 ℃, 搅拌速率为800 r·min-1的条件下, 考察了5次吸收-再生循环中MDEA/PZ溶液的CO2吸收负荷和解吸率的变化, 结果如图 9所示.
 |
| 图 9 MDEA/PZ多次吸收-再生循环曲线 Fig. 9 MDEA/PZ multiple absorption-regeneration cycle curve |
由图 9可知, 5次吸收-解吸后, CO2吸收负荷从0.80 mol·L-1降至0.57 mol·L-1, 5次吸收-再生循环后至少保留了原液70%的吸收容量;而经热解吸后的MEA再生液的CO2二次吸收负荷只有一次吸收负荷的38%左右(郭超等, 2014), 这说明经钙法解吸后的再生液显示出较好的循环使用稳定性, 具有一定的工业应用价值.这主要是由于钙法在常温(20 ℃)环境再生, 富液解吸过程中吸收剂的氧化降解量大为减少.此外, CO2解吸率从79.79%下降到75.46%, 降幅在4.33%左右, MDEA/PZ体系多次循环后解吸率仍较高, 且解吸率的降低在可接受的范围.因此, MDEA/PZ体系多次循环解吸富液具有一定的可行性.
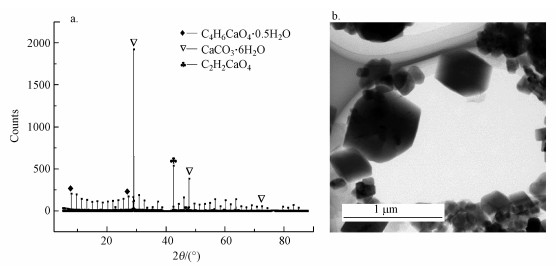
4.8 碳酸化反应后固体产物表征图 10为Ca(OH)2碳酸化后固体产物的XRD图和TEM图.从XRD图可以看到(图 10a), 除有CaCO3·6H2O(PDF#37-0416)存在外, 在2θ=17.3°、38.1°处明显有C4H6CaO4·0.5H2O出现, 而且并没有检测到氢氧化钙的存在, 说明在20 ℃下经过长达15 min的解吸矿化后富液中的CO2转化为含碳钙的化合物, 且与氢氧化钙完全充分反应, 进一步验证了反应机理.从TEM图可知(图 10b), 碳酸化后的产物呈现立方体型, 粒径为30~50 μm, 尺寸大小不一, 有些已经形成轻微的团聚.且反应后生成大量块状颗粒, 说明Ca(OH)2固定CO2后生成CaCO3及含钙的化合物, 达到了Ca(OH)2碳酸化固定CO2的目的.
 |
| 图 10 碳酸化后的XRD(a)和TEM(b)图 Fig. 10 X-ray(a) and chromatic transmission electron microscopy(b) after carbonation |
1) MDEA/PZ富液的解吸效果与CO2负荷、Ca(OH)2投加量、pH、温度、搅拌速率等有关.CO2解吸率随CO2负荷和搅拌速率的升高呈先升高后下降的趋势, 随Ca(OH)2投加量和pH的增大先增大后趋于平稳, 随温度的升高先下降后升高.
2) 在CO2负荷为0.8 mol·L-1, Ca(OH)2投加量为1:1, 温度为20 ℃, 搅拌速率为800 r·min-1的条件下, CO2解吸率达到79.79%.
3) 动态吸收-再生循环实验表明, 与传统热解吸法相比, 经化学再生解吸后的再生液保留了原来70%的吸收性能和稳定的再生率, 具有良好的重复使用性.
Aaron D, Tsouris C. 2005. Separation of CO2 from flue gas:A Review[J]. Separation Science & Technology, 40(1/3): 321-348. |
Ansaripour M, Haghshenasfard M, Moheb A. 2017. Experimental and numerical investigation of CO2 absorption using nanofluids in a hollow fiber membrane contactor[J]. Chemical Engineering & Technology, 41(2): 367-378. |
Aroonwilas A, Tontiwachwuthikul P. 1998. Mass transfer coecients and correlation for CO2 absorption into 2-amine-2-methyl-1-propanol (AMP) using structured packing[J]. Ind Eng Chem Res, 37: 569-575. DOI:10.1021/ie970482w |
Arti M, Youn M H, Park K T, et al. 2017. Single process for CO2 capture and mineralization in various alkanolamines using calcium chloride[J]. Energy & Fuels, 31(1): 763-769. |
Bishnoi S, Rochelle G T. 2002. Absorption of carbon cioxide in aqueous piperazine/methyldiethanolamine[J]. AICHE Journal, 48(12): 2778-2799. |
Crooks J E, Donnellan J P. 1989. ChemInform abstract:Kinetics and mechanism of the reaction between carbon dioxide and amines in aqueous solution[J]. ChemInform, 4(4): 331-333. |
郭超, 陈绍云, 陈思铭, 等. 2014. 13C NMR定量分析一乙醇胺(MEA)与CO2的吸收和解吸特性[J]. 化工进展, 33(11): 3101-3106. |
高红霞, 刘森, 徐彬, 等. 2015. N, N-二乙基乙醇胺(DEEA)溶液CO2吸收解吸性能的实验研究[J]. 化工学报, 66(9): 3739-3745. |
Kang J M, Murnandari A, Youn M H, et al. 2018. Energy-efficient chemical regeneration of AMP using calcium hydroxide for operating carbon dioxide capture process[J]. Chemical Engineering Journal, 34(3): 935-941. |
Kenarsari S D, Yang D, Jiang G, et al. 2013. Review of recent advances in carbon dioxide separation and capture[J]. Rsc Advances, 3(45): 22739-22773. DOI:10.1039/c3ra43965h |
Li Q, Gupta S, Tang L, et al. 2016. A novel strategy for carbon capture and sequestration by rHLPD processing[J]. Front Energy Research, 3: 53. |
Lv Y, Yu X, Tu S T, et al. 2012. Experimental studies on simultaneous removal of CO2 and SO2 in a polypropylene hollow fiber membrane contactor[J]. Applied Energy, 97(9): 283-288. |
Manzolini G, Sanchez Fernandez S, Rezvani S, et al. 2015. Economic assessment of novel amine based CO2 capture technologies integrated in power plants based on European Benchmarking Task Force methodology[J]. Applied Energy, 138: 546-558. DOI:10.1016/j.apenergy.2014.04.066 |
Maqsood K, Ali A, Shariff A B M, et al. 2016. Process intensification using mixed sequential and integrated hybrid cryogenic distillation network for purification of high CO2 natural gas[J]. Chemical Engineering Research and Design, 117(1): 414-438. |
Martin S, Lepaumier H, Picq D, et al. 2012. New amines for CO2 capture.Ⅳ.degradation, corrosion, and quantitative structure property relationship model[J]. Ceramics International, 34(7): 1603-1608. |
Munkejord S T, Hammer M, Løvseth S W. 2016. CO2 transport:Data and models-A review[J]. Applied Energy, 169(5): 499-523. |
马双忱, 孙云雪, 马京香, 等. 2009. 电厂烟气中二氧化碳的捕集技术[J]. 电力科技与环保, 25(6): 58-62. DOI:10.3969/j.issn.1674-8069.2009.06.019 |
马双忱, 王梦璇, 孟亚男, 等. 2012. 氨法吸收烟气中二氧化碳与脱碳后溶液解吸研究进展[J]. 化工进展, 31(5): 1143-1148. |
马伟春, 张卫风, 焦月潭, 等. 2018. 钙法解吸并固定乙醇胺富液中CO2[J]. 环境科学学报, 38(1): 109-114. |
潘丹萍, 郭彦鹏, 陈浩, 等. 2013. 铵基循环碳酸化固定CO2[J]. 化工学报, 64(6): 2232-2239. DOI:10.3969/j.issn.0438-1157.2013.06.044 |
Qing L I, Yun-Song Y U, Jiang J, et al. 2010. CO2 capture by chemical absorption method based on heat pump technology[J]. Journal of Chemical Engineering of Chinese Universities, 24(1): 29-34. |
王昊, 侯法柱, 尚航, 等. 2015. 乙醇胺(MEA)法燃煤电厂CO2捕集系统尾气二次污染分析[J]. 化工进展, 34(9): 3495-3499. |
徐冬, 张军, 翟玉春, 等. 2010. 变压吸附分离工业废气中二氧化碳的研究进展[J]. 化工进展, 29(1): 150-156. |
叶龙泼, 李爽, 岳海荣, 等. 2015. 富钙溶液中萃取与反应耦合强化CO2矿化过程[J]. 化工学报, 66(9): 3511-3517. |
项菲, 施耀, 李伟. 2003. 混合有机胺吸收烟道气中CO2的实验研究[J]. 环境污染与防治, 25(4): 206-208. DOI:10.3969/j.issn.1001-3865.2003.04.006 |
Yan S P, Fang M X, Luo Z Y, et al. 2009. Regeneration of CO2 from CO2-rich alkanolamines solution by using reduced thickness and vacuum technology:Regeneration feasibility and characteristic of thin-layer solvent[J]. Chemistry Engineering Process Process Intensif, 48(1): 515-523. DOI:10.1016/j.cep.2008.06.009 |
Yin J, Qin C, Hui A, et al. 2012. High-temperature pressure swing adsorption process for CO2 separation[J]. Energy & Fuels, 26(1): 169-175. |
晏水平, 方梦祥, 张卫风, 等. 2006. 烟气中CO2化学吸收法脱除技术分析与进展[J]. 化工进展, 25(9): 1018-1024. DOI:10.3321/j.issn:1000-6613.2006.09.008 |
Zhang G, Yang Y, Gang X, et al. 2015. CO2 capture by chemical absorption in coal-fired power plants:Energy-saving mechanism, proposed methods, and performance analysis[J]. International Journal of Greenhouse Gas Control, 39(8): 449-462. |
Zhang Y L, Wang W L, Liu X, et al. 2012. Experimental study on CO2 fixation in the form of Ca/Mg carbonate precipitation in solutions[J]. Engineering Thermophys, 33(9): 1636-1638. |
 2020, Vol. 40
2020, Vol. 40


