五价砷(As(Ⅴ))和三价砷(As(Ⅲ))是水体中砷的主要存在价态, 在中性水体中, As(Ⅴ)以带电的含氧阴离子形式存在(H2AsO4-和HAsO42-)而As(Ⅲ)以不带电的形式(H3AsO30)存在, 因此常用的离子交换工艺能更有效地去除水中的As(Ⅴ)而不是As(Ⅲ)(Yoshida et al., 1978; Matsunaga et al., 1996; Fan et al., 2011).例如, 离子交换剂3-[2-(2-氨乙基氨基)乙胺基]丙基-三甲氧基甲硅烷功能化二氧化硅凝胶吸附剂对As(Ⅲ)的去除能力(2 mg · g-1)明显低于对As(Ⅴ)的去除量(13.2 mg · g-1) (Fan et al., 2011).由于地下水属于还原性环境, 砷主要以As(Ⅲ)形态存在(Nordstrom, 2002), 而且As(Ⅲ)比As(Ⅴ)毒性更大(Jain et al., 2000; Bissen et al., 2003; Cullen et al., 2010), 通常需要先通过物化方法预处理将As(Ⅲ)氧化成As(Ⅴ).例如, Sánchez等(2010)采用电化学氧化技术结合离子交换膜实现了三价砷的去除.近年来, 随着三价砷氧化菌(Arsenite-Oxidizing Bacteria: AsOB)的不断发现, 通过微生物氧化As(Ⅲ)可以替代化学氧化作为一种经济友好型技术来修复砷污染地下水(Michon et al., 2010a; Wan et al., 2010; Dastidar et al., 2012; Corsini et al., 2014; Li et al., 2016).
本研究通过三乙烯四胺(TETA)接枝共聚丙烯腈(PAN)制备能够高效去除阴离子(CrO42-)的新型离子交换功能纤维FFA-1(Dai et al., 2015).利用实验室长期驯化富集具有氧化三价砷能力的AsOB菌群(Wang et al., 2016), 尝试建立微生物氧化As(Ⅲ)联合离子交换纤维FFA-1的组合工艺, 主要研究目标包括:①评价生物氧化联合离子纤维组合工艺的性能;②研究水中共存阴离子如PO43-、NO3-对As(Ⅲ)的去除影响;③研究长期运行过程中功能微生物种群结构在反应器中变化以及对FFA-1再生性能的影响.
2 材料与方法(Materials and methods) 2.1 AsOB的培养接种的三价砷氧化菌(AsOB)提取自实验室富集了AsOB的序批式反应器(SBR)(Wang et al., 2016).在玻璃锥形瓶中加入10 mL SBR反应器静置后取出的上清液和100 mL富集AsOB的培养基(Battagliabrunet et al., 2002), 并添加NaAsO2作为唯一As(Ⅲ)源, 使培养液中As(Ⅲ)浓度保持在10 mg · L-1左右.将上述混合液放置在振荡培养箱中(25 ℃, 140 r · min-1)培养5 d得到富集的AsOB接种液.接种液在接种到反应器之前取出5 mL, 经过滤膜过滤后, 将携带有菌体的滤膜于-20 ℃冷冻保存, 进行后续的微生物多样性分析.
2.2 试验启动及运行如图 1所示, 建立两个直径为2.8 cm, 高度为30 cm(体积为185 mL)的固定床反应器(R1和R2), 分别填充50 g FFA-1.反应系统搭建完成后, R1用富集的AsOB接种液以0.92 L · h-1的流速在R1中封闭循环72 h挂膜, 然后与未挂膜的对照反应器R2同时启动.进水采用的模拟地下水按照表 1配制(Michon et al., 2010b), 添加NaAsO2作为唯一As(Ⅲ)的来源(1~10 mg · L-1).采用蠕动泵以52.5 mL · h-1的流速泵入R1和R2.
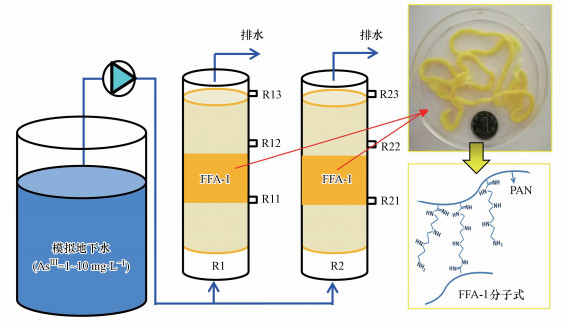 |
| 图 1 试验装置示意图 Fig. 1 Schematic diagram of the experimental set up |
| 表 1 进水水质的化学组成 Table 1 Chemical characteristics of the synthetic water |
试验所用进水中含有各种阴离子, 如SO42-、NO3-等, 每个反应器各设有3个取样口(R11、R12、R13、R21、R22、R23), 测量R1和R2不同阶段各出水中各阴离子浓度, 包括Cl-、SO42-、NO3-、PO43-、AsO43-等.
配制5份100 mL浓度为5 mmol · L-1的As(Ⅴ)溶液于锥形瓶中, 一份作为空白对照, 另外4份分别加入SO42-、NO3-、PO43-、SO42-作为干扰离子(溶液干扰离子与As(Ⅴ)浓度的摩尔比为1 : 1), 经HCl溶液将pH调至7.0~7.5后, 加入1.0 g纤维于振荡培养箱中反应2 h.测定反应前后溶液中各离子浓度的变化.
2.4 纤维的再生实验结束后, 从R1和R2中沿纵向提取不同高度的纤维样品进行As(Ⅴ)的解吸和再吸附试验.首先, 解吸过程用0.2 mol · L-1 NaOH浸泡样品, 在140 r · min-1转速下振荡2 h后取出纤维.然后, 再生过程用0.1 mol · L-1 HCl浸泡纤维0.5 h后用去离子水冲洗.最后, 用再生后的FFA-1纤维(2 g · L-1)处理含As(Ⅴ)(200 mg · L-1)的模拟污水(pH=7.0~7.5), 得到再生后纤维对As(Ⅴ)的去除量M, 与原始纤维的As(Ⅴ)去除量M0作对比.纤维的再生能力用再生率(R)来评估, 再生率公式见式(1).
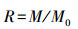
|
(1) |
试验结束后从R1和R2中提取微生物样品, 和冷冻留存的接种微生物样品送至上海美吉生物医药科技有限公司进行微生物多样性测序.测序过程采用E.Z.N.A.Ⓡ soil试剂盒(Omega Bio-tek, Norcross, GA, U.S.)提取DNA, 引物采用338F (5′-ACTCCTACGGGAGGCAGCAG-3′)和806R (5′-GGACTACHVGGGTWTCTAAT-3′), PCR仪为ABI GeneAmpⓇ 9700型.完成扩增后, 回收PCR产物, 经纯化、洗脱、定量后根据Illumina Miseq平台(Illumina, San Diego, USA)构建文库并测序.原始数据上传至NCBI数据库中, 并于上海美吉医药生物科技有限公司所提供的I-Sanger生信分析云平台上完成微生物多样性分析.
2.6 分析方法进水和两个反应器出水的水样用过滤器(∅=0.45 μm)过滤并收集在样品管中, 检测前保存在4 ℃冰箱中.水样中的NO3-、PO43-、SO42-用离子色谱(Thermo Scientific ICS900)检测.总砷浓度用原子荧光分光光度计(HG-AFS)检测, 检测限为0.5 μg · L-1.水体中砷的不同价态用高效液相色谱仪(HPLC)结合HG-AFS检测(Yin et al., 2018), 对As(Ⅲ)和As(Ⅴ)检测限分别为0.1、0.3 μg · L-1.
3 结果与讨论(Results and discussion) 3.1 总砷的去除如图 2所示, 两个平行的反应器(R1和R2)连续运行超过60 d, 在此期间, 进水中除As(Ⅲ)浓度外, 其余成分保持不变.第一阶段, 进水中As(Ⅲ)浓度为1 mg · L-1, R1和R2的去除率分别在第4 d和第6 d达到了90%, R2由于没有提前接种微生物, 启动初期除砷效率较低.第二阶段, As(Ⅲ)浓度上升到2 mg · L-1, R1依旧保持很高的去除效率, 而R2在改变后除砷效率下降, 第2 d才恢复至第一阶段的去除率, 同样的现象发生在第三阶段.而在第四阶段, 进水As(Ⅲ)浓度达到10 mg · L-1, R1除As(Ⅲ)效率依旧很高, 出水中总砷浓度达到了世界卫生组织(WHO)的饮用水质量标准(Wan et al., 2010)(即, 10 μg · L-1), R2除砷效率迅速下降并保持了15 d左右的高浓度.因此, 接种有AsOB的纤维柱(R1)能够高效去除模拟地下水中的砷, 且在浓度突然增大的情况下(1~10 mg · L-1)快速恢复高去除率.而未接种的纤维柱(R2)虽然在运行一段时间后也能够具有很好的去除效果, 但需要较长的时间去应对砷浓度的突升.
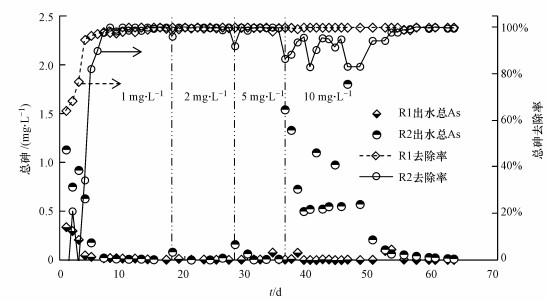 |
| 图 2 两个反应器的出水总砷浓度及其去除效果(pH= 7.0±0.5;流速≈ 52.5 mL · h-1) Fig. 2 Total As in the effluent and the removal rate of the both reactors (pH= 7.0±0.5; flow rate ≈ 52.5 mL · h-1) |
对于离子交换材料来说, 干扰离子是抑制其吸附容量的一个因素, 潘丙才等(2007)的研究认为, 他们制备的新型树脂基水合氧化铁离子交换剂D201-HFO吸附容量(As(Ⅴ))为72.6 mg · g-1, 但是高浓度(>200 mg · L-1)的SO42-会抑制20%的去除率, 且对砷的吸附影响能力大于Cl-(影响很小).本研究中采用的模拟地下水中存在一些浓度较高的阴离子, 如硫酸根(SO42-)和硝酸根(NO3-), 会干扰纤维对砷的去除总量.为了评估竞争离子(NO3-, PO43-和SO42-等)对FFA-1去除砷的影响, 在不同阶段检测了R1和R2各出水口出水中这些离子浓度(其中为了图的简化, 硝酸根、砷酸根分别以NO3-N和AsO4-As计算, 硫酸根以SO42-计算).图 3为砷浓度分别为1、5、10 mg · L-1阶段时, 除砷效果稳定时期的离子浓度和pH监测.如图 3a和3b所示, 各出水口中氯离子(Cl-)逐渐增加, 而各种阴离子浓度大幅度减少, 说明该纤维上的Cl-被包含As(Ⅲ)在内的各种阴离子所取代, 实现了去除各种阴离子的目的.这个过程中发生的反应可以用式(2)表示, 其中R为FFA-1纤维的聚合物骨架.图 3c中, R1的1号出水口中出现了NO3-, 且浓度超过了进水浓度, 而SO42-和As(Ⅴ)浓度依旧保持较低水平, 这一现象说明了FFA-1纤维对NO3-的去除能力最弱, 更容易从纤维上脱附下来, 该现象同样出现在了图 3f中的R21出水口.图 3e中R11出水口中各种阴离子均开始析出, 说明该段纤维已达到饱和.观察图中pH的变化, 可以发现随着各种阴离子被去除, 该方法会较大幅度降低出水的pH.但在纤维逐渐达到饱和不能大量去除各种阴离子时(图 3e, R11出水口), pH会逐渐接近进水pH.因此, 通过检测pH的变化可以判断纤维是否达到吸附饱和.
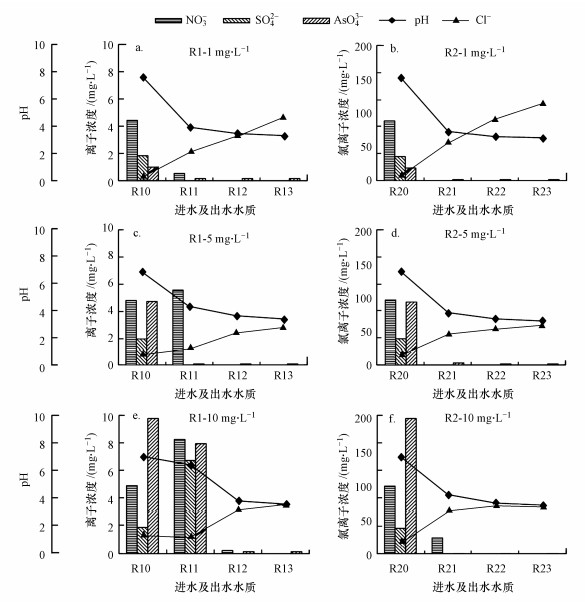 |
| 图 3 各阶段两个反应器各出水口离子浓度和pH监测 Fig. 3 The ion concentration and pH of the two reactors at different outlet |
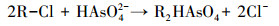
|
(2) |
在竞争离子的静态干扰实验中, 检测了NO3-、PO43-、CO32-、SO42- 4种离子对FFA-1去除As(Ⅴ)的影响.如图 4所示, 在干扰离子与砷酸根1 : 1(摩尔比)存在时, 磷酸根和硫酸根对As(Ⅴ)的去除量影响最大.如表 2所示, 分析竞争离子试验中各干扰离子和砷酸根的主要存在形式及其分布系数A1、B1(带两个电荷数的离子)、A2、B2(带一个电荷数的离子).经公式(3)计算得到被去除离子的总电荷数(ΔQ), 式中, MAs、MX分别为砷酸根和干扰离子的去除量.
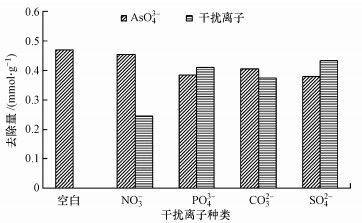 |
| 图 4 不同竞争离子对As(Ⅴ)去除量的影响 Fig. 4 Effects of different competitive ions on the removal of As(Ⅴ) |
| 表 2 干扰试验中各弱酸根离子的分布系数 Table 2 The distribution coefficient of the weak acid ions in the interference test |
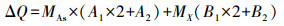
|
(3) |
表 3计算ΔQ和反应前后Cl离子增量的比值, 可以看到它们的比值维持在1.7左右, 这一数据表明大约每1.7 mol的Cl将能交换1.0 mol的电荷.
| 表 3 干扰试验中离子交换比 Table 3 Ion exchange ratio in interference test |
FFA-1纤维经NaOH溶液浸泡后, 结合的砷酸根会从纤维上脱离, 进入到氢氧化钠溶液中, 得到的含砷浓溶液可以进行砷的回收.然后用HCl溶液浸泡纤维, 将氯离子引入到纤维上, 便于纤维进行下一次离子交换.
再生能力决定了离子交换材料是否能够多次利用, 如图 5a所示, 本研究中所采用FFA-1本身具有很好的再生能力, R-0为未接种AsOB纤维的再生率, 大约为90%(原始纤维对As(Ⅴ)去除量为104 mg · g-1).但考虑到研究中接种的微生物可能会降解部分纤维, 需要重新评估接种微生物后纤维的再生性能.当两个反应器的除砷效率在10 mg · L-1阶段达到稳定后停止运行.此时可以观察到填充在不同高度的纤维在外观上存在差异:底部纤维颜色发黑而上部纤维保持原有的黄色.另外, 图 5b数据表明在反应器运行期间, 出水中NH4+浓度与进水相比有增大的现象, 增大量约为1.5 mg · L-1.考虑到所用纤维中含有氨基, 猜测在运行过程中会有纤维被微生物代谢分解, 从而影响纤维的砷去除能力.为确定接种微生物是否会影响FFA-1纤维的砷去除能力, 取出各层纤维(R-1、R-2、R-3分别为固定床底部、中部、上部取出的纤维)测定其再生后对砷的去除量.实验结果如图 5b所示不同高度FFA-1纤维的再生效率均保持在90%左右, 与R-0相比并没有很大的差异, 说明接种微生物并不会明显降低纤维的As(Ⅴ)去除能力.
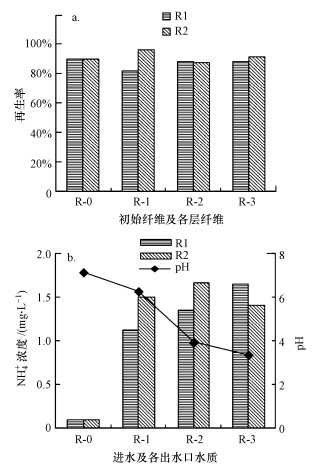 |
| 图 5 出水中氨根浓度的监测(a)和纤维的再生率(b) Fig. 5 Monitoring of ammonia concentration in effluent water (a) and fiber regeneration rate (b) |
反应器停止运行后, 提取R1和R2中微生物与接种微生物比较其多样性.在OTUs水平的Venn图中, 发现接种物中有243种细菌的OTU, 其中只有35个OTU(14.4%)同时出现在两个反应器的微生物样品中(图 6a).与接种样本相比, 分别在R1和R2中发现有113和107个新的OTUs, 分别占他们总OUT的71.5%和71.8%, 这表明在运行过程中进化出了新物种.应该注意的是:R1和R2有118个相同的OTUs, 这占了他们各自总OTUs总数的很大比例(74.7%和79.2%).这可能是因为两个反应器具有相同的填充材料.纲级别物种丰富度直方图(图 6b)表明接种的群落主要由Betaproteobacteria (11.3%), Alpaaproteobacteria(24.9%), Anaerolineae (31.2%), Acidobacteria(8.0%), Gammaproteobacteria (4.7%)和norank_p_parcubacteria(6.4%)组成.在长期的运行之后, R1和R2中的优势纲由Anaerolineae变为Betaproteobacteria, 而Anaerolineae数量的明显下降, 很大程度上是与接种前后水中氧气含量有关.此外纤维填充反应器中出现了一些新的物种, 其中Actinobacteria的数量最多.
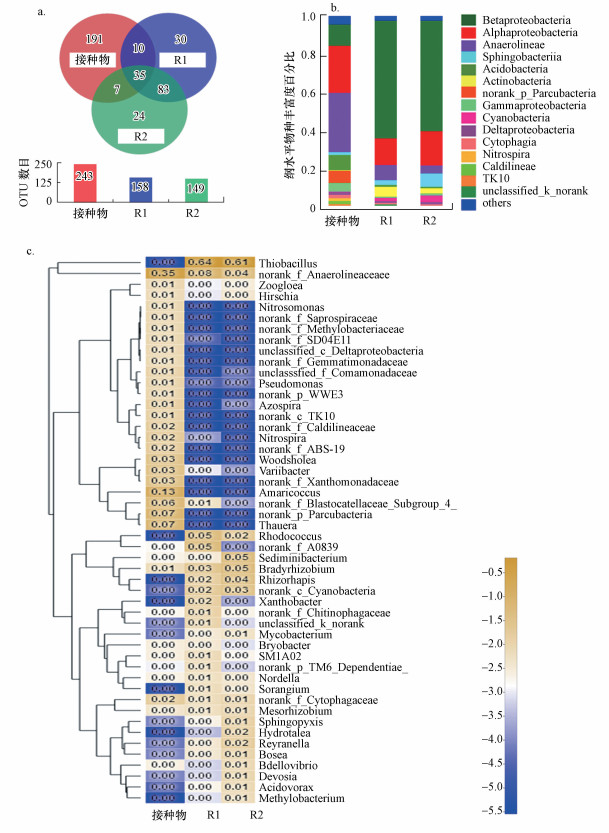 |
| 图 6 接种物、R1和R2中微生物的多样性分析 (a.OTUs水平的Venn图, b.纲水平丰度直方图, c.属水平分层聚类热图) Fig. 6 Microbial diversity analysis of inoculum, R1 and R2 (a. Venn diagram at OTUs level, b. histogram of abundance at class level, c. heat map of stratified clustering at class level) |
如图 6c所示, 用分层聚类热图分析从属水平比较接种物、R1和R2样本中微生物的种群结构相似性.R1和R2中出现一系列微量的固氮根瘤菌如Methylobacterium, Bosea和Mesorhizobium, 这些微生物也许是反应器运行期间检测到的出水氨氮浓度微量升高的原因.此外, 这些菌种或许也与As(Ⅲ)的氧化有关.例如, (Ito et al., 2012)研究中采用的AsOB就属于根瘤菌.值得注意的是, 微生物Rhodococcus (Mcleod et al., 2006)是R1和R2中数量较多的属(5%和2%), 且并未在接种微生物中存在, 这种菌可能也与As(Ⅲ)的生物氧化有关, 因为有些研究表明Rhodococcus中的某些种也可以氧化As(Ⅲ) (Corsini et al., 2014).
3 结论(Conclusions)1) 通过生物氧化结合离子交换技术有效去除地下水中不同浓度的As(Ⅲ)(1~10 mg · L-1), 使总砷浓度低于10 μg · L-1, 这一浓度达到了WHO建议的水质标准.
2) 采用FFA-1去除As时, 不能忽视污染地下水中的共存离子如CO32-和SO42-, 而出水pH值可以作为一种判断离子交换纤维是否饱和的指标.
3) 固定床反应器中的填充材料改变了功能细菌种类和细菌群落, 且纤维状FFA-1是一种适宜微生物附着的材料, 微生物的结合对其再生性能没有明显影响.
Battagliabrunet F, Dictor M C, Garrido F, et al. 2002. An arsenic(Ⅲ)-oxidizing bacterial population:selection, characterization, and performance in reactors[J]. Journal of Applied Microbiology, 93(4): 656-667. DOI:10.1046/j.1365-2672.2002.01726.x |
Bissen M, Frimmel F H. 2003. Arsenic-a Review. Part II:Oxidation of arsenic and its removal in water treatment[J]. Clean-Soil Air Water, 31(2): 97-107. |
Corsini A, Zaccheo P, Muyzer G, et al. 2014. Arsenic transforming abilities of groundwater bacteria and the combined use of Aliihoeflea sp. strain 2WW and goethite in metalloid removal[J]. Journal of Hazardous Materials, 269: 89-97. DOI:10.1016/j.jhazmat.2013.12.037 |
Cullen W R, Reimer K J. 2010. Arsenic speciation in the environment[J]. Chemical Reviews, 89(4): 713-764. |
Dai L, Cui L, Zhou D, et al. 2015. Resource recovery of Cr(VI) from electroplating wastewater:Laboratory and pilot-scale investigation using fibrous weak anion exchanger[J]. Journal of the Taiwan Institute of Chemical Engineers, 54: 170-177. DOI:10.1016/j.jtice.2015.03.010 |
Dastidar A, Wang Y T. 2012. Modeling arsenite oxidation by chemoautotrophic Thiomonas arsenivorans strain b6 in a packed-bed bioreactor[J]. Science of the Total Environment, 432: 113-121. DOI:10.1016/j.scitotenv.2012.05.051 |
Fan H T, Sun T, Xu H B, et al. 2011. Removal of arsenic(Ⅴ) from aqueous solutions using 3-[J]. Desalination, 278(1/3): 238-243. |
Ito A, Miura J, Ishikawa N, et al. 2012. Biological oxidation of arsenite in synthetic groundwater using immobilised bacteria[J]. Water Research, 46(15): 4825-4831. DOI:10.1016/j.watres.2012.06.013 |
Jain C K, Ali I. 2000. Arsenic:occurrence, toxicity and speciation techniques[J]. Water Research, 34(17): 4304-4312. DOI:10.1016/S0043-1354(00)00182-2 |
Li H, Zeng X C, He Z, et al. 2016. Long-term performance of rapid oxidation of arsenite in simulated groundwater using a population of arsenite-oxidizing microorganisms in a bioreactor[J]. Water Research, 101: 393-401. DOI:10.1016/j.watres.2016.05.058 |
Matsunaga H, Yokoyama T, Eldridge R J, et al. 1996. Adsorption characteristics of arsenic(Ⅲ) and arsenic(Ⅴ) on iron(Ⅲ)-loaded chelating resin having lysine-N α, N α-diacetic acid moiety[J]. Reactive & Functional Polymers, 29(3): 167-174. |
Mcleod M P, Warren R L, Hsiao W W, et al. 2006. The complete genome of Rhodococcus sp. RHA1 provides insights into a catabolic powerhouse[J]. Proceedings of the National Academy of Sciences of the United States of America, 103(42): 15582-15587. DOI:10.1073/pnas.0607048103 |
Michon J, Dagot C, Deluchat V, et al. 2010. As(Ⅲ) biological oxidation by CAsO1 consortium in fixed-bed reactors[J]. Process Biochemistry, 45(2): 171-178. DOI:10.1016/j.procbio.2009.09.003 |
Nordstrom D K. 2002. Worldwide occurrences of arsenic in ground water[J]. Science, 296(5576): 2143-2145. DOI:10.1126/science.1072375 |
潘丙才, 张庆建, 陈新庆, 等. 2007. 基于Donnan膜效应的树脂基水合氧化铁的制备及对砷的吸附性能研究[J]. 中国科学B辑:化学, 37(5): 426-431. |
Sánchez J, Rivas B L. 2010. Arsenic extraction from aqueous solution:Electrochemical oxidation combined with ultrafiltration membranes and water-soluble polymers[J]. Chemical Engineering Journal, 165(2): 625-632. DOI:10.1016/j.cej.2010.10.012 |
Wan J, Klein J, Simon S, et al. 2010. As(Ⅲ) oxidation by Thiomonas arsenivorans in up-flow fixed-bed reactors coupled to As sequestration onto zero-valent iron-coated sand[J]. Water Research, 44(17): 5098-5108. DOI:10.1016/j.watres.2010.08.044 |
Wang J, Wan J, Li H, et al. 2017. Biological arsenite oxidation with nitrate as sole electron acceptor[J]. Environmental Technology, 38(16): 2070-2076. DOI:10.1080/09593330.2016.1245362 |
Yin Y, Wan J, Li S, et al. 2018. Transformation of roxarsone in the anoxic-oxic process when treating the livestock wastewater[J]. Science of the Total Environment, 616-617: 1235-1241. DOI:10.1016/j.scitotenv.2017.10.194 |
Yoshida I, Ueno K, Kobayashi H. 1978. Selective separation of arsenic(Ⅲ) and (Ⅴ) ions with ferric complex of chelating ion-exchange resin[J]. Separation Science and Technology, 13(2): 173-184. DOI:10.1080/01496397808057099 |
 2020, Vol. 40
2020, Vol. 40


