2. 浙江师范大学行知学院, 金华 321004;
3. 浙江师范大学体育与健康科学学院, 金华 321004
2. College of Xing Zhi, Zhejiang Normal University, Jinhua 321004;
3. College of Sports and Health Science, Zhejiang Normal University, Jinhua 321004
氟作为与人体健康密切相关的微量元素之一, 安全范围较窄, 我国规定饮用水中氟化物的含量不得超过1.0 mg·L-1.长期摄入过量氟会导致慢性全身性疾病, 称为地氟病, 不但会损伤骨相器官(Wei et al., 2019), 还会透过血-睾屏障, 在生殖器官蓄积, 对生殖系统造成损伤(孙子龙等, 2012);也会影响下丘脑-垂体-性腺轴的变化, 干扰生殖内分泌, 从而影响生殖繁育能力(Ma et al., 2017).此外, 本课题组前期研究表明, 慢性氟暴露会影响小鼠睾丸和附睾的酶活性从而损伤雄性生殖功能(尉俊仁等, 2012), 但其分子机制仍不明确.
内质网应激(Endoplasmic Reticulum Stress, ERS)是真核细胞的一种保护性应激反应, 当使内质网持续性处于应激条件或诱导因素刺激下则可激活细胞的凋亡通路, 触发细胞凋亡(王在然等, 2019).本课题组前期研究表明, 内质网应激介导了氟暴露致仔鼠脑海马细胞的损伤(邵丹丹等, 2019).但有关内质网应激在氟暴露对小鼠睾丸损伤中的作用至今还鲜有报道.因此, 本研究在实验室前期研究的基础上, 拟通过5、30 mg·L-1的氟化钠水溶液暴露, 探讨内质网应激在氟暴露致小鼠睾丸组织损伤中的作用及分子机制, 以期为进一步探究氟化物的生殖毒性提供基础资料.
2 材料与方法(Materials and methods) 2.1 实验动物与分组选用购自浙江省实验动物中心(实验动物合格证号:SCYK(浙)2003-0001)的初断乳清洁级ICR雄性小鼠30只, 每只体重18~20 g, 动物实验通过浙江师范大学实验动物伦理委员会审查, 受理编号为dw2019004.按体重大小采用随机数字表法分为对照组、低氟组和高氟组, 每组10只, 适应7 d后, 分别自由饮用自来水(氟含量 < 0.2 mg·L-1)及由自来水配制的5 mg·L-1和30 mg·L-1 NaF溶液染毒(根据药理试验中小鼠与人体等效剂量换算约为10 : 1, 可知5 mg·L-1 NaF在人体中约为0.5 mg·L-1, 属于低氟浓度, 30 mg·L-1 NaF在人体中约为3.0 mg·L-1, 属于高氟浓度)(黄继汉等, 2004).饲养室采用空调和自动排风装置保持通风, 室温温度为(23±2) ℃, 湿度为40%~70%, 光暗周期为12 h, 小鼠标准饮食, 自由饮水, 所有程序均根据《NIH实验动物的护理和使用指南》进行.
2.2 实验器材与试剂器材:小鼠断头器(GLOBALEBIO);恒温数显水浴锅(上海秉越);光学显微镜(日本Olympus);超低温冰箱(FORMA Scientific);移液枪(德国BRAND);离心机(德国Eppendorf);组织切片机(Shandon Fineses ME+, 美国);水平电泳槽、电泳仪(美国Major Science);酶标仪(北京普朗);PCR扩增仪(美国Bio-Rad);凝胶成像系统(美国11-S.N);曝光仪(GENE公司);电子分析天平(上海天平仪器厂);组织匀浆器(美国Pro Scientific).
试剂:总RNA提纯试剂盒(上海赛百盛);2×Taq MasterMix(Dye)(北京康为世纪);HiScript Q RT SuperMix for qPCR(+gDNA wiper)(南京诺唯赞);分析纯氟化钠、4%多聚甲醛、无水乙醇(金华医药公司);BCA蛋白浓度测定试剂盒、总抗氧化能力(T-AOC)检测试剂盒、总超氧化物歧化酶(SOD)活性检测试剂盒、谷胱甘肽过氧化物酶(GSH-PX)检测试剂盒、丙二醛(MDA)检测试剂盒(上海碧云天);乳酸脱氢酶(LDH)试剂盒(南京建成生物工程研究所);TUNEL细胞凋亡检测试剂盒(上海基尔顿);β-actin、Grp78、Chop、Caspase-12、Caspase-3引物(上海生物生工).
2.3 实验方法 2.3.1 亚慢性氟暴露剂量、方法和时间对照组、低氟组和高氟组各10只ICR雄性小鼠, 适应7 d后, 采取自由饮水的方式进行染毒, 分别饮用自来水(氟含量 < 0.2 mg·L-1)、5 mg·L-1和30 mg·L-1氟化钠水溶液90 d.在整个氟暴露过程中, 各组受试小鼠没有发生濒死及死亡现象, 也未出现异常行为和症状.
2.3.2 小鼠体重、睾丸质量和睾丸脏器系数的测定亚慢性氟暴露90 d后, 小鼠称重后迅速断颈处死, 冰上快速取下睾丸并称重, 脏体比(c)计算方法见式(1).

|
(1) |
式中, a为睾丸质量(mg), b为体重(g).
2.3.3 小鼠睾丸氧化及抗氧化酶的测定取睾丸去净结缔组织, 洗净其表面的血污, 用滤纸吸干表面的水分, 称重后剥离被膜剪碎, 按质量/体积比为1 : 9的比例用生理盐水在4 ℃下制成组织匀浆.取部分匀浆液在3000 r·min-1下低温离心10 min后取上清液, 按照试剂盒上的说明进行总蛋白浓度、谷胱甘肽过氧化物酶(GSH-PX)、乳酸脱氢酶(LDH)、总抗氧化能力(T-AOC)、总超氧化物歧化酶(SOD)酶活和丙二醛(MDA)含量测定.
2.3.4 小鼠睾丸组织形态结构观察小鼠睾丸经4%多聚甲醛固定, 不同浓度的乙醇由低到高浓度逐级脱水, 透明(二甲苯), 恒温浸蜡, 包埋, 切片(厚约3 μm), 苏木精-伊红(染色).实验结果通过显微镜采集分析样本相关部位.
2.3.5 精子质量的测定取一侧附睾放入5 mL生理盐水中, 用手术剪快速剪碎并用4层擦镜纸过滤, 制成原液, 取1 mL原液加入9 mL生理盐水, 制成精子悬液.取少量精子悬液, 滴入血细胞计数板上, 每计数室分别选取5个中方格计数精子数, 计算公式为:附睾精子数N=NT/5×25×10000×稀释倍数, 其中, NT为5个中格细胞总数.另快速取悬液于载玻片上计数200个精子, 进行分级, 分级标准为:(Ⅰ)具有快速、直线的向前运动;(Ⅱ)慢速或迟钝的直线或非直线向前运动;(Ⅲ)原地转动或摆动;(Ⅳ)不活动.精子活动率R=N(Ⅰ+Ⅱ+Ⅲ)/N(Ⅰ+Ⅱ+Ⅲ+Ⅳ)×100%, 其中, N为相应分级标准的精子数量.另取精子悬液涂片, 10%甲醇固定, 吉氏染液染色, 显微镜下观500条完整的精子形态, 计算出畸形率及百分比构成.
2.3.6 小鼠睾丸组织细胞凋亡检测采用TUNEL法分别检测各组小鼠睾丸组织细胞凋亡情况.根据凋亡检测试剂盒说明书方法进行石蜡切片常规脱蜡、蛋白酶K消化;加样、反应、孵育、显色等步骤严格按试剂盒说明书进行.反应结束后, 苏木素轻度复染, 常规封片, 阳性标记的凋亡细胞核是棕色的, 在光学显微镜下观察阳性标记细胞的数目并拍照.采用ImageJ软件统计凋亡细胞个数, 每张切片记数200个细胞, 计算100个细胞内凋亡阳性细胞数, 用细胞凋亡指数表示.
2.3.7 RT-PCR检测睾丸组织Grp78、Chop、Caspase-12、Caspase-3基因表达由美国国立生物信息技术中心(NCBI)和Primer 5.0软件设计小鼠Grp78、Chop、Caspase-12、Caspase-3和内参β-actin荧光定量PCR引物, 引物序列及大小见表 1.根据总RNA提纯试剂盒说明提取睾丸组织总RNA, 检测RNA浓度及纯度.A260/A280比值在1.9~2.1表示无蛋白或DNA影响, 为可用RNA.放入-80 ℃冰箱保存, 避免反复冻融.按逆转录试剂盒HiScript Q RT SuperMix for qPCR(+gDNA wiper)说明, 吸取4 μL总RNA为模板进行逆转录合成cDNA, 第一步为基因组DNA去除, 在200 μL RNase free的离心管中用移液枪分别吸取4 μL RNase-free ddH2O、2 μL 4×gDNA wiper Mix和2 μL模板RNA, 混合均匀后, 在PCR仪中设置42 ℃放置2 min.第二步为配制逆转录反应体系, 在上一步的反应体系中用移液枪加入2 μL 5×qRT Super Mix Ⅱ, 共10 μL体系, 混合均匀后, 放入PCR仪中进行逆转录反应(表 2), 逆转录获得高质量cDNA, -20 ℃保存待用, 注意避免反复冻融.第三部为进行扩增反应, 在新的200 μL RNase free的离心管中用移液枪分别加入12.5 μL 2×Taq MasterMix、9.5 μL ddH2O、1 μL模板、1 μL上引、1 μL下引, 共25 μL体系, 轻微吹打混合均匀后, 放入PCR仪中进行cDNA扩增反应:94 ℃预变性2 min;94 ℃变性30 s, 退火(β-actin:59 ℃ 30 s;Grp78:59 ℃ 30 s;Chop:54 ℃ 30 s;Caspase-12:58 ℃ 30 s;Caspase-3:56 ℃ 30 s), 72 ℃延伸30 s, 40个循环;72 ℃终延伸2 min.PCR结果用琼脂糖凝胶电泳(1%)进行测定, 上样4~5 μL, 120 V, 30 min, 电泳结束后用凝胶成像系统拍摄图片.用半定量法将所得图片用Quantity One凝胶分析软件分析.
| 表 1 基因引物序列 Table 1 Gene primer sequences |
| 表 2 逆转录反应 Table 2 Reverse transcriptional reaction |
采用SPSS20.0对各组实验数据进行统计学分析.所得数据以平均值±标准差(M±SD)表示, 采用单因素方差分析(One-Way ANOVA)和两两比较LSD检验.以p < 0.05为差异有统计学意义.
3 结果与分析(Results and analysis) 3.1 亚慢性氟暴露对小鼠体重、睾丸质量及睾丸脏器系数的影响亚慢性氟暴露下小鼠体重、睾丸质量及睾丸脏器系数测定结果见表 3.与对照组比, 各组小鼠体重、睾丸质量及睾丸脏器系数均无统计学差异(p > 0.05).
| 表 3 亚慢性氟暴露下小鼠体重、睾丸质量及睾丸脏器系数统计分析 Table 3 Results of subchronic fluoride exposure on body weight, testis weight and organ coefficient in mice |
小鼠睾丸组织氧化/抗氧化酶活性和氧化产物MDA含量检测结果见表 4.由表 4可知, 与对照组比, LF组和HF组LDH、SOD、T-AOC活性下降, MDA含量上升, HF组GSH-PX活性下降, 差异有统计学意义(p < 0.05或p < 0.01).
| 表 4 小鼠睾丸组织部分氧化/抗氧化酶活性和MDA含量检测结果 Table 4 Results of part of oxidation/antioxidant enzyme activity and MDA content in mice testis |
小鼠睾丸形态组织结构如图 1所示.对照组睾丸结构中各级精原细胞形态结构清晰完整、层次分明, 精子细胞清晰可见(图 1a);LF组精原细胞和精母细胞染色质固缩, 间隙增宽, 细胞数量减少, 精子数量下降(图 1b);HF组精原细胞和精母细胞溶解, 出现空泡化, 细胞层次明显减少, 管腔成熟精子数量极少(图 1c).
 |
| 图 1 小鼠睾丸组织形态结构(a.对照组, b.LF组, c.HF组; Ⅰ为精原细胞, Ⅱ为精母细胞, Ⅲ为精子, Ⅳ为间质细胞; ×400) Fig. 1 Histological structure of testicular tissues in mice |
小鼠睾丸精子质量测定结果见表 5.与对照组比, LF组和HF组小鼠的精子活力降低, HF组小鼠精子数量下降, 畸形率上升, 差异有统计学意义(p < 0.05或p < 0.01).
| 表 5 亚慢性氟暴露对小鼠精子质量影响 Table 5 Effect of subchronic fluoride exposure on sperm quality in mice |
在光学显微镜下, 棕褐色为TUNEL染色阳性的凋亡细胞, 蓝色为被苏木素染色的细胞核.小鼠睾丸细胞凋亡如图 2所示.由图可知, 各组均见不同程度的凋亡细胞, 与对照组比, LF组和HF组凋亡细胞明显增多.
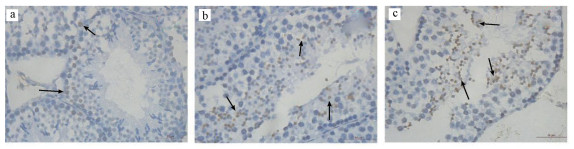 |
| 图 2 小鼠睾丸细胞凋亡(a.对照组, b.LF组, c.HF组; 箭头所示为显微镜下细胞核呈棕褐色的凋亡细胞; ×400) Fig. 2 Cell apoptosis in mice testis |
小鼠睾丸细胞凋亡检测结果见图 3, 与对照组比, LF、HF组细胞凋亡率均明显增加, 差异有统计学意义(p < 0.01).
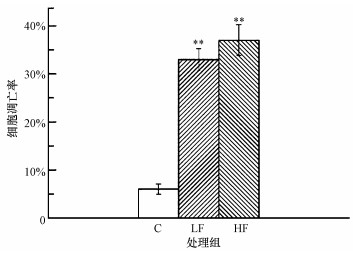 |
| 图 3 小鼠睾丸细胞凋亡检测结果(**p < 0.01, 与对照组比) Fig. 3 Results of cell apoptosis in mice testis |
小鼠睾丸细胞内Grp78基因表达水平检测结果如图 4所示, 与对照组比, LF、HF组Grp78基因表达水平均明显增加, 差异具有统计意义(p < 0.05).
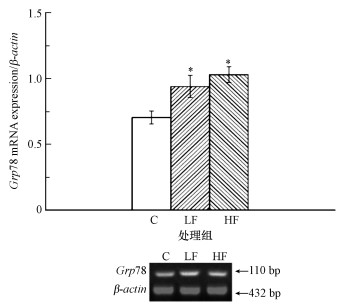 |
| 图 4 小鼠睾丸Grp78 mRNA表达水平检测结果(*p < 0.05, 与对照组比) Fig. 4 Results of Grp78 mRNA expression in mice testis |
小鼠睾丸细胞内Chop基因表达水平检测结果见图 5a.与对照组比, 各组Chop基因表达水平均无显著差异(p>0.05).小鼠睾丸细胞内Caspase-12基因表达水平检测结果见图 5b.与对照组比, LF、HF组Caspase-12基因表达水平明显增加, 差异具有统计意义(p < 0.05).小鼠睾丸细胞内Caspase-3基因表达水平检测结果见图 5c.与对照组比, LF组和HF组Caspase-3基因表达水平明显增加, 差异有统计学意义(p < 0.05或p < 0.01).
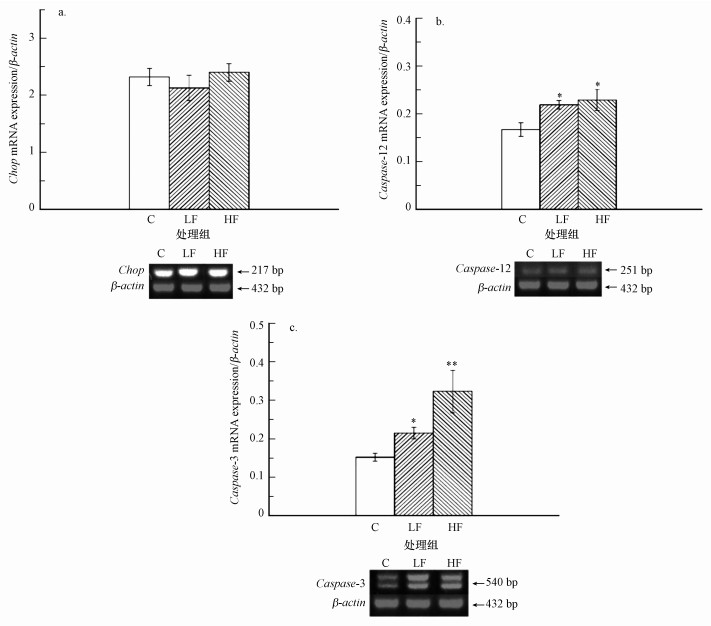 |
| 图 5 小鼠睾丸Chop(a)、Caspase-12(b)及Caspase-3(c) mRNA表达水平检测结果(*p < 0.05, **p < 0.01, 与对照组比) Fig. 5 Results of Chop(a)、Caspase-12(b) and Caspase-3(c) mRNA expression in mice testis |
地氟病是一种病程漫长的非致死性疾患, 属于全球性公共卫生问题, 其最显著的临床症状是氟斑牙和氟骨症(汪希兰等, 2019).由于氟致机体损伤的机制未明, 至今其理论假说仍众说纷纭, 目前较为公认的是自由基损伤学说, 即氟致自由基平衡紊乱诱导脂质过氧化, 破坏生物膜的完整性, 损伤细胞正常生理功能(刘燕斐等, 2012).Suzuki等(2015)研究发现氟可引起细胞内产生过量活性氧.Zhang(2015)也研究发现细胞内活性氧水平基本与氟暴露水平基本呈线性关系.本实验研究结果证明, 亚慢性氟中毒引起睾丸组织脂质过氧化产物MDA含量升高和抗氧化酶活性下降, 使机体处于较高水平的氧化应激状态, 具体表现为:脂质过氧化中间代谢产物MDA含量升高, GSH-PX、LDH、SOD、T-AOC活性降低, 并导致睾丸内精子细胞形态结构异常, 精子数量和质量明显下降, 这再次为氟致自由基损伤学说提供了佐证, 但其细胞和分子机制尚待阐明.
细胞凋亡(Cell apoptosis)是指在细胞内外特定的生理或病理性因素的诱导下, 为维护细胞内环境, 从而引发有序的自主程序性死亡的一种生理形式(吴佳怡等, 2018).细胞凋亡对机体的防御和免疫反应、疾病或中毒时引起的细胞损伤、肿瘤的发生进展起着重要作用(李月华, 2013).近年来, 氟中毒与机体细胞凋亡的关系逐渐引起人们的关注.有研究表明, 高浓度氟化物暴露致神经细胞增殖能力降低与神经细胞凋亡密切相关(邢德利等, 2006).张筱文等(2014)研究发现, 慢性氟中毒可导致睾丸生殖细胞周期紊乱, 诱导生殖细胞凋亡, 损害大鼠生殖系统.本实验细胞凋亡检测结果显示, 氟暴露导致凋亡细胞明显增多, 提示细胞凋亡可能参与了氟致小鼠睾丸损伤的发生.但有关氟中毒致小鼠睾丸细胞凋亡的分子机制尚未明确.
哺乳动物细胞依赖Caspase引发的凋亡主要有3条途径:死亡受体途径、线粒体途径和内质网途径(袁长青等, 2002).内质网应激途径(Endoplasmic stress, ERS)作为一条细胞凋亡的信号转导途径, 近些年来备受关注(Wei et al., 2013).有研究表明, 内质网未折叠蛋白的聚集及由此引发的细胞应激反应, 可诱导细胞凋亡的发生(魏玮等, 2018).Grp78是在内质网中首个被发现的分子伴侣, 具有调节蛋白质折叠和诱导应激条件下蛋白质应答的双重功能(刘楠等, 2013).由于Grp78对未折叠蛋白的高度敏感性, 在毒理和病理实验研究中常作为评价内质网应激程度的关键指标.Caspase家族全称为天冬氨酸特异性的半胱氨酸蛋白水解酶家族.Caspase-12定位于内质网, 是介导ERS反应性凋亡的关键分子.Caspase-12作为内质网膜上应激特异性促凋亡分子, 其磷酸化活化是内质网应激介导的细胞凋亡的中心环节(冯婧, 2018).Caspase-3是凋亡执行功能最主要的蛋白酶之一, 位于Caspase级联反应的最下游(冯骁等, 2014).张凯强等(2014)研究发现, 大鼠饮用150 mg·L-1的氟化钠水溶液可激活内质网应激分子, 导致成釉细胞产生内质网应激, 并最终诱导细胞发生凋亡.氟暴露可引起大鼠睾丸组织MDA含量增高, SOD和GSH-Px活力降低, 激活内质网PERK/p- eIF2α/CHOP途径, 使GRP78、PERK、p-eIF2α和CHOP蛋白表达水平上调(杨阳等, 2015).本课题组前期研究结果表明, 母鼠氟暴露后仔鼠脑海马神经细胞内质网应激伴侣分子Bip、Chop、Crt基因表达水平升高(邵丹丹等, 2019).本研究首次探讨了内质网应激在氟暴露致小鼠睾丸损伤中的作用及分子机制, 提示氟暴露一方面使睾丸细胞内质网应激伴侣分子Grp78基因表达水平显著上调;另一方面使睾丸细胞内下游凋亡信号分子Caspase-12和Caspase-3基因表达水平显著或极显著上调.研究结果提示, 除氧化应激以外, 内质网应激介导了亚慢性氟暴露致小鼠睾丸损伤, 凋亡信号通路分子Caspase-12和Caspase-3基因表达水平上调可能是氟暴露致小鼠睾丸细胞凋亡异常的分子机制之一.
Chop属于CCAAT增强子结合蛋白转录因子C/EBP家族, 是一种控制凋亡通路相关基因的转录因子.Chop的高表达通常被认为细胞内质网过度应激导致细胞凋亡的发生, 王海臻等(2018)证实了在滋养细胞凋亡机制中内质网应激标记物Chop呈高表达, 但也有不一致的文献报道, 如一次性力竭运动后大鼠比目肌Chop表达量并未出现显著性增加(蔡阜生等, 2018).高容量血液滤过(HVHF)治疗患有多器官功能障碍综合征(MODS)的实验犬后, 肝、肾、肺组织Chop mRNA表达水平无显著差异(努尔孜叶·阿布里克木, 2015).另有研究证实Grp78作为内质网应激反应的上游起始因子, Grp78高度表达可以抑制Chop的表达(Wang et al., 2016), 这也从侧面说明在内质网应激反应中, 由于内质网应激传导通路的复杂性, Chop表达的影响因素是多方面的, 其机制有待于进一步研究.本研究结果表明, 氟暴露小鼠睾丸细胞内质网伴侣分子Chop基因表达无明显变化, 这与蔡阜生等(2018)的研究结果相一致, 其机制还有待于进一步探讨.
饮水氟的安全剂量一直存在争议(戴力维, 2017; 熊传龙等, 2017).有研究发现, 长期低水平氟化物暴露在淋巴细胞中可以剂量依赖性方式诱导细胞凋亡(Wen et al., 2019).本课题组实验室最新电生理研究表明, 低氟暴露(5 mg·L-1)也能使小鼠脑海马细胞L-型钙通道过度开放, 使小鼠脑海马细胞钙超载(Yu et al., 2019).根据药理试验中小鼠与人体等效剂量换算约为10 : 1, 可知5 mg·L-1在人体中约为0.5 mg·L-1, 属于国家规定的安全剂量(黄继汉等, 2004).低氟暴露下还能导致肾脏细胞凋亡增强, 引起肾脏细胞的损伤(汪晓宇, 2019).本研究结果表明, 在低氟暴露下, 小鼠睾丸细胞氧化/抗氧化系统失衡, 形态结构改变, 精子数量/质量下降, 睾丸细胞凋亡和下游凋亡调节相关分子Caspase-12及Caspase-3基因表达水平显著上调.提示地氟病防治中要注意防范低氟暴露的生殖健康风险, 同时也提示睾丸对氟暴露敏感, 是氟中毒的靶器官.
总之, 内质网应激在氟暴露致小鼠睾丸损伤中的作用可能是:亚慢性氟暴露后, 睾丸细胞抗氧化能力下降, 内质网应激过强, 睾丸细胞内质网应激伴侣分子Grp78基因表达上调, 下游凋亡信号分子Caspase-12、Caspase-3基因表达上调, 导致睾丸细胞凋亡增强, 引起睾丸组织损伤, 小鼠精子质量下降.本研究结果为进一步阐明氟暴露致非骨相器官——睾丸损伤的分子机制提供了基础资料.今后, 我们将采用Western Blot法检测氟暴露致上述睾丸细胞应激伴侣分子和下游凋亡信号分子蛋白表达水平的变化, 进一步探讨氟暴露的雄性生殖毒性及分子机制.
蔡阜生, 张媛, 张蕴琨. 2018. 不同运动方式对大鼠比目鱼肌GRP78、CHOP的影响[J]. 辽宁体育科技, 40(5): 70-73. |
戴力维. 2011. 饮水氟含量与人体健康[J]. 中国城乡企业卫生, 32(11): 34-37. |
冯婧, 田晓琳, 董妮莎, 等. 2018. 氟致内质网应激性凋亡的研究进展[J]. 环境与职业医学, 35(6): 566-571. |
冯骁, 田聆, 黄倩. 2014. Caspase-3基因表达调控研究进展[J]. 生命科学, 26(9): 936-942. |
黄继汉, 黄晓晖, 陈志扬, 等. 2004. 药理试验中动物间和动物与人体间的等效剂量换算[J]. 中国临床药理学与治疗学, 9(9): 1069-1072. |
刘楠, 李岩, 牛振华. 2013. 内质网应激介导的神经细胞凋亡通路[J]. 中风与神经疾病杂志, 30(8): 57-759. |
刘燕斐, 官志忠. 2012. 慢性氟中毒性肝损伤及其发病机制[J]. 中国地方病学杂志, 31(5): 588-590. |
李月华. 2013. 浅谈细胞凋亡与相关疾病的研究[J]. 新课程学习(社会综合), (3): 182. |
Ma Q, Huang H, Sun L, et al. 2017. Gene-environment interaction:Does fluoride influence the reproductive hormones in male farmers modified by ERα gene polymorphisms?[J]. Chemosphere, 188: 525-531. |
努尔孜叶·阿布里克木, 廖汉文, 王顺, 等. 2015. 高容量血液滤过对多器官功能障碍犬CHOP蛋白的影响[J]. 中华肾脏病杂志, 31(2): 115-119. |
邵丹丹, 于秋丽, 年未未, 等. 2019. 内质网应激在不同钙水平下对母鼠氟暴露后仔鼠脑海马细胞的作用[J]. 生态毒理学报, (6): 1-9. |
孙子龙, 牛瑞燕, 王俊东. 2012. 氟对雄性小鼠生长发育及性腺中氟含量的影响[J]. 中国畜牧兽医, 39(3): 227-229. |
Suzuki M, Bandoski C, Barlett J D. 2015. Fluoride induces oxidative damage and SIRT1/autophagy through ROS-mediated JNK signaling[J]. Free Radical Biology & Medicine, 89: 369-378. |
王海臻, 蔡丹纯, 廖丹丹, 等. 2018. 内质网应激介导滋养细胞凋亡在妊娠期肝内胆汁淤积症中的作用及机制[J]. 南方医科大学学报, 38(5): 572-577. |
尉俊仁, 冯佩, 章子贵. 2012. 硒对氟致大鼠睾丸与附睾中某些酶活性变化的影响[J]. 毒理学杂志, 26(1): 4-8. |
吴佳怡. 2018. 细胞凋亡研究进展[J]. 当代化工研究, (12): 190-192. |
Wen P J, Wei X M, Liang G Q, et al. 2019. Long-term exposure to low level of fluoride induces apoptosis via P53 pathway in lymphocytes of aluminum smelter workers[J]. Environmental Science and Pollution Research International, 26(3): 2671-2680. |
Wei W, Pang S J, Sun D J. 2019. The pathogenesis of endemic fluorosis:Research progress in the last 5 years[J]. cellular and molecular medicine, 23(4): 2333-2342. |
魏玮, 王伟, 赵巧湜, 等. 2018. 氟对大鼠免疫细胞增殖及凋亡的影响[J]. 中华地方病学杂志, 37(11): 876-880. |
汪希兰, 明娟, 邱冰, 等. 2019. 燃煤污染型氟中毒患者氟暴露、骨相损伤程度与骨形成标志物的关系[J]. 应用生态学报, 30(1): 43-48. |
汪晓宇.2019.L-型钙通道在氟致肾脏细胞损伤中的作用及机理的研究[D].金华: 浙江师范大学
|
王在然, 杨冀萍. 2019. 内质网应激与细胞凋亡[J]. 脑与神经疾病杂志, 27(8): 517-520. |
Wang X Z, Lawson B, Brewer J W. 2006. Signals from the stressed endoplasmic reticulum induce C/EBP-homologous protein (CHOP/GADD153)[J]. Mol Cell Biol, 16(8): 4273-4280. |
邢德利, 徐淑艳, 张文岚, 等. 2006. 过量摄氟对大鼠脑组织氧化侵袭与细胞凋亡的影响[J]. 中国地方病防治杂志, 21(1): 7-9. |
熊传龙, 李卫东, 范中学, 等. 2017. 饮水氟含量与儿童氟斑牙剂量反应关系的研究[J]. 中华地方病学杂志, 36(2): 100. |
袁长青, 丁振华. 2002. Caspase的活化及其在细胞凋亡中的作用[J]. 生理科学进展, 33(3): 220-224. |
杨阳.2015.氧化应激偶联内质网应激在氟中毒大鼠生殖损伤中的作用及机制[D].河南: 郑州大学
|
Yu Q L, Shao D D, Zhang R, et al. 2019. Effects of drinking water fluorosis on L-type calcium channel of hippocampal neurons in mice[J]. Chemosphere, (220): 169-175. |
张凯强, 张颖, 顾何锋, 等. 2014. 内质网应激分子在慢性氟中毒大鼠成釉细胞中的表达[J]. 北京口腔医学, 22(4): 181-186. |
张筱文, 张珂, 许飞华. 2014. 氟对雄性大鼠睾丸细胞周期及细胞凋亡的影响[J]. 中华地方病学杂志, 33(3): 272-274. |
Zhang S M, Zheng X R, Sun Y, et al. 2015. Alterrations in oxidative stress and apotosis in cultured pc12 cells exposed to flouride[J]. Fluoride, 48(3): 213-222. |
 2020, Vol. 40
2020, Vol. 40


