目前, 环境颗粒物(PM)污染已成为棘手的世界性公共卫生问题, 其中以PM2.5为主的室外空气污染是严重影响人类健康的因素之一.PM2.5是由大气中的化学反应和燃料燃烧产生的空气微粒组成, 含镍、钒、酸性氧化物、致病菌等有毒物质, 进入人体后能吸附于肺泡, 并与肺细胞分泌的表面活性剂相互作用, 然后被巨噬细胞吸收清除或直接与肺细胞相互作用, 破坏肺泡壁, 引发炎症, 从而导致肺功能下降及结构损伤, 甚至能进入血液循环损害心血管系统(Bell, 2012;Li et al., 2019;范威等, 2019).流行病学研究表明, 吸入PM2.5污染物会增加呼吸系统疾病患病率, 包括哮喘、慢性阻塞性肺病(COPD)和肺癌等(Fan et al., 2016;Li et al., 2016a;Pun et al., 2017).据报道, 空气污染导致的肺癌是伤残调整寿命年(Disability Adjusted of Life Years, DALYs)的主要原因, 也是中国最常见的第四大死亡原因(Yang et al., 2013).PM2.5浓度越高, 肺癌患者死亡率越高(Fu et al., 2015).此外, 体内外研究也表明, PM2.5可通过氧化应激、炎症反应、遗传和表观遗传改变等途径引发肺损伤(Ji et al., 2019).
研究显示, PM2.5对呼吸系统的毒性主要作用在炎性损伤阶段, 即急性肺损伤(Acute lung injury, ALI)(丛鲁红等, 2017).ALI是一种以炎性浸润、肺泡-毛细血管损伤、肺泡(间质)水肿、免疫细胞蓄积和蛋白释放为特征的肺部疾病, 主要特点是肺泡和肺间质水肿伴高蛋白液体(Grommes et al., 2011;Barreto et al., 2018).水平衡在肺部主要病理生理过程中起关键作用.水通道蛋白(Aquaporins, AQPs)是一组疏水性的跨膜转运蛋白, 介导机体对体液和渗透压变化的生理反应, 可为机体水稳态提供重要的系统调节(Krane et al., 2007).其中, AQP1参与了多种与肺水肿相关疾病的发生, 通过对肺泡、肺间质及肺毛细血管间水的转运调节, 来保持肺内液体平衡(Verkman, 2007;Ebeling et al., 2014).研究显示, 腺病毒感染会导致肺炎、肺水肿和肺功能下降, 且肺组织中AQP1的含量在腺病毒注入后降低(Towne et al., 2000).缺氧可造成大鼠肺AQP升高, 通过药物治疗下调AQP1表达可以减轻肺损伤(Wang et al., 2016).另有研究发现, 海水吸入可刺激大鼠肺组织、A549细胞和原代肺泡Ⅱ型细胞中AQP1和AQP5表达升高, 通过药物抑制AQP1和AQP5的过表达, 可以减轻海水吸入性肺水肿(Li et al., 2011).以上报道均提示AQP1与急性肺损伤时肺水肿的形成关系紧密.
目前对于大气污染物PM2.5暴露所致的肺损伤中, 对于AQP1是否参与及其相关机制的研究鲜为报道.因此, 本实验用PM2.5暴露处理肺泡上皮细胞A549及SD大鼠, 检测其对肺细胞及组织的细胞活性、形态结构及AQP1表达的影响, 探究AQP1是否参与PM2.5所致的肺损伤过程, 进一步揭示PM2.5暴露引起呼吸系统疾病的机制.
2 材料和方法(Materials and methods) 2.1 PM2.5样品的采集和提取于2017—2018年在北京市使用石英纤维膜和TH-1000C型智能大流量空气颗粒物采样器采集PM2.5, 采样流量为1 m3·min-1.采样完成后将石英纤维膜用乙醇润湿, 冰浴超声, 用6层纱布过滤, 真空冷冻干燥后, 称重, 用无菌水或生理盐水配成相应浓度的PM2.5样品悬液, 于-80 ℃条件下保存.
2.2 细胞培养与染毒处理A549细胞购买于中国医学科学院基础医学研究所细胞资源中心.A549细胞生长于含有10%胎牛血清和1%抗青霉素/链霉素的DMEM细胞培养基中, 37 ℃、5%CO2条件下培养, 之后将细胞接种到6/96孔板, 37 ℃培养24 h, 直至长到70%~80%融合度.根据实验测定结果确定PM2.5悬液使用浓度, 用DMEM培养基配制成PM2.5染毒液, 温育6、12、24 h后用于后续检测.
2.3 实验动物染毒处理选取SPF级雄性SD大鼠10只(购于北京维通利华实验动物技术有限公司), 体重180~200 g, 饲养在SPF级动物房, 饲养条件为恒温(21±2) ℃, 湿度为50%±10%, 12 h/12 h昼夜交替, 适应性喂养一周后随机分成2组, 每组各5只, 分别为生理盐水对照组(记为C组)和PM2.5染毒组(1.5 mg·kg-1体重, 记为D组).以气管滴注的方式进行PM2.5染毒, 对照组给予等体积生理盐水, 隔天染毒1次, 共7次, 染毒结束24 h后, 处死大鼠, 取部分肺组织进行固定, 其余肺组织用液氮速冻后置于-80 ℃冰箱保存.
2.4 细胞活力测定取对数生长期的A549细胞以4×103个·孔-1的密度接种于96孔板, 37 ℃、5%CO2培养24 h后, 将PM2.5悬液用DMEM培养基稀释成浓度分别为25、50、100、200、400 μg·mL-1的染毒液, 每孔加100 μL.另外, 每组设5个平行孔, 未染毒的细胞作为正常对照组, 背景孔不接种细胞, 只加入相应浓度的PM2.5染毒液或培养基, 培养24 h后, 每孔加入10 μL的CCK 8溶液, 避光孵育1.5 h, 用酶标仪测定450 nm处的吸光度值(Optical Density OD).细胞存活率R的计算公式如下:R=(OD实验组-OD实验组背景)/(OD对照组-OD对照组背景)×100%.实验测得的IC50为235 μg·mL-1, 后续细胞实验均采用此浓度配制PM2.5染毒液.
2.5 总RNA的提取与荧光定量PCR
按照5×105个·孔-1将A549细胞接种于6孔板, 培养24 h后, 融合度达70%~80%, 加入PM2.5染毒液(浓度为235 μg·mL-1), 同时设对照组, 培养6、12、24 h后(下同), 用Trizol法裂解A549细胞提取总RNA, 参照PrimeScript RT Reagent Kit(Takara)反转录试剂盒说明, 将1 μg RNA逆转录成cDNA.Real Time PCR扩增使用SYBR® Premix DimerEraser(Takara)试剂盒, 按照说明书进行, 用ViiA7实时定量PCR仪进行qPCR分析, 反应条件如下:95 ℃变性5 s, 55 ℃退火30 s, 72 ℃延伸30 s, 40个循环, 结果采用2-△△Ct计算AQP1 mRNA表达差异.引物由上海生工公司合成, 引物序列见表 1.
| 表 1 荧光定量PCR所用引物序列 Table 1 Primers used in real time PCR |
将A549细胞以5×105个·孔-1接种于6孔板, 达到70%~80%融合度后进行PM2.5染毒, 结束后收集细胞.细胞总蛋白提取使用含有蛋白酶抑制剂的RIPA裂解液, 大鼠肺组织蛋白提取采用液氮研磨法, 用BCA法定量各样本总蛋白.在8%或10%的SDS-聚丙烯酰胺凝胶上分离蛋白质, 用半干转法将蛋白转印到PVDF膜上, 5%BSA封闭1.5 h, 一抗4 ℃孵育过夜(一抗AQP1、β-actin均购买于Abcam公司), 封闭洗涤缓冲液(TBST)洗3次后, 加入二抗孵育2 h(羊抗鼠远红外荧光二抗和羊抗兔远红外荧光二抗购买于KPL公司), TBST洗3次后, 用LI-COR Odyssey红外扫膜仪检测蛋白印迹, 保存图片计算灰度值.
2.7 免疫荧光在24孔板中放入细胞爬片, A549以8×104个·孔-1接种于内, 进行细胞染毒, 结束后将爬片上的细胞用4%多聚甲醛室温固定15 min, 0.3% TritonX-100室温通透10 min;然后加入10%驴血清(Solarbio公司), 室温封闭0.5 h, 将一抗AQP1按体积比1:50稀释, 37 ℃孵育1 h, 驴抗兔绿色荧光二抗(Earthox公司)按体积比1:100稀释, 室温避光孵育1 h;最后用Hoechst 33258(MedChemExpress公司)染核, 避光室温孵育20 min, PBS洗涤后封片, 在Leica TCS SP2激光共聚焦显微镜下观察荧光.
2.8 HE染色大鼠处死后立即取右肺上叶组织放入4%多聚甲醛中固定, 通过石蜡包埋, 制备厚度5 μm的病理切片, 随后对标本进行苏木素-伊红(HE)染色, 脱水、透明、封片, 显微镜下观察并拍照分析.
2.9 统计分析实验数据表示为平均值±标准差, 使用GraphPad Prism 6软件进行统计学分析, 实验结果采用One-way ANOVA法和T检验法比较有无显著性差异, 若p < 0.05, 则认为差异有统计学意义.
3 结果(Results) 3.1 PM2.5暴露对A549细胞活性及形态的影响将PM2.5悬液用DMEM培养基稀释成浓度分别为25、50、100、200、400 μg·mL-1的染毒液并加入到A549细胞中, 染毒处理24 h, 用CCK 8法测定细胞活性, 结果如图 1所示.由图可知, 随着PM2.5浓度的增加, 各剂量组细胞存活率均显著降低, 二者呈现负相关性;由剂量-细胞存活率曲线可得, PM2.5暴露对A549细胞的半数抑制浓度IC50为235 μg·mL-1.
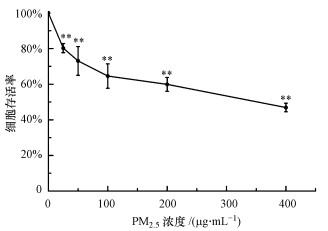 |
| 图 1 不同浓度PM2.5暴露对A549细胞存活率的影响(T test, n=3, 与对照组相比, *p<0.05, **p<0.01) Fig. 1 Effects of PM2.5 at different concentrations on cell viability in A549 cells |
将PM2.5悬液用DMEM培养基稀释成浓度分别为25、50、100、200、400 μg·mL-1的染毒液并加入到A549细胞中, 染毒处理24 h后, 用显微镜进行细胞形态学观察, 结果如图 2所示.由图可知, 未经PM2.5染毒的对照组细胞生长状态良好;PM2.5染毒组随着暴露浓度的增加细胞形态发生变化, 200 μg·mL-1以上, 细胞形态逐渐改变, 边缘变钝, 呈现皱缩, 显示PM2.5对A549细胞的生长状态有显著影响.
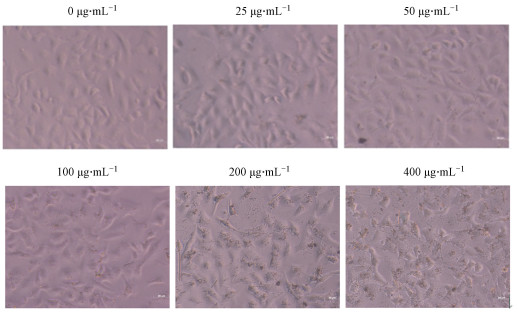 |
| 图 2 不同浓度PM2.5暴露对A549细胞形态的影响 Fig. 2 Effects of PM2.5 at different concentrations on the morphology of A549 cells |
将A549细胞用235 μg·mL-1的PM2.5悬液暴露不同时间后, 用qPCR检测AQP1转录水平上的变化情况.图 3结果显示, 与对照组相比, PM2.5暴露后A549细胞内AQP1 mRNA表达量先升高后降低, 刺激6 h时达到对照组的2.27倍(p < 0.01);此后AQP1 mRNA表达量继续升高, 在12 h时达到高峰, 为正常对照组的2.64倍(p < 0.01).
 |
| 图 3 不同时间PM2.5暴露对A549细胞中AQP1 mRNA表达的影响(One-way ANOVA test, n = 3, 与对照组相比, *p<0.05, **p<0.01) Fig. 3 Effects of PM2.5 from different times exposure on mRNA levels of AQP1 in A549 cells |
用235 μg·mL-1的PM2.5染毒处理A549细胞0、6、12、24 h, 测定AQP1的蛋白表达, 结果表明, 各组细胞AQP1蛋白表达水平差异有统计学意义.如图 4所示, 与0 h的对照组相比PM2.5刺激后AQP1蛋白表达量先增加后降低, 6 h时处于表达上升状态, 此时为对照组的1.89倍(p < 0.05), 12 h达到峰值, 是正常对照的2.80倍(p < 0.01).
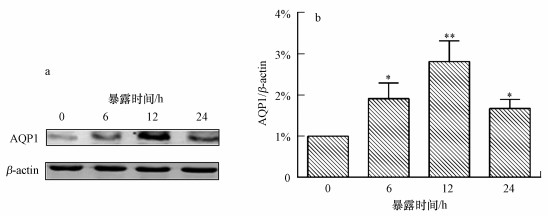 |
| 图 4 不同时间下PM2.5暴露对A549细胞中AQP1表达的影响(a.Western blot结果;b.灰度分析结果, One-way ANOVA test, n=3, 与对照组相比, *p<0.05, **p<0.01) Fig. 4 Effects of PM2.5 from different times exposure on protein levels of AQP1 in A549 cells |
免疫荧光结果如图 5所示, PM2.5暴露24 h内AQP1表达量先增加后降低, 与qPCR及Western blot结果均一致;12 h内AQP1蛋白水平在细胞质基质中累积, 且成颗粒状分布;24 h时细胞质基质中AQP1表达水平降低, 但在细胞膜上有显著分布.这些结果提示PM2.5能够刺激AQP1表达, 并可能被转运定位到细胞质膜上.
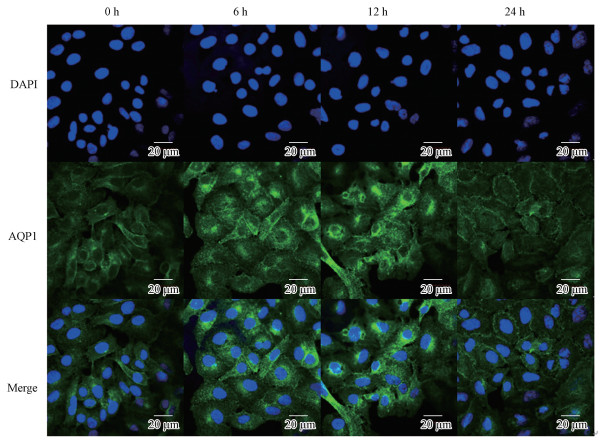 |
| 图 5 PM2.5暴露对A549细胞内AQP1表达定位的影响(蓝色荧光表示细胞核, 绿色荧光表示AQP1) Fig. 5 Effect of PM2.5 exposure on the localization of AQP1 expression in A549 cells |
生理盐水对照组SD大鼠皮毛有光泽, 精神状态良好, 活动量正常, 反应灵敏, 进食正常.1.5 mg·kg-1的PM2.5染毒组SD大鼠皮毛无光泽, 精神状态欠佳, 活动量减少, 反应迟缓, 进食减少.
3.6 PM2.5暴露对大鼠肺AQP1蛋白表达的影响如图 6所示, 暴露于1.5 mg·kg-1的PM2.5后, 染毒组大鼠肺组织中AQP1蛋白表达相对于生理盐水对照组显著升高, 为对照组的1.27倍(p < 0.05).
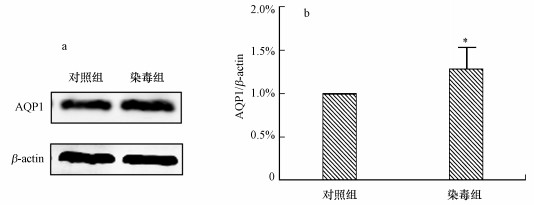 |
| 图 6 PM2.5暴露对肺组织AQP1蛋白表达的影响(a.Western blot结果, b.灰度分析结果;One-way ANOVA test, n = 3, 与对照组相比, *p<0.05) Fig. 6 Effect of PM2.5 exposure on AQP1 protein expression in rat lungs |
将SD大鼠用1.5 mg·kg-1的PM2.5呼吸暴露后, 进行肺组织病理学观察, 发现正常对照组肺组织结构清晰, 肺泡大小均匀, 结构完整, 未见炎性浸润, 肺泡隔较薄无水肿(图 7a).PM2.5暴露组肺组织可见肺泡隔增厚, 局部断裂, 肺泡萎缩塌陷, 大面积肺泡融合, 结构紊乱(黄色箭头), 血管周围有广泛的(间质)水肿(黑色箭头)及大量炎症细胞浸润(蓝色剪头), 少量红细胞渗出(红色箭头)(图 7b).
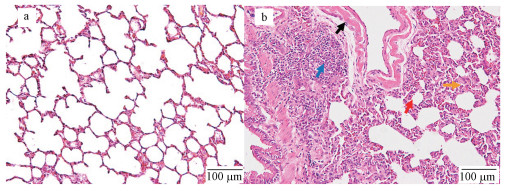 |
| 图 7 PM2.5暴露对肺组织形态的影响(100×) (a.生理盐水对照组;b.PM2.5染毒组, 黑色箭头表示血管周围(间质)水肿, 蓝色箭头表示炎性细胞浸润, 红色箭头表示肺泡少量红细胞渗出, 黄色箭头表示肺泡间隔增厚) Fig. 7 Effect of PM2.5 exposure on the localization of AQP1 expression in A549 cells |
PM2.5是一种非均质混合物, 其较大的表面积能吸附更多的有害物质并通过呼吸道进入肺部, 从而引起肺组织病变、免疫系统功能下降, 严重时可诱发癌症(Feng et al., 2016).研究表明, 在中国PM2.5是第四大死亡危险因素, 每年导致120万人死亡(Yang et al., 2013).PM2.5通过呼吸道进入肺部, 沉积于肺泡和肺间质, 破坏上皮屏障, 导致或诱发ALI、气道炎症、氧化损伤、DNA损伤等, 最终导致肺损伤甚至肺癌的发生.据报道, 成年大鼠呼吸量为200 mL·min-1, 连续2 d呼吸量达0.576 m3, 根据中国国家环境质量标准(NAAQS, 2012), PM2.5(0.075 mg·m-3)连续2 d的吸入量为0.0432 mg, 大鼠每2 d的PM2.5暴露剂量为0.216 mg·kg-1体重.通过计算得到每只大鼠每2 d暴露PM2.5的平均剂量大约在0.464~1.993 mg·kg-1体重之间, 取中间值将SD大鼠的PM2.5染毒剂量设为1.5 mg·kg-1体重(Li et al., 2015).本研究发现, 用不同浓度的PM2.5暴露处理肺上皮细胞A549后, 细胞形态发生改变, 细胞活性降低且与PM2.5浓度呈负相关.另外, PM2.5暴露会引发SD大鼠肺部水肿充血及大量炎性浸润, 肺泡塌陷, 肺泡间隔增宽等.
ALI是以肺泡-毛细血管损伤为主的临床综合征, 肺损伤时存在水的异常跨膜转运及肺组织中水的异常累积等病理过程.AQP1是一种具有转运水和部分阳离子双重功能的跨膜蛋白, 它的嵌入使生物膜对水的通透能力大大提高, 对调节肺水平衡起着关键作用, 与ALI肺水肿的形成和清除密切相关(Day et al., 2014).多种因素均可诱导AQP1表达改变.研究表明, 高氧暴露会导致A549细胞在AQP1沉默后细胞体积与细胞膜渗透水通透性降低, 说明AQP1下调可引起细胞内外液体平衡失调, 阻碍细胞外液向细胞内的转运(Zhang et al., 2014).缺氧可调节血管内皮细胞内AQP1表达, 其机制可能是AQP1含有蛋白激酶A(Protein kinase A, PKA)磷酸化的同源序列, 缺氧可激活PKA使AQP1发生磷酸化, 使其由胞浆囊泡向细胞膜转移, 并通过胞吐作用融合嵌入胞膜, 使细胞膜上AQP1的分布短时增加(吴琴琴等, 2008).本研究发现, PM2.5暴露24 h内A549细胞中AQP1表达量先增加后降低;另外, 免疫荧光结果显示, 暴露12 h内AQP1蛋白水平在细胞质基质中累积, 且成颗粒状分布;24 h时AQP1在细胞膜上有显著分布, 但在细胞质基质中分布降低.这些结果提示PM2.5能够刺激AQP1表达, 并可能被转运定位到细胞质膜上.
肺组织水液代谢失调与肺AQPs的异常表达密切相关, AQPs参与了肺泡腔水肿液的转运(吴华杰等, 2018).研究发现, 海水高渗环境能使A549细胞体积减小, 细胞内水外渗, 肺毛细血管通透性增加, 肺水肿加重, 并诱导大鼠肺组织及A549细胞内AQP1、AQP5表达显著上调, 推测AQP表达升高是机体在水增多的情况下一种适应性代偿机制(周长喜, 2008).高原缺氧亦可引发大鼠肺水肿且肺组织中AQP1、AQP4蛋白表达均显著升高, 认为肺水肿的发生与AQP1有关(祁玉婷等, 2013).另外, 在脂多糖诱导的大鼠ALI模型中发现随着时间延长, 肺水肿逐渐加重, AQP1、AQP5表达下调, 推测肺水肿液体的清除能力降低与AQP1、AQP5表达下调有关(陈国兵等, 2016).这些研究结果均表明AQP1的表达参与肺水肿损伤过程.本研究结果显示, PM2.5暴露诱导肺源细胞A549及大鼠肺组织中AQP1的表达水平显著升高, 并且伴以肺组织水肿现象, 说明AQP1参与了PM2.5暴露刺激引起的肺损伤作用.PM2.5通过呼吸作用进入肺泡, 导致肺泡上皮屏障受损, 液体进入肺间质, 形成肺泡性肺水肿, AQP1的表达增加是机体在急性肺损伤早期的代偿性反应, 可促进多余水的清除, 减轻肺损伤.但组织细胞损伤过度, 可能导致AQP1表达降低或其功能受损, 水清除效果降低, 从而引起肺损伤及水肿趋重.
5 结论(Conclusions)PM2.5暴露可诱导肺细胞和组织中AQP1表达升高, 并伴随以肺组织水肿损伤.进一步研究PM2.5暴露诱导肺AQP1的应激表达及与肺损伤的关系, 不仅能更好地揭示PM2.5的毒理学机制, 而且可为开发防治措施提供新的依据.
Bell M L. 2012. Assessment of the health impacts of particulate matter characteristics[J]. Research Report(Health Effects Institute), 161: 5-38. |
Barreto T R, Costola-De-Souza C, Margatho R O, et al. 2018. Repeated domperidone treatment modulates pulmonary cytokines in LPS-induced acute lung injury in mice[J]. Int Immunopharmacol, 56: 43-50. |
陈国兵, 连珠兰, 占珠琴, 等. 2016. 水通道蛋白1、5在LPS诱导大鼠急性肺损伤组织中的表达[J]. 基础医学与临床, 36(1): 53-57. |
丛鲁红, 吴依娜, 段军, 等. 2017. 可吸入颗粒物PM2.5对大鼠肺纤维化的影响及糖皮质激素的干预作用[J]. 心肺血管病杂志, 36(6): 482-487. DOI:10.3969/j.issn.1007-5062.2017.06.016 |
Day R E, Kitchen P, Owen D S, et al. 2014. Human aquaporins:Regulators of transcellular water flow[J]. Biochimica Et Biophysica Acta-General Subjects, 1840(5SI): 1492-1506. |
Ebeling G, Blaesche R, Hofmann F, et al. 2014. Effect of P2X7 receptor knockout on AQP-5 expression of type Ⅰ alveolar epithelial cells[J]. PLOS ONE, 9: e1002826. DOI:10.1371/journal.pone.0100282 |
Fu J, Jiang D, Lin G, et al. 2015. An ecological analysis of PM2.5 concentrations and lung cancer mortality rates in China[J]. Bmj Open, 5: e00945211. |
Fan J, Li S, Fan C, et al. 2016. The impact of PM2.5 on asthma emergency department visits:a systematic review and meta-analysis[J]. Environmental Science and Pollution Research, 23(1): 843-850. |
Feng S, Gao D, Liao F, et al. 2016. The health effects of ambient PM2.5 and potential mechanisms[J]. Ecotoxicology and Environmental Safety, 128: 67-74. |
范威, 王贵, 安珍, 等. 2019. 大气细颗粒物对胶原结构样巨噬细胞受体基因敲除小鼠呼吸和循环系统的影响[J]. 新乡医学院学报, 36(1): 7-12. |
Grommes J, Soehnlein O. 2011. Contribution of neutrophils to acute lung injury[J]. Mol Med, 17(3/4): 293-307. |
Ji X, Yue H, Ku T, et al. 2019. Histone modification in the lung injury and recovery of mice in response to PM2.5 exposure[J]. Chemosphere, 220: 127-136. |
Krane C M, Goldstein D L. 2007. Comparative functional analysis of aquaporins/glyceroporins in mammals and anurans[J]. Mamm Genome, 18(6/7): 452-462. |
Li J, Xu M, Fan Q, et al. 2011. Tanshinone IIA ameliorates seawater exposure-induced lung injury by inhibiting aquaporins (AQP)1 and AQP5 expression in lung[J]. Respir Physiol Neurobiol, 176(1/2): 39-49. |
Li M H, Fan L C, Mao B, et al. 2016. Short-term exposure to ambient fine particulate matter increases hospitalizations and mortality in COPD:A systematic review and meta-analysis[J]. Chest, 149(2): 447-458. |
Li R, Kou X, Geng H, et al. 2015. Effect of Ambient PM2.5 on lung mitochondrial damage and fusion/fission gene expression in rats[J]. Chemical Research in Toxicology, 28(3SI): 408-418. |
Li Y, Dong T, Jiang X, et al. 2019. Chronic and low-level particulate matter exposure can sustainably mediate lung damage and alter CD4 T cells during acute lung injury[J]. Molecular Immunology Mol Immunol, 112: 51-58. |
Pun V C, Kazemiparkouhi F, Manjourides J, et al. 2017. Long-term PM2.5 exposure and respiratory, cancer, and cardiovascular mortality in older US adults[J]. American Journal of Epidemiology, 186(8): 961-969. |
祁玉婷, 郭鹏, 李建宇, 等. 2013. 急性高原缺氧大鼠肺组织损伤及其机制研究[J]. 武警后勤学院学报(医学版), 22(2): 77-80. |
Towne J E, Harrod K S, Krane C M, et al. 2000. Decreased expression of aquaporin (AQP)1 and AQP5 in mouse lung after acute viral infection[J]. American Journal of Respiratory Cell And Molecular Biology, 22(1): 34-44. |
Verkman A S. 2007. Role of aquaporins in lung liquid physiology[J]. Respiratory Physiology & Neurobiology, 159(3): 324-330. |
Wang C, Yan M, Jiang H, et al. 2016. Protective effects of puerarin on acute lung and cerebrum injury induced by hypobaric hypoxia via the regulation of aquaporin (AQP) via NF-kappaB signaling pathway[J]. Int Immunopharmacol, 40: 300-309. |
吴华杰, 丁翠玲, 石曌玲, 等. 2018. 1, 25-二羟维生素D_3减轻幼鼠海水吸入性肺损伤中组织水肿的机制[J]. 中国妇幼健康研究, 29(11): 1387-1391. |
吴琴琴, 陈玉成, 姜小飞, 等. 2008. 缺氧条件下体外培养血管内皮细胞AQP1表达的变化[J]. 四川大学学报(医学版), (6): 916-920. |
Yang G, Wang Y, Zeng Y, et al. 2013. Rapid health transition in China, 1990-2010:Findings from the global burden of disease study 2010[J]. Lancet, 381(9882): 1987-2015. |
周长喜.2008.海水淹溺肺损伤肺水通道蛋白1、5的表达及意义的实验研究[D].重庆: 第三军医大学.109
|
Zhang Q, Fu J, Xue X. 2016. Inhibition of the expression of aquaporin-1 by RNA interference in pulmonary epithelial cells and its effects on water transport[J]. Molecular Medicine Reports, 13(1A): 281-286. |
 2020, Vol. 40
2020, Vol. 40


