镉作为一种有毒重金属, 常通过各种途径进入土壤(罗琼等, 2014;Xu et al., 2019).土壤中的镉无法被降解, 容易被植物富集通过食物链进入动物和人体中, 对生态环境和人体健康产生毒害, 因此人们对土壤镉污染问题极为关注(Rinaldi et al., 2017;孙婕妤等, 2018).电动修复是近年来兴起的一门土壤原位修复技术.它通过在污染土壤中形成直流电场使带电离子向两极迁移, 或通过电渗方式使土壤孔隙中的溶液迁出土壤, 从而达到修复的目的(王宇等, 2016).然而传统的电动修复技术能耗大, 运行成本高, 在修复过程中存在“聚焦现象”, 即重金属离子易在土壤阴极区发生沉淀而无法被迁出, 导致其广泛应用受到限制(Zhou et al., 2005;Vizcaíno et al., 2018).
微生物技术具有修复成本低, 生态效益好等优点, 同时一些耐镉菌能吸附Cd或使Cd发生形态转化从而降低土壤中的重金属毒性(王京文等, 2015;袁金蕊等, 2018).结合微生物的优势, 开发电动-微生物修复技术修复镉污染土壤, 理论上能克服传统电动技术的瓶颈问题.但目前关于电动-微生物联合技术在实际运用中存在有一些挑战:①施加电场后, 耐镉菌的耐受性是否会受到抑制;②耐镉菌在电场作用下是否具有迁移能力.因此关于耐镉菌株的筛选至关重要.
本研究从镉污染土壤中筛选分离出3种耐镉细菌Escherichia coli strain、Bacillus sp.和Bacillus cereus strain, 将其分别接种至人工模拟镉污染土样中, 进行电动-微生物联合修复试验(对照组为传统电动修复).通过比较土壤中Cd去除率和其形态转化, 以及土壤性质(pH, 电导率等)变化, 筛选出修复效果及经济效益比较高的一株耐镉菌, 为电动-微生物联合修复镉污染土壤的进一步研究提供试验材料和科学依据.
2 材料与方法(Materials and methods) 2.1 供试土壤试验土样取自中南林业科技大学生态站0~15 cm土层(未受镉污染), 剔除杂质后, 自然风干过20目筛.在土样中加入一定浓度的Cd(NO3)2溶液, 充分搅拌混匀后熟化一年制成人工模拟镉污染土壤, 土壤中Cd含量为11.07 mg · kg-1.未处理前供试土壤的基本理化性质见表 1.
| 表 1 供试土壤的基本理化性质 Table 1 The physicochemical properties of the tested soil |
培养基配方:牛肉膏3.0 g, 蛋白胨10 g, 琼脂15~20 g, NaCl 5 g, 蒸馏水1000 mL, pH为7.0~7.2.
称取人工模拟镉污染土壤10 g, 放入装有90 mL无菌水的三角瓶中, 振荡均匀, 静置后对上清液进行梯度稀释.将适量土壤稀释液涂布在含Cd固体培养基上, 培养一段时间后挑取单菌落分别接种至不同Cd2+浓度的固体培养基中, 多次划线培养获得耐镉菌株.
2.3 耐镉菌株的鉴定从人工模拟镉污染土壤中经过多次分离及纯化培养筛选出3种耐镉细菌, 分别命名为菌株A-1、B-1、C-1.
形态学鉴定.将3种耐镉细菌接种在LB固体培养基上, 于37 ℃培养24 h后, 通过观察菌落的形状, 大小, 颜色等形态学特征和其生理生化反应, 对菌株进行初步鉴定(Ludwig et al., 2009).
分子鉴定.菌株的测序工作由上海美吉生物医药科技有限公司完成.对菌株进行16Sr DNA测序, 将测序结果用BLAST程序在NCBI数据网上进行同源性比对, 并用MEGA 7.0软件构建系统发育树(图 1).最终确定菌A-1为大肠杆菌Escherichia coli strain, 菌B-1为芽胞杆菌Bacillus sp., 菌C-1为蜡样芽胞杆菌Bacillus cereus strain.
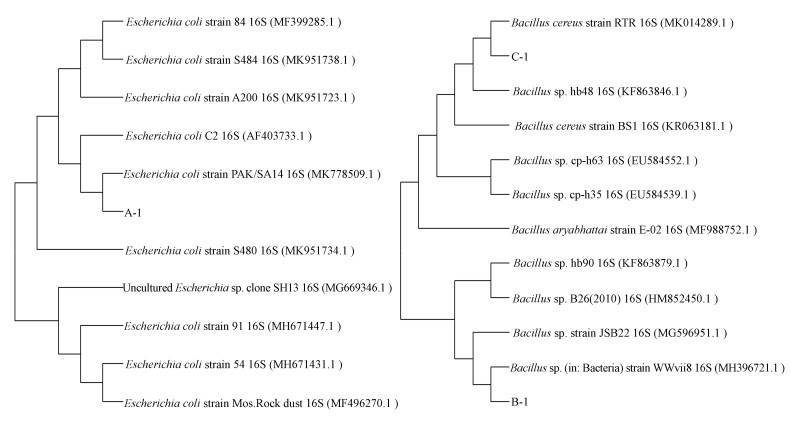 |
| 图 1 菌株A-1(a)和菌株B-1, C-1(b)的系统发育树 Fig. 1 The phylogenetic tree of strain A-1 (a) and B-1, C-1 (b) |
本试验所用电动修复装置主要由直流电源, 阴极阳极室, 圆柱形土壤室(长9 cm, 直径12 cm, 装土量345 g), 蠕动泵, 无纸记录仪和pH自动控制加液机组成.土壤室和阴极阳极室之间用烧结玻璃隔开, 蠕动泵连接电解池和阴阳极溶液库用于更新电解液.阳极为石墨板, 阴极为钛板.
如表 2所示试验共设4组处理.试验组EBR-Ecs、EBR-Bs、EBR-Bcs为电动-微生物联合修复(每组处理接种不同的菌株), 将经活化的耐镉细菌在液体培养基(牛肉膏3.0 g, 蛋白胨10 g, NaCl 1.25 g, 蒸馏水1000 mL, pH为7.0~7.2)振荡培养16 h(对数期)后投加到土壤中混合, 菌液OD600值为1.5左右, 接种量为100 mL, 土壤中菌体浓度为(4.8±0.2)×105 cfu · g-1.随后用去离子水维持土壤含水率为25%左右, 平衡24 h后装入土壤室中通电进行电动处理.对照组为传统电动修复, 土壤中不接种耐镉细菌.考虑到缓冲能力、电解质性质和成本问题, 选择将0.045 mol · L-1 Tris-乙酸缓冲液(TA;pH 7.0)作为阴极液(Deflaun et al., 1997), 并通过pH自动控制系统控制其酸碱值, 阳极液为清水.试验设电压梯度为1 V · cm-1, 运行周期为10 d, 通电过程中实时监测土柱电流, 每隔1 d测定电渗流量.通电结束后将土样从阳极到阴极等距平均分为5份, 记为S1~S5(S1靠近阳极), 自然风干过筛后测定每部分土样的pH值, 电导率, 镉总量和形态镉含量.
| 表 2 试验设计 Table 2 Experimental design of treatments |
总电能消耗在绝大程度上可作为评估成本的一项指标, 本研究为了更准确地评价电动-微生物修复技术的效益和可行性, 采用总电耗能和单位修复耗能共同评估试验结果.试验中电压设为12 V, 电流随时间而变, 由无纸记录仪记录下来.利用式(1)来计算电耗能, 式(2)来计算单位修复能耗.
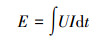
|
(1) |
式中, E为电能消耗量, U为电压值, I为电流值, t为时间.
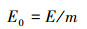
|
(2) |
式中, E0为单位修复能耗, E为电能消耗量, m为土壤中去除的Cd含量.
2.6 分析方法实验过程中的电流数据通过无纸记录仪自动记录.土壤基本理化性质测定的流程参考《土壤污染与生态修复实验指导》, 土壤pH值和电导率分别使用雷磁pHSJ-4F型pH计(上海雷磁仪器厂)和哈纳HI-8733型便携式电导率仪(北京哈纳科仪科技有限公司)测定.土壤Cd全量使用盐酸-硝酸-高氯酸消化, 土壤各形态Cd含量采用BCR顺序提取法, 消化液和提取液用ICE3000火焰原子吸收分光光度计(美国THERMO公司)测定(Zimmerman et al., 2010).土壤中可培养细菌数量采用涂抹平板培养计数法.所有测试样品重复3次.试验数据为平均值±标准差, 使用SPSS22.0和Excel 2010进行统计分析, 用origin7.0制作图表.
3 结果与分析(Results and analysis) 3.1 耐镉菌株的主要生理特性菌株A-1、B-1、C-1在LB固体培养基上最大Cd耐受浓度分别为400、600、700 mg · kg-1, 在LB液体培养基上最大Cd耐受浓度分别为150、200、200 mg · L-1.菌株A-1、B-1、C-1对水相中Cd2+的吸附率分别为19.40%、30.55%、37.36%(Cd污染水平为40 mg · L-1).3种菌株的主要生理生化特性见表 3.
| 表 3 菌株的生理生化特性 Table 3 The physiological and biochemical characteristics of stains |
电流的变化见图 2a.所有试验组电流偏低, 电流大小为0.5~4 mA.除对照组之外, 其余试验组电流变化都是先增大, 20 h左右达到峰值后逐渐减小, 最后趋于稳定.其中试验组EBR-Ecs的电流在处理期间一直大于EBR-Bs和EBR-Bcs, EBR-Bs和EBR-Bcs的电流大小和变化趋势十分接近.对照组电流先逐渐上升, 增大到2.1 mA后电流一直维持在该值左右.试验组EBR-Ecs、EBR-Bs和EBR-Bcs在处理前期电流明显大于Control, 随着电流趋向稳定后, 对照组的电流则大于另外3组.
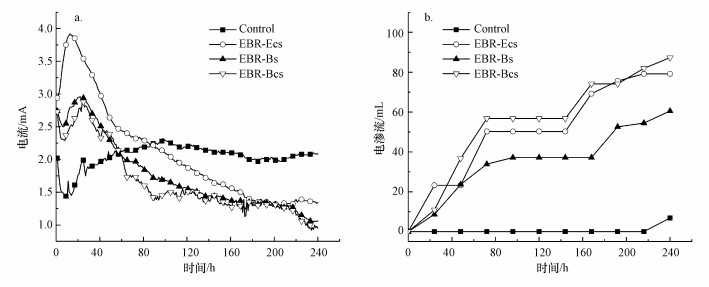 |
| 图 2 不同试验过程中电流(a)和电渗流(b)的变化 Fig. 2 Change of electric current and electroosmotic flow with time in various treatments |
电渗流的变化见图 2b.由图可知, 所有试验组的电渗流方向均流向阴极, 表明土壤颗粒表面带负电荷.累积电渗流量大小顺序为:EBR-Bcs>EBR-Ecs>EBR-Bs>Control, 最大累积电渗流量为87.27 mL.试验组EBR-Ecs、EBR-Bs和EBR-Bcs的电渗流变化趋势基本一致, 对照组在试验期间几乎没有电渗流产生, 说明耐镉细菌的加入能增强电渗流作用.
3.3 处理后土壤pH和电导率的变化经过电动-微生物处理/电动处理后土壤pH值的分布见图 3a.4组处理的土壤截面pH变化趋势基本相同, pH值从阳极到阴极逐渐上升, 阳极附近土壤(S1)pH对比土壤初始值均下降了1.2~1.6个单位.由于实验控制阴极池溶液pH为6.0~7.0, 且供试土样红壤本身为酸性土壤, 对OH-具有较强的缓冲能力, 因此土壤各截面pH < 7, 且大多低于土壤初始pH值.与其他处理组相比, EBR-Ecs的pH较高, 对照组在S4、S5截面中pH值也很高.试验组EBR-Bs和EBR-Bcs在土壤各截面的pH值比较接近.因为阳极附近pH值较小, 土壤易出现酸化现象使阳极区可溶性物质增多, 造成阳极附近土壤电导率偏高.如图 3b所示, 各处理组的电导率从阳极到阴极逐渐下降, 对照组的电导率最低.
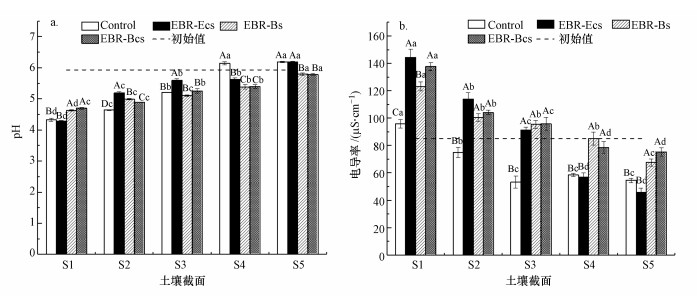 |
| 图 3 处理后土壤各截面的pH(a)和电导率分布(b)(大写字母表示各试验组间差异(p<0.05), 小写字母表示试验组内差异(p<0.05), 下同) Fig. 3 Soil pH and electrical conductivity in soil after treatment |
处理后土壤中Cd的含量和形态分布如图 4所示.C1形态为弱酸提取态, C2为可还原态, C3为可氧化态, 残留态Cd在本次试验中并未检出.由图中可得出, 靠近阳极区域的土壤中各形态Cd含量较初始值都明显减少, 土壤中剩余Cd含量从阳极到阴极基本呈现逐渐上升的趋势.从表 4可知, 总Cd去除率的大小排序为:EBR-Bcs(30.77%)> EBR-Bs(28.45%)> EBR-Ecs(18.87%)> Control(11.24%).
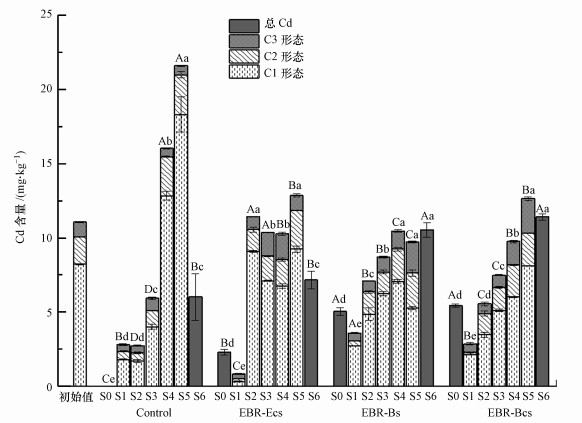 |
| 图 4 处理后土壤各截面Cd含量及分布 (土样从阳极到阴极等距平均分为5份, 记为S1~S5, S0表示阳极液, S6表示阴极液) Fig. 4 Profiles and fractions of Cd in soil after treatments |
| 表 4 不同试验组的总Cd去除率 Table 4 The removal efficiency of total Cd of various treatment |
对照处理中, C1, C2态Cd的含量在S1~S3截面虽然有显著降低, 却集中分布在阴极附近, S5中C1态Cd比初始Cd含量高2倍.接种芽胞杆菌 Bacillus sp.和蜡样芽胞杆菌Bacillus cereus strain的试验组, 各形态Cd含量和分布较为相似, Cd有明显迁移, 大部分截面的Cd含量低于初始值.EBR-Ecs处理中, Cd在S1截面分布非常少, 但在S2~S5截面几乎没有迁移, Cd含量仅在初始值上下波动.
3.5 能耗估计试验组Control、EBR-Ecs、EBR-Bs、EBR-Bcs的总电能消耗量分别为354.20、361.89、303.38、286.95 kW · min, 单位修复能耗为165.48、100.70、55.96、48.94 kW · min · mg-1.
4 讨论(Discussion)电动技术修复重金属污染土壤时, 污染物主要通过电迁移、电渗、电泳3种途径迁出土壤(Lu et al., 2012;樊广萍等, 2015).电迁移指带电离子在电场作用下向其所带电荷相反的方向移动(Cameselle et al., 2016);电渗流指土壤孔隙水及其所带双电层在电场作用下做相对土壤带电表层的移动(Shi et al., 2010);电泳指土壤中带电胶体颗粒如细小土壤颗粒, 腐殖质和微生物相对于稳定液体的运动(周东美等, 2003).如图 2所示对照组几乎没有电渗流, Cd2+主要以电迁移的方式往阴极移动至S4和S5截面(图 4), Cd未能被迁出土壤, 在阴极区域出现“聚焦现象”.由表 5可知pH与各形态Cd及总Cd含量均成显著性正相关, 这是由于阴极发生还原反应生成OH-和H2, 阴极区出现OH-的积累, 在电场作用下往阳极迁移, 从而改变土壤的pH值以及Cd的移动(俞一统等, 2009;Yan et al., 2015).当从阳极迁往阴极的Cd2+遇到阴极产生的OH-时, 两者发生沉淀反应生成Cd(OH)2, 导致Cd在土壤中无法移动, 这与之前报道的传统电动修复中重金属容易在阴极生成沉淀难以迁移的研究一致(李文娟等, 2018;Gu et al., 2018).
| 表 5 土壤理化性质与Cd各形态含量的相关性关系 Table 5 Correlation between the physicochemical properties of soil and the contents of Cd forms |
由于耐镉细菌会吸附Cd(菌株A-1、B-1、C-1对Cd2+的吸附率分别为19.40%、30.55%、37.36%), 因此在电动-微生物联合修复中, 耐镉细菌的迁移方式会影响Cd在电场下的迁移.耐镉细菌在电场作用下主要有两种迁移方式:电泳和电渗.由于土壤初始pH大于细菌等电点(pH为4~5)(周群英等, 2000), 耐镉细菌进入土壤后表面会带负电荷, 在电场中以电泳的方式向阳极移动, 如图 4所示接种耐镉细菌试验组的阳极液中Cd含量要高于对照组.另一方面因为接种耐镉细菌试验组的电渗流量和阴极液中Cd含量均高于对照组(图 2和图 4), 且相关性分析显示电渗流与C1态、C3态Cd含量呈正相关, 说明加入耐镉细菌会增强电动过程中的电渗作用, 耐镉细菌同时随着电渗流流向阴极(Virkutyte et al., 2002).通过比较不同土壤截面上可培养细菌的数量发现试验组EBR-Ecs、EBR-Bs、EBR-Bcs中可培养细菌数都呈现出阳极区域>中间区域>阴极区域的趋势, 这说明在电泳与电渗的综合作用下, 由于耐镉细菌在电场中迁移时电泳作用大于电渗作用, 耐镉细菌向阳极迁移的数量大于向阴极迁移的数量(Azhar et al., 2016).许伟等研究施加电场后枯草芽孢杆菌在土壤中的迁移方向和速率时也发现, 枯草芽孢杆菌向阳极迁移的速率为13.5 cm · d-1大于向阴极迁移速率7.5 cm · d-1, 这表明枯草芽孢杆菌在电场作用下主要通过电泳方式向阳极迁移, 同时还受电渗流作用流向阴极(许伟等, 2011).可见电动-微生物联合修复技术能通过增强电动过程中电泳和电渗效应, 从而促进土壤中Cd的迁移, 提高Cd去除率.
试验组EBR-Ecs、EBR-Bs、EBR-Bcs均为电动-微生物修复, 由于接种的耐镉细菌在生理生化和耐镉特性上存在差异, 如革兰氏染色、生长温度、生长条件与pH的关系以及对Cd的吸附等, 3组处理中Cd的迁移和转化并不相同.EBR-Bs和EBR-Bcs的Cd去除率比EBR-Ecs高, 证明芽孢杆菌属比大肠杆菌属更适用于电动-微生物修复, 认为主要是由3种细菌对Cd吸附量不同和它们革兰氏染色的差异造成的.试验结果显示, 蜡样芽孢杆菌和芽孢杆菌的最大Cd耐受浓度和对Cd2+的吸附率均大于大肠杆菌.程静, 刘红娟、Kulkarni等的研究也证实芽孢杆菌对重金属离子吸附效果明显(程静, 2008;刘红娟等, 2010;Kulkarni et al., 2014).在电动过程中菌株C-1比菌株B-1和A-1能吸附更多的Cd向外迁移, 所以接种蜡样芽孢杆菌的试验组中土壤剩余Cd含量更少.另一方面, 试验所筛选的耐镉细菌中芽孢杆菌和蜡样芽孢杆菌为革兰氏阳性菌, 大肠杆菌为革兰氏阴性菌.已知革兰氏阳性菌等电点比阴性菌低, 同一pH条件下革兰氏阳性菌所带负电荷会更多, 因此芽孢杆菌属与Cd2+的结合力比大肠杆菌属更强, 认为这也是造成试验组EBR-Ecs、EBR-Bs、EBR-Bcs中Cd的迁移和去除不同的原因.
表 6结果可看出试验组EBR-Bs和EBR-Bcs中C1态Cd比例下降, C2和C3态Cd比例上升, 结合总Cd的去除率, 认为迁出土壤的重金属形态主要是弱酸提取态, 且芽孢杆菌的添加使C1形态Cd向C2和C3态Cd转化.C1态Cd是由水溶态和可交换态构成, 它在所有形态中活性最强, 容易被植物根部吸收, 生物有效性最高(Petruzzelli et al., 2013).C2、C3形态分别为Fe-Mn氧化物结合态Cd, 有机物和硫化物结合态Cd, 这两种形态比较稳定, 流动性低, 难以被植物吸收利用(Passarini et al., 2001).芽孢杆菌进入土壤后不仅会吸附土壤中的Cd, 还能通过影响土壤理化性质而降低有效态Cd含量, 从而减弱土壤中Cd的生物毒性(Jézéquel et al., 2008;余劲聪等, 2016).纪宏伟等的研究也发现枯草芽孢杆菌能降低土壤中5.07%~42.63%的有效态Cd含量, 且随着培养时间延长, 枯草芽孢杆菌对土壤的钝化效果更明显(纪宏伟等, 2015).
| 表 6 不同处理后不同形态Cd的质量分数 Table 6 The proportion of different forms of Cd after various treatment |
从能耗角度上分析, 总电耗能的大小顺序为EBR-Ecs>Control >EBR-Bs>EBR-Bcs.单位修复耗能是指去除每mg重金属Cd所需要消耗的电能, 它比总电耗更能较好地评估试验的效益性, 其大小排序为:Control> EBR-Ecs>EBR-Bs>EBR-Bcs.电动-微生物联合修复比传统电动修复所消耗的单位修复耗能少, 且接种蜡样芽孢杆菌的试验组单位修复耗能只有48.94 kW · min · mg-1, 比传统电动修复节省60%.这表明电动-蜡样芽孢杆菌联合修复技术的经济效益和可行性较高.
5 结论(Conclusions)1) 电动-微生物联合修复中耐镉细菌的加入能增强电渗和电泳作用, 相比于传统电动修复, 接种Escherichia coli strain、Bacillus sp.、Bacillus cereus strain试验组的Cd去除率分别增加7.63%、17.21%、19.53%;单位修复能耗分别降低64.78、109.52、116.54 kW · min · mg-1.
2) 由于耐镉细菌Bacillus cereus strain比Escherichia coli strain和Bacillus sp.对Cd吸附量高, 蜡样芽孢杆菌Bacillus cereus strain与电动技术联用时修复修复效果最佳, 总Cd去除率为30.77%, 单位修复耗能为48.94 kW · min · mg-1.同时蜡样芽孢杆菌还能降低土壤中有效态Cd含量, 从而减少土壤中Cd的生物可利用度.
Azhar A T S, Nabila A T A, Nurshuhaila M S, et al. 2016. Electromigration of contaminated soil by electro-bioremediation technique[J]. IOP Conference Series:Materials Science and Engineering, 136(1): 012023. |
程静. 2008.枯草芽孢杆菌对水相中Cu2+和Cd2+的生物吸附[D].沈阳: 东北大学 http://d.wanfangdata.com.cn/thesis/Y1840956
|
Cameselle C, Pena A. 2016. Enhanced electromigration and electro-osmosis for the remediation of an agricultural soil contaminated with multiple heavy metals[J]. Process Safety and Environmental Protection, 104: 209-217. DOI:10.1016/j.psep.2016.09.002 |
DeFlaun M F, Condee C W. 1997. Electrokinetic transport of bacteria[J]. Journal of Hazardous Materials, 55(1/3): 263-277. |
樊广萍, 朱海燕, 郝秀珍, 等. 2015. 不同的增强试剂对重金属污染场地土壤的电动修复影响[J]. 中国环境科学, 35(5): 1458-1465. DOI:10.3969/j.issn.1000-6923.2015.05.024 |
Gu Y Y, Zhao C, Li H, et al. 2018. The enhancement of synthesized wastewater on non-uniform electrokinetic remediation of a Cd-spiked natural clayey soil[J]. Environmental Science & Pollution Research, 25(2): 1103-1114. |
Jézéquel K, Lebeau T. 2008. Soil bioaugmentation by free and immobilized bacteria to reduce potentially phytoavailable cadmium[J]. Bioresource Technology, 99(4): 690-698. DOI:10.1016/j.biortech.2007.02.002 |
纪宏伟, 王小敏, 庞宏伟, 等. 2015. 枯草芽孢杆菌与巨大芽孢杆菌对土壤有效态Cd的影响研究[J]. 水土保持学报, 29(3): 325-329. |
Kulkarni R M, Shetty K V, Srinikethan G. 2014. Cadmium (II) and nickel (II) biosorption by Bacillus laterosporus (MTCC 1628)[J]. Journal of the Taiwan Institute of Chemical Engineers, 45(4): 1628-1635. DOI:10.1016/j.jtice.2013.11.006 |
Ludwig W, Schleifer K H, Whitman W B. 2009. Taxonomic outline of the phylum Firmicutes[M]. Bergey's Manual of Systematics of Archaea and Bacteria
|
刘红娟, 党志, 张慧, 等. 2010. 蜡状芽孢杆菌抗重金属性能及对镉的累积[J]. 农业环境科学学报, 29(1): 25-29. |
Lu P, Feng Q, Meng Q, et al. 2012. Electrokinetic remediation of chromium-and cadmium-contaminated soil from abandoned industrial site[J]. Separation and Purification Technology, 98: 216-220. DOI:10.1016/j.seppur.2012.07.010 |
罗琼, 王昆, 许靖波, 等. 2014. 我国稻田镉污染现状·危害·来源及其生产措施[J]. 安徽农业科学, 42(30): 10540-10542. DOI:10.3969/j.issn.0517-6611.2014.30.040 |
李文娟, 王平, 徐海音, 等. 2018. 不同增强剂的电动技术对土壤中镉去除及土壤酶活性的影响[J]. 环境工程学报, 12(8): 2320-2327. |
Passarini F, Pavoni B, Ugo P. 2001. Chemical analyses of heavy metal contamination in sediments of the Venice Lagoon and toxicological implications[J]. Annali di chimica, 91(7/8): 471-478. |
Petruzzelli G, Pedron F, Pezzarossa B. 2013. From conceptual model to remediation: bioavailability, a key to clean up heavy metal contaminated soils[C]. EGU General Assembly Conference Abstracts, 15
|
Rinaldi M, Micali A, Marini H, et al. 2017. Cadmium, organ toxicity and therapeutic approaches:a review on brain, kidney and testis damage[J]. Current Medicinal Chemistry, 24(35): 3879-3893. |
Shi W X, Zhao Z W, Zhao L Y, et al. 2010. Cadmium removal and electroosmotic flow during electrokinetic remediation of contaminated soil[J]. Advanced Materials Research, 113-116: 2237-2240. DOI:10.4028/www.scientific.net/AMR.113-116.2237 |
孙婕妤, 刘艳秋, 李佰林, 等. 2018. 植物对镉的耐性机制以及对镉污染土壤修复的研究进展[J]. 江苏农业科学, 46(7): 12-19. |
Virkutyte J, Sillanpää M, Latostenmaa P. 2002. Electrokinetic soil remediation-critical overview[J]. Science of the Total Environment, 289(1/3): 97-121. |
Vizcaíno R L, Yustres A, Asensio L, et al. 2018. Enhanced electrokinetic remediation of polluted soils by anolyte pH conditioning[J]. Chemosphere, 199: 477-485. DOI:10.1016/j.chemosphere.2018.02.038 |
王京文, 李丹, 柳俊, 等. 2015. 耐镉菌株对土壤镉形态及土壤微生物群落结构的影响[J]. 农业环境科学学报, 24(9): 1693-1699. |
王友保. 2015.土壤污染与生态修复实验指导[M].芜湖: 安徽师范大学出版社
|
王宇, 李婷婷, 魏小娜, 等. 2016. 污染土壤电动修复技术研究进展[J]. 化学研究, 27(1): 34-43. |
许伟, 王翠苹, 张志远, 等. 2011. 均匀电场下两株多环芳烃降解菌在土壤中的迁移及电动注入[J]. 农业环境科学学报, 30(1): 60-64. |
Xu H, Luo Y, Wang P, et al. 2019. Removal of thallium in water/wastewater:A review[J]. Water Research, 165: 114981. DOI:10.1016/j.watres.2019.114981 |
俞一统, 田光明, 和苗苗, 等. 2009. 两种生物沥滤-电动修复联合技术的比较[J]. 环境科学学报, 29(1): 163-168. DOI:10.3321/j.issn:0253-2468.2009.01.025 |
Yan F, Reible D. 2015. Electro-bioremediation of contaminated sediment by electrode enhanced capping[J]. Journal of Environmental Management, 155: 154-161. |
余劲聪, 何舒雅, 曾润颖, 等. 2016. 芽孢杆菌修复土壤重金属镉污染的研究进展[J]. 广东农业科学, 43(1): 73-78. DOI:10.3969/j.issn.1004-874X.2016.01.014 |
袁金蕊, 郭富睿, 邹冬生, 等. 2018. 镉对土壤微生物的影响及微生物修复镉污染研究进展[J]. 湖南农业科学, (3): 114-117. |
周群英, 高廷耀. 2000. 环境工程微生物学[M]. 北京: 高等敎育出版社.
|
周东美, 邓昌芬. 2003. 重金属污染土壤的电动修复技术研究进展[J]. 农业环境科学学报, 22(4): 505-508. DOI:10.3321/j.issn:1672-2043.2003.04.031 |
Zhou D M, Deng C F, Cang L, et al. 2005. Electrokinetic remediation of a Cu-Zn contaminated red soil by controlling the voltage and conditioning catholyte pH[J]. Chemosphere, 61(4): 519-527. DOI:10.1016/j.chemosphere.2005.02.055 |
Zimmerman A J, Weindorf D C. 2010. Heavy metal and trace metal analysis in soil by sequential extraction: a review of procedures[J]. International Journal of Analytical Chemistry, (3/4): 387803
|
 2020, Vol. 40
2020, Vol. 40


