2. 湖南省灌溉水源水质污染净化工程技术研究中心, 长沙 410128;
3. 农业农村部南方产地污染防控重点实验室, 长沙 410128
2. Hunan Engineering & Technology Research Center for Irrigation Water Purification, Changsha 410128;
3. Key Laboratory of Southern Farmland Pollution Prevention and Control, Ministry of Agriculture and Rural Affairs, Changsha 410128
锑(Sb)是一种广泛存在于土壤中的微量元素, 在采矿和冶炼过程中, 大量的含锑物质不合理排放, 从而对周围土壤、河流和含水层造成了严重的锑污染.锑在环境中以无机和有机形态存在, 其中, 锑的无机形态主要为Sb(Ⅲ)和Sb(Ⅴ), 其三价化合物毒性比五价化合物高10倍, 因此, 锑已被美国环境保护署和欧盟列为优先污染物, 其引起的毒性和致癌性也日趋严重, 对人类和动植物健康安全构成了严重威胁(季海冰等, 2003;何孟常等, 2004;席建红等, 2010).
土壤锑污染修复的方法主要包括:物理法、化学法、植物修复法、微生物法和农业生态修复技术等(张菊梅等, 2019), 其中, 微生物法具有去除速度快、资金投入少、操作简单和再生能力强等优点, 因而受到人们的广泛关注.近几十年来, 科研人员开展了大量的土壤耐重金属微生物筛选工作, 并研究微生物对重金属的吸附, 但目前针对Cd、Cu、Zn、Pb、As的研究较多, 有关耐锑细菌的报道还不多.罗国升(2011)在锑污染区筛选了12株Sb抗性细菌, 发现细菌种类多集中在Bacillus、Comamonas和Pseudomonas菌属.此外, 国内外其他学者也相继筛选出几种高耐锑细菌(Giri et al., 2013; Li et al., 2013; 2018; 聂孝红等, 2017).由于Sb(Ⅲ)的毒性远远高于Sb(Ⅴ), 因此, 现有的研究多关注锑氧化细菌的分离鉴定及氧化过程和机理(Nguyen et al., 2014; Terry et al., 2015), 很少有研究关注锑在细菌表面的初始吸附过程.胞外(细胞壁)吸附是细菌与锑作用的第一步, 细菌表面的大分子物质和官能团已被广泛证实能吸附络合重金属阳离子(Fein et al., 1997), 而何种组分和官能团在锑吸附过程中发挥作用目前还未见报道.
基于此, 本研究从锑尾渣土壤中筛选分离出几株耐锑细菌, 研究其生物学特性, 借助宏观吸附获得其吸附Sb的参数, 并利用X射线光电子能谱(XPS)研究与Sb络合的表面官能团, 以深入探讨锑在土壤耐性微生物表面的吸附机制, 为锑污染土壤修复提供理论基础.
2 材料与方法(Materials and methods) 2.1 材料土壤样品:锑矿尾渣土壤采自有“世界锑都”之称的湖南省冷水江市锡矿山(27°44′46″N, 111°27′39″E, 海拔为205 m)表层土壤(0~10 cm), 样品风干后过筛.经测定, 土壤pH为6.5(电极法, 水土比2.5 : 1), 锑含量为34.5 mg · kg-1.
牛肉膏蛋白胨培养基:10 g · L-1蛋白胨、3 g · L-1牛肉膏、5 g · L-1氯化钠、pH ~7.0.固体培养基则加入1.5%~2.0%的琼脂粉.
Sb(Ⅲ)、Sb(Ⅴ)母液分别由三氧化二锑(Sb2O3)和焦锑酸钾(K2H2Sb2O2 · 4H2O)配置.
2.2 耐锑菌株的分离鉴定与形貌特征称取10 g土壤样品, 加入到装有无菌水的三角瓶中振荡15 min, 使土壤与无菌水充分混合.静置后取上清液, 分别以2%的接种量逐步接种到含Sb(Ⅲ)和Sb(Ⅴ)的液体培养基中(200~800 mg · L-1).在锑浓度为800 mg · L-1的培养基中取1 mL菌液, 用无菌水以10倍比稀释后, 取0.1 mL涂布在相同锑浓度的固体培养基上.肉眼观察菌落生长情况, 分别挑选不同形态和生长良好的菌株, 通过平板划线进行纯化, 再将分离纯化的菌株逐步转接到含更高锑浓度的固体培养基中.在转接中, 不断选择适宜生长的菌株进行多次筛选、分离和纯化, 最终得到3株锑耐性最高(2000 mg · L-1)的菌株, 简单标记为TJ1、TJ2和TJ3.
3株耐锑菌的形态及生理生化鉴定:观察菌株的形态特征并根据菌株的形态特征, 按照《常见细菌系统鉴定手册》进行生理生化试验, 对分离纯化的细菌进行鉴定.
将细菌基因组DNA抽提后, 取5 μL提取液加入到2 μL Loading Buffer进行电泳检测.采用细菌16S rDNA的一对保守引物(正向引物27F:5′-AGA GTT TGA TCC TGG CTC AG-3′和反向引物1492R:5′-GGT TAC CTT GTT ACG ACT T-3′)进行PCR扩增.回收的扩增DNA片段由广州吉美公司测定序列, 测序结果在GenBank中进行同源比对, 构建系统发育树.
将菌体用2.5%的戊二醛溶液固定, 并用梯度浓度为30%、50%、70%、90%和100%的乙醇溶液依次进行脱水处理, 冷冻干燥.样品喷金后在透射电镜FEI-TEM(Technai G2 20, US)上记录形貌.
2.3 耐锑细菌生长特性研究准备不含锑和含锑(800 mg · L-1)的牛肉膏蛋白胨培养基, 高温灭菌后添加至生长曲线测定仪的接种盘, 每个孔450 μL.分别接种筛选出的3种耐锑菌(已活化7~8 h)至接种盘, 测定不同时间点的悬浮液OD600值, 绘制菌株生长曲线.
2.4 锑吸附试验设计将菌株接种在液体培养基中进行扩大培养, 离心收集, 并用0.1 mol · L-1 KCl溶液清洗菌株3次后重新悬浮.在50 mL离心管中加入一定体积的菌悬液和锑溶液, 用0.1 mol · L-1 KCl溶液定容到30 mL.控制最终吸附剂浓度为0.1 g · L-1, 锑浓度为1、3、5、10、20、30、50、60 mg · L-1, pH调节为6.5, 此pH为锑污染土壤pH, 以模拟实际土壤环境.样品摇匀后置于25 ℃恒温振荡箱中反应4 h后取出, 于4500 r · min-1下离心10 min, 上清液过0.2 μm滤膜, 利用ICP-OES测定Sb浓度, 底部胶状物进行XPS测定.
引入Langmuir方程拟合等温吸附数据, 公式如下:
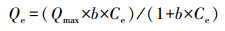
|
(1) |
式中, Qe为在平衡浓度(Ce)下细菌吸附锑量(mg · g-1);Qmax为理论最大吸附容量(mg · g-1);b为与吸附相关的结合常数, 可代表吸附亲和力(L · g-1).
2.5 XPS表征将细菌吸附Sb前后的样品在X射线光电子能谱仪(Thermo Fisher Scientific, US)上进行测定, 该仪器为单色化Al Kα X射线源(1486.6 eV), 能量范围为0~5000 eV, 束斑面积从900 μm到200 μm连续可调.在扫描C 1s和N 1s的高分辨率图谱时, 步长设为0.05 eV.利用XPSPEAK41软件拟合XPS光谱, C 1s峰(~284.8 eV)校准结合能.
3 结果与分析(Results and discussion) 3.1 菌株鉴定与表征3株菌的生理生化指标:革兰氏染色、运动型、葡萄糖发酵试验、淀粉水解试验、明胶水解试验、吲哚试验V-P试验, 均参照《伯杰氏细菌鉴定手册》, 研究发现, TJ1、TJ2、TJ3菌的生理生化特征分别与人苍白杆菌、芽孢杆菌和蜡状芽孢杆菌吻合.3株耐锑细菌系统发育进化树如图 1所示.由图可知, TJ1菌序列与人苍白杆菌(Ochrobactrum anthropi)16S rDNA序列的相似性达95%, TJ2菌序列与芽孢杆菌属(Bacillus sp.)序列的相似性达98%, TJ3菌序列与数据库中的蜡状芽孢杆菌(Bacillus cereus)16S rRNA序列相似性达96%.因此, TJ1、TJ2和TJ3菌分别为人苍白杆菌、芽孢杆菌和蜡状芽孢杆菌.将菌株序列提交GenBank数据库, 其登录号分别为MH345840、MH345839和MH345838.
 |
| 图 1 筛选的耐锑菌株(TJ1、TJ2、TJ3)16S rRNA序列系统发育树 Fig. 1 Phylogenetic tree of 16S rRNA sequences of the selected antimony-resistant bacteria (TJ1, TJ2, TJ3) |
3种菌株的TEM图像如图 2所示.由图可知, 3种菌均为杆状, 但尺寸有差异, 其中, 蜡状芽孢杆菌尺寸最大, 长约2.5 μm, 宽约1 μm;人苍白杆菌次之, 长约1.5 μm, 宽约0.5 μm;芽孢杆菌尺寸最小, 长约1 μm, 宽约0.3 μm.人苍白杆菌胞外胶状分泌物显著多于另外两株菌, 而芽孢杆菌属电子透射率较高, 胞内物质较明显, 暗示其细胞壁可能比另外两种细菌薄.
 |
| 图 2 人苍白杆菌(a、b)、芽孢杆菌(c、d)和蜡状芽孢杆菌(e、f)的透射电镜(TEM)图谱 Fig. 2 TEM images of Ochrobactrum anthropi (a, b), Bacillus sp. (c, d) and Bacillus cereus (e, f) |
3种菌株的生长曲线如图 3所示, 在无锑存在时, 3种细菌几乎都没有生长延滞期, 代谢旺盛并很快进入对数生长期;人苍白杆菌和蜡状芽孢杆菌在10 h左右进入稳定期, 芽孢杆菌约在40 h时进入稳定期.当营养液中存在锑时, 3株菌的生长延滞期都有不同程度的增加:人苍白杆菌增加到5 h, 芽孢杆菌属增加到2 h, 而蜡状芽孢杆菌最长, 约为20 h.这一结果表明, Sb的存在会不同程度地抑制细菌在初期的生物活性.随着时间增加, 3株菌都能进入指数生长期并达到稳定, 且本研究发现, 在有Sb存在时, 细菌在稳定期的OD600值都大于无Sb存在时的OD600值, 表明3种细菌都能在锑胁迫下形成可观的生物量.
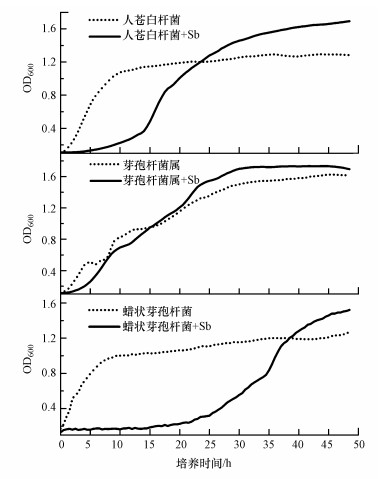 |
| 图 3 耐锑细菌的生长曲线 Fig. 3 Growth curves of antimony-resistant bacteria in the presence and absence of antimony |
图 4为3种耐锑细菌在pH=6.5条件下对Sb(Ⅲ)和Sb(Ⅴ)的等温吸附结果.由图可知, 随着Sb平衡浓度的升高, Sb的吸附量先快速升高, 随后达到平衡.对比3种不同细菌发现, 蜡状芽孢杆菌对Sb的吸附能力高于另外两株细菌;3株细菌对Sb(Ⅲ)的吸附量都略高于Sb(Ⅴ), 但差异不大.Langmuir模型可以很好地拟合Sb的等温吸附, R2>0.95(表 1), 故推测3种细菌对锑的吸附属于单分子层吸附(苏艳蓉等, 2011).通过拟合得到最大吸附容量:蜡状芽孢杆菌对Sb(Ⅲ)和Sb(Ⅴ)的理论最大吸附量分别约为14.3 mg · g-1和13.8 mg · g-1, 芽孢杆菌分别约为12.0 mg · g-1和11.9 mg · g-1, 人苍白杆菌分别约为11.3 mg · g-1和11.0 mg · g-1(表 1).Sb与细菌的亲和力(b)介于0.05~0.10(表 1).由等温吸附结果可知, 筛选的3株细菌理论最大吸附容量约为1%.
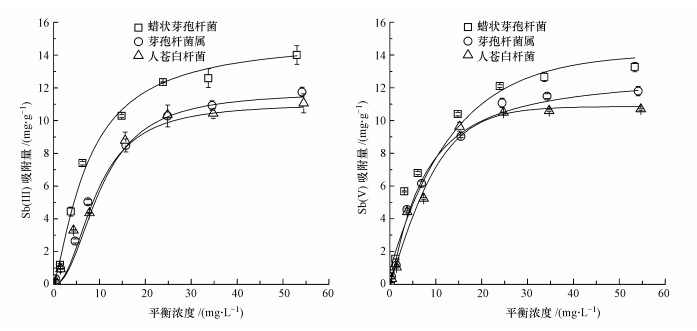 |
| 图 4 3种耐锑细菌对Sb(Ⅲ)和Sb(Ⅴ)的等温吸附(实线为Langmuir方程拟合曲线) Fig. 4 Adsorption isotherms of Sb(Ⅲ) and Sb(Ⅴ) to three antimony-resistant bacteria (solid lines are the Langmuir model fits) |
| 表 1 3种耐锑菌对Sb(Ⅲ)和Sb(Ⅴ)的等温吸附参数 Table 1 Langmuir parameters for Sb(Ⅲ) and Sb(Ⅴ) adsorption to three antimony-resistant bacteria |
因蜡状芽孢杆菌与芽孢杆菌均属于革兰氏阳性菌(汤显春等, 1999), 人苍白杆菌为革兰氏阴性菌(刘志国等, 2015), 因此, 只选择芽孢杆菌属和人苍白杆菌作为代表研究锑的吸附机理.图 5为芽孢杆菌和人苍白杆菌吸附Sb(Ⅲ)和Sb(Ⅴ)前后的C 1s和N 1s的XPS光谱.由图可知, C 1s峰可分为3个组分:C—(C, H), 位于约285 eV处, 主要代表脂质或者氨基酸的侧链;C—(O, N), 位于约286.2 eV处, 猜测为醇、氨和酰胺;C O/O—C—O, 位于约288.2 eV处, 主要包括羧基、脂基.芽孢杆菌吸附Sb后C O/O—C—O组分含量由16%分别下降到11%(Sb(Ⅲ))和13%(Sb(Ⅴ));人苍白杆菌吸附Sb后C O/O—C—O组分含量也有不同程度下降, 这表明羧基可能参与了锑的络合.N 1s峰分为非质子化氨基(Nnonpr, ~399.8 eV)和质子化胺基(Npr, ~401.3 eV);芽孢杆菌吸附Sb后质子化氨基含量由43%分别下降到33%(Sb(Ⅲ))和32%(Sb(Ⅴ)), 人苍白杆菌吸附锑后质子化氨基含量由31%分别下降到14%(Sb(Ⅲ))和25%(Sb(Ⅴ)), 这一结果表明氨基也参与了Sb的吸附.综上所述, 革兰氏阳性和阴性细菌都主要通过羧基和氨基参与Sb的吸附反应:羧基可能通过形成Sb—O—C键吸附Sb, 而氨基可能通过质子化氨基(R-NH3+)与Sb离子静电吸附.
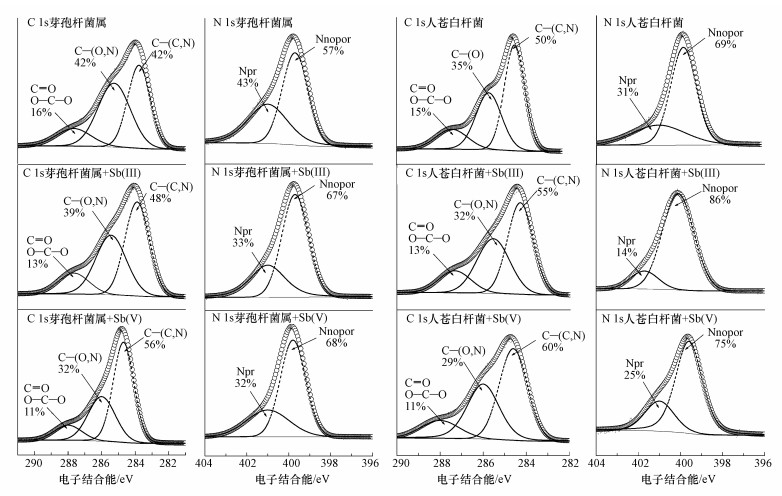 |
| 图 5 芽孢杆菌与人苍白杆菌吸附Sb(Ⅲ)和Sb(Ⅴ)前后的高分辨率C 1s与N 1s XPS光谱 Fig. 5 High-resolution C 1s and N 1s XPS of Bacillus sp. and Ochrobactrum anthropic before and after adsorbing Sb(Ⅲ) or Sb(Ⅴ) |
微生物修复是当下土壤污染修复的研究热点, 而重金属耐性菌株筛选与吸附研究越来越受到重视.相对于研究较多的Cd、Cu、Pb、As, 有关锑(Sb)污染土壤微生物修复的机理研究和实践工作还很少.本研究筛选分离了3株耐锑细菌(人苍白杆菌、芽孢杆菌、蜡状芽孢杆菌), 最高耐锑浓度可达2000 mg · L-1, 且在锑存在下, 3株细菌都能进入对数生长期, 并最终形成可观的生物量, 这表明筛选的菌株在锑污染环境中有极强的适应性, 暗示其具有良好的应用潜力.最近聂孝红等(2017)在锑污染土壤中筛选出了假单胞菌、剑菌属、拉乌尔菌属和寡养单胞菌, 且都具有较高的锑耐性, 结合本研究筛选的3株菌, 可推测土壤中可能存在不同菌属的高耐锑性细菌, 但它们在土壤中的丰度可能千差万别.因此, 后期研究需关注锑污染土壤中丰度较高的优势耐锑微生物菌群.
等温吸附结果表明, 3种不同细菌对锑的理论最大吸附量约为1%, 这一吸附能力相较于微生物吸附Cd、Pb等离子要小很多(杜辉辉等, 2017).这种差异主要因为锑是以含氧酸根形式存在, 与细菌多存在静电斥力.此外, 细菌对Sb(Ⅲ)的吸附能力略高于Sb(Ⅴ), 这可能是由于Sb(Ⅲ)主要以Sb(OH)3的形式存在于溶液中, 而Sb(Ⅴ)以Sb(OH)6-的形式存在, Sb(Ⅴ)与细菌的静电斥力更强, 因而吸附量少.XPS结果表明, 细菌主要通过细胞壁或胞外EPS上的羧基和氨基络合Sb, 相似的结果也在藻类吸附锑体系中发现(Sun et al., 2014;孙福红等, 2016).虽然革兰氏阳性细菌和革兰氏阴性细菌在细胞壁结构上存在差异, 但这两类细菌对Sb的吸附机制相同, 因此推测在土壤细菌表面, 羧基和氨基是广谱性的Sb结合官能团.为进一步验证这些基团的作用, 未来的研究可采取一些手段, 如酯化反应(减少质子化羧基数量), 探究锑吸附量的差别.本研究从宏观和微观层面阐释了土壤细菌吸附锑的机理, 为更好地发挥其在污染土壤修复中的作用提供了理论支撑.
5 结论(Conclusions)1) 经筛选和鉴定得到3株对锑耐性较高的菌株, 分别为人苍白杆菌(Ochrobactrum anthropi)、芽孢杆菌属(Bacillus sp.)和蜡状芽孢杆菌(Bacillus cereus), 且3株细菌都能在高浓度锑营养液中保持活性, 并产生可观的生物量.
2) 3种细菌对锑的吸附符合Langmuir模型, 对锑的吸附量约为11.0~14.3 mg · g-1, 且对Sb(Ⅲ)的吸附量略高于Sb(Ⅴ).在细菌吸附Sb过程中, 羧基和氨基发挥主导作用.
杜辉辉.2017.Cd(Ⅱ)、Pb(Ⅱ)在土壤矿物-有机互作界面的分子结合机制[D].武汉: 华中农业大学 http://cdmd.cnki.com.cn/Article/CDMD-10504-1017171681.htm
|
Fein J B, Daughney C J, Yee N, et al. 1997. A chemical equilibrium model for metal adsorption onto bacterial surfaces[J]. Geochimica et Cosmochimica Acta, 61: 3319-3328. |
Giri A K, Patel R K, Mahapatra S S, et al. 2013. Biosorption of arsenic (Ⅲ) from aqueous solution by living cells of Bacillus cereus[J]. Environmental Science & Pollution Research, 20(3): 1281-1291. |
何孟常, 万红艳. 2004. 环境中锑的分布、存在形态及毒性和生物有效性[J]. 化学进展, 16(1): 131-135. |
季海冰, 何孟常, 赵承易. 2003. 环境中锑的形态分析研究进展[J]. 分析化学, 31(11): 1393-1398. |
Li J, Wang Q, Zhang S, et al. 2013. Phylogenetic and genome analyses of antimony-oxidizing bacteria isolated from antimony mined soil[J]. International Biodeterioration & Biodegradation, 76(76): 76-80. |
Li J, Yu H, Wu X, et al. 2018. Novel hyper antimony-oxidizing bacteria isolated from contaminated mine soils in China[J]. Geomicrobiology Journal, 35(8): 1-8. |
刘志国, 崔步云, 夏咸柱. 2015. 人苍白杆菌研究进展[J]. 微生物学报, 55(8): 977-982. |
罗国升.2011.矿区土壤抗砷/锑细菌多样性研究与抗砷/锑细菌的多相分类学鉴定[D].武汉: 华中农业大学 http://cdmd.cnki.com.cn/Article/CDMD-10504-1011405456.htm
|
Nguyen V K, Lee J U. 2014. Isolation and characterization of antimony-reducing bacteria from sediments collected in the vicinity of an antimony factory[J]. Geomicrobiology Journal, 31: 855-861. |
聂孝红, 尹昊, 郭东矗, 等. 2017. 四株耐锑细菌的生物学特性及其对油菜在锑污染土壤中的促生作用[J]. 生态学杂志, 36(6): 1658-1666. |
苏艳蓉.2011.重金属耐受菌的分离及吸附铅的研究[D].长沙: 中南大学 http://cdmd.cnki.com.cn/Article/CDMD-10533-1012305217.htm
|
孙福红, 廖海清, 陈艳卿, 等. 2016. 微囊藻对锑(Ⅴ)生物吸附作用研究[J]. 中国环境科学, 36(11): 3383-3389. |
Sun F, Yan Y, Liao H, et al. 2014. Biosorption of antimony(Ⅴ) by freshwater cyanobacteria Microcystis from Lake Taihu, China:effects of pH and competitive ions[J]. Environmental Science & Pollution Research, 21(9): 5836-5848. |
Terry L R, Kulp T R, Wiatrowski H, et al.2015 Microbiological oxidation of antimony(Ⅲ) with oxygen or nitrate by bacteria isolated from contaminated mine sediments[J].Applied Environmental Microbiology, 81: 8478-8488
|
汤显春, 陈绳亮, 罗勤, 等. 1999. 广西四川金矿床区土壤样品中蜡状芽孢杆菌的分离和鉴定[J]. 华中师范大学学报(自然科学版), 2: 271-277. |
席建红, 何孟常, 林春野, 等. 2010. Sb(Ⅴ)在三种矿物表面的吸附行为[J]. 土壤通报, 41(1): 38-42. |
张菊梅, 刘灵飞, 龙健, 等. 2019. 土壤锑污染及其修复技术研究进展[J]. 环境科学与技术, 42(4): 61-70. |
 2020, Vol. 40
2020, Vol. 40


