2. 哈尔滨工业大学环境学院, 哈尔滨 150090
2. School of Environment, Harbin Institute of Technology, Harbin 150090
玉米淀粉生产废水是以玉米为原料生产淀粉过程中产生的高浓度有机废水, 含有大量的碳水化合物和氮、磷等营养元素, COD高达8000~30000 mg·L-1, BOD为5000~20000 mg·L-1(Zhao et al., 2011).由于玉米淀粉生产废水的可生化性较高, 因此生物处理法是处理玉米淀粉生产废水的主要方法.目前普遍采用厌氧+好氧的综合工艺, 如:升流式厌氧污泥床反应器(UASB)+接触氧化、UASB+A/O等(李艳春2009;韩雪琴, 2013;杨卫等, 2015).其中, 厌氧生物处理单元在玉米淀粉废水处理过程中发挥着关键作用.
有机物厌氧消化是在产酸发酵菌群、产氢产乙酸菌群、同型产乙酸菌群和产甲烷菌群的代谢活动下完成的(张立国等, 2018).其中, 产甲烷菌群位于厌氧消化“食物链”末端, 它将其他菌群代谢产生的H2/CO2、乙酸、甲酸等简单化合物转化为甲烷, 是决定有机物去除效能的关键菌群(任南琪等, 2013).因此, 它们的活性对于维持厌氧消化系统高效稳定运行具有重要意义.
厌氧折流板反应器(ABR)是由一系列垂直的折流板组成的生物反应器(刘梦林等, 2016).ABR的特殊结构使其具有较强的抗冲击负荷能力, 适于处理各种高浓度有机废水(郭昱廷等, 2012;赵丽等2017).本研究将ABR用于处理玉米淀粉生产废水, 探讨有机负荷率(OLR)对ABR处理效能的影响, 并采用间歇培养方式考察ABR处理玉米淀粉生产废水过程中, 其沿程格室不同营养类型产甲烷菌群对OLR提高的响应规律.
2 材料与方法(Materials and methods) 2.1 ABR反应器运行调控如图 1所示, ABR由有机玻璃制成, 为等容积四格室(分别记作C1、C2、C3、C4)结构, 总有效容积为18 L.反应器外壁缠绕加热丝, 并由温控仪将系统内温度控制为(35±1) ℃.在C4后设有水位控制箱(1.5 L), 使4个格室的水位保持一致.各格室的发酵气单独收集, 并由湿式气体流量计计量.在每个格室水面下5 cm处、中间和底部分别设有取样口各一个.废水经蠕动泵从C1的下部进入, 然后以折流方式依次流经C2、C3和C4, 最后由水位控制箱排出.
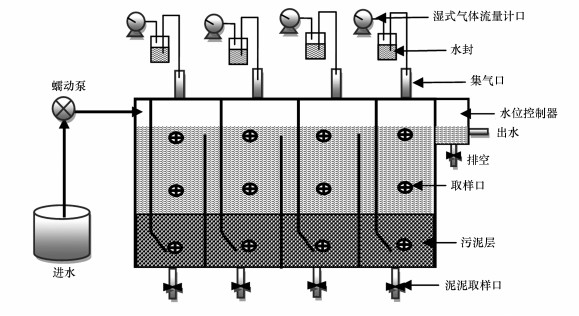 |
| 图 1 ABR装置示意图 Fig. 1 Schematic diagram of ABR |
试验废水取自当地某玉米淀粉生产企业, 其水质为:COD:8000~13000 mg·L-1, BOD5:5612~8354 mg·L-1, NH3-N:113~141 mg·L-1, 总磷:35~47 mg·L-1, SS:500~800 mg·L-1, pH:4.5~5.6.添加微生物生长所必须的微量元素及维生素等(Ban et al., 2013).C1和C2均采用城市污水处理厂二沉池污泥作为接种污泥, 其MLVSS/MLSS为0.63, 接种量分别为10.4、9.6 g·L-1;C3和C4的接种污泥为实验室UASB反应器颗粒污泥, 其MLVSS/MLSS为0.72, 接种量分别为11.3、10.9 g·L-1.
ABR的启动和调控运行共分为3个阶段.第一阶段为反应器的启动期, 控制参数为:温度为(35±1) ℃、水力停留时间(HRT)为36 h, 进水COD稀释为4000 mg·L-1(OLR=2.7 kg·m-3·d-1).运行31 d后, ABR达到稳定运行状态, 并进入第二运行阶段.在第二阶段, 其他控制参数不变, 通过提高进水COD为8000 mg·L-1, 将OLR增加至5.3 kg·m-3·d-1左右并持续运行48 d.第三运行阶段, 将进水COD提高到12000 mg·L-1左右, 使OLR达到8.0 kg·m-3·d-1并持续运行55 d.每次OLR的提高, 均在前一运行阶段达到稳定状态后进行.整个启动和调控运行期间, 采用投加NaHCO3的方式将进水的pH值调节为7.0±0.5.
2.2 活性污泥产甲烷活性分析OLR对ABR各格室产甲烷活性分析采用间歇培养方式进行.首先通过沉降的方式使ABR反应器中不同格室厌氧污泥浓缩, 然后加入磷酸缓冲液稀释成相同浓度.实验容器为200 mL厌氧瓶.每个厌氧瓶中加入10 mL厌氧污泥(MLVSS为2.6 g·L-1)和40 mL液体培养基, 其中碳源分别为H2/CO2(150 mL、体积比4:1)或乙酸(1000 mg·L-1).将培养液pH值用1 mol·L-1 HCl或1 mol·L-1 NaOH调至反应器相应值.然后将厌氧瓶置于空气浴摇床进行静态摇甁试验.每个样品做3个平行样, 数据分析取其平均值.每12 h测定一次产气量和气体组成.
2.3 动力学参数拟合ABR各格室活性污泥的产甲烷动力学参数分析参照Gompertz模型.公式见式(1).
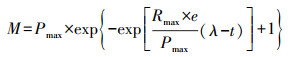
|
(1) |
式中, M为反应t (h)累计甲烷产量(mL), Pmax为最大产甲烷量(mL), Rmax为最大产甲烷速率(mL·h-1), λ为延迟时间(h).将累计甲烷产量和相应反应时间代入公式, 用统计软件Origin 9.0计算出Pmax、Rmax、λ(张立国等, 2016).
2.4 分析项目及方法pH值、SS、NH3-N、总磷和生物量采用标准方法测定(国家环保局, 2002), ABR的产气量通过湿式气体流量计(LML-1, 长春汽车滤清器有限责任公司)测定, 间歇试验的甲烷发酵产气量通过10~50 mL的玻璃注射器排气计量.累计甲烷产量参照Owen法进行计算(Owen et al., 1979).气体组成和挥发酸组成采用气相色谱仪测定(GC-6800A, 山东鲁南瑞虹化工仪器有限公司)(Ban et al., 2013).
3 结果与讨论(Results and discussion) 3.1 OLR对ABR运行效能的影响ABR在(35±1) ℃、HRT 36 h和进水COD为4000 mg·L-1(OLR=2.7 kg·m-3·d-1)的条件下启动运行, 31 d后达到相对稳定状态, 稳定期平均COD去除率为92.5%(表 1).其中, C3对总COD去除的贡献率最大, 其去除率为51.0%.在OLR为2.7 kg·m-3·d-1条件下, C1和C2呈现出典型的产酸发酵特征, 其污泥的挥发酸(VFAs)比产率分别为0.72和0.76 kg·kg-1·d-1.相反, C3和C4中VFAs较前两个格室显著降低, 而甲烷含量却明显增加, 表现为典型的产甲烷特征, 其污泥的比产甲烷速率达98 L·kg-1·d-1以上.由表 1还可以看出, C1、C2、C3、C4的生物量分别为5.8、7.5、7.8和3.6 g·L-1, 而比产甲烷速率沿程呈现出先增加后降低的变化趋势, 并在第3格室达到最大值(120.6 L·kg-1·d-1).
| 表 1 不同OLR条件下ABR处理玉米淀粉生产废水的运行特征 Table 1 Performance under different OLR conditions of ABR treating corn starch processing wastewater |
当OLR从2.7 kg·m-3·d-1分阶段提高至8.0 kg·m-3·d-1时, C1和C2中的pH值有所降低, 而C3和C4中的pH值则略有升高(表 1).C1、C2、C4的VFAs较2.7 kg·m-3·d-1条件下增加了10.6%~40.4%, 而C3的VFAs含量随OLR提高呈现先降低后增加的变化趋势.尽管ABR C1~ C3的比产甲烷速率随OLR的提高呈现先增加后降低的变化趋势, 但C4的比产甲烷速率随OLR的提高不断增加, 同时每个格室的生物量均随OLR的增加而增加, 使得ABR在OLR为5.3和8.0 kg·m-3·d-1条件下的COD去除率达到了90.0%以上.然而, 孙晋刚等(2008)的研究表明, 当OLR为5.5 kg·m-3·d-1时, 采用UASB系统处理玉米淀粉废水时的COD去除率仅为80%.在OLR为7.0~8.0 kg·m-3·d-1条件下, UASB作为厌氧处理单元时的COD去除率为83%~84.5%(李亚峰等, 2010;韩雪琴, 2013).由此可见, 具有微生物相分离作用的ABR在处理玉米淀粉生产废水中具有显著优势.
由表 1可以看出, 在OLR为2.7~8.0 kg·m-3·d-1时, 该ABR系统的前两个格室(C1和C2)始终呈现产酸发酵特征, 为产酸相, 而后两个格室(C3和C4)表现为产甲烷特征, 为产甲烷相.已有的研究表明, 多数已分离鉴定的产甲烷菌生活在弱碱性环境中(pH 6.8~8.5)(Liu et al., 2008), 而C3和C4的pH值为7.3~7.7, 为产甲烷菌提供了适宜的pH环境.因此, ABR C3和C4的甲烷产量分别为4.2~11.3 L·d-1和1.6~2.2 L·d-1.尽管C1和C2中的pH值为5.8~6.4, 但仍然有少量(25.6%~36.7%)甲烷产生.研究表明, 一些氢营养型产甲烷菌可以在酸性条件生长(Horn et al., 2003;Williams et al., 2010).
3.2 OLR对氢营养型产甲烷菌群代谢活性的影响根据底物类型的不同, 厌氧消化器中主要的产甲烷菌群可分为氢营养型产甲烷菌群和乙酸营养型产甲烷菌群(Liu et al., 2008).除了底物类型不同外, 这两类产甲烷菌群的生态学特征也有明显的差异(Horn et al., 2003;Demirel et al., 2008;张立国等, 2016).为此, 本研究探讨了OLR对ABR沿程格室两类产甲烷菌群代谢活性的影响, 结果如图 2、图 3和表 2所示.
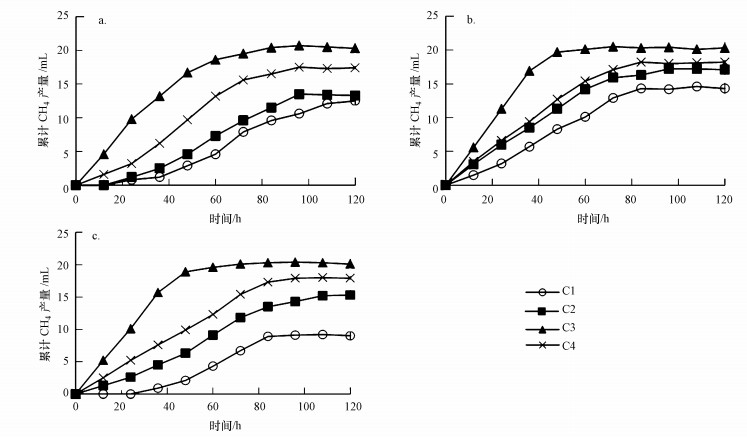 |
| 图 2 氢营养型产甲烷菌群的累计甲烷产量 ((a)、(b)、(c)分别是ABR在OLR 2.7、5.3和8.0 kg·m-3·d-1运行阶段的测试结果;C1、C2、C3、C4依次为ABR 4个格室的活性污泥) Fig. 2 Accumulative methane yield of hydrogenotrophic methanogens |
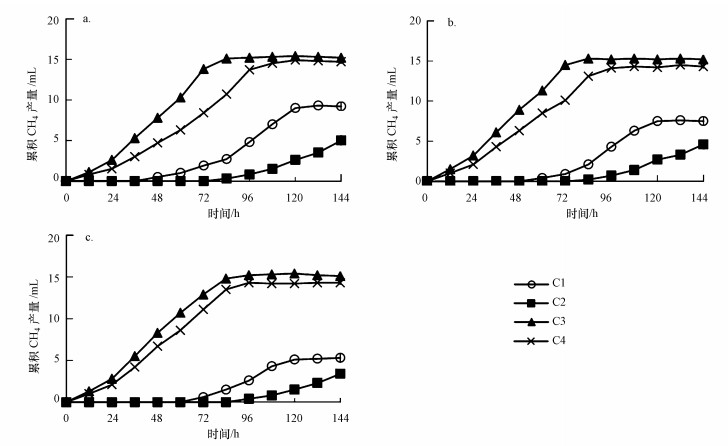 |
| 图 3 乙酸营养型产甲烷菌群的累计甲烷产量 ((a)、(b)、(c)分别是ABR在OLR 2.7、5.3和8.0 kg·m-3·d-1运行阶段的测试结果;C1、C2、C3、C4依次为ABR 4个格室的活性污泥) Fig. 3 Accumulative methane yield of acetotrophic methanogens under different OLR conditions |
| 表 2 ABR各格室活性污泥的产甲烷特征 Table 2 Methane production characteristics in each compartment of ABR under different OLR conditions |
对ABR各格室活性污泥的氢营养型产甲烷菌群代谢活性测试的结果(图 2和表 2)表明, 在OLR为2.7 kg·m-3·d-1条件下, C3和C4中的活性污泥在培养初期就表现出较高的产甲烷活性, 分别在培养84 h和96 h后累计甲烷产量达到最大值20.4 mL和17.4 mL.相反, C1和C2中的活性污泥在培养初期出现了短暂的停滞期, 随后累计产甲烷量开始逐渐增加, 表明氢营养型产甲烷菌经过12 h的适应, 其代谢活性缓慢恢复.累计产甲烷量最终分别稳定在12.5、13.5 mL左右.当OLR从2.7提高至5.3 kg·m-3·d-1时, ABR 4个格室的产甲烷速率显著提高.C3中的活性污泥在培养至第60 h时, 累计产甲烷量就达到了平台期, 为20.3 mL.而C1、C2和C4中的活性污泥的累计产甲烷量比OLR=2.7 kg·m-3·d-1条件下提高了4.6%~26.7%.当OLR进一步提高至8.0 kg·m-3·d-1时, 4个格室中活性污泥的氢营养型产甲烷活性有所下降.经过120 h的连续培养后, 从C1到C4中的污泥累计甲烷产量依次为:9.0、15.3、20.1和17.9 mL.类似地, 在一个处理丙酸合成废水的中温UASB反应器中, 当OLR为7.2 kg·m-3·d-1时, 其氢营养型产甲烷菌的累计甲烷产量24.7 mL(张立国等, 2016).
结合图 2和表 2可以发现, 在OLR为2.7~8.0 kg·m-3·d-1时, ABR的C3中氢营养型产甲烷菌群始终具有较高的产甲烷活性, 而其余格室活性污泥的累计产甲烷量随OLR的提高呈现出先增加后减少的变化趋势.尽管产酸相(C1和C2)的产甲烷活性低于产甲烷相(C3和C4), 然而所有样品的H2却被完全消耗, 说明C1和C2中氢营养型产甲烷菌群的活性受到抑制, 但仍有一定活性.由此可见, 在ABR产酸相中, 氢营养型产甲烷作用是可以实现的.然而, 当大豆蛋白生产废水作为底物时, ABR产酸格室中未检测到甲烷, 可能由于底物含有一定浓度的氨氮, 抑制了耐酸产甲烷菌的活性(Zhu et al., 2015;唐泽雨, 2016).
3.3 OLR对乙酸营养型产甲烷菌群代谢活性的影响如图 3所示, 在OLR为2.7为2.7~8.0 kg·m-3·d-1时, C3和C4中的乙酸营养型产甲烷菌群具有较高的活性, 经过84 ~96 h培养后, 累计甲烷产量达到14 mL以上.分析认为, C3和C4为产甲烷相(表 1), 其pH为7.3~7.7, 是乙酸营养型产甲烷菌适宜的pH环境, 经过ABR长期运行后, 污泥中乙酸营养型产甲烷菌群的数量较高.因此, 这两个格室的乙酸营养型产甲烷菌活性较高.然而, C1和C2中的乙酸营养型产甲烷菌群的活性明显低于C3和C4.由图 3可知, C1的活性污泥经过36~60 h的停滞期后, 累计产甲烷量开始逐渐增加, 最后稳定在5.3~9.2 mL.而C2的乙酸营养型产甲烷菌群的停滞期长达72~84 h, 经过144 h的培养后, 累计甲烷产量仅为3.4~5.0 mL.导致这种现象的可能原因如下:①C1和C2的pH较低(pH =5.8~6.4), 已有研究表明, 当pH < 6.2, 乙酸营养型产甲烷菌的代谢水平受到显著抑制(Demirel et al., 2008);②C1和C2为产酸相, 乙酸营养型产甲烷菌群的数量较少.
从表 2可以看出, 在不同OLR条件下, ABR 4个格室乙酸营养型产甲烷菌群的累计甲烷产量从大到小依次为:C3>C4>C1>C2.随着OLR分阶段从2.7 kg·m-3·d-1提高至8.0 kg·m-3·d-1时, C3和C4的乙酸营养型产甲烷菌群的活性相对稳定, 保持了较高的产甲烷能力.而C1和C2的乙酸营养型产甲烷菌的活性随着OLR的提高而不断下降.
3.4 产甲烷菌群的代谢动力学分析如表 3所示, 拟合系数(R2)均大于0.98, 表明Gompertz模型用来描述累计产甲烷量的进程是合理的.OLR为2.7 kg·m-3·d-1时, C1的氢营养型产甲烷菌群的最大甲烷产量(Pmax)、延迟时间(λ)和最大比产甲烷速率分别为14.0 mL、33.7 h和7.7 mL·g-1·h-1. C2的最大比产甲烷速率比C1高出10.4%, 而λ比C1减少了22.0%.C3和C4的最大比产甲烷速率显著高于C1和C2, 分别为16.5和11.9 mL·g-1·h-1.当OLR从2.7经由5.3提高至8.0 kg·m-3·d-1时, C1和C2中氢营养型产甲烷菌群的Pmax呈现先增加后降低的变化趋势, C3没有明显变化, 而C4随OLR增加逐渐提高.从表 3还可以看出, 随着OLR的提高, ABR 4个格室中氢营养型产甲烷菌群的最大比产甲烷速率均呈现先增加后降低的变化趋势.
| 表 3 产甲烷动力学分析 Table 3 Kinetic parameters of methane production |
对于乙酸营养型产甲烷菌而言, C1和C2的乙酸营养型产甲烷菌在低负荷(2.7 kg·m-3·d-1)条件下的Pmax和最大比产甲烷速率相对较高, 分别为11.0和13.0 mL及6.2和4.2 mL·g-1·h-1.随OLR分阶段提高至8.0 kg·m-3·d-1, C1的Pmax降低了48.2%, C3和C4的Pmax相对稳定, 而C2的Pmax表现出先降低后增加的变化趋势.从表 3还可以看出, 随着OLR的提高C1的最大比产甲烷速率呈现先增加后降低的变化趋势;C2和C3的最大比产甲烷速率相对稳定, 分别为3.5~4.2和10.0~10.8 mL·g-1·h-1;而C4的最大比产甲烷速率则表现为先降低后增加的趋势.
4 结论(Conclusions)1) 在35 ℃和HRT 36 h条件下, 当OLR从2.7分阶段逐步提高到8.0 kg·m-3·d-1时, 处理玉米淀粉生产废水的4格室ABR在运行稳定期的COD去除率为90%以上.
2) 在OLR为2.7~8.0 kg·m-3·d-1时, ABR表现出显著的生物相分离特征, 其中C1和C2的产酸发酵特征显著, 为产酸相, 而C3和C4则表现出典型的产甲烷特征, 为产甲烷相.
3) ABR C3中活性污泥的产甲烷活性最高, 其氢营养型和乙酸营养型产甲烷菌群的最大比产甲烷速率分别为16.5和10.0 mL·g-1·h-1以上;C1和C2的产甲烷活性相对较低, 两类产甲烷菌群的最大比产甲烷速率为7.7~10.8和3.5~7.3 mL·g-1·h-1.
Ban Q, Li J, Zhang L, et al. 2013. Syntrophic propionate degradation response to temperature decrease and microbial community shift in an UASB Reactor[J]. Journal of Microbiology and Biotechnology, 23: 382-389. DOI:10.4014/jmb.1210.10008 |
Demirel B, Scherer P. 2008. The roles of acetotrophic and hydrogenotrophic methanogens during anaerobic conversion of biomass methane:A review[J]. Review in Environmental Science and Biology, 7: 173-190. |
国家环保局. 2002. 水和废水监测分析方法[M]. 北京: 中国环境科学出版社, 27-30.
|
郭昱廷, 彭剑峰, 宋永会, 等. 2012. 温度对ABR反应器处理效果和微生物群落结构的影响[J]. 环境科学学报, 32(7): 1542-1548. |
韩雪琴. 2013. UASB-A/O工艺处理玉米淀粉废水[D].天津: 河北工业大学 http://cdmd.cnki.com.cn/Article/CDMD-10082-1014148663.htm
|
Horn M A, Matthies C, Küsel K, et al. 2003. Hydrogenotrophic methanogenesis by moderately acid-tolerant methanogens of methane-emitting acidic peat[J]. Applied and Environmental Microbiology, 69: 74-83. DOI:10.1128/AEM.69.1.74-83.2003 |
李亚峰, 陈涛, 闫旭. 2010. UASB反应器处理淀粉废水的效果及影响因素[J]. 工业安全与环保, 365(5): 1-2. DOI:10.3969/j.issn.1001-425X.2010.05.001 |
Liu Y, Whitman W B. 2008. Metabolic, phylogenetic, and ecological diversity of the methanogenic archaea[J]. Annals of the New York Academy of Sciences, 1125: 171-189. DOI:10.1196/annals.1419.019 |
李艳春. 2009. UASB/接触氧化工艺处理玉米淀粉废水的研究[J]. 气象与环境学报, 25(1): 68-71. DOI:10.3969/j.issn.1673-503X.2009.01.015 |
刘梦林, 李平, 于可可, 等. 2016. 有机负荷对ABR处理疫病动物尸骸废水的产酸及产甲烷特性影响[J]. 环境工程学报, 10(6): 3051-3056. |
Owen W F, Stuckey D C, Healy J B, et al. 1979. Bioassay for monitoring biochemical methane potential and anaerobic toxicity[J]. Water Research, 13: 485-492. DOI:10.1016/0043-1354(79)90043-5 |
任南琪, 马放, 杨基先, 等. 2013. 污染控制微生物学[M]. 哈尔滨: 哈尔滨工业大学出版社, 300-307.
|
孙晋刚, 朱茂田, 王彬. 2008. UASB-A/O工艺处理玉米淀粉生产废水[J]. 中国给水排水, 24(10): 57-59. DOI:10.3321/j.issn:1000-4602.2008.10.016 |
唐泽雨. 2016.盐度和氨氮对产氢产乙酸反应和产甲烷反应的影响[D].哈尔滨: 哈尔滨工业大学 http://cdmd.cnki.com.cn/Article/CDMD-10213-1016773681.htm
|
Williams R T, Crawford R L. 1985. Methanogenic bacteria, including an acid-tolerant strain, from peatlands[J]. Applied and Environmental Microbiology, 50: 1542-1544. DOI:10.1128/AEM.50.6.1542-1544.1985 |
杨卫, 李孟, 闫爱萍. 2015. 脉冲水解/EGSB/倒置A2/O工艺处理玉米淀粉废水[J]. 中国给水排水, 31(18): 95-97. |
张立国, 班巧英, 李建政. 2016. UASB反应器中产甲烷菌对温度胁迫的响应[J]. 中国环境科学, 36(4): 1082-1086. DOI:10.3969/j.issn.1000-6923.2016.04.018 |
张立国, 李彦霖, 班巧英, 等. 2018. qPCR揭示丙酸降解菌群随OLR提高的演替规律[J]. 中国环境科学, 38(8): 2997-3002. DOI:10.3969/j.issn.1000-6923.2018.08.027 |
赵丽, 陈晴, 王毅力, 等. 2017. ABR处理模拟畜禽养殖废水中有机物的快速启动与运行优化研究[J]. 环境工程学报, 11(7): 3943-3949. |
Zhao J, Yu L, Qin J Y. 2011. Application of membrane biological reactor on purifying wastewater fromcorn starch processing[C]. Third International Conference on Measuring Technology and Mechatronics Automation, 543-546 https://www.researchgate.net/publication/224222086_Application_of_Membrane_Biological_Reactor_on_Purifying_Wastewater_from_Corn_Starch_Processing
|
Zhu G, Li J, Liu C, et al. 2015. Simultaneous production of bio-hydrogen and methane from soybean protein processing wastewater treatment using anaerobic baffled reactor (ABR)[J]. Desalination and Water Treatment, 53: 2675-2685. DOI:10.1080/19443994.2013.868836 |
 2020, Vol. 40
2020, Vol. 40


