2. 南京大学环境学院, 污染控制与资源化研究国家重点实验室, 南京 210023
2. State Key Laboratory of Pollution Control and Resource Reuse, School of the Environment, Nanjing University, Nanjing 210023
溴代阻燃剂四溴双酚A(tetrabromobisphenol A, TBBPA)常用来提高电子电器、化工纺织、建材等产品的防火安全性, 是全球生产使用量最大的溴代阻燃剂(>60%)(de Wit, 2002).由于亚洲地区, 特别是中国聚集众多的电子和电器及其配件的生产加工厂, 对阻燃剂需求巨大, 导致TBBPA在亚洲地区的消耗量超过其全球使用量的80%(Birnbaum et al., 2004).大量生产和过度使用导致TBBPA已经广泛地在各种环境介质(土壤、沉积物、水体、大气等), 以及人体和生物体中被检测到(de Wit, 2002;Birnbaum et al., 2004).此外, TBBPA的生态风险和对人体的毒性效应也引起了极大关注.已证实, TBBPA具有细胞毒性、免疫毒性、雌激素效应以及神经毒性等(Helleday et al., 1999;Kitamura et al., 2002;Mariussen et al., 2003;Pullen et al., 2003;Darnerud, 2003).因此, 开发经济、环境友好的处理技术用于处理TBBPA污染的水体是十分必要的.
目前, TBBPA的去除技术主要有吸附(Shen et al., 2018)、微生物降解(An et al., 2011)、高级氧化技术(Ji et al., 2016)等.尽管这些技术对TBBPA去除效率可观, 但仍存在耗能大、运行成本高、中间产物具有高毒性等缺点.近年来, 酶催化技术应用于降解去除有机污染物的研究引起了人们的极大关注.特别的, 漆酶(laccase)是一种含多铜的多酚氧化酶, 在O2的作用下能直接氧化降解污染物, 被认为是环境友好型的酶(Bollag et al., 1988;Riva, 2006).漆酶催化体系已被广泛开发用于多种污染物的降解处理(Auriol et al., 2007;Garcia et al., 2011;Yang et al., 2017;Mtibaa et al., 2018;Pandey et al., 2018).污染物经漆酶催化反应生成的产物一般是分子量较高的聚合物, 这些聚合物通常具有低水溶解性, 进而易于通过进一步的吸附、沉淀以及过滤等方法从水中除去(Yu et al., 1994;Nicell et al., 1995;Feng et al., 2013)
基于漆酶的酶催化反应体系有望作为一种替代工艺应用于TBBPA污染水体的治理.本课题组之前的研究已证实漆酶和过氧化物酶均能有效催化降解水中的TBBPA, 同时能大大降低其对水生生物大型蚤的急性毒性(Feng et al., 2013;Feng et al., 2017).现有研究发现, 在自然水体中漆酶催化反应速率远低于实验室配置的缓冲盐体系, 这意味着水质组分(金属离子、天然有机质、矿物等)对漆酶催化效率有显著影响(Wagner et al., 2002;Lorenzo et al., 2005;Kim et al., 2006;Murugesan et al., 2009;Auriol et al., 2007;Feng et al., 2013;Feng et al., 2017).金属离子广泛存在于自然水体和废水中, 对微生物种群具有极高的毒性效应(Liu et al., 2011).其中, 金属离子对微生物酶活性的影响是其具有毒性效应的原因之一.研究已证实, 金属离子能够显著抑制漆酶的催化活性进而降低酶的催化效率, 抑制作用与金属离子种类、浓度以及漆酶来源有关(Lorenzo et al., 2005;Kim et al., 2006;Murugesan et al., 2009;Lu et al., 2012;Luo et al., 2017;Sun et al., 2017b;Lu et al., 2017;Xu et al., 2018).虽然这些研究已经考察了金属离子对漆酶酶活性的抑制作用, 但是对其抑制机制的探讨不足.同时, 对提供有效方法用以提高金属离子抑制作用下漆酶对污染物处理效率的研究还较少.因此, 探索研究不同金属离子对漆酶催化降解TBBPA反应的影响及阐明其影响机制是十分必要的.
基于此, 本研究考察自然水体及废水中广泛存在的金属离子对漆酶活性以及对漆酶催化降解TBBPA效率的影响, 并分析探讨不同金属离子的影响机制.考察常见漆酶介体物质2, 2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)、1-羟基苯并三唑(HBT)、2, 2, 6, 6-四甲基哌啶-氮-氧化物(TEMPO)对金属离子存在下漆酶对TBBPA去除的促进作用.该工作为探索金属离子存在下TBBPA经漆酶催化反应转化降解过程, 以及开发优化基于漆酶催化技术处理TBBPA污染水体提供参考.
2 材料与方法(Materials and methods) 2.1 材料与试剂漆酶(laccase, 分离自Trametes versicolor)、ABTS, 纯度>98.0%、HBT, 纯度>97.0%、TEMPO, 纯度>97.0%、TBBPA, 纯度>97%)购自美国Sigma-Aldrich公司;磷酸氢二钠、磷酸二氢钠及本实验所用金属离子均为分析纯, 购自南京化学试剂有限公司.有机试剂(甲醇、乙酸)均为色谱纯, 购自Tedia公司, 实验用水均为超纯水.
2.2 实验方法 2.2.1 酶活测定漆酶的酶活性通过ABTS法测定(Feng et al., 2013;Feng et al., 2019).漆酶可直接将ABTS氧化成ABTS · +, 其在420 nm下有较强的特征吸收峰, 测定该吸收峰峰值的数值变化可计算出漆酶酶活性.测定反应体系如下:2.8 mL醋酸钠缓冲溶液(10 mmol · L-1, pH=5.0), 0.1 mL ABTS(20 mmol · L-1)溶液, 以及0.1 mL稀释的漆酶储备溶液, 反应启动后在420 nm处监测ABTS · +的生成动力学.1个漆酶酶活性单位(U)定义为每分钟催化氧化1 μmol ABTS所需要的漆酶酶量.
2.2.2 漆酶催化降解TBBPA首先考察不同金属离子Na+、K+、Ca2+、Mg2+、Mn2+、Zn2+、Cd2+、Pb2+、Cu2+、Hg2+、Fe2+、Fe3+、Al3+对漆酶稳定性的影响, 金属离子浓度设定为1.0和10.0 mmol · L-1.将漆酶分别与不同种类、不同浓度的单一金属离子混合均匀, 置于25 ℃振荡培养30 min, 之后通过ABTS分析测定残留漆酶的酶活性.不加金属离子的组设置为空白对照组.
漆酶催化降解TBBPA的反应在8 mL玻璃反应试管中进行.2 mL反应体系设置如下:TBBPA初始浓度为10 μmol · L-1, 漆酶初始酶活设定为0.1 U · mL-1, 金属离子浓度分别设定为1.0和10.0 mmol · L-1, 反应溶液为10 mmol · L-1磷酸盐缓冲溶液(pH = 6.0).试管置于恒温振荡培养装置中(转速为150 r · min-1)反应30 min.反应30 min后, 2 mL甲醇和50 μL HCl溶液(5 mol · L-1)加入到反应溶液中, 分别用以终止反应和酸化反应溶液.此外, ABTS、HBT、TEMPO作为典型的漆酶介体用于促进金属离子存在下漆酶对TBBPA的催化去除效率.反应体系包含10 μmol · L-1 TBBPA、0.1 U · mL-1漆酶、50 μmol · L-1 ABTS/HBT/TEMPO、10 mmol · L-1金属离子、10 mmol · L-1磷酸盐缓冲溶液(pH = 6.0).反应溶液经过0.45 μm滤膜过滤除去大颗粒杂质后, 残留的TBBPA通过高效液相色谱进行分离和定量分析.每个实验样品至少设3个重复, 取平均值, 含有热失活漆酶的处理组作为对照实验组.
2.3 分析测定方法通过紫外分光光度计(Cary 100, Varian, USA)测定漆酶酶活, 在波长420 nm处进行定量分析.安捷伦高效液相色谱仪(HPLC, Agilent 1200)用以分离及定量检测溶液中TBBPA浓度.具体分析测定条件如下:流动相为甲醇-0.05%乙酸水(85 : 15, V : V), 流速设定为1 mL · min-1;Thermo Syncronis C18反相色谱柱(250 mm × 4 mm, 5 μm, Thermo, USA);检测器为可变波长扫描紫外检测器(VWD), 检测波长为230 nm, 进样量设置为20 μL, 柱温为25℃. SPSS 16.0 (IBM)用于数据分析, 显著性水平设定为p < 0.05.
漆酶酶活(Activitylaccase)计算公式见式(1).
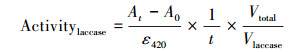
|
(1) |
式中, At和A0分别指测定时间t和初始时间的溶液吸光度;Vtotal和Vlaccase分别指测定酶活反应体系总体积和加入漆酶的体积;ε420 = 36000 mol-1 · L · cm-1.
漆酶活性抑制率(IR)计算公式见式(2).
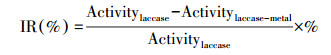
|
(2) |
式中, Activitylaccase和Activitylaccase-metal分别指按照式(1)测试计算得到的无、有金属离子存在时漆酶的活性.
3 结果与讨论(Results and discussion) 3.1 金属离子对漆酶稳定性影响金属离子对漆酶稳定性的影响与金属离子的种类和浓度有关, 如图 1所示.Na+、K+、Zn2+、Cd2+、Hg2+、Fe2+、Fe3+均能抑制漆酶的活性, 并且10 mmol · L-1金属离子的抑制作用显著高于1 mmol · L-1. Pb2+和Al3+浓度为1.0 mmol · L-1时, 对漆酶活性没有显著影响, 而在10.0 mmol · L-1浓度水平下显著抑制漆酶活性.这些金属离子能够与漆酶结构中游离的半胱氨酸结合, 形成失活的蛋白加合物, 并因此导致漆酶失活(Kim et al., 2006;Murugesan et al., 2009;Lu et al., 2012).其中, Fe2+浓度为1和10 mmol · L-1时, 漆酶活性完全被抑制, 这与已报道的研究成果是一致的(Murugesan et al., 2009;Lu et al., 2012). Ca2+、Mg2+、Mn2+浓度为1 mmol · L-1时对漆酶酶活性几乎没有影响, 甚至在高浓度下还对漆酶活性具有一定的促进作用, 如添加10.0 mmol · L-1 Mg2+时, 漆酶活性提高了6%.
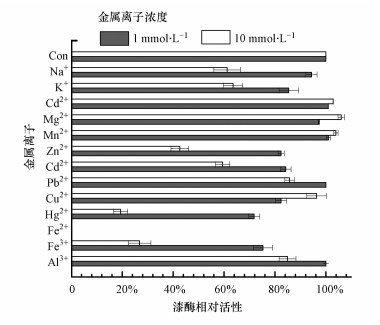 |
| 图 1 不同金属离子对漆酶酶活性的影响 Fig. 1 Effect of metal ions on laccase stability at 25 ℃ |
铜离子(Cu2+)是漆酶催化反应的活性中心, 在漆酶的电子传递过程起重要作用.本研究发现, 溶液中存在Cu2+能抑制漆酶活性, 而随着Cu2+浓度的增加抑制作用增大.有文献报道Cu2+对漆酶活性的影响与其浓度水平和漆酶的来源、种类相关. Murugesan等报道了在溶液中存在10 mmol · L-1 Cu2+时, 灵芝(G. lucidum)漆酶的活性提高了72%(Murugesan et al., 2009);而Lorenzo等则发现当Cu2+浓度低于1.0 mmol · L-1时, 对变色栓菌(Trametes versicolor CBS)漆酶的活性具有激活作用, 而当Cu2+浓度为2.0~80.0 mmol · L-1时则显著抑制漆酶活性(Lorenzo et al., 2005).同样的, 已有研究也发现加入0.1、0.5、1.0 mmol · L-1 Cu2+能提高凤尾菇(Pleurotus pulmonarius)漆酶的活性(De Souza et al., 2003).由此推测, 来源不同的漆酶对金属离子具有不同的敏感性(Couto et al., 2005).
3.2 金属离子对漆酶催化去除TBBPA的影响本研究考察了不同金属离子对漆酶催化去除TBBPA的影响, 结果表明其影响效果与金属离子的种类有关, 如图 2所示.Ca2+、Mn2+、Mg2+浓度为1.0和10.0 mmol · L-1时对TBBPA的去除率没有显著影响. Na+、K+、Pb2+、Al3+、Cu2+、Zn2+、Hg2+、Cd2+、Fe2+、Fe3+则在不同程度上干扰漆酶对TBBPA的催化转化.尤其的, Fe2+和Hg2+对TBBPA的去除具有极大的抑制作用.如, 添加1.0和10.0 mmol · L-1 Fe2+时漆酶对TBBPA催化去除效率的抑制率可达95.0%和100%, 而添加1.0和10.0 mmol · L-1 Hg2+时的抑制率也有59.8%和76.4%.添加1 mmol · L-1 Fe3+轻微抑制TBBPA的转化(抑制率约为12.1%), 而其他金属离子在浓度为1.0 mmol · L-1时对TBBPA的降解去除没有表现出明显的抑制作用.当Na+、K+、Pb2+、Al3+、Cu2+、Zn2+、Cd2+、Fe3+浓度增加到10.0 mmol · L-1时均对TBBPA的去除表现出抑制.抑制程度大小顺序为Al3+(抑制率为99.8%)> Fe3+(抑制率为93.7%)> Cu2+(抑制率为87.1%)> Pb2+(抑制率为79.9%)> Cd2+(抑制率为50.3%)> Zn2+(抑制率为47.8%)> K+(抑制率为14.9%)> Na+(抑制率为12.7%).这些抑制主要是通过金属离子抑制漆酶酶活性以及干扰漆酶催化反应过程中电子传输过程导致的(Kim et al., 2006;Murugesan et al., 2009;Lu et al., 2012).
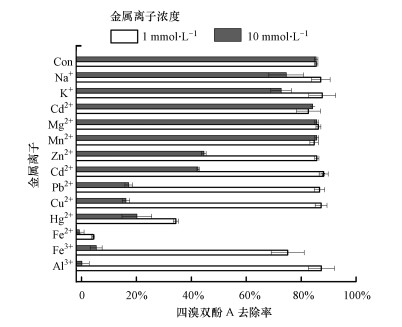 |
| 图 2 金属离子对漆酶催化降解TBBPA的影响 Fig. 2 Effect of metal ions on TBBPA removal |
从以上结果可以看出, 除Fe2+和Hg2+外, 金属离子的抑制作用与离子价态有关, 价态越高抑制越大.这可能是因为漆酶在水溶液中带负电, 金属阳离子价态越高, 与漆酶之间的静电作用力更强, 越能吸附结合更多的漆酶, 从而导致漆酶活性降低(Lu et al., 2017).研究结果还表明, 对于具有相同价态的金属离子, 离子半径越大、抑制作用越大, 如K+> Na+、Pb2+> Cd2+> Zn2+.这可能是由于金属离子的离子半径越大、水合半径越小, 越容易与漆酶结合导致的.此外, 不同金属离子与漆酶酶蛋白中官能团的特异结合, 也可能是导致其对漆酶酶活表现出不同干扰的主要原因.研究发现, Hg2+、Pb2+、Cd2+、Zn2+与N-乙酰半胱氨酸(ML0)的络合常数分别为32.11、7.21、6.53、5.52(Cardiano et al., 2016).这主要是因为不同金属离子与氨基酸结构中—SH、—NH—/—NH2、—COOH的结合能力不同导致的, 如Hg2+与—SH的强络合作用, Pb2+更易与—COOH结合.这些金属离子和漆酶结构中氨基酸络合, 一方面导致漆酶构型变化失活, 另外还可置换催化中心的Cu2+从而导致漆酶失活.Cu2+作为漆酶的催化活性中心, 也显著抑制漆酶的催化活性.排除置换催化活性中心Cu2+的原因, 由此推断, Cu2+的抑制作用主要是通过与氨基酸(特别是—NH—/—NH2官能团)络合, 导致漆酶构型改变引起的活性降低.然而, 考虑到自然环境水体中、以及大多数的电子生产废水中重金属离子的浓度水平一般不会超过1 mmol · L-1.因此可以推断, 在漆酶的实际应用中, 本研究涉及的大部分金属离子不会显著影响漆酶对污染物的催化去除, 这十分有利于开发漆酶在处理含高浓度重金属有机废水领域的应用.
3.3 对比Fe2+和Hg2+的影响由于Fe2+和Hg2+在浓度为1.0 mmol · L-1时仍能高度抑制漆酶活性并从而降低TBBPA的降解去除率.因此, 本研究进一步考察了Fe2+和Hg2+在更低的浓度水平(0.001~ 0.5 mmol · L-1)对TBBPA去除率的影响, 并由此得到其最小抑制浓度.如图 3所示, 低浓度的Fe2+和Hg2+仍对TBBPA的去除率具有显著的抑制作用, 如当Fe2+和Hg2+浓度为10 μmol · L-1时, 仍对TBBPA的降解去除率有10%的抑制.此外, 同等浓度下, Fe2+的抑制效果显著高于Hg2+, 如当加入0.5 mmol · L-1 Fe2+和Hg2+时, TBBPA去除率从83%分别降低到5%和48%.
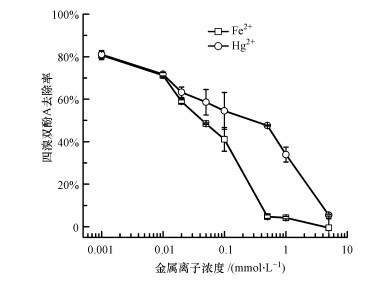 |
| 图 3 不同浓度Fe2+和Hg2+对漆酶催化降解TBBPA的影响 Fig. 3 TBBPA removal via laccase-catalyzed reaction in the presence of Fe2+ and Hg2+ under the concentrations varying from 0 to 5.0 mmol · L-1 |
Fe2+和Hg2+在低浓度水平下能够强烈抑制漆酶-Cu2+复合体系的效能(Lu et al., 2012).研究也发现了Hg2+的抑制程度随着反应时间的延长逐渐增大, 而Fe2+的抑制程度则随着反应时间的延长逐渐缓解, 这意味着二者对漆酶活性的抑制机理不同.已证实Hg2+与漆酶的氨基酸残基具有较高的结合能, 导致漆酶构型变化, 强烈干扰漆酶的电子传输过程, 并因此抑制漆酶活性(Xu et al., 2018).O2是漆酶催化反应过程中电子传输的最终受体, 对漆酶的催化活性极其关键.Fe2+能被水体中溶解氧氧化, 这将与漆酶竞争O2.通过给反应溶液持续暴露O2的方法证实这一推测, 并由此对比Fe2+和Hg2+对漆酶的抑制机制.如图 4所示, 在无O2暴露时, 0.1 mmol · L-1 Fe2+强烈抑制漆酶催化反应.反应30 min后, TBBPA的去除率约为36%, 而将反应时间延长至240 min后, TBBPA的去除率也仅提高至40%.进行O2暴露后, TBBPA的去除率提高至70%, 这表明Fe2+的抑制作用大大被缓解.而无论是否暴露O2均不能Hg2+对漆酶催化去除TBBPA的抑制效果.因此, 由以上结果可推测, Fe2+与漆酶或其底物没有直接的相互作用, 是通过竞争O2或是通过还原反应中间产物自由基干扰漆酶催化反应过程;而Hg2+则是通过与漆酶的一些氨基酸官能团络合从而改变漆酶构型影响其活性(Murugesan et al., 2009;Lu et al., 2012).
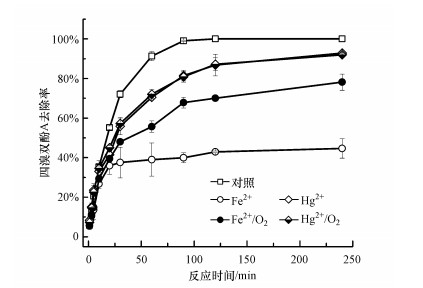 |
| 图 4 氧气对Fe2+和Hg2+存在下漆酶催化降解TBBPA的影响 Fig. 4 Effect of oxygen aeration on TBBPA removal via laccase-catalyzed reaction in the presence of 0.1 mmol · L-1 Fe2+ and Hg2+ |
在酶催化处理技术中, 介体物质常用于提高酶催化反应效率及拓宽其底物范围.在本研究中, 本课题组探索了一些常见的介体物质包括ABTS、HBT和TEMPO对金属离子存在下漆酶催化去除TBBPA的促进效果.如图 5所示, 在无金属离子存在时, 3种介体物质(浓度为50 μmol · L-1)就能使得TBBPA的去除率由85.4%提高至100%, 这表明介体物质均能有效促进漆酶催化转化TBBPA.在10.0 mmol · L-1 Pb2+、Al3+、Cu2+、Zn2+、Hg2+、Cd2+、Fe3+、Fe2+存在时, 3种介体物质仍能有效提高漆酶对TBBPA的催化去除率.如, 10.0 mmol · L-1Hg2+存在时, TBBPA的去除率约为20.2%, 而加入50 μmol · L-1 ABTS、HBT和TEMPO则可分别将TBBPA去除率提高至42.6%、57.4%和62.4%.同样的, 10.0 mmol · L-1 Fe2+存在时, TBBPA的去除完全被抑制, 而3种介体物质的加入仍可将TBBPA的去除率提高至6.3%~12.2%.研究结果还表明3种介体物质对TBBPA去除率促进效果的顺序为ABTS < HBT < TEMPO.
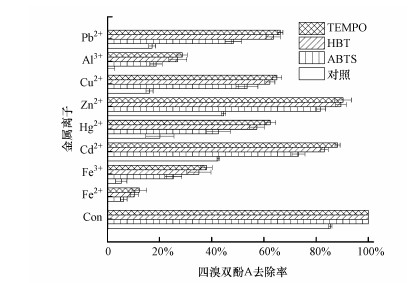 |
| 图 5 不同介体对金属离子存在下漆酶催化降解TBBPA的影响 Fig. 5 Effects of ABTS, HBT, and TEMPO mediators on TBBPA removal in the presence of metal ions |
ABTS、HBT和TEMPO对漆酶催化反应活性的促进作用的机制不同.漆酶可将ABTS催化氧化为ABTS阳离子自由基(ABTS · +), ABTS · +具有较高的氧化还原电位, 可通过电子传输的机制加速漆酶对其他化合物的催化转化(Duran et al., 2000;Morozova et al., 2007;Husain et al., 2008). HBT结构中—N—OH基团可在漆酶作用下形成HBT自由基(—N—O ·), 这个自由基可通过氢原子转移机制进一步促进漆酶对化合物的降解转化(Hata et al., 2010;Luo et al., 2015;Sun et al., 2017a).TEMPO经漆酶氧化后可形成N=O自由基(—N=O ·), 可进一步通过离子氧化机制促进漆酶催化效率(Keum et al., 2004).尽管3种介体物质能有效提高金属离子存在下漆酶对TBBPA的催化去除效率, 但由于这3种介体物质均是人工合成化学品, 在选用它们时仍需考虑包括费用、潜在毒性效应等问题(Camarero et al., 2005;Auriol et al., 2007;Garcia et al., 2011).因此, 在以后的研究中需要寻找一些天然的介体物质用于提高漆酶对TBBPA的催化降解效率, 尤其是与本研究应用的3种人工合成介体物质具有类似结构、活性官能团及类似作用机制的天然化合物.目前已经发现的能够高效促进漆酶催化效率的天然介体物质包括对香豆酸(p-coumaric acid, PCA)、丁香醛(syringaldehyde, SA)、乙酰丁香酮(acetosyringone, AS)(Fillat et al., 2010)和乙酰丙酮(acetylacetone, AA)(Sun et al., 2016;Huang et al., 2019)等.此外, 在应用人工合成介体物质时, 可以通过固定化的方法实现漆酶和介体物质的循环利用, 一方面可以降低实际运营费用, 还可以避免有毒介体物质进入水体带来的其他环境问题(Sun et al., 2016; Gao et al., 2018; Gu et al., 2019).
4 结论(Conclusions)1) 大多数金属离子在高浓度水平下抑制漆酶活性以及降低漆酶对TBBPA的催化去除效率, 而在实际浓度水平则将无显著影响.
2) Fe2+和Hg2+在低浓度水平仍具有显著的抑制作用.
3) Fe2+的抑制作用是由于竞争溶液中溶解O2, 而Hg2+则是因为与漆酶结构中氨基酸残基络合改变漆酶构型导致的.
4) 额外添加介体物质通过不同机制能有效促进金属离子存在下漆酶对TBBPA的降解转化效率.
An T, Zu L, Li G, et al. 2011. One-step process for debromination and aerobic mineralization of tetrabromobisphenol-A by a novel Ochrobactrum sp. T isolated from an e-waste recycling site[J]. Bioresource Technology, 102(19): 9148-9154. DOI:10.1016/j.biortech.2011.06.080 |
Auriol M, Filali-meknassi Y, Tyagi R D, et al. 2007. Laccase-catalyzed conversion of natural and synthetic hormones from a municipal wastewater[J]. Water Research, 41: 3281-3288. DOI:10.1016/j.watres.2007.05.008 |
Birnbaum L S, Staskal D F. 2004. Brominated flame retardants:Cause for concern?[J]. Environmental Health Perspectives, 112: 9-17. |
Bollag J M, Shuttleworth K L, Anderson D H. 1988. Laccase-mediated detoxification of phenolic compounds[J]. Appl Environ Microbiol, 54: 3086-3091. DOI:10.1128/AEM.54.12.3086-3091.1988 |
Camarero S, Ibarra D, Martinez M J, et al. 2005. Lignin-derived compounds as efficient laccase mediators for decolorization of different types of recalcitrant dyes[J]. Applied and Environmental Microbiology, 71: 1775-1784. DOI:10.1128/AEM.71.4.1775-1784.2005 |
Cardiano P, Foti C, Giuffrè O. 2016. On the interaction of N-acetylcysteine with Pb2+, Zn2+, Cd2+ and Hg2+[J]. Journal of Molecular Liquids, 223: 360-367. DOI:10.1016/j.molliq.2016.08.050 |
Couto S R, Sanroman M, Gubitz G M. 2005. Influence of redox mediators and metal ions on synthetic acid dye decolourization by crude laccase from Trametes hirsuta[J]. Chemosphere, 58: 417-422. DOI:10.1016/j.chemosphere.2004.09.033 |
Darnerud P O. 2003. Toxic effects of brominated flame retardants in man and in wildlife[J]. Environment International, 29: 841-853. DOI:10.1016/S0160-4120(03)00107-7 |
De Souza C G M, Peralta R M. 2003. Purification and characterization of the main laccase produced by the white-rot fungus Pleurotus pulmonarius on wheat bran solid state medium[J]. Journal of Basic Microbiology, 43: 278-286. DOI:10.1002/jobm.200390031 |
De Wit C A. 2002. An overview of brominated flame retardants in the environment[J]. Chemosphere, 46: 583-624. DOI:10.1016/S0045-6535(01)00225-9 |
Duran N, Esposito E. 2000. Potential applications of oxidative enzymes and phenoloxidase-like compounds in wastewater and soil treatment:A review[J]. Applied Catalysis B-Environmental, 28: 83-99. DOI:10.1016/S0926-3373(00)00168-5 |
Feng Y, Lu K, Gao S, et al. 2017. The fate and transformation of tetrabromobisphenol A in natural waters, mediated by oxidoreductase enzymes[J]. Environmental Science:Processes & Impacts, 19: 596-604. |
Feng Y P, Colosi L M, Gao S X, et al. 2013. Transformation and removal of tetrabromobisphenol A from water in the presence of natural organic matter via laccase-catalyzed reactions:Reaction rates, products, and pathways[J]. Environmental Science & Technology, 47: 1001-1008. |
Feng Y P, Shen M Y, Wang Z, et al. 2019. Transformation of atenolol by a laccase-mediator system:Efficiencies, effect of water constituents, and transformation pathways[J]. Ecotoxicology and Environmental Safety, 183: 109555. DOI:10.1016/j.ecoenv.2019.109555 |
Fillat A, Colom J F, Vidal T. 2010. A new approach to the biobleaching of flax pulp with laccase using natural mediators[J]. Bioresource Technology, 101: 4104-4110. DOI:10.1016/j.biortech.2010.01.057 |
Garcia H A, Hoffman C M, Kinney K A, et al. 2011. Laccase-catalyzed oxidation of oxybenzone in municipal wastewater primary effluent[J]. Water Research, 45: 1921-1932. DOI:10.1016/j.watres.2010.12.027 |
Gao Z, Yi Y, Zhao J, et al. 2018. Co-immobilization of laccase and TEMPO onto amino-functionalized magnetic Fe3O4 nanoparticles and its application in acid fuchsin decolorization[J]. Bioresources and Bioprocessing, 5: 27. DOI:10.1186/s40643-018-0215-7 |
Gu Y, Ping X, Feng J, et al. 2019. Co-immobilization of laccase and ABTS onto novel dual-functionalized cellulose beads for highly improved biodegradation of indole[J]. Journal of Hazardous Materials, 365: 118-124. DOI:10.1016/j.jhazmat.2018.10.076 |
Hata T, Shintate H, Kawai S, et al. 2010. Elimination of carbamazepine by repeated treatment with laccase in the presence of 1-hydroxybenzotriazole[J]. Journal of Hazardous Materials, 181: 1175-1178. DOI:10.1016/j.jhazmat.2010.05.103 |
Helleday T, Tuominen K L, Bergman A, et al. 1999. Brominated flame retardants induce intragenic recombination in mammalian cells[J]. Mutation Research-Genetic Toxicology and Environmental Mutagenesis, 439: 137-147. DOI:10.1016/S1383-5718(98)00186-7 |
Huang W, Yang H, Zhang S. 2019. Acetylacetone extends the working life of laccase in enzymatic transformation of malachite green by interfering with a key intermediate[J]. Journal of Hazardous Materials, 366: 520-528. DOI:10.1016/j.jhazmat.2018.12.028 |
Husain M, Husain Q. 2008. Applications of redox mediators in the treatment of organic pollutants by using oxidoreductive enzymes:A review[J]. Critical Reviews in Environmental Science and Technology, 38: 1-42. |
Ji Y, Kong D, Lu J, et al. 2016. Cobalt catalyzed peroxymonosulfate oxidation of tetrabromobisphenol A:kinetics, reaction pathways, and formation of brominated by-products[J]. Journal of Hazardous Materials, 313: 229-237. DOI:10.1016/j.jhazmat.2016.04.033 |
Keum Y S, Li Q X. 2004. Fungal laccase-catalyzed degradation of hydroxy polychlorinated biphenyls[J]. Chemosphere, 56: 23-30. DOI:10.1016/j.chemosphere.2004.02.028 |
Kim Y J, Nicell J A. 2006. Impact of reaction conditions on the laccase-catalyzed conversion of bisphenol A[J]. Bioresource Technology, 97: 1431-1442. DOI:10.1016/j.biortech.2005.06.017 |
Kitamura S, Jinno N, Ohta S, et al. 2002. Thyroid hormonal activity of the flame retardants tetrabromobisphenol A and tetrachlorobisphenol A[J]. Biochemical and Biophysical Research Communications, 293: 554-559. DOI:10.1016/S0006-291X(02)00262-0 |
Liu H, Zhao H M, Quan X, et al. 2011. Formation of 2'-hydroxy-2, 3', 4, 5'-tetrabromodipheyl ether(2'-HO-BDE68)from 2, 4-dibromophenol in aqueous solution under simulated sunlight irradiation[J]. Chemosphere, 84: 512-518. DOI:10.1016/j.chemosphere.2011.03.011 |
Lorenzo M, Moldes D, Couto S R, et al. 2005. Inhibition of laccase activity from Trametes versicolor by heavy metals and organic compounds[J]. Chemosphere, 60: 1124-1128. DOI:10.1016/j.chemosphere.2004.12.051 |
Lu C, Cao L, Liu R, et al. 2012. Effect of common metal ions on the rate of degradation of 4-nitrophenol by a laccase-Cu2+ synergistic system[J]. Journal of Environmental Management, 113: 1-6. |
Lu J H, Shi Y Y, Ji Y F, et al. 2017. Transformation of triclosan by laccase catalyzed oxidation:The influence of humic acid-metal binding process[J]. Environmental Pollution, 220: 1418-1423. DOI:10.1016/j.envpol.2016.10.092 |
Luo Q, Lu J H, Zhang H, et al. 2015. Laccase-catalyzed degradation of perfluorooctanoic acid[J]. Environmental Science & Technology Letters, 2: 198-203. |
Luo Q, Wang Z Y, Feng M B, et al. 2017. Factors controlling the rate of perfluorooctanoic acid degradation in laccase-mediator systems:The impact of metal ions[J]. Environmental Pollution, 224: 649-657. DOI:10.1016/j.envpol.2017.02.050 |
Mariussen E, Fonnum F. 2003. The effect of brominated flame retardants on neurotransmitter uptake into rat brain synaptosomes and vesicles[J]. Neurochemistry International, 43: 533-542. DOI:10.1016/S0197-0186(03)00044-5 |
Morozova O V, Shumakovich G P, Shleev S V, et al. 2007. Laccase-mediator systems and their applications:A review[J]. Applied Biochemistry and Microbiology, 43: 523-535. DOI:10.1134/S0003683807050055 |
Mtibaa R, Olicon-Hernandez D R, Pozo C, et al. 2018. Degradation of bisphenol A and acute toxicity reduction by different thermo-tolerant ascomycete strains isolated from arid soils[J]. Ecotoxicology and Environmental Safety, 156: 87-96. DOI:10.1016/j.ecoenv.2018.02.077 |
Murugesan K, Kim Y M, Jeon J R, et al. 2009. Effect of metal ions on reactive dye decolorization by laccase from Ganoderma lucidum[J]. Journal of Hazardous Materials, 168: 523-529. DOI:10.1016/j.jhazmat.2009.02.075 |
Nicell J A, Saadi K W, Buchanan I D. 1995. Phenol polymerization and precipitation by horseradish peroxidase enzyme and an additive[J]. Bioresource Technology, 54: 5-16. DOI:10.1016/0960-8524(95)00104-2 |
Pandey R K, Tewari S, Tewari L. 2018. Lignolytic mushroom Lenzites elegans WDP2:Laccase production, characterization, and bioremediation of synthetic dyes[J]. Ecotoxicology and Environmental Safety, 158: 50-58. DOI:10.1016/j.ecoenv.2018.04.003 |
Pullen S, Boecker R, Tiegs G. 2003. The flame retardants tetrabromobisphenol A and tetrabromobisphenol A-bisallylether suppress the induction of interleukin-2 receptor αchain(CD25)in murine splenocytes[J]. Toxicology, 184: 11-22. DOI:10.1016/S0300-483X(02)00442-0 |
Riva S. 2006. Laccases:Blue enzymes for green chemistry[J]. Trends Biotechnol: 219-226. |
Sun K, Huang Q G, Li S Y. 2017a. Transformation and toxicity evaluation of tetracycline in humic acid solution by laccase coupled with 1-hydroxybenzotriazole[J]. Journal of Hazardous Materials, 331: 182-188. DOI:10.1016/j.jhazmat.2017.02.058 |
Shen J, Huang G, An C J, et al. 2018. Removal of tetrabromobisphenol A by adsorption on pinecone-derived activated charcoals:Synchrotron FTIR, kinetics and surface functionality analyses[J]. Bioresource Technology, 247: 812-820. DOI:10.1016/j.biortech.2017.09.177 |
Sun K, Kang F X, Waigi M G, et al. 2017b. Laccase-mediated transformation of triclosan in aqueous solution with metal cations and humic acid[J]. Environmental Pollution, 220: 105-111. DOI:10.1016/j.envpol.2016.09.028 |
Wagner M, Nicell J A. 2002. Impact of dissolved wastewater constituents on peroxidase-catalyzed treatment of phenol[J]. Journal of Chemical Technology and Biotechnology, 77: 419-428. DOI:10.1002/jctb.571 |
Xu X, Huang X, Liu D, et al. 2018. Inhibition of metal ions on Cerrena sp. laccase:Kinetic, decolorization and fluorescence studies[J]. Journal of the Taiwan Institute of Chemical Engineers, 84: 1-10. DOI:10.1016/j.jtice.2017.12.028 |
Yang J, Lin Y H, Yang X D, et al. 2017. Degradation of tetracycline by immobilized laccase and the proposed transformation pathway[J]. Journal of Hazardous Materials, 322: 525-531. DOI:10.1016/j.jhazmat.2016.10.019 |
Yu J, Taylor K E, Zou H X, et al. 1994. Phenol conversion and dimeric intermediates in horseradish peroxidase-catalyzed phenol removal from water[J]. Environmental Science & Technology, 28: 2154-2160. |
 2020, Vol. 40
2020, Vol. 40


