2. 南京工业大学生物与制药工程学院, 南京 211816;
3. 南阳师范学院农业工程学院, 南阳 473061
2. College of Biotechnology and Pharmaceutical Engineering, Nanjing Tech University, Nanjing 211816;
3. School of Agricultural Engineering, Nanyang Normal University, Nanyang 473061
嗪草酮(Metribuzin)是德国拜耳公司于1971年开发的一种三氮苯类除草剂, 具有高效、广谱、选择性强等优点(Baranowska et al., 2006), 用于防除阔叶杂草, 主要用于大豆、马铃薯、番茄、甘蔗、玉米、黄瓜等旱地作物(Huang et al., 2017).其作用机理是通过竞争性与光合系统复合体Ⅱ(PSⅡ)反应中心D1蛋白上的质体醌(PQ)QB结合位点结合, 从而阻止电子链的传递, 阻碍还原性辅酶Ⅱ(NADPH)、三磷酸腺苷(ATP)的形成及碳的还原, 进而抑制植物光合作用, 最终导致目标植物死亡(张一宾, 2006;王恒亮等, 2013).嗪草酮在我国使用广泛, 但长期施用该类除草剂会导致其在环境中残留, 进而污染土壤、地下水、饮用水, 对水生生物产生毒性, 并对后茬敏感作物安全产生不良影响(宋嫚, 2015).此外, 嗪草酮作为一种内分泌干扰物, 当被动物和人吸收时会产生异常的生理反应(Majumdar et al., 2007).因此, 环境中嗪草酮的去除引起了广泛的关注.研究表明, 环境中嗪草酮可以通过水解法或者电化学方法进行消除(Zhong et al., 2009), 而微生物降解也逐渐成为嗪草酮去除的重要方式(Lin et al., 2005).
迄今为止, 关于嗪草酮微生物降解的研究相对较少.研究发现, 菌株Bacillus sp. N1在120 h内对20 mg · L-1嗪草酮的降解率达到73.5%(Zhang et al., 2014);菌株Burkholderia cepacia CH9在20 d内对50 mg · L-1嗪草酮的降解率为86.0%(Gopal et al., 2011);菌株Paracoccus sp. QCT6在7 d内对50 mg · L-1嗪草酮的降解率为86.4%(Huang et al., 2017).虽然目前已分离到少量降解嗪草酮的菌株, 但高效降解菌株仍十分匮乏;有关嗪草酮残留的微生物修复应用研究也十分薄弱, 且尚未见针对其水体修复的报道, 也缺乏嗪草酮降解菌株修复水体环境的相关数据.同时, 菌株在复杂水体环境中的存活能力也限制了功能菌株修复污染环境技术的发展.
基于此, 本研究从某农药厂污染土壤中分离得到1株高效降解菌株MA, 对菌株的降解特性及其代谢产物进行研究鉴定, 并探索菌体细胞的固定化方法, 以提高其生存能力, 最后开展菌株对不同水体环境中嗪草酮的去除能力研究, 以期为嗪草酮残留污染水体的修复提供菌株资源和理论依据.
2 材料与方法(Materials and methods) 2.1 培养基、试剂与水体LB培养基(g · L-1):蛋白胨10.0, 酵母粉5.0, NaCl 5.0.
GMSM基础盐培养基(g · L-1):葡萄糖3.0, NaCl 0.5, K2HPO4 1.5, KH2PO4 0.5, MgSO4 · 7H2O 0.2;GMSM固体培养基每升添加15 g琼脂粉.
嗪草酮购自百灵威科技有限公司, 1.0 g嗪草酮溶解于100 mL甲醇中, 配制成10000 mg · L-1母液, 过滤除菌后备用.海藻酸钠(SA)、无水氯化钙购自上海阿拉丁科技股份有限公司, 乙腈(色谱纯)和二氯甲烷(分析纯)等有机试剂购自汉邦科技有限公司, 各种分子生物学试剂如Taq酶、pMD19-T载体等购自TaKaRa公司, PCR引物合成及测序由南京金斯瑞生物科技有限公司完成, 黄瓜种子购自于江苏明天种业有限公司.
池塘水采自江苏省无锡市青鱼标准化养殖与示范基地, 湖水采自江苏省无锡市蠡湖, 并对水体的理化性质进行测定.
2.2 嗪草酮降解菌株的筛选与分类地位的鉴定从常州某农药厂采集土壤样品, 并对其进行驯化和富集培养(Nie et al., 2011).具体方法如下:称取10 g土壤接种至含50 mg · L-1嗪草酮的100 mL GMSM中, 于30 ℃、180 r · min-1的恒温摇床中培养7 d后, 以5%的接种量将富集液转接至含100 mg · L-1嗪草酮的GMSM中, 连续传代3~4次.将具有降解效果的富集液进行梯度稀释涂布于添加有50 mg · L-1嗪草酮的GMSM固体培养基上, 30 ℃培养3~5 d.挑选不同形态的菌株进行划线纯化, 再将扩大培养后的单菌接种至含50 mg · L-1嗪草酮的GMSM中验证其降解效果.
嗪草酮的测定采用高效液相色谱(HPLC)法:采用盐酸调节反应后培养液的pH(2.0~3.0), 并加入等体积的二氯甲烷, 涡旋振荡2 min, 静置5 min, 待水相和有机相分层后, 吸取有机相, 加入无水硫酸钠去除残余水分, 静置3 min, 吸取2.0 mL, 自然风干后加入0.5 mL甲醇, 溶解待测物, 经0.22 μm有机滤膜过滤后, 进行HPLC检测.仪器型号为RID-10A, 色谱柱为C18反相色谱柱(250 mm×4.6 mm×5 μm), 流动相为乙腈:水:乙酸(70 : 20 : 0.5, 体积比), 柱温为40 ℃, 流速为1.0 mL · min-1, 进样量为20 μL, 检测波长为230 nm.
采用高盐法提取降解菌株的基因组DNA(薛景波, 2018), 并用细菌16S rRNA基因通用引物扩增菌株的16S rDNA, 纯化回收, TA克隆后进行测序(Ke et al., 2018).通过原核生物鉴定在线数据库(http://www.ezbiocloud.net/)对测序所得的16S rRNA基因序列进行在线比对分析, 下载同源性较高的菌株的16S rRNA基因序列, 共同导入MEGA 6.0软件, 用Clustal W进行基因序列比对(Larkin et al., 2007), 采用邻接法构建降解菌株的16S rRNA基因的系统进化树(Tamura et al., 2011).根据《常见细菌系统鉴定手册》(东秀珠等, 2000)和《Bergey′s Manual of Determinative Bacteriology》(Whitman et al., 2013), 对降解菌株的形态与生理生化特性进行分析.
2.3 菌株对嗪草酮降解特性的研究 2.3.1 降解菌悬液的制备挑取新鲜培养的单菌落接种至100 mL LB液体中培养, 30 ℃、180 r · min-1培养至对数后期, 5000 r · min-1离心5 min收集菌体, 用无菌水洗涤3次, 重悬, 将OD600调至1.0备用.
2.3.2 温度对菌株降解嗪草酮的影响在嗪草酮终浓度50 mg · L-1的GMSM中, 按5%接种量接入OD600=1.0的菌悬液, 分别于20、25、28、30、35、37、40 ℃下摇床(200 r · min-1)培养, 5 d取样, 利用HPLC测定嗪草酮浓度, 计算降解率.
2.3.3 培养基初始pH对菌株降解嗪草酮的影响在培养基初始pH分别为4.0、5.0、6.0、7.0、8.0、9.0、10.0, 嗪草酮浓度为50 mg · L-1的GMSM中, 按5%接种量接入OD600=1.0的菌悬液, 置于30 ℃、200 r · min-1摇床培养, 5 d取样, 利用HPLC测定嗪草酮浓度, 计算降解率.
2.3.4 嗪草酮初始浓度对菌株降解及生长的影响在初始嗪草酮终浓度分别为25、50、100、200 mg · L-1的GMSM中, 按5%接种量接入OD600=1.0的菌悬液, 置于30 ℃、200 r · min-1摇床培养, 5 d取样, 利用HPLC测定嗪草酮浓度, 计算降解率, 同时测定不同处理反应液中菌株的数量, 以CFU · mL-1表示.
2.4 菌株降解嗪草酮代谢产物的鉴定及代谢途径预测在嗪草酮终浓度为50 mg · L-1的GMSM中, 按5%接种量接入OD600=1.0的菌悬液, 30 ℃、200 r · min-1培养, 每隔1 d取样1次, 进行HPLC检测后, 选取中间代谢产物积累较多的样品, 进一步进行GC-MS分析.色谱条件如下:色谱柱为HP-5石英毛细管柱, 30 m×0.25 mm(内径), 膜厚0.25 μm;色谱柱初始温度100 ℃保持2 min, 以30 ℃ · min-1升至220 ℃, 保持8 min;进样口温度为250 ℃;检测器温度为300 ℃;载气、尾吹气为氦气, 纯度≥99.99%, 载气1 mL · min-1, 尾吹气8 mL · min-1;氢气2 mL · min-1;空气60 mL · min-1;进样体积1 μL.质谱条件如下:电离方式EI, 能量70 eV, 离子监测;接口温度280 ℃;m/z范围为50~260.
2.5 固定菌株MA细胞的方法菌株MA的GFP标记:接种MA至LB液体培养基中, 最适条件下培养至对数期, 离心收集菌体, 并用ddH2O重悬至终体积200~300 μL, 冰上预冷.吸取上述菌悬液100 μL至离心管中, 加入pLYC2质粒(携带有绿色荧光蛋白基因), 轻轻混匀, 转入预冷的1 mm电转杯中, 电转后立即加入1 mL室温LB液体培养基, 30 ℃、80 r · min-1复苏过夜, 涂布在含有50 mg · L-1卡那霉素的LB平板上, 挑取成功导入并且发出绿色荧光的单菌落, 对菌株进行单独培养, PCR验证, 命名为MA-GFP, 并用15%的甘油保藏菌种.
配制浓度为20、30和40 g · L-1的海藻酸钠胶体, 浓度为20、30和40 g · L-1的CaCl2溶液, 121 ℃、20 min灭菌后待用.将SA胶体与MA-GFP菌悬液混匀(6 : 1, 8 : 1, 10 : 1, V/V), 用吸管吸取混合液逐滴滴入CaCl2溶液中, 制备成大小均匀的凝胶颗粒, 室温放置, 交联固定化2、4和6 h.交联结束后, 将固定化小球取出, 用生理盐水清洗待用.以固定化菌体细胞对嗪草酮的降解率为主要指标, 成型度和强度为参考, 确定固定化的最佳条件.
2.6 固定化菌株对嗪草酮污染水体的修复作用取不同水样400 mL(池塘水或湖水), 加入嗪草酮储备液, 使水体中嗪草酮终浓度为15 mg · L-1, 加入未经固定化的MA-GFP菌悬液, 使水样中降解菌含量为1.0×108 CFU · mL-1, 另外加入等量经最佳包埋条件制成的固定化菌体, 以不加MA-GFP菌悬液的含药水样为对照;每组实验设置3个重复.置于30 ℃生化培养箱中, 每5 d取1次样品, 取至20 d, 测定不同处理中嗪草酮的含量.
水体中嗪草酮的提取方法:取10 mL水样至三角瓶中, 加入50 mL蒸馏水, 盐酸调节pH至3.0, 置于180 r · min-1摇床中振荡1 h, 静置30 min, 取25 mL上清液用25 mL二氯甲烷萃取, 重复3次, 合并二氯甲烷, 氮吹仪吹干, 加入1 mL甲醇重悬, 0.22 μm有机滤膜过滤后, HPLC定量检测嗪草酮含量.
水体中菌株MA-GFP数量的测定:定时取样, 稀释涂布于含有50 mg · L-1卡那霉素的LB平板, 使平板中菌落数在30~300个之间, 在蓝光下对发绿色荧光的菌株进行计数.
2.7 数据处理采用SPSS 17.0进行数据统计分析, 用Microsoft Excel 2010软件绘图.
3 结果(Results) 3.1 嗪草酮降解菌株的分离与鉴定将具有降解效果的富集液稀释至10-3~10-6, 涂布于含50 mg · L-1嗪草酮的LB平板, 30 ℃培养3~5 d, 挑选出不同形态的菌株进行效果验证, 发现1株具有降解嗪草酮的功能(图 1), 平板划线纯化后, 保藏于15%甘油管中, 并命名为菌株MA.
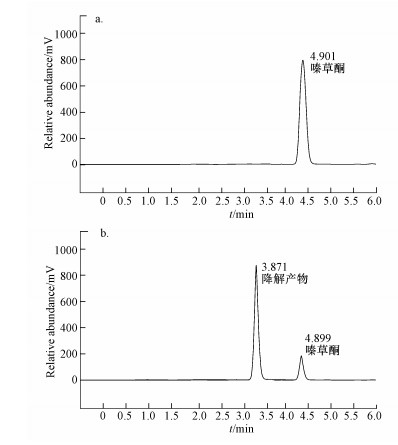 |
| 图 1 菌株MA降解嗪草酮的HPLC图(a.嗪草酮;b.嗪草酮+菌株MA) Fig. 1 HPLC spectrums of metribuzin degradation by strain MA(a.metribuzin; b.metribuzin+MA) |
菌株MA在LB固体平板上形成的菌落边缘光滑, 粉红色, 凸起, 有光泽.菌株MA为革兰氏阳性、氧化酶阳性, 透射电镜照片(图 2)显示该菌菌体为椭球形, 无鞭毛, 细胞大小约为(0.9~1.2) μm×(1.3~1.7) μm的近球形菌.
 |
| 图 2 降解菌株MA的透射电镜照片 Fig. 2 Transmission electron micrograph of strain MA |
以菌株MA的基因组DNA为模板扩增出16S rRNA基因序列(1483 bp), 系统进化树结果表明, 菌株MA与Rhodococcus ruber DSM 43338T和Rhodococcus electrodiphilus JC435T的16S rRNA基因序列相似性达到99.8%, 且3株菌聚类在一枝上(图 3).根据菌株MA的形态与生理生化特征, 结合16S rRNA基因序列系统发育树分析, 将其鉴定为红球菌属(Rhodococcus sp.)菌株.
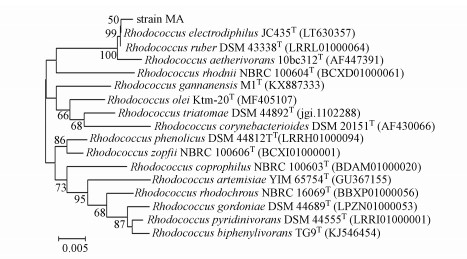 |
| 图 3 基于16S rRNA基因序列构建的菌株MA的系统发育树 Fig. 3 Neighbor-joining tree of strain MA based on 16S rRNA gene sequence |
由图 4可知, 菌株MA在5 d内对50 mg · L-1嗪草酮的降解率达到74.8%.不同温度、培养基初始pH对菌株MA降解嗪草酮的影响如图 5所示.由图可知, 菌株MA在30 ℃时对嗪草酮的降解速度最快, 28 ℃时的降解率仍能达到61.7%, 25 ℃和35 ℃时降解率下降到40%左右.菌株MA在培养基初始pH=7.0时对嗪草酮的降解速度最快, 初始pH=8.0时的降解率可达到68.7%, 其他供试初始pH条件下的降解率均低于42.0%.
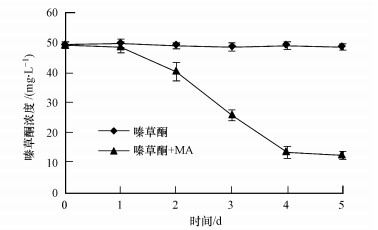 |
| 图 4 菌株MA对嗪草酮的降解曲线 Fig. 4 Metribuzin degradation curve by strain MA |
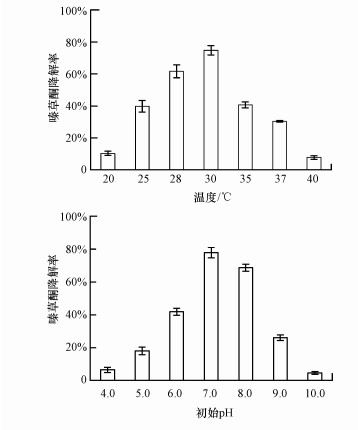 |
| 图 5 温度、培养基初始pH对菌株MA降解嗪草酮的影响 Fig. 5 Effects of temperature, initial pH on the activity of metribuzin degradation by strain MA |
不同嗪草酮初始浓度对菌株MA生长和降解的影响如表 1所示.由表可知, 嗪草酮初始浓度对菌株MA的降解效率有明显影响, 当嗪草酮初始浓度低于50 mg · L-1时, 菌株MA对嗪草酮的降解率在75.0%以上, 其中对25 mg · L-1嗪草酮的降解率为91.9%;而当初始浓度达到100 mg · L-1时, 菌株对嗪草酮的降解率为52.8%;初始浓度达到200 mg · L-1时, 嗪草酮的降解率仅为24.1%.计算不同初始浓度处理下反应液中菌株MA的数量, 结果表明, 嗪草酮浓度低于100 mg · L-1时, 菌株MA利用培养基中嗪草酮与葡萄糖生长, 反应5 d后, 菌株MA数量相比对照(7.18×106 CFU · mL-1)有所增加, 而当嗪草酮浓度达到200 mg · L-1时, 菌株数量基本维持不变.
| 表 1 不同嗪草酮初始浓度对菌株MA生长和降解的影响 Table 1 Different metribuzin concentration on the growth and degradation by MA |
如图 6a所示, 气相色谱可将嗪草酮原药及产物分离.保留时间(RT)为8.90 min物质的质谱图如6b所示, 可知该物质主要碎片峰的质荷比m/z为213.93、199.91、197.95、183.91、181.88、151.94、143.90、102.97, 由此推断该物质为嗪草酮原药峰.保留时间为8.81 min物质的质谱图如6c所示, 可知该物质主要碎片峰的质荷比m/z为199.97、198.91、183.86、156.93、151.91、143.85, 推断该物质为嗪草酮脱去1个氨基所形成的产物.由此推测出菌株MA降解嗪草酮的代谢途径如图 7所示.
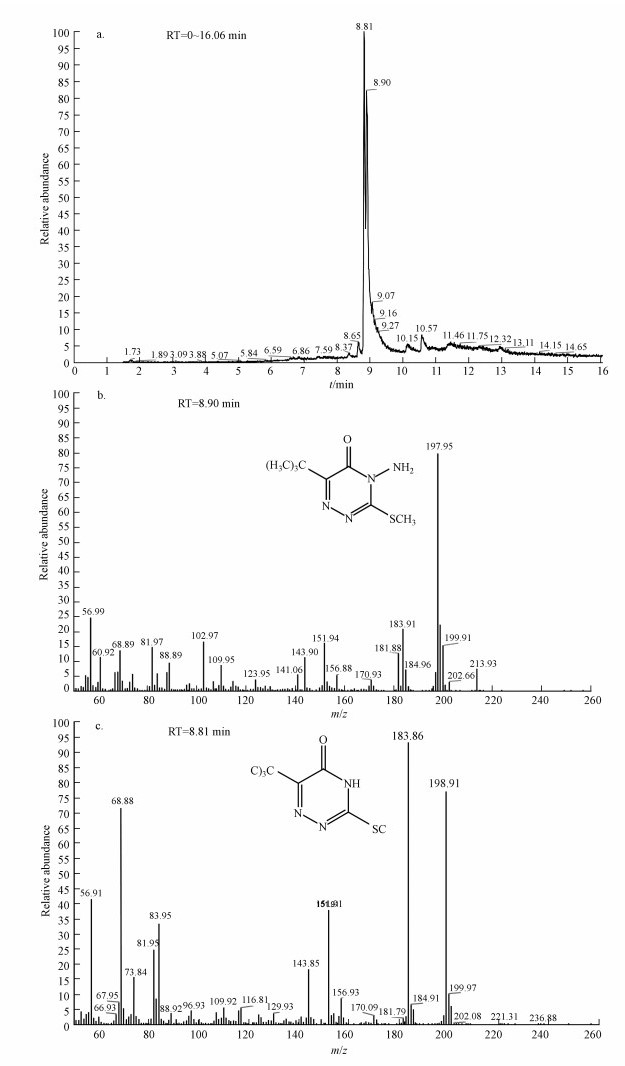 |
| 图 6 菌株MA降解嗪草酮的GC-MS分析 Fig. 6 GC-MS spectrum analysis of metabolites degradation by strain MA |
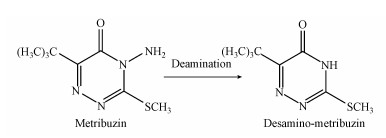 |
| 图 7 菌株MA降解嗪草酮的代谢途径 Fig. 7 Proposed pathway for the metribuzin degradation by strain MA |
海藻酸钠具有生物毒性小、价廉易得且包埋固定化步骤简单等优点, 因而被广泛用于固定化细胞.本研究也采取常规的SA作为包埋剂, 设计四因素三水平正交试验, 探索菌株MA-GFP固定化的最佳参数.SA固定化影响因素如表 2所示, 即SA浓度(A)、包埋比(SA体积/菌液体积) (B)、交联时间(C)、CaCl2浓度(D).
| 表 2 正交试验因素水平表 Table 2 Factors and levels of the orthogonal test |
将不同处理的固定化细胞加入嗪草酮终浓度为50 mg · L-1的GMSM培养基中, 30 ℃、200 r · min-1培养5 d, 测定嗪草酮降解率.如表 3所示, 本试验中各因子的最佳水平分别为A2、B2、C3与D1, 结合A2B2C3D1组合的降解率为71.18%, 高于其他8种组合.因此, 菌株MA-GFP固定化细胞的最佳方案为A2B2C3D1.后续污染水体修复所需的固定化菌体细胞以此方案进行.极差Rj越大, 表明实验因子对结果的影响越大.本试验中, RC>RD>RB>RA, 因此, 交联时间对固定化效果的影响最大, 其次是CaCl2浓度、包埋比、SA浓度.
| 表 3 正交试验表 Table 3 Tab of the orthogonal test |
为探究菌株MA-GFP对不同水体环境中嗪草酮的修复能力, 选择池塘水、湖水作为供试环境进行研究.对供试水体的理化性质进行测定:池塘水pH为7.58, 高锰酸盐19.23 mg · L-1、总氮7.39 mg · L-1、氨氮2.91 mg · L-1、硝酸盐0.86 mg · L-1、亚硝酸盐0.03 mg · L-1、总磷0.60 mg · L-1、正磷酸盐0.082 mg · L-1、有机碳18.30 mg · L-1;湖水pH为7.67, 高锰酸盐3.78 mg · L-1、总氮5.42 mg · L-1、氨氮0.06 mg · L-1、硝酸盐0.79 mg · L-1、亚硝酸盐0.02 mg · L-1、总磷0.38 mg · L-1、正磷酸盐0.020 mg · L-1、有机碳2.85 mg · L-1.
不同处理条件下, 水体中嗪草酮浓度的动态变化如图 8所示.由图可知, 处理20 d后, 未接种菌株MA-GFP的水体样品中, 分别有13.5%(池塘水)和12.1%(湖水)的嗪草酮被降解.当接种MA-GFP菌悬液后, 嗪草酮的降解率提高到69.9%(池塘水)和72.1%(湖水).此外, 接种固定化MA-GFP的水体样品中, 嗪草酮的降解率高于接种菌悬液MA-GFP(池塘水82.1%, 湖水87.3%), 表明菌株对水体中嗪草酮的去除有显著的促进作用.不同处理条件下, 菌株MA-GFP在水体中的数量变化如图 9所示.由图可知, 菌株MA-GFP的数量随着时间延长而不断下降, 10 d内下降趋势缓慢, 未固定化处理的水体中菌株数量在10 d时分别达到8.13×105 CFU · mL-1(池塘水)和1.02×106 CFU · mL-1(湖水), 固定化处理的水体中菌株数量分别为3.72×106 CFU · mL-1(池塘水)和4.68×106 CFU · mL-1(湖水), 在此时间段内, 菌株对嗪草酮的降解较为迅速.而在10~20 d内, 菌株在水体中的数量急速下降, 对嗪草酮的降解效率降低;但固定化处理的水体样品中, 菌株MA-GFP数量始终高于未固定化处理的样品, 表明固定化细胞这一处理方式可显著提高菌株MA-GFP的存活, 进而增强菌株的修复能力.
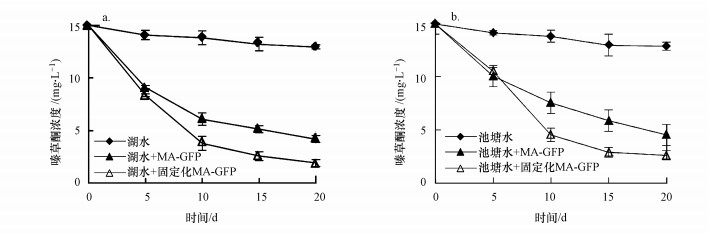 |
| 图 8 固定化处理对菌株MA-GFP降解湖水(a)与池塘水(b)中嗪草酮的影响 Fig. 8 Effect of immobilization treatment on the metribuzin degradation by MA-GFP in lake(a) and pond(b) water |
农业生产中大量施用除草剂以防除田地中杂草, 提高作物的质量及产量, 从而提高经济效益, 但除草剂的环境残留问题也随着其使用量的增加而愈发严重.残留的除草剂会污染土壤、地下水、饮用水, 对农作物产生药害, 对水生生物产生毒性, 也可对小鼠的免疫系统或分泌系统产生重大影响(宋嫚, 2015).部分除草剂可被初级生产者积累进入食物链, 从而危害人类健康.三氮苯类除草剂的使用量逐年增长, 2010年全球三嗪类除草剂的销售市场位列19类除草剂的第6位, 2010年, 嗪草酮全球的销售额达到1.4亿美元(张一宾等, 2013).近年来, 人们在地表水、地下水、河水中频繁检测到嗪草酮, 表明嗪草酮污染治理已刻不容缓.微生物修复以其绿色环保、无二次污染的优势成为环境污染治理的重要手段.目前, 有关嗪草酮高效降解菌株的报道相对较少, 并且没有其污染水体修复的相关数据.菌株直接投加到污染环境中往往由于菌株的生存与定殖受限, 导致降解效率低下, 从而制约了微生物修复的推广与发展.因此, 寻求高效且无二次污染的降解菌种, 并采取相关措施提高其在环境中的存活能力, 是保证微生物修复嗪草酮污染环境的关键.
本研究分离获得的菌株MA鉴定为红球菌属(Rhodococcus sp.)的1株细菌, 丰富了嗪草酮降解的微生物资源.Zhang等(2014)研究发现, 菌株Bacillus sp. N1在反应5 d后对50 mg · L-1和100 mg · L-1嗪草酮的降解率分别为60%和45%, 低于本研究中菌株MA的降解效率, 且该研究缺乏降解途径的相关研究, 当接种菌株N1至20 mg · kg-1嗪草酮污染的土壤中, 至终浓度为1011 CFU · g-1, 30 d时对嗪草酮的降解率为66.4%, 土壤中接种降解菌的浓度过高, 极有可能对土著微生物及土壤理化性质产生不利影响;Gopal等(2011)研究指出, 菌株Burkholderia cepacia CH9在20 d内对50 mg · L-1嗪草酮的降解率为86.0%, 但关于菌株的降解特性、嗪草酮污染环境修复的可行性等均无报道;Huang等(2017)研究表明, 菌株Paracoccus sp. QCT6在7 d内对50 mg · L-1嗪草酮的降解率为86.4%, 接种至玉米根际土壤, 20 d时对15 mg · kg-1嗪草酮的降解率为75.7%, 可较好地修复玉米根际环境, 保证玉米的生长, 而关于如何提高菌株在环境中的存活能力这一关键点并无报道.菌株MA能脱去嗪草酮苯环上的氨基, 形成脱氨基嗪草酮, 5 d对50 mg · L-1嗪草酮的降解率达到74.8%, 最适降解温度和pH分别为30 ℃和7.0.此外, Rhodococcus属的菌株为革兰氏阳性菌, 在土壤中种类多、数量大、代谢类型多样, 在一些特定的极端环境中也能生存(Shao et al., 1995).综合菌株MA的降解特性和生存能力, 表明其具备修复嗪草酮污染环境的潜力, 而修复效率受环境条件及菌株存活能力的限制, 其中, 温度和pH对菌株的降解效率影响显著, 28~30 ℃及pH=7.0~8.0的条件下, 菌株MA的降解效率最高.因此, 夏天的温度环境更适合菌株对水体进行原位修复, 同时可利用生石灰、大苏打、磷酸二氢钠等物质调节水体pH, 从而提高菌株的修复效率.针对如何提高菌株在环境中的存活能力, 可采用固定化细胞技术, 即利用物理或化学手段将游离的微生物固定于有限的空间, 并能使菌株保持活性的技术, 其中包埋法备受关注, 是目前研究和应用较广泛的方法之一.本研究以海藻酸钠为载体, 相较于其他固定化方法, 该方法具有易操作、成本低、无毒等优点.目前将海藻酸钠固定化细胞应用于农业的报道相对较少, 胡小加等(2004)利用海藻酸钠对枯草芽孢杆菌进行固定化处理, 以提高其在植物根际的定殖;Elkatatny等(2003)用海藻酸钠包埋巴西固氮螺菌, 并将其用于小麦土壤中, 发现固定化后的巴西固氮螺菌存活释放需要一定的湿度;甄静等(2014)采用海藻酸钠对枯草芽孢杆菌包埋固定化, 提高了菌株对环境的耐受性.固定化过程中除了海藻酸钠, Ca2+浓度决定着固定化小球内部空间网络之间的交联程度(Park et al., 2002), 与海藻酸钠浓度一样, 过高或过低的Ca2+浓度都会影响固定化细胞的活性, 其他因素还有包埋比与固定时间.随着嗪草酮的广泛应用, 其环境污染问题日益突出, 尽管微生物修复显示出了强大的优势, 但外加菌株往往会受到土著微生物的竞争与排斥, 无法发挥正常的功能.目前, 关于嗪草酮降解菌株固定化处理的研究尚未见报道.本研究通过正交试验, 确定最佳固定化参数, 并将固定化处理的菌体细胞用于后续污染水体的修复.
当菌体细胞被海藻酸钠包埋固定化后, 一方面菌体由于固定化包埋会失去部分活性, 另一方面菌体生存空间受限制, 营养物质的运输会受到一定的阻碍.菌株在适应生存的条件下, 固定化细胞无明显优势, 而将菌株置于复杂生存环境中, 细胞被包裹, 耐受性提高, 能更有效地发挥菌株的降解功能.本实验所使用的水体样品采自池塘水与湖水, 生存环境复杂, 根据水体理化指标, 相比于天然湖水, 池塘水物质充足, 污染更为严重, 限制了菌株MA的生长, 导致菌株与其他微生物之间的竞争力下降;或者由于池塘水环境因子太过复杂, 影响了菌株与嗪草酮的结合, 导致菌株MA在池塘水中的降解率低于湖水样品.此外, 固定化处理污染水样中的菌株含量始终高于未固定化处理样品, 伴随着菌株降解效率的提高.而菌株发挥降解功能需要达到一定浓度, 低于此浓度, 降解效率很低.因此, 本实验前10 d, 菌株细胞浓度较高, 嗪草酮迅速降解, 而10 d以后, 细胞浓度降低, 嗪草酮降解有变缓慢的趋势(图 8、图 9).目前, 关于嗪草酮修复污染环境的报道较少, 且无水体修复的相关数据.本实验通过固定化处理, 将水体中15 mg · L-1嗪草酮的降解效率分别提高了15.2%(湖水:72.1%~87.3%)和12.7%(池塘水:69.9%~82.6%), 可为后续嗪草酮污染水体的修复提供性能良好的菌种资源和处理方式, 具有广阔的应用前景.
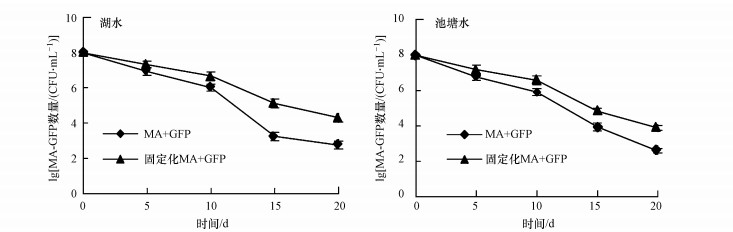 |
| 图 9 不同处理条件下菌株MA-GFP的数量 Fig. 9 The number of strains MA-GFP under different treatment conditions |
1) 从农田土壤中分离筛选得到1株嗪草酮高效降解菌株Rhodococcus sp. MA, 通过脱氨基作用将嗪草酮降解为脱氨基嗪草酮, 5 d内可将50 mg · L-1的嗪草酮降解74.8%, 最适反应温度和初始pH分别为30 ℃和7.0.
2) 以海藻酸钠为包埋剂, 通过正交试验确定最佳固定化条件为:3%海藻酸钠, 2%CaCl2, 包埋比8 : 1, 固定时间6 h.水体修复实验中, 固定化处理可提高菌株的存活能力, 进而增强菌株的修复效果, 对湖水和池塘水中15 mg · L-1嗪草酮的降解率分别达到87.3%和82.6%, 分别提高了15.2%和12.7%.
Baranowska I, Barchańska H, Pacak E. 2006. Procedures of trophic chain samples preparation for determination of triazines by HPLC and metals by ICP-AES methods[J]. Environmental Pollution, 143(2): 206-211. DOI:10.1016/j.envpol.2005.11.039 |
东秀珠, 蔡妙英. 2000. 常见细菌系统鉴定手册[M]. 北京: 科学出版社.
|
Elkatatny M H, Hetta A M, Shaban G M, et al. 2003. Improvement of cell wall degrading enzymes production by alginate encapsulated Trichoderma spp[J]. Food Technology and Biotechnology, 41(3): 219-225. |
Gopal M, Dutta D, Jha S, et al. 2011. Biodegradation of imidaclopridand metribuzin by Burkholderia cepacia strain CH9[J]. Pesticide Research Journal, 23(1): 36-40. |
Huang X, Zhang H, Chen F, et al. 2017. Colonization of Paracoccus sp.QCT6 and enhancement of metribuzin degradation in maize rhizosphere soil[J]. Current Microbiology, 75(7): 1-7. |
胡小加, 江木兰, 张银波. 2004. 固定化植物促生菌的存活性研究[J]. 中国油料作物学报, 26(3): 54-56. DOI:10.3321/j.issn:1007-9084.2004.03.012 |
Ke Z, Yang M J, Jia W B, et al. 2018. Chitinophaga parva sp.nov., a new member of the family Chitinophagaceae, isolated from soil in a chemical factory[J]. International Journal of Systematic and Evolutionary Microbiology, 68(11): 3452-3457. DOI:10.1099/ijsem.0.003006 |
Larkin M, Blackshields G, Brown N, et al. 2007. Clustal W and clustal X version 2.0[J]. Bioinformatics, 23(21): 2947-2948. DOI:10.1093/bioinformatics/btm404 |
Lin A Y, Reinhard M. 2005. Photodegradation of common environmental pharmaceuticals and estrogens in river water[J]. Environmental Toxicology and Chemistry:An International Journal, 24(6): 1303-1309. DOI:10.1897/04-236R.1 |
Majumdar K, Singh N. 2007. Effect of soil amendments on sorption and mobility of metribuzin in soils[J]. Chemosphere, 66(4): 630-637. DOI:10.1016/j.chemosphere.2006.07.095 |
Nie Z J, Hang B J, Cai S, et al. 2011. Degradation of cyhalofop-butyl (CyB) by Pseudomonas azotoformans strain QDZ-1 and cloning of a novel gene encoding CyB-hydrolyzing esterase[J]. Journal of Agricultural and Food Chemistry, 59(11): 6040-6046. DOI:10.1021/jf200397t |
Park D H, Cha J M, Ryu H W, et al. 2002. Hydrogen sulfide removal utilizing immobilized Thiobacillus sp.IW with Ca-alginate bead[J]. Biochemical Engineering Journal, 11(2): 167-173. |
Shao Z Q, Seffens W, Mulbry W, et al. 1995. Cloning and expression of the s-triazine hydrolase gene (trzA) from Rhodococcus corallinus and development of Rhodococcus recombinant strains capable of dealkylating and dechlorinating the herbicide atrazine[J]. Journal of Bacteriology, 177(20): 5748-5755. DOI:10.1128/JB.177.20.5748-5755.1995 |
宋嫚.2015.嗪草酮降解菌株的分离、降解特性及生物修复研究[D].南京: 南京农业大学
|
Tamura K, Peterson D, Peterson N, et al. 2011. MEGA5:molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods[J]. Molecular Biology and Evolution, 28(10): 2731-2739. DOI:10.1093/molbev/msr121 |
王恒亮, 吴仁海, 职倩倩, 等. 2013. 除草剂作用机制研究进展[J]. 河南农业科学, 42(12): 11-15. DOI:10.3969/j.issn.1004-3268.2013.12.003 |
Whitman W B. 2013. Systematic bacteriology[J]. Asian Australasian Journal of Animal Sciences, 26(9): 1237-1246. DOI:10.5713/ajas.2013.13040 |
薛景波, 毛健, 刘双平. 2018. 黄酒麦曲微生物总DNA提取方法比较[J]. 食品与生物技术学报, 37(2): 217-223. DOI:10.3969/j.issn.1673-1689.2018.02.017 |
Zhang H, Zhang Y B, Hou Z G, et al. 2014. Biodegradation of triazine herbicide metribuzin by the strain Bacillus sp.N1[J]. Journal of Environmental Science and Health.Part.B, 49(2): 79-86. DOI:10.1080/03601234.2014.844610 |
张一宾. 2006. 世界三嗪类除草剂的发展概况[J]. 中国农药, 2: 25-26. |
张一宾, 钱虹. 2013. 均三氮苯类除草剂的品种、市场及发展[J]. 世界农药, 35(3): 20-22. DOI:10.3969/j.issn.1009-6485.2013.03.004 |
甄静, 王继雯, 李冠杰, 等. 2014. 海藻酸钠固定化包埋对枯草芽孢杆菌有机磷降解效果的影响[J]. 中国农学通报, 30(18): 84-88. DOI:10.11924/j.issn.1000-6850.2013-2820 |
Zhong M, Chen Y. 2009. Photochemical fate of metribuzin in aqueous solution under simulated sunlight irradiation[J]. Acta Scientiae Circumstantiae, 29(7): 1470-1474. |
 2020, Vol. 40
2020, Vol. 40


