近年来, 为促进动物生长和降低疾病风险, 铜(Cu)和锌(Zn)等重金属元素被不断添加入畜禽养殖的动物饲料中(Li et al., 2019; Zhang et al., 2019).然而这些元素并不能被动物完全吸收, 大部分随粪便排出, 造成巨大的环境风险, 最终对人类的健康造成不可估量的伤害(Huang et al., 2017; Yang et al., 2019).因此, 在畜禽粪便被排入环境之前, 对其进行适当的处理是有必要的.
目前, 对于畜禽粪便的最佳处置方式就是堆肥法(Chen et al., 2017; Hagemann et al., 2018).但是传统的堆肥法不仅周期长, 且粪便中重金属的生物可利用性没有得到有效降低(Lang et al., 2019; Li et al., 2019).此外, 传统堆肥过程中氮流失严重, 不仅产生恶臭, 还削弱了堆肥产品的农用价值(Ren, 2010; Tiquia et al., 2012; Ren et al., 2018).多数研究表明, 好氧堆肥过程中氮素损失占总氮的45%~71%(Jiang et al., 2015; Chen et al., 2019).因此, 如何在降低畜禽粪便中重金属生物可利用性的同时, 改善堆肥过程中氮的流失已成为人们关注的焦点(Xi et al., 2007; Zhang et al., 2011).
许多研究表明, 在堆肥过程中添加外源微生物菌剂可提高堆肥效率, 有利于重金属钝化, 并减少氮的流失(Sarkar et al., 2010; Zeng et al., 2010).如Zhang等(2013)观察到黄孢原毛平革菌接种改善了理化参数, 提高了底物利用率.Zhao等(2016)发现放线菌接种可促进堆肥过程中的纤维素降解, 加速了堆肥进程.Guo等(2017)在寒冷的气候条件下, 接种嗜冷-嗜热复合微生物剂促进了牛粪的堆肥化.Xiang等(2000)接种铁氧化细菌对污泥堆肥中的重金属进行了钝化, 使Cu和Zn的钝化率分别提高了48.6%和11.2%.Xu等(2019)接种地衣芽孢杆菌对牛粪堆肥进行了固氮(Xu et al., 2019).由此可知, 添加外源微生物菌剂在堆肥行业中应用广泛, 筛选并制备高效的好氧堆肥菌剂, 对提高堆肥效率具有重要意义.
本研究以猪粪为堆肥原料, 采用接种以黄孢原毛平革菌(p)、黑曲霉(a)和地衣芽孢杆菌(b)为主的系列复合菌剂进行好氧堆肥, 探究了添加不同配比菌剂对推进堆肥进程和堆肥效果、重金属钝化以及堆肥过程中氮转化的影响, 并对好氧堆肥接种复合菌剂解决畜禽粪便中的重金属污染和氮损失问题的机理进行了初步的探讨.
2 材料与方法(Materials and methods) 2.1 供试材料堆肥材料由新鲜猪粪、水稻秸秆和糖蜜组成.新鲜猪粪从中国广州某养猪场采集.收集的水稻秸秆来自广州市增城区的稻田,用秸秆粉碎机碾碎至2~4 cm.糖蜜购买自广西博华食品有限公司(中国广西).表 1列出了最初的堆肥材料的物理和化学特性.
| 表 1 堆肥原料的理化性质 Table 1 Physiochemical properties of composting materials |
黄孢原毛平革菌(BKMF-1767)(p)购买自中国典型培养物保藏中心(武汉).采用以羧甲基纤维素钠为碳源的方法对牛粪及其自然堆肥样品进行纤维素降解菌的分离, 再结合纤维素刚果红水解圈测定和滤纸条降解实验做进一步筛选, 最终分离纯化出具有优良纤维素降解能力的真菌, 经形态学和18S rDNA序列分析鉴定为黑曲霉菌.刮取孢子于无菌蒸馏水中混匀制取孢子悬浮液.通过高温筛选法和生物量检测法得到嗜热菌, 具体步骤为:取猪粪样品于离心管中, 加入适量生理盐水, 充分振荡使其分布均匀后, 置于100 ℃沸水中保持12 h.取出后逐步稀释, 进行涂布培养得到初筛的几个菌株, 分离纯化.将初筛得到的菌株接种于牛肉膏蛋白胨培养基, 分别于35、45、55、65、75 ℃, 170 r·min-1进行摇床培养5 d, 每12 h取一次样通过分光光度计测OD值, 选取生物量最高的菌株作为本次实验添加的嗜热菌, 经鉴定为地衣型芽孢杆菌.
微生物菌剂设置如表 2所示, 其接种总量均为物料干重的0.2%, 同时加入5%物料干重的糖蜜.
| 表 2 各处理的菌剂设置 Table 2 Bacteria agents setting of each treatment |
在室内放置了7个嵌有聚苯乙烯的木箱作为堆肥的装置, 如图 1所示, 每个装置中加入约14 kg堆肥材料(干重), 装置内部尺寸为0.41 m× 0.41 m× 0.50 m (长×宽×高).温度探头与仪表板相连, 可实时准确地监测堆体每层中心的温度.鼓风机连接流量计, 可将新鲜空气输送至堆体底部.每当温度达到60 ℃, 鼓风机将以1 m3·h-1的鼓风速度开启, 并持续0.5 h.每当温度达到70 ℃, 鼓风机将以1.75 m3·h-1的鼓风速度开启, 并持续1 h.温度在60 ℃以下时, 不开启鼓风装置.堆肥初始, 利用秸秆将堆体的C/N调节至30, 用无菌水含水率调节至60%左右并使其始终维持在60%左右.本次堆肥共持续40 d.
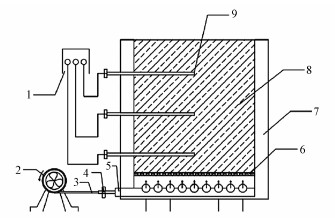 |
| 图 1 装置CAD图 (1.温度采集系统, 2.鼓风机, 3.通风管, 4.流量计, 5.PVC多孔进气管, 6.筛网, 7.聚乙烯, 8.堆肥材料, 9.温度传感器) Fig. 1 The schematic diagram of the composting device |
样品采集于5个纵向剖面和不同深度, 充分混匀后作为当天收集的样品进行理化性质、氮以及重金属的形态检测.每天通过仪表盘定时记录温度, 取其平均值作为当天的温度.采用精密pH计(雷磁, PHS-3C)测定堆体的pH.将取得的新鲜样品与水按质量比1:2混合振荡l h, 取上清液过滤后作为样品浸提液.在洁净无菌的9 cm培养皿内垫上一张滤纸, 均匀放入10颗白菜种子, 准确吸取5 mL堆肥样品浸提液于培养皿中, 25 ℃下于暗处培养24 h后取出测量根长并计算发芽率, 每个样品做3次重复, 同时用灭菌去离子水做空白试验, 然后计算种子发芽指数.
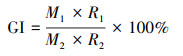
|
(1) |
式中, M1为处理平均发芽率, M2为对照平均发芽率, R1为处理平均跟长, R2为对照平均跟长.
2.5 重金属及各种氮的形态检测方法采用tessier五步提取法进行Cu和Zn的可交换态、碳酸盐结合态、铁锰氧化物结合态、有机结合态和残渣态5种形态的提取, 具体步骤如表 3所示, 并通过ICP(普析, TAS-990)测定每种形态的含量.使用凯氏定氮仪(力辰科技, KDN-04)对堆肥烘干样品的总氮(TN)含量进行测定.使用2 mol·L-1的氯化钾溶液浸提堆肥的新鲜样品, 然后使用流动注射仪(宝德, BDFIA-8000)测定堆肥样品水溶性铵态氮(NH4+-N)和硝态氮(NO3--N).
| 表 3 重金属形态的连续分级提取方法 Table 3 Continuous grading extraction method of heavy metal morphology |
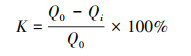
|
(2) |
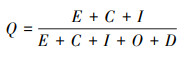
|
(3) |
式中, K为钝化率, Q为生物可利用态占比, Q0和Qi分别为初始和腐熟期的生物可利用态占比, E、C、I、O和D分别为可交换态、碳酸盐结合态、铁锰氧化物结合态、有机结合态和残渣态的含量.
2.6 统计分析数据采用SPSS进行数据统计分析, 根据细菌群落、基本理化性质、氮的4种形态以及重金属之间的皮尔逊相关系数, 使用R 3.1.0绘制相关性热图, 采用Origin 8.5作图软件进行理化性质、重金属以及氮的4种形态作图, 使用WPS软件绘制机理图.
3 结果与讨论(Results and discussion) 3.1 不同菌剂对猪粪堆肥腐熟程度的影响温度、pH、C/N和种子发芽率是发酵的关键指标(Guo et al., 2015).这些因素决定了许多生物过程的速率, 并在微生物群落进化和演替中起着选择性的作用(Wei et al., 2014).堆肥过程中各理化参数的变化见图 2, 各因素差异具有统计学意义(ANOVA, p < 0.05).
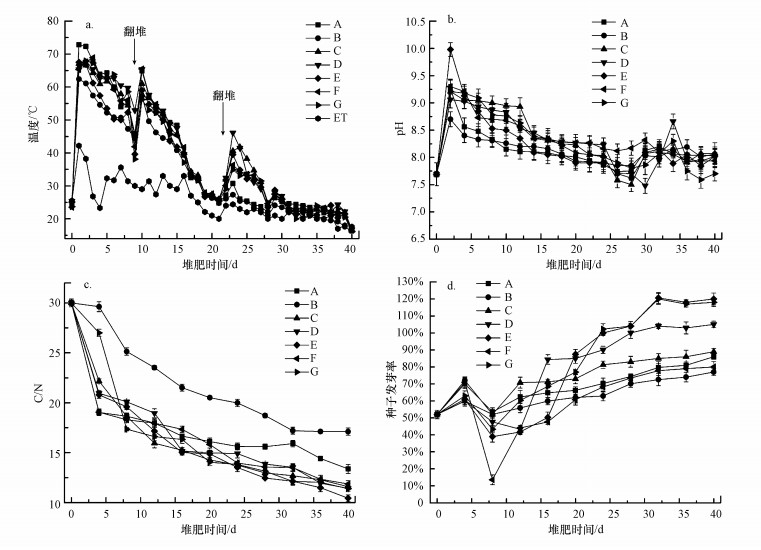 |
| 图 2 不同处理下猪粪堆肥理化性质 Fig. 2 Physicochemical properties of pig manure compost under different treatments |
温度是堆体中微生物活性和堆肥过程性能的一个重要指标, 它遵循了堆肥过程的典型演化规律.如图 2a所示, 在堆肥初期, 各处理的温度迅速在2 h内(升温期0~2 h)上升至60 ℃以上, 这可能是由于大量低分子量物质(如氨基酸、低聚糖、单糖等)被微生物活动降解所致.在第1 d, 处理A~G的温度分别达72.7、62.3、67.1、65.4、67.5、65.3和66.5 ℃, 可以看出处理B(空白组)低于所有菌剂处理, 且处理A(b:p:a=0:1:0)的温度明显高于其他处理, 这可能是由于处理A中单独2%的黄孢原毛平革菌的添加有助于其他微生物降低重金属毒性对生长的影响.但从堆肥本身的角度来说, 堆体过高的温度将抑制微生物的活性, 过度消耗有机质, 并降低堆肥产品的质量, 因此启动鼓风机进行通风降温.各处理发酵温度保持50 ℃以上超过7 d(高温期, 第1~8 d), 足以对猪粪进行充分消毒, 杀死其中各类寄生虫卵和有害致病菌, 达到腐熟标准(Yu et al., 2007; Guo et al., 2015).在本实验中, 处理A~G的高温期分别为8、7、8、13、7、8和8 d, 从高温期维持时间来看, 应是处理D(b:p:a=1:5:5, 生物量)最优.
在高温期结束时, 温度在第9 d急剧下降至最低38.1 ℃, 可能是由于营养物质的减少.随后进行翻堆, 与预期一样, 翻堆后温度在第10 d有明显的升高, 然后在接下来的10 d内下降(冷却阶段, 第11~21 d).最后维持在22 ℃左右(腐熟期, 第30~40 d).在整个堆肥过程中, 环境温度变化范围为17.6~42.2 ℃, 但始终低于堆温.
pH是影响功能微生物群落和有效氮含量的重要因素(Guo et al., 2015).如图 2b所示, 在堆肥开始的2 d内, pH值从初始值7.69迅速增加, 达到峰值.在第2 d, 处理A~G的pH分别达9.26、8.6、9.21、9.04、9.98、9.3和9.23.一般情况下, 在有机物降解过程中, 由于有机和无机酸的释放, pH值会先降低(Chen et al., 2010; Li et al., 2012; Jiang et al., 2015).在本研究中, 初始阶段pH值的增加可能是由于铵离子的产生暂时抵消了有机和无机酸的产生, 随着发酵的进行, 氮矿化促进了更多铵离子的产生, 使pH值升高.随后, 各处理的pH值迅速降低, 且相对于B(CK)来说, 处理A(b:p:a=0:1:0, 生物量)和E(b:p:a=1:8:0, 生物量)下降的趋势尤为显著, 这可能是由于菌剂的添加使硝化作用增强、NH4+-N损失以及大分子有机物产生有机酸和酚类化合物.从第4 d开始, 各处理的pH呈缓慢降低并逐渐趋于稳定的趋势, 基本维持在7.5~8.5, 直到第40 d, 下降到接近8左右, 此时堆肥已经完全腐熟(Guo et al., 2015; Sun et al., 2016).
C/N通常用于评价堆肥的腐熟程度(Mathur et al., 1993).在本文中, 堆肥过程中C/N的变化如图 2c所示.处理A~G的C/N从初始值约30, 到最终值分别为13.3、18、12、11.3、10.4、11.8和11.2, 有明显的下降.处理A~G的C/N的最终值均满足(< 20)堆肥腐熟的标准(Huang et al., 2010), 且处理E(b:p:a=1:8:0, 生物量)中微生物对堆体中各类有机物质的降解最为彻底.此外, 各菌剂组的C/N显著低于空白处理B(CK).
通常通过计算GI值来检测堆肥样品的植物毒性和腐熟度.当GI大于80%时, 可判断堆肥已经腐熟(Sun et al., 2014).在本文中, 堆肥过程中GI的变化如图 2d所示.结果表明, 堆肥样品的GI变化有显著性差异(p < 0.03).处理A~G分别在第36、40、24、16、20、40和24 d GI值达到80%, 可以看出处理D(b:p:a=1:5:5, 生物量)最先达到腐熟, 效果最优.从重金属的毒性角度来看, 添加了黄孢原毛平革菌的处理比未添加该菌种的处理先达到腐熟, 可能的原因是黄孢原毛平革菌能帮助其他微生物抵抗并降低重金属毒性对生长的影响.且其对重金属的防御机制, 包括细胞外螯合和细胞内摄取两种方式(Petr et al., 2003).综上所述, 结合理化性质的4个指标, 在促进堆肥进程和腐熟程度的效果上, 菌剂组远大于空白组, 且在菌剂组中, 菌剂(b+p+a)>菌剂(b+p)>菌剂(p).当b:p:a=1:5:5时(处理D), GI在第16 d达到80%, 且C/N降低至11.4, 效果最佳.这可能是因为相对于菌剂(p), 菌剂(b+p)中嗜热菌(地衣型芽孢杆菌)的添加使得堆肥的高温期延长, 加速了堆体中有机物质的降解.而与菌剂(b+p), 菌剂(b+p+a)中黑曲霉菌的添加可与黄孢原毛平革菌形成协同作用, 进一步促进堆肥达到腐熟.
3.2 不同处理下堆肥重金属含量与形态分布特征为更直观了解Cu和Zn各形态之间的转化, 计算各形态在堆肥各阶段中所占比并通过Origin 8.5绘制了图 3.
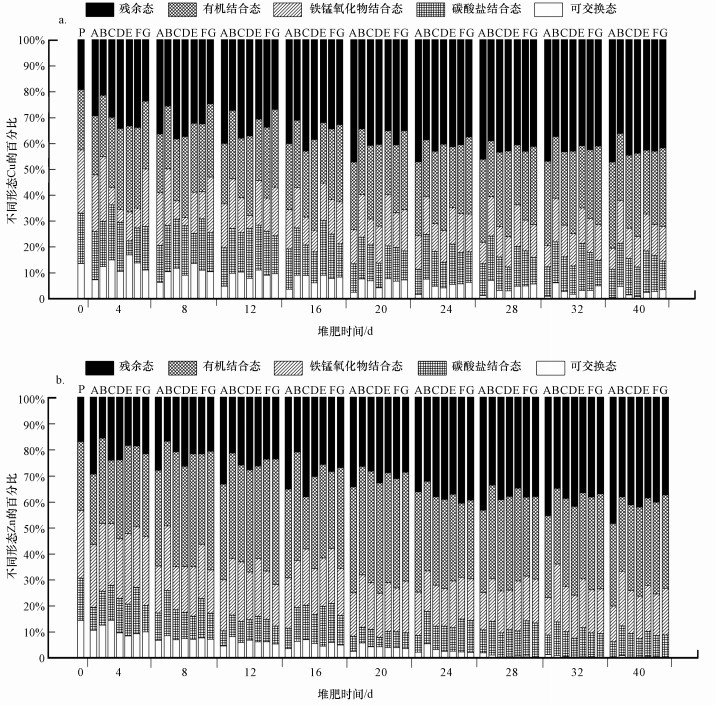 |
| 图 3 不同处理下重金属形态分配率 Fig. 3 Distribution rates of heavy metal morphology under different treatments |
如图 3所示, 堆肥开始时, Cu和Zn主要存在于包括可交换态、碳酸盐结合态以及铁锰氧化物结合态在内的生物可利用态, 占比分别为57%和56%.随着堆肥的进行, Cu和Zn的主要形态由生物可利用态向以有机结合态和残渣态为主的生物难以利用态转化, 在这其中, 碳酸盐结合态和铁锰氧化物结合态变化不明显.
在堆肥第2 d, 可溶性交换态和残渣态的Cu和Zn有明显变化, 这可能是由于堆肥初期在菌剂作用下pH迅速升高形成的碱性环境, 利用Cu和Zn的稳定.这与Singh和Kalamdhad发现的弱碱性条件(pH < 11)有利于形成金属的有机复合体, 造成金属钝化的结果一致(Sun et al., 2014).在本研究中, pH值在第2 d便达到了8.7~9.98, 同时观察到了Cu和Zn的稳定化.
各菌剂组与B(CK)相比, 差异具有显著性.以Zn为例, 在堆肥腐熟期, 菌剂组A、C、D、E、F和G中生物难利用态Zn所占比分别高出B(CK)13.1%、7.3%、9.5%、5.3%、8.5%和6.4%, 其中处理A的钝化效果尤为显著.处理A中Zn和Cu的生物可利用态分别由最初的56%和57.6%降低至22.7%和17.4%, 钝化率分别达59.4%和69.7%.这可能是由于黄孢原毛平革菌分泌的胞外金属螯合剂固定了Cu和Zn, 降低了Cu和Zn的生物利用率, 且黄孢原毛平革菌可以促进有机质的降解, 从而促进腐殖质的产生, 形成有机金属螯合物从而促进重金属的钝化(Mathur et al., 1993).
处理E(b:p:a=1:8:0)和G(b:p:a =1:4:0)(与处理A的b:p:a=0:1:0)相比, 钝化效果较差.但菌剂G对Zn和Cu的钝化效果均略高于处理E(表现为以残渣态和有机结合态为主的生物难利用态比例较高), 说明黄孢原毛平革菌有明显的重金属钝化效果, 且其在菌剂(b+p)中, 并非黄孢原毛平革菌含量越高钝化效果越好, 其在添加菌剂总量中占比80%钝化效果优于89%.此外, 菌剂(b+p+a)的钝化效果优于菌剂(b+p), 可能是由于菌剂(b+p+a)中黑曲霉菌的加入与黄孢原毛平革菌的共同起到了协同钝化的效果.当b:p:a=1:5:5时(处理D), 钝化效果较好.
综上所述, Cu和Zn均由生物可利用转化为生物难以利用状态.主要结论为:①菌剂组的钝化效果明显优于空白组;②在菌剂组中, 钝化效果有:菌剂(p)>菌剂(b+p+a)>菌剂(b+p);③当仅添加菌剂(p)时, 重金属Cu和Zn钝化效率最高, 钝化率分别达69.7%和59.4%.④在菌剂(b+p)中, 并非黄孢原毛平革菌含量越高钝化效果越好, 其在添加菌剂总量中占比80%钝化效果优于89%;⑤在菌剂(b+p+a)添加的处理中, 当b:p:a=1:5:5时(处理D), 即黑曲霉与黄孢原毛平革菌在添加菌剂总量中占比等同时钝化效果最好.
3.3 不同处理下堆肥氮形态特征本实验通过堆体中氮的4种主要存在形态(TN、有机氮、NH4+-N和NO3--N)以及计算总氮和有机氮损失来综合衡量各处理的固氮效果, 如图 4所示.
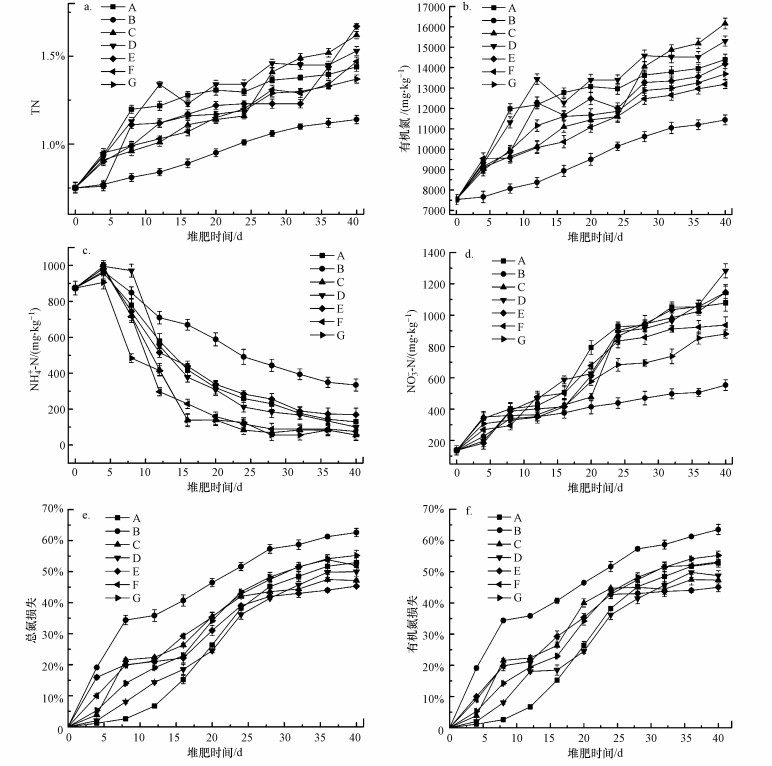 |
| 图 4 不同处理下氮形态变化 Fig. 4 Changes in nitrogen forms under different treatments |
图 4a显示了堆肥过程中总氮的动态变化, 各处理的总氮在堆肥前期的第8~12 d内增长迅速, 至第12 d, 处理A~G的TN分别达1.2179%、0.84%、1.01%、1.34%、1.12%、1.03%和1.12%, 可知菌剂组明显高于空白组(处理B).随后TN稍有下降, 这可能是由于NH4+-N是通过氨化作用下的有机氮的降解和矿化而积累的, 并且可以转化为NH3挥发, 从而导致了少量的氮损失(Sommer et al., 2001).到堆肥后期(第25~40 d), 总氮含量缓慢上升, 并趋于稳定, 一方面可能是由于后期堆肥体积和重量减少产生的浓度效应, 另一方面可能是由于温度降低使得NH3排放较少所致(Zhang et al., 2017).至第40 d, 处理A~G的TN分别达1.44%、1.14%、1.62%、1.53%、1.67%、1.47%和1.37%, 可以看出处理E(b:p:a=1:8:0, 生物量)最优.
在堆肥全过程, 有机氮(图 4b)含量和总氮呈现出非常相似的变化趋势.这可能是由于秸秆和猪粪中氮的形态以有机氮为主, 占比达86.5%.至堆肥末期, 处理A~G的有机氮分别达14397.68、11436.61、16161.03、15303.38、14184.6、13184.6和13690.04 mg·kg-1, 菌剂组均高于空白组, 且处理C(B:P:A=1:3:7, 生物量)最优.通过总氮和有机氮在堆肥过程中的变化可以初步得出, 菌剂的添加有明显的固氮作用.
NH4+-N(图 4c)和NO3--N(图 4d)是氮在硝化和反硝化过程中的主要形式(Guo et al., 2015).以往的研究表明, NH4+-N和NO3--N的变化主要取决于高温、pH、好氧或厌氧条件以及堆肥原始材料中氨氧化菌的活性(Liu et al., 2017; Zhang et al., 2014).在本研究中, 初期的NO3--N含量很低(< 200 mg·kg-1), 低于发酵初期的NH4+-N水平(> 800 mg·kg-1), 这说明新鲜猪粪中无机氮的形态主要以NH4+-N为主.
在堆肥开始时, 由温度变化可知堆体在开堆后2 h内即进入高温期, 氨化反应增加使大量的有机氮通过微生物群落的矿化迅速转化为NH4+-N, 导致pH升高.NH4+-N含量在第4 d即增至峰值, 达到905~967 mg·kg-1.随后, 一方面由于高温高pH条件下大量NH4+-N以NH3的形式挥发, 另一方面NH4+-N被微生物同化为蛋白质、核酸和氨基酸, 导致NH4+-N含量下降, 直至降至最低(Lu et al., 2009).在堆肥的腐熟期, 处理A~G的NH4+-N分别降至129.51、333.988、55.531、99.882、169.382、75.631和55.526 mg·kg-1.有研究表明, NH4+-N的降低可以作为一个评估良好的堆肥和腐熟过程的关键参数, 处理G(b:p:a=1:4:0, 生物量)的NH4+-N低于其他各处理(Riffaldi et al., 1986; Zhang et al., 2017).在整个堆肥过程中, NH4+-N呈现出先升高后降低的趋势, 而NO3--N含量则是不断升高.此外, NO3--N含量在高温期过后增长更为迅速, 可能是由于前期的高温条件抑制了硝化细菌的生长和活动.至第40 d, 处理A~G的NO3--N分别达到1077.652、553.346、1145.255、1283.096、1146.323、936.402和879.968 mg·kg-1, 远高于初始值.一般认为, NH4+-N的减少和NO3--N的增加是发酵成熟的标志(Das et al., 2011; Guo et al., 2015).
根据混合堆肥过程中总氮和有机氮质量的变化, 得到了总氮和有机氮随时间的损失(图 4e和图 4f).与有机氮含量和总氮含量的变化趋势一样, 总氮损失和有机氮损失的变化趋势同样呈现出高度的相似性.在前25 d, 总氮和有机氮损失积累显著, 可能是由于高温高NH4+-N浓度下使NH3排放较多.堆肥后期, 各处理的总氮和有机氮较少, 至堆肥结束时, A~G 7个处理的总氮损失分别为52.9%、62.6%、47.1%、49.9%、45.3%、51.9%、55.2%, 有机氮损失分别为52.8%、63.5%、47.3%、48.7%、45.0%、53.1%、55.3%.可知处理E(b:p:a=1:8:0, 生物量)的总氮和有机氮损失均低于其他处理.且与处理B (CK)相比, 总氮和有机氮损失分别减少了17.3%和18.5%.
综合氮的6个指标(TN、有机氮、NH4+-N、NO3--N、总氮损失和有机氮损失)可得, 菌剂组固氮效果明显优于空白组.在菌剂组中, 固氮效果大致为菌剂(b+p)>(b+p+a)>菌剂(p).在二菌复合菌剂添加的处理中, 以处理E(b:p:a=1:8:0, 生物量)为固氮效果最优, 与处理B(CK)相比, 总氮和有机氮损失分别减少了17.3%和18.5%.
3.4 接种菌剂的作用机理分析为了识别在堆肥过程中参与重金属钝化和固氮的重要菌属, 进一步探讨进行重金属钝化和固氮的可能机理.利用皮尔逊相关分析研究了氮的4种形态(TN、有机氮、NH4+-N和NO3--N)、Cu和Zn的生物难利用态(铁锰氧化物结合态、有机结合态、残渣态)、基本理化性质与细菌群落(前50个细菌属)的共现模式(图 5a).
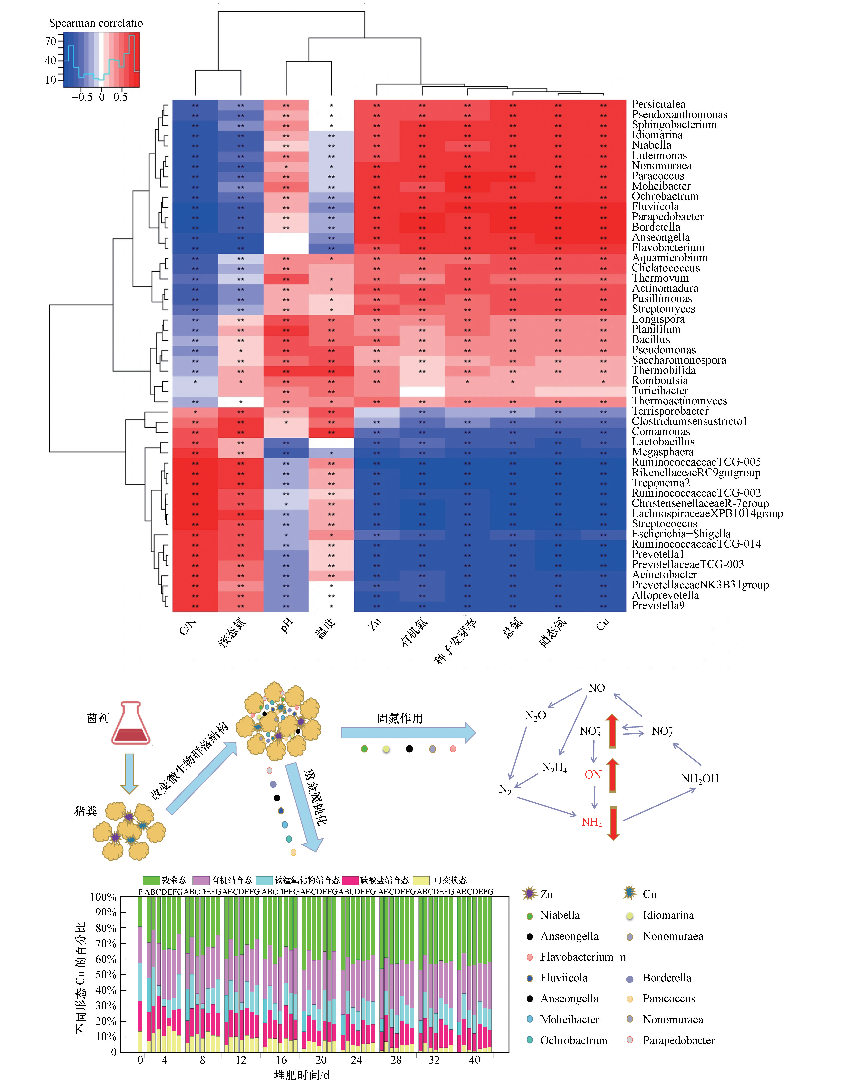 |
| 图 5 皮尔逊相关分析热图(a)和好氧堆肥接种菌剂的作用机理图(b) (*, 0.01 < p < 0.05, **, 0.001 < p < 0.01) Fig. 5 Pearson correlation analysis heat map (a) and mechanism of aerobic compost inoculation |
结果表明, 氮的4种形态、Cu和Zn的生物难利用态与微生物群落之间存在显著的相关性.具体表现为:Niabella、Idiomarina、Nonomuraea、Flavobacterium、Anseongella与有机氮、总氮和硝态氮间呈显著的正相关性, 而与铵态氮呈明显的负相关性, 表明这些菌属可能具有潜在的固氮作用.此外, Anseongella、Bordetella、Parapedobacter、Fluviicola、Ochrobactrum、Moheibacter、Paracoccus、Nonomuraea与Cu和Zn两种重金属的生物难利用态呈强烈的正相关性, 表明这些菌属可能在重金属钝化过程中发挥了重要作用, 可能具有潜在的重金属钝化作用.因此, 皮尔逊的热图分析也通过测定其潜在的作用菌, 证实了细菌群落对堆肥过程中重金属钝化和固氮的重要影响.基于此, 本文初步探讨了本实验中添加复合菌剂进行好氧堆肥进行重金属钝化和固氮的可能机理.
图 5b揭示了受重金属污染的猪粪通过接种复合菌剂进行好氧堆肥处理的可能机制.图中主要展示了堆肥过程中氮的内循环, 含无机废物的有机氮可以通过化学反应降解为NH4+.一部分NH4+转化为NH3挥发损失, 另一部分NH4+转化为NH2OH并进一步转化为NO2-, NO3-也可以转化为ON和NO2-, 部分NO2-转化为NO, 再通过反硝化作用转化为N2和N2O而损失(Maeda et al., 2011).这些氮的损失会降低作为肥料的堆肥产品的质量.基于此, 本实验以TN、ON、NH4+-N和NO3--N为主要指标研究对堆体内的氮元素进行固定.
复合菌剂接种的机理大致分为两步:第一步, 制备菌剂, 加入被Zn和Cu污染的猪粪中, 并混合均匀.第二步, 堆体在添加的微生物菌剂作用下迅速升温达到高温期, 与此同时pH值达到9以上, 堆体形成碱性环境, 堆体理化性质的变化使得堆体中的微生物群落结构发生改变, 促进了固氮菌(Niabella、Idiomarina、Nonomuraea、Flavobacterium、Anseongella)和重金属钝化菌(Anseongella、Bordetella、Parapedobacter、Fluviicola、Ochrobactrum、Moheibacter、Paracoccus、Nonomuraea)短时间内大量繁殖.它们在固氮和钝化重金属同时, 迅速推进堆肥进程.最终, 在短时间内达到了良好的堆肥效果.
4 结论(conclusions)1) 添加不同配比的菌剂促进堆肥腐熟的效果和进程不同:菌剂组远大于空白组, 且在菌剂组中, 菌剂(b+p+a)>菌剂(b+p)>菌剂(p).当b:p:a=1:5:5时(处理D), GI在第16 d即达到80%, 且C/N降低至11.4, 效果最佳.
2) 添加不同配比的菌剂促进堆肥过程重金属钝化的效果不同:菌剂组的钝化效果明显优于空白组, 在菌剂组中, 钝化效果有:菌剂(p)>菌剂(b+p+a)>菌剂(b+p).最佳菌剂处理A, 即菌剂(p), 至堆肥结束时, 以可交换态、碳酸盐结合态以及铁锰氧化物结合态为主的Zn和Cu生物可利用态分别由最初的56%和57.6%降低至22.7%和17.4%, 钝化率分别达59.4%和69.7%.
3) 综合氮的6个指标可得, 菌剂组固氮效果明显优于空白组.在菌剂组中, 固氮效果大致为菌剂(b+p)>菌剂(b+p+a)>菌剂(p).以处理E(b:p:a=1:8:0, 生物量)为固氮效果最优, 与处理B(CK)相比, 总氮和有机氮损失分别减少了17.3%和18.5%.
4) 本实验对好氧堆肥接种复合菌剂解决畜禽粪便中的重金属污染问题、氮流失问题以及传统堆肥的长周期问题的机理进行了初步的探讨.
Chen M, Wang C, Wang B, et al. 2019. Enzymatic mechanism of organic nitrogen conversion and ammonia formation during vegetable waste composting using two amendments[J]. Waste Management, 95: 306-315. DOI:10.1016/j.wasman.2019.06.027 |
Chen Y, Liu Y, Li Y, et al. 2017. Influence of biochar on heavy metals and microbial community during composting of river sediment with agricultural wastes[J]. Bioresource Technology, 243: 347-355. DOI:10.1016/j.biortech.2017.06.100 |
Chen Y X, Huang X D, Han Z Y, et al. 2010. Effects of bamboo charcoal and bamboo vinegar on nitrogen conservation and heavy metals immobility during pig manure composting[J]. Chemosphere, 78(9): 1177-1181. DOI:10.1016/j.chemosphere.2009.12.029 |
Das M, Uppal H S, Singh R, et al. 2011. Co-composting of physic nut (Jatropha curcas) deoiled cake with rice straw and different animal dung[J]. Bioresource Technology, 102(11): 6541-6546. DOI:10.1016/j.biortech.2011.03.058 |
Gou C, Wang Y, Zhang X, et al. 2017. Inoculation with a psychrotrophic-thermophilic complex microbial agent accelerates onset and promotes maturity of dairy manure-rice straw composting under cold climate conditions[J]. Bioresource Technology, 243: 339-346. DOI:10.1016/j.biortech.2017.06.097 |
Guo H, Zhu C, Geng B, et al. 2015. Improved fermentation performance in an expanded ectopic fermentation system inoculated with thermophilic bacteria[J]. Bioresource Technology, 198: 867-875. DOI:10.1016/j.biortech.2015.09.105 |
Hagemann N, Subdiaga E, Orsetti S, et al. 2018. Effect of biochar amendment on compost organic matter composition following aerobic composting of manure[J]. Science of the Total Environment, 613-614: 20-29. DOI:10.1016/j.scitotenv.2017.08.161 |
Huang D L, Zeng G M, Feng C L, et al. 2010. Changes of microbial population structure related to lignin degradation during lignocellulosic waste composting[J]. Bioresource Technology, 101: 4062-4067. DOI:10.1016/j.biortech.2009.12.145 |
Huang H, Yang T, Lai F, et al. 2017. Co-pyrolysis of sewage sludge and sawdust/rice straw for the production of biochar[J]. Journal of Analytical and Applied Pyrolysis, 125: 61-68. DOI:10.1016/j.jaap.2017.04.018 |
Jiang J, Liu X, Huang Y, et al. 2015. Inoculation with nitrogen turnover bacterial agent appropriately increasing nitrogen and promoting maturity in pig manure composting[J]. Waste Management, 39: 78-85. DOI:10.1016/j.wasman.2015.02.025 |
Lang Q, Chen M, Guo Y, et al. 2019. Effect of hydrothermal carbonization on heavy metals in swine manure:speciation, bioavailability and environmental risk[J]. Waste Management, 234: 97-103. |
Li J, Xu Y, Wang L, et al. 2019. Heavy metal occurrence and risk assessment in dairy feeds and manures from the typical intensive dairy farms in China[J]. Environmental Science and Pollution Research International, 26(7): 6348-6358. DOI:10.1007/s11356-019-04125-1 |
Li M, Ren L, Zhang J C, et al. 2019. Population characteristics and influential factors of nitrogen cycling functional genes in heavy metal contaminated soil remediated by biochar and compost[J]. Science of the Total Environment, 651: 2166-2173. DOI:10.1016/j.scitotenv.2018.10.152 |
Li R, Wang J, Zhang Z, et al. 2012. Nutrient transformations during composting of pig manure with bentonite[J]. Bioresource Technology, 121: 362-368. DOI:10.1016/j.biortech.2012.06.065 |
Liu W, Huo R, Xu J, et al. 2017. Effects of biochar on nitrogen transformation and heavy metals in sludge composting[J]. Bioresource Technology, 235: 43-49. DOI:10.1016/j.biortech.2017.03.052 |
Lu Y, Wu X, Guo J. 2009. Characteristics of municipal solid waste and sewage sludge co-composting[J]. Waste Management, 29(3): 1152. DOI:10.1016/j.wasman.2008.06.030 |
Maeda K, Hanajima D, Toyoda S, et al. 2011. Microbiology of nitrogen cycle in animal manure compost[J]. Microbial Biotechnology, 4: 700-709. DOI:10.1111/j.1751-7915.2010.00236.x |
Mathur S P, Owen G, Dinel H, et al. 1993. Determination of compost biomaturity. Ⅰ. Literature review[J]. Biological Agriculture & Horticulture, 10: 65-85. |
Petr B. 2003. Interactions of heavy metals with white-rot fungi[J]. Enzyme and Microbial Technology, 32: 78-91. DOI:10.1016/S0141-0229(02)00245-4 |
Ren L, Cai C, Zhang J C, et al. 2018. Key environmental factors to variation of ammonia-oxidizing archaea community and potential ammonia oxidation rate during agricultural waste composting[J]. Bioresource Technology, 270: 278-285. DOI:10.1016/j.biortech.2018.09.042 |
Ren L, Schuchardt F, Shen Y, et al. 2010. Impact of struvite crystallization on nitrogen losses during composting of pig manure and cornstalk[J]. Waste Management, 30(5): 885-892. DOI:10.1016/j.wasman.2009.08.006 |
Riffaldi R, Levi-Minzi R, Pera A, et al. 1986. Evaluation of compost maturity by means of chemical and microbial analyses[J]. Waste Management & Research, 4(4): 387-396. |
Sarkar S, Banerjee R, Chanda S, et al. 2010. Effectiveness of inoculation with isolated Geobacillus strains in the thermophilic stage of vegetable waste composting[J]. Bioresource Technology, 101(8): 2892-2895. DOI:10.1016/j.biortech.2009.11.095 |
Sommer S G. 2001. Effect of composting on nutrient loss and nitrogen availability of cattle deep litter[J]. European Journal of Agronomy, 14: 123-133. DOI:10.1016/S1161-0301(00)00087-3 |
Sun D, Lan Y, Xu E G, et al. 2016. Biochar as anovel niche for culturing microbial communities in composting[J]. Waste Management, 54: 93-100. DOI:10.1016/j.wasman.2016.05.004 |
Sun X P, Lu P, Jiang T, et al. 2014. Influence of bulking agents on CH4, N2O, and NH3 emissions during rapid composting of pig manure from the Chinese Ganqinfen system[J]. Journal of Zhejiang University-Science B, 15: 353-364. DOI:10.1631/jzus.B13a0271 |
Tiquia S M, Tam N F. 2002. Characterization and composting of poultry litter in forced-aeration piles[J]. Process Biochem, 37(8): 869-880. DOI:10.1016/S0032-9592(01)00274-6 |
Wei L, Wan S, Jin Z, et al. 2014. Biochar influences the microbial community structure during tomato stalk composting with chicken manure[J]. Bioresource Technology, 154(2): 148-154. |
Xi B D, Huang G H, Zhang G J, et al. 2007. A temperature-guided three-stage inoculation method for municipal solid wastes composting[J]. Environmental Engineering Science, 24(6): 745-754. DOI:10.1089/ees.2005.0091 |
Xiang L, Chan L C, Wong J W C. 2000. Removal of heavy metals from anaerobically digested sewage sludge by isolated indigenous iron-oxidizing bacteria[J]. Chemosphere, 41(1): 283-287. |
Xu J, Lu Y Y, Shan G C, et al. 2019. Inoculation with compost-born thermophilic complex microbial consortium induced organic matters degradation while reduced nitrogen loss during co-composting of dairy manure and sugarcane leaves[J]. Waste and Biomass Valorization, 10: 2467-2477. DOI:10.1007/s12649-018-0293-y |
Yang K J, Zhu L J, Zhao Y, et al. 2019. A novel method for removing heavy metals from composting system:The combination of functional bacteria and adsorbent materials[J]. Bioresource Technology, 293: 122095. DOI:10.1016/j.biortech.2019.122095 |
Yu H, Zeng G, Huang H, et al. 2007. Microbial community succession and lignocellulose degradation during agricultural waste composting[J]. Biodegradation, 18(6): 793-802. DOI:10.1007/s10532-007-9108-8 |
Zeng G, Yu M, Chen Y, et al. 2010. Effects of inoculation with Phanerochaete chrysosporium at various time points on enzyme activities during agricultural waste composting[J]. Bioresource Technology, 101(1): 222-227. DOI:10.1016/j.biortech.2009.08.013 |
Zhang J, Zeng G, Chen Y, et al. 2013. Impact of Phanerochaete chrysosporium inoculation on indigenous bacterial communities during agricultural waste composting[J]. Applied Microbiology and Biotechnology, 97(7): 3159-3169. DOI:10.1007/s00253-012-4124-y |
Zhang J, Zeng G, Chen Y, et al. 2011. Effects of physico-chemical parameters on the bacterial and fungal communities during agricultural waste composting[J]. Bioresource Technology, 102(3): 2950-2956. DOI:10.1016/j.biortech.2010.11.089 |
Zhang L, Sun X. 2014. Changes in physical, chemical, and microbiological properties during the two-stage co-composting of green waste with spent mushroom compost and biochar[J]. Bioresource Technology, 171: 274-284. DOI:10.1016/j.biortech.2014.08.079 |
Zhang L H, Zeng G M, Dong H R, et al. 2017. The impact of silver nanoparticles on the co-composting of sewage sludge and agricultural waste:evolutions of organic matter and nitrogen[J]. Bioresource Technology, 230: 132-139. DOI:10.1016/j.biortech.2017.01.032 |
Zhang P, Li Y, Cao Y, et al. 2019. Characteristics of tetracycline adsorption by cow manure biochar prepared at different pyrolysis temperatures[J]. Bioresource Technology, 285: 121348. DOI:10.1016/j.biortech.2019.121348 |
Zhao Y, Lu Q, Wei Y, et al. 2016. Effect of actinobacteria agent inoculation methods on cellulose degradation during composting based on redundancy analysis[J]. Bioresource Technology, 219: 196-203. DOI:10.1016/j.biortech.2016.07.117 |
 2020, Vol. 40
2020, Vol. 40


