2. 中国科学院生态环境研究中心饮用水科学与技术重点实验室, 北京 100085
2. Key Laboratory of Drinking Water Science and Technology, Center for Ecological Environment Research, Chinese Academy of Sciences, Beijing 100085
人类活动产生的氮化合物已大大超过了大自然的循环能力, 氮污染问题已经成为主要的环境问题(Canfield et al., 2010; Zhu et al., 2011).氮循环驱动主要是通过微生物一系列的氧化还原反应, 转化成不同的含氮化合物(Jetten et al., 2009).其中, 微生物涉及的硝酸盐(NO3--N)反应过程最多, 包括反硝化、硝酸盐异化还原为铵(dissimilatory nitrate reduction to ammonium, DNRA)和厌氧氨氧化(Kraft et al., 2011).反硝化和厌氧氨氧化将NO3--N还原成N2, 从而造成氮素的损失(Portmann et al., 2012).DNRA是将易损失的NO3--N转化为NH4+-N, 而被植物或微生物重新吸收利用, 有助于湿地生态系统中的氮保留(Gardner et al., 2006; Rütting et al., 2011; Zhang et al., 2014; Wang et al., 2018).DNRA的发现扩展了微生物氮循环, 相较于反硝化可以减少温室气体的排放, 对环境保护方面具有重要意义.
目前, DNRA途径公认有两种:一种与微生物的发酵有关, 另一种与硫的氧化有关(Burgin et al., 2007).微生物发酵的DNRA细菌多为专性厌氧菌和兼性厌氧菌(Simon, 2002; Mohan et al., 2007).近年来, 在各种生态系统中越来越多学者研究N循环中的DNRA, 以探索其在N循环中的重要性(Rütting et al., 2011), 通过使用15N同位素标记的方法, Dong等(2009)在河口沉积物中得出DNRA过程对NO3--N还原的贡献率为10.7%~59.4%.然而, DNRA的研究主要在河口、海洋沉积物、稻田和湖泊等各种生态系统中(Yin et al., 2002; Nizzoli et al., 2010; Giblin et al., 2013; Song et al., 2014).相较于湿地生态系统, DNRA可能是氮转化研究最少的过程(Vymazal, 2007), 却是NO3--N还原的重要途径之一, 从而影响人工湿地生态系统服务(Burgin et al., 2013), 但DNRA过程中的微生物是如何被控制的呢?
人工湿地是人为设计的系统, 主要是对湿地生态系统进行特定的修改, 以提高处理能力(Kadlec et al., 2008).人工湿地具有经济和生态优势, 已被广泛应用于处理各种N污染的废水, 其中以微生物介导的N循环通常被认为是去除氮化合物最经济有效的方法(Vymazal, 2007; Zhi et al., 2012).最近的研究表明, 与湿地沉积物中反硝化相比, DNRA可能是重要的过程(Burgin et al., 2013).Van Oostrom和Russell (1994)发现DNRA对人工湿地中NO3--N去除的贡献率为5%.尽管DNRA在去除氮方面起着至关重要的作用, 但很少有研究关注人工湿地中进行DNRA过程的微生物(Burgin et al., 2007).石臼漾人工湿地位于长江三角洲的浙江省嘉兴市, 目前是我国国内最大的城市饮用水净化湿地系统之一.在所有功能区中, 植物床/沟壕系统是人工湿地的核心反应区.前期研究发现, anammox、AOA和AOB微生物在沟壕系统中发生较大的差异(Wang et al., 2013; Su et al., 2018; Wang et al., 2018).因此, 本课题组推测人工湿地沟壕系统沉积物中DNRA细菌丰度和群落组成可能会受到环境因子影响.
因此, 本研究以微小尺度的人工湿地沟壕系统为研究对象, 采用高通量测序分析方法研究湿地冬、夏两季沉积物中DNRA的功能基因nrfA的多样性, 应用多元统计分析方法, 研究DNRA的多样性、群落结构以及与沉积物中环境因子之间的关系.研究结果有助于了解人工湿地沟壕系统中DNRA的群落特征及其主要影响因素, 为氮循环研究提供理论和数据基础.
2 材料与方法(Materials and methods) 2.1 样品采集与保存石臼漾人工湿地位于中国浙江省嘉兴市东北部(30°46′ 43.25″ N, 120°42′ 17.25″ E), 总占地面积为108.7 hm 2, 其中水域面积为63.3 hm 2.它是源头河水进入当地水厂取水前的最后一道防护屏障.其功能区包括预处理区、植物床/沟壕系统、泵提升和曝气充氧区和深度净化区.在所有功能区中, 植物床/沟壕系统是人工湿地的核心反应区.沟壕系统中的大沟是25 m宽的大沟壕, 通过蜿蜒曲折的形状增加水域面积和水流通过的长度, 其水流流速为0.1~0.9 m·s-1.其间共分布有61个植物床、62条小沟壕, 单个植物床长50~200 m, 宽16.3 m.两个植物床之间的小沟壕宽10 m, 水流流速为0.01~0.02 m·s-1.小沟主要用来增加陆地和水体间接触界面面积, 产生“边界效应”.而大沟主要用来分配和调节过水通量, 其过水通量高达65%, 而小沟过水通量只有35%.植物床/沟壕系统模拟了白洋淀湿地的自然景观结构(Wang et al., 2012), 由于芦苇(Phragmites australis)根际具有较强的水净化功能而被移植在植物床上(Wang et al., 2002; Wang et al., 2008).目前, 石臼漾人工湿地已成功运行10年.
选取冬季(1月)、夏季(7月)两个季节的大沟中心(LDC)、大沟边缘(LDE)、小沟中心(SDC)和小沟边缘(SDE)共8个表层沉积物样品为研究对象.在每个采样点, 去除表面死亡植物后, 采集3个平行的表层沉积物样品, 混合以形成一个复合样品置于无菌塑料袋中.随后, 把这些沉积物样品密封且避光, 并用冰袋运送到实验室.将每个混合样品分成两部分:一部分用来测定其物理化学性质, 剩余样品保存于4 ℃冰箱.另一部分经过冷冻干燥后保存在-80 ℃超低温冰箱中, 用于DNA提取和后续的分子生物实验.
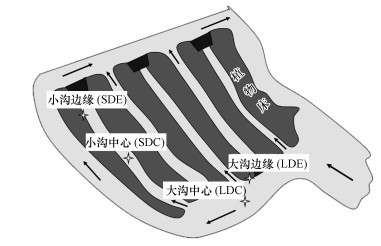 |
| 图 1 石臼漾人工湿地采样点示意图 Fig. 1 Sampling sites in Shijiuyang constructed wetland |
根据《土壤农化分析》(鲍士旦, 2000)中的方法测量沉积物样品的有关理化指标.简言之, 将沉积物混合样品用2 mol·L-1 KCl溶液浸提1 h后, 再用0.45 μm微孔滤膜过滤得到上清液, 用酶标仪测量土壤氨氮(NH4+-N)、硝酸盐氮(NO3--N)、亚硝酸盐氮(NO2--N)浓度.在沉积物样品中加入超纯水(1:5)后通过DELTA 320 pH分析仪(Mettler Toledo, USA)测定沉积物的pH.含水率(MC)的测量通过在108 ℃下烘干5 g新鲜沉积物直至达到恒重来计算沉积物失水量, 然后将样品置于550 ℃的微波马弗炉中5 h以确定总有机质(TOM)(张文河等, 2007).使用元素分析仪(Elementar Analysen System GmbH, Germany)测定通过冷干研磨过筛后沉积物中的总氮(TN)、总碳(TC)和总硫(TS).对于上述所有样品的理化指标, 都进行了3次重复测定(表 1).
| 表 1 石臼漾湿地沉积物样品理化特性 Table 1 Physicochemical indexes of Shijiuyang wetland sediments |
根据Mobio DNA提取试剂盒(PowerSoil® DNA Isolation Kit, USA)中的使用说明, 称取约0.25 g冷冻干燥的土壤提取样品中的DNA.然后用1%凝胶电泳上检测提取的DNA质量, 并使用Nano Drop 2000 UV-Vis Spectrophotometer (Thermo Fisher Scientific, USA)测定其浓度.在260 nm和280 nm处的吸光度比值均在1.8~2.0之间, 这表明获得了具有良好质量的DNA.所得质量合格的总DNA在冰箱-20 ℃保存待用.使用DNRA菌的nrfA功能基因的特异性引物nrfA-F2aw (5′-CARTGYCAYGTBG ARTA-3′)和nrfA-R1 (5′-TWNGGCATRTGRCARTC-3′)对样品中总的DNA进行PCR扩增(Welsh et al., 2014).扩增体系为25 μL: Go Taq®Green Master Mix 12.5 μL, 浓度为10 mmol·L-1的前、后引物各1 μL, 牛血清蛋白(BSA) 0.25 μL, 稀释10倍的DNA模板2 μL, 用ddH2O补足至25 μL.扩增条件为:95 ℃预变性10 min;95 ℃变性30 s, 52 ℃退火30 s, 72 ℃延伸30 s, 40个循环;72 ℃延伸10 min.取5 μL PCR扩增产物用1%凝胶电泳验证, 通过Illumina Miseq PE300平台进行测序(美吉生物医药科技有限公司, 上海).
2.4 实时荧光定量PCR采用具有荧光染料SYBR Green I方法在ABI 7500 Real-Time PCR System扩增仪(Applied Biosystems, CA, USA)上进行实时荧光定量PCR, 以量化特异性引物nrfA-F2aw和nrfA-R1功能基因nrfA的丰度. qPCR的反应为20 μL体系: SYBR Premix Ex Taq酶(TaKaRa, 大连, 中国)10 μL, ROXⅡ 0.4 μL, 牛血清蛋白(BSA) 0.4 μL, 正反向引物(10 mmol·L-1)各1 μL, 稀释10倍的DNA模板2 μL, ddH2O补足至总体积为20 μL.扩增测序如下: 95 ℃预变性5 min, 95 ℃变性30 s, 52 ℃退火30 s, 72 ℃延伸20 s, 共40循环.将质粒按10倍浓度梯度稀释, 设置8个梯度, 每个梯度3个平行.在每次扩增中增加3个模板为ddH2O的阴性对照, 所有样品均设置3个平行.将已知浓度和拷贝数的质粒绘制标准曲线从而计算样品中的DNRA细菌的丰度值.在每次测定后产生溶解曲线以检查扩增的特异性.样品扩增效率为90%~110%, 标准曲线相关性系数(R2)大于0.99.通过溶解曲线分析以确定PCR扩增的特异性.
2.5 测序和网络分析利用带有Barcode信息的引物从DNA中扩增出nrfA基因.高通量测序是在Illumina Miseq PE300平台(Illumina, San Diego, CA, USA)上进行, 且构建高通量基因测序文库(美吉生物医药科技有限公司, 上海).①首先使用Qiime过滤掉低质量的序列和短序列(Caporaso et al., 2010).接着利用Mothur软件(Schloss et al., 2009)从剩余的核酸序列中获得非冗余的核酸序列.②用Bioedit软件将非冗余的核酸序列翻译成氨基酸序列, 然后使用Uclust软件将氨基酸序列按90%的相似度聚类(Edgar et al., 2010), 得到可操作分类单元(operational taxonomic units, OTUs)的分配结果.③将每个OTUs的代表序列在Genbank数据库进行BLAST(Basic Local Alignment Search Tool)比对, 得到对应的分类学信息.④通过自写的Perl脚本计算各样品的覆盖率(coverage)、丰富度指数(Chao1)和多样性指数(Shannon、Simpson)等(庄林杰等, 2017).利用所获得的OTU进行了系统发育分子生态网络(PMENS), 探讨了DNRA细菌之间潜在的种间关系.使用R包psych计算并由Gephi软件可视化(Bastian et al., 2009).
2.6 数据分析使用SPSS 22.0软件(Statistical Product and Service Solutions)进行相关性分析(采用Spearman相关系数).除非另有说明, 否则本研究中的显著性水平为α=0.05.基于Bray-Curtis差异度指数进行群落的分类和排序, 分类选择UPGMA算法(Mothur计算), 排序选用主坐标分析(Principle Coordinate Analysis, PCoA).利用Canoco 4.5程序进行去趋势对应分析(Detrended Correspondence Analysis, DCA)和去冗余分析(Redundancy analysis, RDA).表中数值均为平均值±标准差.利用Origin 9.0及Gephi等软件作图.
3 结果(Results) 3.1 湿地沉积物样品理化性质采样期间的平均气温分别为(7±3) ℃ (冬季, n=30 d)和(32±2) ℃ (夏季, n=30 d).在冬、夏两季中, 石臼漾湿地沉积物呈弱酸性, pH值在6.15~6.74之间(表 1).在空间尺度上, 沟壕中心沉积物NH4+-N含量((17.62±3.1) mg·kg-1)高于沟壕边缘((9.71±2.66) mg·kg-1) (p=0.05).NO3--N含量存在显著差异(p=0.01), 沟壕中心沉积物为(10.2±2.88) mg·kg-1, 沟壕边缘为(1.92±0.33) mg·kg-1.沟壕中心沉积物的TN、TC和TS浓度显著高于沟壕边缘(p=0.001、0.011和0.017).在时间尺度上, 夏季样品的TOM含量显著高于冬季样品(p=0.01), 而TS浓度则是冬季样品高于夏季样品(p=0.015).夏季样品的C/N值(10.78±0.85)高于冬季样品(9.83±1.39), 差异不显著(p> 0.05).
3.2 DNRA细菌的功能基因丰度的分布DNRA细菌丰度在夏季的大沟中心样点最高为3.73 × 109 copies·g-1, 而在冬季的小沟边缘样点最低为2.71 × 108 copies·g-1(图 2).统计学分析表明, 沟壕中心DNRA细菌丰度((2.26±1.19) × 109 copies·g-1)高于沟壕边缘((1.22±1.46) × 109 copies·g-1), 差异不显著(p> 0.05).夏季DNRA细菌丰度显著高于冬季样品(p < 0.05), 其中, 夏季大沟中心沉积物丰度高于小沟中心, 冬季则相反.沟壕系统中DNRA细菌丰度值存在明显的时空差异.
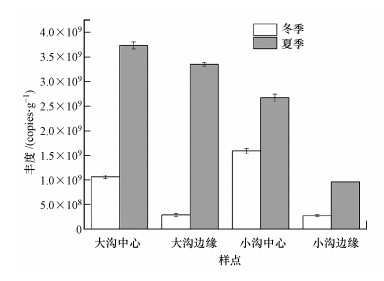 |
| 图 2 石臼漾湿地沉积物样品DNRA细菌丰度 Fig. 2 Abundance of DNRA bacteria in sediment samples of Shijiuyang wetland |
将高通量测序获得的序列上传至NCBI, 登录号为SAMN13683808-SAMN13683815.结果表明, 质控后的序列均为DNRA细菌的nrfA序列.质控后的高质量序列条数在Uclust软件以相似度为90%下进行聚类.得到OTUs数及其覆盖率分布情况如表 2所示.根据表中统计结果可以得到, 样品中OTUs数量在5450~6823, 覆盖率均大于96.8%.在门的分类水平上, 共注释到15个门, 其中变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、硝化螺旋菌门(Nitrospirae)在所有样点中占主导地位, 分别占总序列条数的30.79%、20.56%和10.92%.在属的分类水平上(图 3), 注释到了65个属, 两个季节的沉积物中占比最高的属是Caldilinea、Anaeromyxobacter和Haliangium, 分别占69.75%±3.64%、66.41%±1.19%和55.80%±1.60%.Caldilinea属在夏季样品的占比(39.78%±5.15%)高于冬季样品(29.98%±0.57%), 夏季LDE样品中Caldilinea属占比最高(17.16%).Anaeromyxobacter属在沟壕中心的占比(35.14%±0.83%)高于沟壕边缘(31.28%±0.76%), 且小沟(34.33%±1.40%)高于大沟(32.08%±1.33%).为了更好地检测样品OTU之间的性能差异, 每个样本的OTU序列条数都进行标准化处理(log10(x +1))后绘制Heatmap (图 4), 通过颜色的梯度和相似程度来反映样品的相似性和差异性.在属的水平上, Caldilinea和Anaeromyxobacter属是DNRA群落中的优势菌属.这与相对丰度图的结果一致.与SDE样点相比, Caldilinea是LDE沉积物中占比最高的属(冬季为8.33%, 夏季为17.16%).各样点沉积物聚类时同一季节的样品聚集在一起, 体现出一定的季节效应.表明季节的差异性对DNRA细菌的群落结构有一定的影响.
| 表 2 高通量测序样品描述及DNRA细菌的α-多样性指数 Table 2 High throughput sequencing sample description and α-diversity index of DNRA bacteria |
 |
| 图 3 石臼漾湿地表层沉积物中基于属水平的DNRA细菌的相对丰度图 Fig. 3 Relative abundance of DNRA bacteria in surface sediments of Shijiuyang wetland based on the genus level |
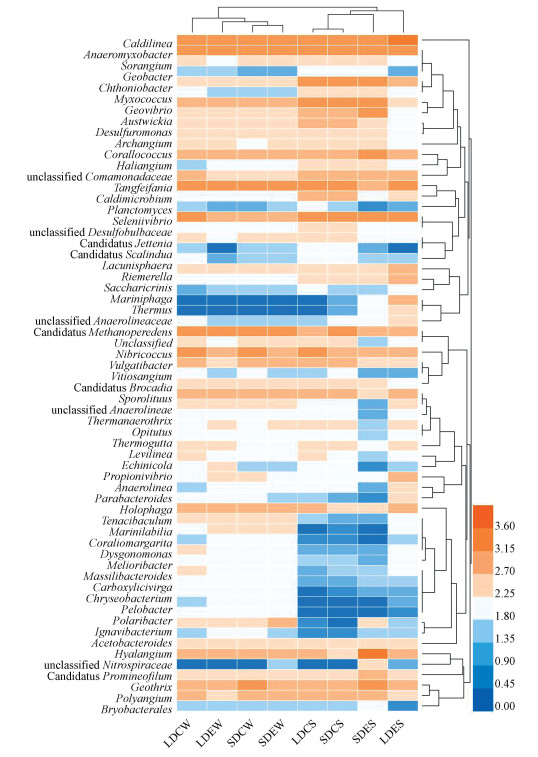 |
| 图 4 石臼漾湿地表层沉积物中DNRA细菌的热图 Fig. 4 The heatmap of DNRA bacteria in surface sediments of Shijiuyang wetland |
选取丰富度指数(Chao1 index)、多样性指数(Shannon index)和优势度指数(Simpson index)对DNRA菌群的α-多样性进行分析(表 2).由表 2中可以得出:石臼漾湿地表层沉积物中, Chao1指数最高的是夏季大沟边缘(8590.51), 最低的是冬季大沟边缘(5524.15);Shannon指数最高的是冬季小沟中心(7.77), 最低的是夏季小沟边缘(7.04);Simpson指数最高的是夏季小沟边缘(0.00405), 最低的是冬季小沟边缘(0.00092) (表 2).
比较各样点的α-多样性指数发现, 不同地点间的多样性差异较小.夏季沉积物中DNRA群落的丰富度和优势度高于冬季样品沉积物.沟壕中心沉积物的DNRA群落丰富度高于沟壕边缘, 冬、夏季样点的多样性差异不大, 分别为CV=1.3%, CV=2.7%, n=4.
基于OTUs水平计算石臼漾湿地表层沉积物样品的Bray-Curtis差异度矩阵, 进行DNRA细菌的群落排序(图 5), 两轴排序结果的解释度分别为36.56%和21.48%.结果表明, 在石臼漾湿地表层沉积物样品中, 冬季沉积物的DNRA群落结构在两轴上的排序距离较近, 夏季样品的排序距离较远.两个季节的LDC和SDC及SDEW和LDEW沉积物样品距离较近, 表明LDC和SDC及LDEW和SDEW的DNRA细菌的群落结构更相似;而LDES和SDES沉积物的距离较远, 表明LDES和SDES的DNRA细菌的群落结构差异较大.
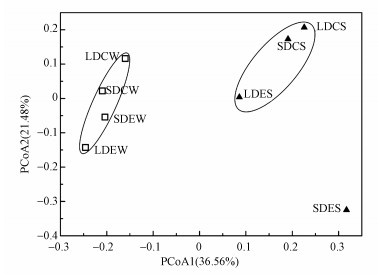 |
| 图 5 石臼漾湿地表层沉积物中DNRA群落的pcoa排序分析 Fig. 5 PCoA of DNRA community in surface sediments of Shijiuyang wetland |
对沉积物中DNRA细菌基因丰度以及群落结构, 结合理化因子进行斯皮尔曼(Spearman)相关性分析(表 3)和冗余分析(RDA) (图 6).DNRA细菌基因丰度与TOM (r=0.881, p=0.004)、MC (r=0.810, p=0.015)和C/N (r=0.810, p=0.015)呈显著正相关关系.Caldimicrobium属与MC (r=0.762, p=0.028)呈显著正相关.TOM与Caldimicrobium属(r=0.786, p=0.021)和Chthoniobacter属(r=0.762, p=0.028)呈显著正相关, 而与Geothrix属呈显著负相关(r=-0.881, p=0.004).NO2--N与Desulfuromonas属呈显著负相关(r=-0.862, p=0.006).
| 表 3 石臼漾湿地表层沉积物中DNRA细菌群落组成与环境因子的相关性分析(n=8) Table 3 Correlation analysis between DNRA bacterial community composition and environmental factors in surface sediments of Shijiuyang wetland (n=8) |
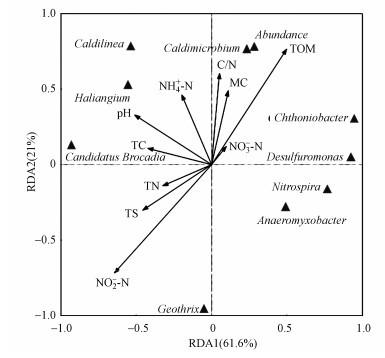 |
| 图 6 DNRA群落与环境因子的RDA分析 Fig. 6 RDA analysis of DNRA bactreial community and environmental factors |
利用种间网络分析方法分析DNRA群落的优势细菌共存模式.Spearman相关系数ρ > 0.8和p- value < 0.05被认为是分类群之间的统计稳健相关性(图 7).DNRA的nrfA基因网络由9个模块组成, 其中2个模块节点最多.在286个节点和2951个相互作用中, 蓝线表示两个单独节点之间的正相关作用(58.01%), 而红线表示负相关作用(41.99%).Anaeromyxobacter (8.74%)和Caldilinea (8.04%)是关键类群, 且分布在不同的模块中.
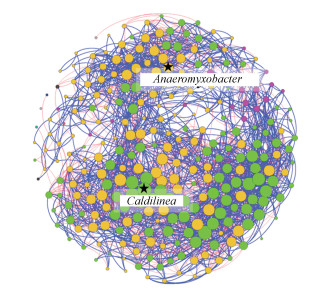 |
| 图 7 石臼漾湿地表层沉积物中DNRA细菌的种间系统发育分子生态网络 Fig. 7 Interspecific phylogenetic molecular ecological networks (pMENs) of DNRA bacteria in surface sediments of Shijiuyang wetland |
本文研究石臼漾人工湿地冬夏两季沉积物中DNRA过程, 进一步比较沟壕系统内部的小沟与外围的大沟等不同区域的DNRA细菌分布规律、群落结构、多样性等, 并研究了其影响因素.
4.1 有机质(TOM)浓度影响DNRA细菌丰度异化NO3--N还原为NH4+-N是一种厌氧微生物代谢, 在水生环境中普遍存在(Burgin et al., 2007).以往研究表明, DNRA细菌对NO3--N有很高的亲和力(Van Den Berg et al., 2016), 而DNRA细菌存在的生境中, 以专性厌氧菌和兼性厌氧菌为主导(Steenkamp et al., 1981).而这些微生物主要以有机质发酵型为主(Giblin et al., 2013).在本研究中, 沟壕边缘发生频繁水位波动使其处于好氧-缺氧交替条件下(Vidon et al., 2010), 而沟壕中心沉积物受到的干扰较小, 长期处于厌氧状态, 有相对较高的有机质浓度.有机质可以为微生物活动提供生长所需的能量和反应媒介, 使得DNRA过程在有机质含量高的土壤中容易发生(Rütting et al., 2011, Song et al., 2014).与沟壕边缘沉积物相比, 较高的TOM浓度是沟壕中心沉积物中DNRA细菌丰度偏高、群落结构复杂一个重要因素.另外, 有研究表明, 温度是影响DNRA细菌的丰度、群落结构和活性的原因之一, 较高的温度有利于提高微生物的活性和基质的有效性, 从而促进NO3--N的还原(Ogilvie et al., 1997, Dong et al., 2013, Dunn et al., 2013), 这与本研究夏季样品DNAR丰度高于冬季的结果相吻合.
4.2 含水率和C/N影响DNRA细菌丰度以往研究认为, 土壤含水率为20%~70%时, DNRA细菌丰度较高(Rubol et al., 2013).这是因为需氧微生物对氧浓度的强烈敏感性削弱硝化作用的发生, 也降低反硝化作用产生N2O, 但微氧环境对于DNRA细菌的生长和生命活动是有利的, 可以促进氮保留而减少了NO3--N的损失(Klefoth et al., 2014).本文中含水率为30%~62%, 且沟壕中心沉积物含水率高于沟壕边缘, 表明含水率对DNRA细菌丰度有一定的影响.除此以外, 早期研究结果显示, 当DNRA过程与反硝化作用竞争底物NO3--N时, 在低C/NO3--N比条件下, 反硝化是唯一的硝酸盐还原过程, 而在高C/NO3--N比时, 主要以DNRA过程为主(Tiedje et al., 1983, Hardison et al., 2015).另外, 由于DNRA转化1 mol NO3--N需要得到8 mol电子, Tiedje(1988)认为DNRA细菌在碳源丰富而不稳定的环境中更容易发生.在本研究中, DNRA细菌丰度与C/N比显著相关, 实验测得C/N比在7.79~11.68之间, 属于较高程度, 是推动DNRA过程的一个重要因素.
4.3 Anaeromyxobacter属和Caldilinea属在沟壕系统中起着重要作用许多微生物包括专性厌氧细菌、兼性厌氧细菌、好氧细菌和真菌等都可以进行DNRA过程(Tiedje, 1988).由于NO3--N是比O2产能效率低的电子受体(Alexander et al., 2000), 因此DNRA细菌多为专性厌氧菌和兼性厌氧菌.Potter等(1999)研究结果显示DNRA细菌的Ks (μmol·L-1 NO3--N)值估计为15, 低于反硝化细菌Ks (约为200 μmol·L-1 NO3--N) (Goddard et al., 2008).在沟壕系统中, DNRA群落占有优势的菌属为Anaeromyxobacter和Caldilinea属.Anaeromyxobacter属是根据16S rRNA基因系统发育分类的第一个以粘球菌(传统称为“粘细菌”)为分类的厌氧菌(Thomas et al., 2008).而Anaeromyxobacter属缺乏反硝化作用中的nirS和nirK基因, 只能还原NO3--N生成NH4+-N或者还原N2O生成N2来获得生长所需的能量(He et al., 2003; Onley et al., 2018).在本研究中, 在夏季大沟边缘沉积物中Caldilinea属的占比较高.Sekiguchi等(2003)在厌氧污泥反应器中, 分离出嗜热的Caldilinea属, 它是一种兼性厌氧菌.目前, Caldilinea属是Caldilineae类中被描述的属, 文献中没有关于Caldilinea属的Km值的报道(Kragelund et al., 2011).微生物的分子生态网络中优势种属Anaeromyxobacter和Caldilinea分布于不同的模块中, 研究表明关系紧密的微生物一般具有相同的生物学分类(Zhou et al., 2011), 同一个模块的物种通常有着相似的生态位(Zhou et al., 2010).表明两类微生物有不同的生态位且在DNRA过程发挥着重要的作用.
5 结论(Conclusions)在石臼漾人工湿地沟壕系统中, DNRA细菌丰度呈现出沟壕中心沉积物高于沟壕边缘的趋势, 且冬、夏季样品间差异性显著.冬、夏季沟壕中心沉积物中DNRA群落丰富度高于沟壕边缘.DNRA群落中占有优势的菌属为Anaeromyxobacter和Caldilinea属.环境因子TOM、C/N和含水率等是影响沉积物中DNRA细菌丰度和群落特征的关键影响因素.
Alexander R B, Smith R A, Schwarz G E. 2000. Effect of stream channel size on the delivery of nitrogen to the Gulf of Mexico[J]. Nature, 403(6771): 758. DOI:10.1038/35001562 |
Bastian M, Heymann S, Jacomy M. 2009. Gephi:an open source software for exploring and manipulating networks[J]. International AAAI Conference on Weblogs and Social Media, 8(2009): 361-362. |
Burgin A J, Hamilton S K. 2007. Have we overemphasized the role of denitrification in aquatic ecosystems? A review of nitrate removal pathways[J]. Frontiers in Ecology and the Environment, 5(2): 89-96. DOI:10.1890/1540-9295(2007)5[89:HWOTRO]2.0.CO;2 |
Burgin A J, Hamilton S K, Gardner W S, et al. 2013. Nitrate reduction, denitrification, and dissimilatory nitrate reduction to ammonium in wetland sediments[J]. Methods in Biogeochemistry of Wetlands, (methodsinbiogeo): 519-537. |
Canfield D E, Glazer A N, Falkowski P G. 2010. The evolution and future of earths nitrogen cycle[J]. Science, 330(6001): 192-196. DOI:10.1126/science.1186120 |
Caporaso J G, Kuczynski J, Stombaugh J, et al. 2010. QIIME allows analysis of high-throughput community sequencing data[J]. Nature methods, 7(5): 335. DOI:10.1038/nmeth.f.303 |
Chen Z, Wang C, Gschwendtner S, et al. 2015. Relationships between denitrification gene expression, dissimilatory nitrate reduction to ammonium and nitrous oxide and dinitrogen production in montane grassland soils[J]. Soil Biology and Biochemistry, 87: 67-77. DOI:10.1016/j.soilbio.2015.03.030 |
Dong L F, Smith C J, Papaspyrou S, et al. 2009. Changes in benthic denitrification, nitrate ammonification, and anammox process rates and nitrate and nitrite reductase gene abundances along an estuarine nutrient gradient (the Colne Estuary, United Kingdom)[J]. Appl Environ Microbiol, 75(10): 3171-3179. DOI:10.1128/AEM.02511-08 |
Dong L F, Sobey M N, Smith C J, et al. 2011. Dissimilatory reduction of nitrate to ammonium, not denitrification or anammox, dominates benthic nitrate reduction in tropical estuaries[J]. Limnology and Oceanography, 56(1): 279-291. DOI:10.4319/lo.2011.56.1.0279 |
Dunn R J K, Robertson D, Teasdale P R, et al. 2013. Benthic metabolism and nitrogen dynamics in an urbanised tidal creek:Domination of DNRA over denitrification as a nitrate reduction pathway[J]. Estuarine, Coastal and Shelf Science, 131: 271-281. DOI:10.1016/j.ecss.2013.06.027 |
Edgar R C. 2010. Search and clustering orders of magnitude faster than blast[J]. Bioinformatics, 26(19): 2460. DOI:10.1093/bioinformatics/btq461 |
Giblin A E, Tobias C R, Song B, et al. 2013. The importance of dissimilatory nitrate reduction to ammonium (DNRA) in the nitrogen cycle of coastal ecosystems[J]. Oceanography, 26(3): 124-131. DOI:10.5670/oceanog.2013.54 |
Goddard A D, Moir J W B, Richardson D J, et al. 2008. Interdependence of two NarK domains in a fused nitrate/nitrite transporter[J]. Molecular Microbiology, 70(3): 667-681. DOI:10.1111/j.1365-2958.2008.06436.x |
Hardison A K, Algar C K, Giblin A E, et al. 2015. Influence of organic carbon and nitrate loading on partitioning between dissimilatory nitrate reduction to ammonium (DNRA) and N2 production[J]. Geochimica et Cosmochimica Acta, 164: 146-160. DOI:10.1016/j.gca.2015.04.049 |
He Q, Sanford R A. 2003. Characterization of Fe (Ⅲ) reduction by chlororespiring Anaeromxyobacter dehalogenans[J]. Appl Environ Microbiol, 69(5): 2712-2718. DOI:10.1128/AEM.69.5.2712-2718.2003 |
Jetten M S, Lv N, Strous M, et al. 2009. Biochemistry and molecular biology of anammox bacteria[J]. Crit Rev Biochem Mol Biol, 44(2/3): 65-84. |
Klefoth R R, Clough T J, Oenema O, et al. 2014. Soil bulk density and moisture content influence relative gas diffusivity and the reduction of nitrogen-15 nitrous oxide[J]. Vadose Zone Journal, 13(11). |
Kraft B, Strous M, Tegetmeyer H E. 2011. Microbial nitrate respiration-genes, enzymes and environmental distribution[J]. Journal of biotechnology, 155(1): 104-117. DOI:10.1016/j.jbiotec.2010.12.025 |
Kragelund C, Thomsen T R, Mielczarek A T, et al. 2011. Eikelboom's morphotype 0803 in activated sludge belongs to the genus Caldilinea in the phylum Chloroflexi[J]. FEMS microbiology ecology, 76(3): 451-462. DOI:10.1111/j.1574-6941.2011.01065.x |
Kadlec R H, Wallace S. 2008. Treatment wetlands, Second Edition[M].
|
Mohan S B, Cole J A. 2007. The dissimilatory reduction of nitrate to ammonia by anaerobic bacteria[M]//Biology of the nitrogen cycle. Elsevier, 93-106
|
Nizzoli D, Carraro E, Nigro V, et al. 2010. Effect of organic enrichment and thermal regime on denitrification and dissimilatory nitrate reduction to ammonium (DNRA) in hypolimnetic sediments of two lowland lakes[J]. Water Research, 44(9): 2715-2724. DOI:10.1016/j.watres.2010.02.002 |
Ogilvie B G, Rutter M, Nedwell D B. 1997. Selection by temperature of nitrate-reducing bacteria from estuarine sediments:species composition and competition for nitrate[J]. FEMS Microbiology Ecology, 23(1): 11-22. DOI:10.1111/j.1574-6941.1997.tb00386.x |
Onley J R, Ahsan S, Sanford R A, et al. 2018. Denitrification by Anaeromyxobacter dehalogenans, a common soil bacterium lacking the nitrite reductase genes nirS and nirK[J]. Appl Environ Microbiol, 84(4): e01985-17. |
Portmann R W, Daniel J S, Ravishankara A R. 2012. Stratospheric ozone depletion due to nitrous oxide:influences of other gases[J]. Philosophical Transactions of the Royal Society B:Biological Sciences, 367(1593): 1256-1264. DOI:10.1098/rstb.2011.0377 |
Potter L C, Millington P, Griffiths L, et al. 1999. Competition between Escherichia coli strains expressing either a periplasmic or a membrane-bound nitrate reductase:does Nap confer a selective advantage during nitrate-limited growth?[J]. Biochemical Journal, 344(1): 77-84. DOI:10.1042/bj3440077 |
Rubol S, Manzoni S, Bellin A, et al. 2013. Modeling soil moisture and oxygen effects on soil biogeochemical cycles including dissimilatory nitrate reduction to ammonium (DNRA)[J]. Advances in water resources, 62: 106-124. DOI:10.1016/j.advwatres.2013.09.016 |
Rütting T, Boeckx P, Müller C, et al. 2011. Assessment of the importance of dissimilatory nitrate reduction to ammonium for the terrestrial nitrogen cycle[J]. Biogeosciences, 8(7): 1779-1791. DOI:10.5194/bg-8-1779-2011 |
Schloss P D, Westcott S L, Ryabin T, et al. 2009. Introducing mothur:open-source, platform-independent, community-supported software for describing and comparing microbial communities[J]. Appllied Environmental Microbiology, 75(23): 7537-7541. DOI:10.1128/AEM.01541-09 |
Sekiguchi Y, Yamada T, Hanada S, et al. 2003. Anaerolinea thermophila gen.nov., sp. nov. and Caldilinea aerophila gen. nov., sp. nov., novel filamentous thermophiles that represent a previously uncultured lineage of the domain Bacteria at the subphylum level[J]. International Journal of Systematic and Evolutionary Microbiology, 53(6): 1843-1851. DOI:10.1099/ijs.0.02699-0 |
Simon J. 2002. Enzymology and bioenergetics of respiratory nitrite ammonification[J]. FEMS Microbiology Reviews, 26(3): 285-309. DOI:10.1111/j.1574-6976.2002.tb00616.x |
Song B, Lisa J A, Tobias C R. 2014. Linking DNRA community structure and activity in a shallow lagoonal estuarine system[J]. Frontiers in Microbiology, 5: 460. |
Steenkamp D J, Peck H D. 1981. Proton translocation associated with nitrite respiration in Desulfovibrio desulfuricans[J]. Journal of Biological Chemistry, 256(11): 5450-5458. |
Su Y, Wang W, Wu D, et al. 2018. Stimulating ammonia oxidizing bacteria (AOB) activity drives the ammonium oxidation rate in a constructed wetland (CW)[J]. Science of the Total Environment, 624: 87-95. DOI:10.1016/j.scitotenv.2017.12.084 |
Thomas S H, Wagner R D, Arakaki A K, et al. 2008. The mosaic genome of Anaeromyxobacter dehalogenans strain 2CP-C suggests an aerobic common ancestor to the delta-proteobacteria[J]. PloS one, 3(5): e2103. DOI:10.1371/journal.pone.0002103 |
Tiedje J M, Sexstone A J, Myrold D D, et al. 1983. Denitrification:ecological niches, competition and survival[J]. Antonie van Leeuwenhoek, 48(6): 569-583. DOI:10.1007/BF00399542 |
Tiedje J M. 1988. Ecology of denitrification and dissimilatory nitrate reduction to ammonium[J]. Biology of Anaerobic Microorganisms, 717: 179-244. |
Van Den Berg E M, Van Dongen U, Abbas B, et al. 2015. Enrichment of DNRA bacteria in a continuous culture[J]. The ISME Journal, 9(10): 2153. DOI:10.1038/ismej.2015.26 |
Vidon P, Allan C, Burns D, et al. 2010. Hot spots and hot moments in riparian zones:Potential for improved water quality management 1[J]. JAWRA Journal of the American Water Resources Association, 46(2): 278-298. DOI:10.1111/j.1752-1688.2010.00420.x |
Vymazal J. 2007. Removal of nutrients in various types of constructed wetlands[J]. Science of the Total Environment, 380(1/3): 48-65. |
Van Oostrom A J, Russell J M. 1994. Denitrification in constructed wastewater wetlands receiving high concentrations of nitrate[J]. Water Science and Technology, 29(4): 7-14. DOI:10.2166/wst.1994.0146 |
Wang C, Zhu G, Wang W, et al. 2013. Preliminary study on the distribution of ammonia oxidizers and their contribution to potential ammonia oxidation in the plant-bed/ditch system of a constructed wetland[J]. Journal of Soils and Sediments, 13(9): 1626-1635. DOI:10.1007/s11368-013-0750-y |
Wang S, Wang W, Liu L, et al. 2018. Microbial nitrogen cycle hotspots in the plant-bed/ditch system of a constructed wetland with N2O mitigation[J]. Environmental Science & Technology, 52(11): 6226-6236. |
Wang W, Wang D, Yin C. 2002. A field study on the hydrochemistry of land/inland water ecotones with reed domination[J]. Acta Hydrochimica et Hydrobiologica, 30(2/3): 117-127. |
Wang W, Yin C. 2008. The boundary filtration effect of reed-dominated ecotones under water level fluctuations[J]. Wetlands Ecology and Management, 16(1): 65-76. DOI:10.1007/s11273-007-9057-3 |
Wang Y, Zhu G, Ye L, et al. 2012. Spatial distribution of archaeal and bacterial ammonia oxidizers in the littoral buffer zone of a nitrogen-rich lake[J]. Journal of Environmental Sciences, 24(5): 790-799. DOI:10.1016/S1001-0742(11)60861-9 |
Welsh A, Chee-Sanford J C, Connor L M, et al. 2014. Refined nrfA phylogeny improves PCR-based nrfA gene detection[J]. Applied & Environmental Microbiology, 80(7): 2110-2119. |
Yin S X, Chen D, Chen L M., et al. 2002. Dissimilatory nitrate reduction to ammonium and responsible microorganisms in two Chinese and Australian paddy soils[J]. Soil Biology and Biochemistry, 34(8): 1131-1137. DOI:10.1016/S0038-0717(02)00049-4 |
Zhi W, Ji G. 2012. Constructed wetlands, 1991-2011:a review of research development, current trends, and future directions[J]. Science of the Total Environment, 441: 19-27. DOI:10.1016/j.scitotenv.2012.09.064 |
Zhou J, Deng Y, Luo F., et al. 2010. Functional molecular ecological networks[J]. mBio, 1: e00169-00110. |
Zhou J, Deng Y, Luo F., et al. 2011. Phylogenetic molecular ecological network of soil microbial communities in response to elevated CO2[J]. mBio, 2: e00122-00111. |
Zhu G, Wang S, Wang Y, et al. 2011. Anaerobic ammonia oxidation in a fertilized paddy soil[J]. Isme Journal, 5(12): 1905-1912. DOI:10.1038/ismej.2011.63 |
Zhang W, Zhang Y, Su W, et al. 2014. Effects of cathode potentials and nitrate concentrations on dissimilatory nitrate reductions by Pseudomonas alcaliphila in bioelectrochemical systems[J]. Journal of Environmental Sciences, 26(4): 885-891. DOI:10.1016/S1001-0742(13)60460-X |
鲍士旦. 2000. 土壤农化分析(第3版)[M]. 北京: 中国农业出版社.
|
张文河, 穆桂金. 2007. 烧失法测定有机质和碳酸盐的精度控制[J]. 干旱区地理, 30(3): 137-141. |
庄林杰, 夏超, 田晴, 等. 2017. 高通量测序技术研究典型湖泊岸边陆向深层土壤中厌氧氨氧化细菌的群落结构[J]. 环境科学学报, 37(1): 261-271. |
 2020, Vol. 40
2020, Vol. 40


