消毒副产物(Disinfection by-products, DBPs)是消毒剂与一些天然有机物或无机物反应生成的化合物, 广泛存在于各种水体中(赵玉丽等, 2011;韩慧慧等, 2017;崔晓宇等, 2019).卤代苯醌(Halobenzoquinones, HBQs)作为一类新型的DBPs, 于2010年首次被发现(Feng et al., 2010).随着分析技术的发展, 越来越多的HBQs在水体中被检测出, 目前已知的有十余种HBQs, 其中, 2, 6-二氯-1, 4-苯醌(2, 6-dichloro-1, 4-benzoquinone, 2, 6-DCBQ)由于检出率和含量最高, 因而其潜在的环境风险引起了人们的高度关注(Tardif et al., 2016;Wang et al., 2018).Bull等(2011)通过定量结构毒性关系(QSTR)计算发现, 2, 6-DCBQ的毒性是常规受监管DBPs(THMs和HAAs)毒性的1000多倍.2, 6-DCBQ的较高毒性引起了研究人员的高度重视, 随后对其毒性展开深入研究, 发现2, 6-DCBQ具有较高的基因毒性和细胞毒性(Du et al., 2013;Wang et al., 2018).此外, 通过实验还发现, 2, 6-DCBQ的暴露能够诱导斑马鱼胚胎发生脂质过氧化反应, 并干扰胚胎的脂肪酸代谢(Sun et al., 2019).有研究指出, 脂肪酸代谢的异常将会影响能量的提供, 进而影响机体的生长发育(Anderson et al., 2011; Ho et al., 2016).基于此, 可推测2, 6-DCBQ可能具有发育毒性.然而目前仅有有限的研究报道2, 6-DCBQ对斑马鱼胚胎的毒性效应, 而且相关研究主要集中在2, 6-DCBQ对细胞凋亡的影响(Wang et al., 2018; Sun et al., 2019).因此, 本课题组将延续先前的研究继续探究2, 6-DCBQ的发育毒性.
由于具有胚体透明、发育同步且速度快等特性, 斑马鱼胚胎被认为是研究发育毒性的理想材料(杜青平等, 2012).因此, 本实验主要以斑马鱼胚胎为实验材料, 通过急性暴露实验确定2, 6-DCBQ对斑马鱼胚胎不同发育时期的半致死浓度、安全浓度及超氧化物歧化酶活性和转录的影响.
2 材料与方法(Materials and methods) 2.1 斑马鱼胚胎的收集与暴露将购于国家斑马鱼资源中心(武汉)的成年斑马鱼(4月龄, AB系)置于循环养殖系统(ESEN, 北京)中进行驯养.驯养期间温度设为(28±1) ℃, pH设为7.2±0.5, 光周期设为14 h(光):10 h(暗), 每天喂食3次鲜活的丰年虫幼虫.驯养一周后, 斑马鱼开始进行周期性产卵.随后收集胚胎并通过体式显微镜(SZX7, Olympus, Japan)进行观察、挑选(OECD, 2013).将健康正常的胚胎用E3培养液(5 mmol·L-1 NaCl, 0.17 mmol·L-1 KCl, 0.33 mmol·L-1 CaCl2, 0.33 mmol·L-1 MgSO4, pH=7.4)冲洗干净后随机放置到称量瓶(25 mm× 40 mm)中, 每个称量瓶中包含30粒胚胎.根据先前研究人员的实验结果, 本研究将2, 6-DCBQ的浓度设为0、40、60、80、100、120、150 μg·L-1.每个浓度设置6个平行组, 并在胚胎受精后4 h内完成暴露.
2.2 实验试剂及仪器将2, 6-DCBQ(≥98%, Sigma, USA)溶于0.01%乙醇(AR, Sigma, USA)溶液配制成浓度为10 g·L-1的储备液(置于-80 ℃冰箱保存).实验用溶液由E3培养液(5 mmol·L-1 NaCl, 0.17 mmol·L-1 KCl, 0.33 mmol·L-1 CaCl2, 0.33 mmol·L-1 MgSO4, pH=7.4)稀释而成.为了确保2, 6-DCBQ的溶液浓度恒定不变, 每24 h更换一次溶液.
实验用仪器主要包括:斑马鱼循环养殖系统(爱生, 中国)、交配盒(爱生, 中国)、电子分析天平(赛多利斯, 德国)、体式显微镜(奥林巴斯, 日本)、恒温培养箱(扬辉, 中国)、pH计(雷磁, 中国)、斑马鱼微视行为分析系统(诺达思, 荷兰)、荧光定量PCR仪(罗氏, 瑞士).
2.3 2, 6-DCBQ对斑马鱼胚胎存活情况的影响根据OECD236斑马鱼胚胎急性毒性实验方法(Sobanska et al., 2018), 本研究在受精后8、12、24、36、48、60、72、96、120 h通过显微镜观察并记录斑马鱼胚胎的存活发育情况, 并及时剔除死亡个体.死亡率(R)的计算公式如下所示:
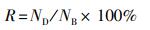
|
(1) |
式中, ND为死亡个体数;NB为胚胎暴露总数;
计算12、24、36和48 h的半致死浓度(Lethal concentration 50, LC50), 并根据24 h和48 h的LC50值(24h-LC50和48h-LC50)计算2, 6-DCBQ的安全浓度Cs (罗小燕等, 2016), 公式如下所示:

|
(2) |
在实验过程中, 将观察到的心跳停止、胚胎自溶和卵凝结现象视为个体的死亡症状;将幼鱼脊柱弯曲、尾部畸形、卵黄囊水肿及心包水肿现象视为个体的发育畸形.当实验暴露60 h时, 每个浓度组随机取10条仔鱼, 利用3%甲基纤维素溶液将仔鱼固定于载玻片上, 并保证仔鱼处于平躺状态, 通过体视显微镜进行拍照并通过相应软件拍摄10 s视频.随后用斑马鱼微视行为分析系统(DanioScope, Netherlands)测量仔鱼体长(从头部最前端到尾尖的长度)并分析计算仔鱼心率.
2.5 2, 6-DCBQ对斑马鱼体内超氧化物歧化酶活性及转录水平的影响为了更好地了解2, 6-DCBQ对斑马鱼胚胎的毒性效应, 根据2, 6-DCBQ的安全浓度(27.15 μg·L-1)及72 h-LC50(94.2 μg·L-1), 将实验浓度设置为0、30、60、90 μg·L-1继续开展实验.待暴露至72 hpf, 收集样品.一部分样品用于测定超氧化歧化酶(Superoxide Dismutase, SOD)活性和总蛋白(Total Protein, TPN)含量, 其中, SOD和TPN试剂盒均采购于南京建成生物工程研究所, 实验操作步骤、计算方法均按照说明书进行.另一部分通过RT-qPCR检测分析2, 6-CDBQ对SOD基因表达的影响.反应条件为:95 ℃预变性10 min, 95 ℃变性10 s, 56~64 ℃退火30 s, 72 ℃延伸32 s, 循环40次, 所有测量重复3次.基因相对表达采用2-△△Ct法计算(△△Ct=(Ct目的基因-Ct管家基因)实验组-(Ct目的基因-Ct管家基因)对照组)(Livak et al., 2001).在使用方法之前, 确定目的基因和管家基因的扩增效率基本一致.β-actin基因作为内参基因.引物序列如表 1所示.
| 表 1 RT-qPCR实验中使用到的引物 Table 1 RT-qPCR primers used in the present study |
本文中采用SPSS 16.0软件进行数据处理, 使用SigmaPlot 11.0软件进行图表绘制, 采用单因素方差分析法(One-way ANOVE)对其差异性进行分析.
3 结果和分析(Results and discussion) 3.1 不同浓度2, 6-DCBQ对斑马鱼存活的影响斑马鱼胚胎发育阶段是受精卵细胞快速增殖、分化并形成器官的重要时期, 对外界污染物的刺激非常敏感(黄凯等, 2011).因此, 本研究以斑马鱼胚胎为实验材料评估2, 6-DCBQ的发育毒性.研究发现, 斑马鱼胚胎的存活率随时间的延长而降低, 到24 hpf时, 斑马鱼胚胎的死亡率基本趋于稳定(图 1).众所周知, 8~24 hpf阶段是斑马鱼胚胎器官发育的重要时期(Yang et al., 2009).本研究表明, 2, 6-DCBQ在斑马鱼器官早期发育阶段对斑马鱼胚胎会产生毒性效应, 并引起死亡.雌二醇也曾被证实具有相似的毒性效应, Soares等(2009)报道2 ng·L-1雌二醇能够影响斑马鱼胚胎(≤24 hpf)器官的早期发育.在本实验中发现, 斑马鱼胚胎的存活率与2, 6-DCBQ表现出剂量效应关系, 随着2, 6-DCBQ浓度的升高, 斑马鱼胚胎的存活率明显下降, 到120 hpf时, 0、40、60、80、100、120、150 μg·L-1暴露组中斑马鱼胚胎的存活率分别为94.58%、96.67%、82.5%、65%、36.67%、23.33%、19.17%.此外, 通过对不同时期的观察记录可知, 斑马鱼胚胎12、24、36、48、60、72 h时的LC50值分别为106.4、96.1、94.7、94.2、94.2和94.2 μg·L-1(表 2).许慧慧等(2009)报道24 hpf胚胎氯仿和一溴二氯甲烷(两种受管控的消毒副产物)的LC50分别为1.076 mg·L-1和2.676 mg·L-1.通过对比发现, 2, 6-DCBQ的毒性远远高于常规受管控消毒副产物(氯仿和一溴二氯甲烷).根据Turubell法计算2, 6-DCBQ的安全浓度为27.15 μg·L-1(Yang et al., 2010).参照我国化学物质对鱼类毒性分级标准GB/T21281—2007(96 h-LC50≤1.0 mg·L-1时为急性毒性Ⅰ级;1.0 mg·L-1≤96 h-LC50≤10.0 mg·L-1时为急性毒性Ⅱ;10.0 mg·L-1≤96 h-LC50≤100.0 mg·L-1为急性毒性Ⅲ级)(国家环保局, 1990), 可判定2, 6-DCBQ的急性毒性为Ⅰ级, 因此, 水体中2, 6-DCBQ存在的潜在环境风险不容小觑.
 |
| 图 1 不同浓度2, 6-DCBQ在不同时间段对斑马鱼胚胎存活率的影响 Fig. 1 The effect of different concentrations of 2, 6-DCBQ on survival performance of zebrafish embryo at different time |
| 表 2 斑马鱼暴露2, 6-DCBQ各时间段的LC50值 Table 2 Different exposure duration LC50 values of zebrafish for 2, 6-DCBQ |
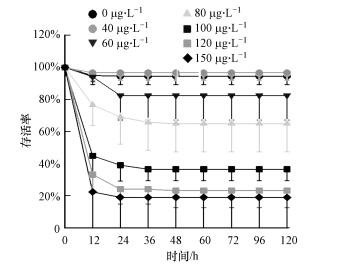
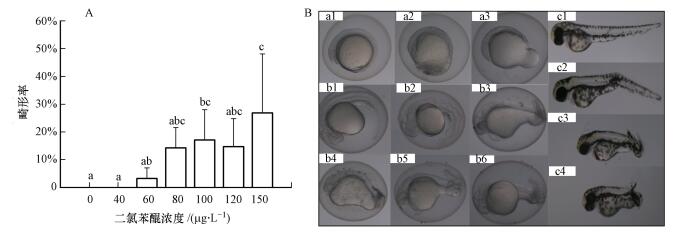
实验过程中, 2, 6-DCBQ对斑马鱼胚胎的生长并没有表现出明显的毒性效应, 但高浓度(100 μg·L-1和150 μg·L-1)的2, 6-DCBQ对斑马鱼胚胎及仔鱼表现出明显的致畸效应(图 2A).在整个暴露过程中观察到斑马鱼胚胎及仔鱼出现各种发育缺陷(图 2B), 包括尾部发育异常(图 2B中a2~a3);卵黄囊延伸部异常, 尾部畸形(图 2B中b2~b6);仔鱼尾部异常(图 2B中c2~c4).此外, 本研究还通过Viewpoint软件发现与对照组相比, 2, 6-DCBQ对斑马鱼胚胎心率有明显的毒性效应, ≥80 μg·L-1 2, 6-DCBQ明显降低了斑马鱼胚胎的心率(图 3).这可能是因为2, 6-DCBQ能够抑制斑马鱼胚胎心脏钾离子通道, 从而抑制斑马鱼胚胎的心率.Burns等(2010)通过高通量分析发现, 钾离子通道功能的异常是小分子物质降低斑马鱼胚胎心率的一个重要原因.
 |
| 图 2 不同浓度2, 6-DCBQ对斑马鱼胚胎发育的影响(A.不同浓度2, 6-DCBQ对畸形率的影响,不同小写字母表示差异显著, 下同;B.斑马鱼胚胎及仔鱼出现各种形态学异常, 包括尾部发育异常(图 2B中a2~a3);卵黄囊延伸部异常, 尾部畸形(图 2B中b2~b6);仔鱼尾部异常(图 2B中c2~c4)) Fig. 2 The effect of different concentrations of 2, 6-DCBQ on the development of zebrafish embryo(A. the effect of different concentrations of 2, 6-DCBQ on aberration rate; B. morphological abnormalities of zebrafish embryo and larvae, tail abnormalities(Figure 2B, c2~c4), developmental abnormal of yolk sac, tail deformaties(Figure 2B, b2~b6); larvae tail deformaties(Figure 2B, c2~c4)) |
 |
| 图 3 不同浓度二氯苯醌对斑马鱼胚胎心率的影响 Fig. 3 The effect of different concentrations of 2, 6-DCBQ on the hearting beating of zebrafish embryo |
通过本实验发现, 2, 6-DCBQ需要累积到一定的浓度(≥80 μg·L-1)才会对斑马鱼胚胎心脏产生毒性效应, 而心率的减慢能够影响血液循环速度, 进而影响营养物质的正常运送, 从而诱导胚胎发育过程中出现畸形, 甚至死亡.通过相关性分析发现, 2, 6-DCBQ对斑马鱼胚胎心率的影响与死亡率(r=0.86)、畸形率(r=0.87)呈正相关性, 推测2, 6-DCBQ的心脏毒性是其诱导斑马鱼胚胎出现畸形及死亡的一个重要因素.
3.3 不同浓度2, 6-DCBQ对斑马鱼体内超氧化物歧化酶活性及转录水平的影响尽管2, 6-DCBQ只有在高浓度(≥100 μg·L-1)时才会引起斑马鱼胚胎的大量畸形及死亡, 但低浓度(< 100 μg·L-1)的2, 6-DCBQ对鱼类早期发育阶段的危害依然不容小觑.基于此, 本研究选择安全浓度与半致死浓度之间的30、60和90 μg·L-1浓度组探究2, 6-DCBQ的毒性效应.有研究表明, 氧化应激在2, 6-DCBQ诱导多种毒性效应的过程中起着重要的作用.超氧化物歧化酶(Superoxide Dismutase, SOD)作为机体内清除氧化应激的重要酶类, 经常被用作指示机体内氧化状态的指标.在本研究中发现, 2, 6-DCBQ能够明显提升SOD活性, SOD活性与2, 6-DCBQ浓度表现出良好的剂量效应关系, 随着2, 6-DCBQ浓度的升高, SOD活性逐渐增加(图 4A).该实验结果与Wang等(2018)的实验结论相反, 他们曾报道≥885 μg·L-1的2, 6-DCBQ降低了SOD活性.这可能是因为高浓度(≥885 μg·L-1)的2, 6-DCBQ可诱导较高的毒性, 抑制了SOD酶的活性, 而本研究中2, 6-DCBQ的浓度较低(≤90 μg·L-1), 斑马鱼胚胎通过提高SOD活性消除低浓度(≤90 μg·L-1)2, 6-DCBQ诱导的氧化应激.
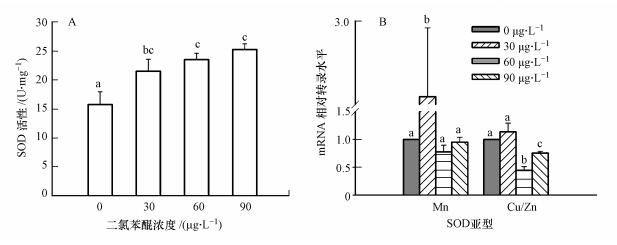 |
| 图 4 不同浓度2, 6-DCBQ对斑马鱼SOD活性(A)及转录水平(B)的影响 Fig. 4 The concentration effect of 2, 6-DCBQ on the activity(A) and mRNA transcriptional levels(B) of SOD of zebrafish embryo |
生物体在基因水平的调控是生物应对环境胁迫的早期响应机制之一.伴随着氧化应激的产生, SOD酶在基因水平的转录情况也表现出明显的变化.Cu/Zn-SOD和Mn-SOD是SOD酶的两个重要亚型, Cu/ZnSOD主要存在于胞浆中, MnSOD主要存在于细胞线粒体中, 二者在清除氧化应激过程中均起着重要的作用.本研究发现, 30 μg·L-1 2, 6-DCBQ明显提升了MnSOD的转录水平, 但却对Cu/ZnSOD的转录没有显著影响;60和90 μg·L-1 2, 6-DCBQ对MnSOD的转录水平没有显著影响, 但却明显抑制了Cu/ZnSOD的转录(图 4B).在本实验中, MnSOD和Cu/ZnSOD的转录水平表现出不同的变化趋势, 这可能是因为它们在细胞中的位置不同, 从而发挥不同的功能.MnSOD位于细胞线粒体中, 负责呼吸过程中产生的ROS, Cu/ZnSOD位于胞浆中, 主要负责维持细胞内氧化还原平衡状态.本实验中通过二者的变化可知, 低浓度(30 μg·L-1) 2, 6-DCBQ的暴露仅仅刺激斑马鱼胚胎在呼吸过程中产生ROS, 并未改变细胞内的氧化还原状态, 与此同时, 机体通过提高MnSOD的转录水平和SOD酶的活性来消除氧化应激;当2, 6-DCBQ浓度提高到60和90 μg·L-1时, 2, 6-DCBQ诱导斑马鱼胚胎细胞中产生氧化应激, 并对Cu/ZnSOD的转录水平产生明显的抑制效应.根据此结果可推测, 斑马鱼胚胎可以承受安全浓度范围内的2, 6-DCBQ, 而超过安全浓度(> 30 μg·L-1)的2, 6-DCBQ在斑马鱼胚胎体内代谢过程中产生大量的氧化应激, 可能会对斑马鱼胚胎造成损伤.
4 结论(Conclusions)1) 2, 6-DCBQ的毒性效应远远高于常规消毒副产物, 属于Ⅰ级毒性污染物.在整个胚胎发育过程中, 8~24 hpf为斑马鱼胚胎器官发育的重要阶段, 此时对2, 6-DCBQ的刺激非常敏感.
2) 尽管2, 6-DCBQ对斑马鱼胚胎的生长没有明显的毒性效应, 但100和150 μg·L-1 2, 6-DCBQ却表现出显著的致畸效应, 可诱导胚胎及仔鱼发育畸形.此外, 高浓度(≥80 μg·L-1)的2, 6-DCBQ可以明显抑制斑马鱼胚胎的心率.
3) 2, 6-DCBQ暴露能够诱导斑马鱼胚胎产生大量的ROS, 低于安全浓度(≤30μg·L-1)的2, 6-DCBQ仅刺激斑马鱼胚胎在呼吸过程中产生ROS, 而高于安全浓度(>30μg·L-1)的2, 6-DCBQ在斑马鱼胚胎体内代谢过程中产生大量的ROS, 并对Cu/ZnSOD的转录水平有明显的抑制作用.
Anderson J L, Carten J D, Farber S A. 2011. Zebrafish lipid metabolism:from mediating early patterning to the metabolism of dietary fat and cholesterol[J]. Methods in Cell Biology, 101: 111-141. DOI:10.1016/B978-0-12-387036-0.00005-0 |
Bull R J, Reckhow D A, Li X, et al. 2011. Potential carcinogenic hazards of non-regulated disinfection by-products:Haloquinones, halo-cyclopentene and cyclohexene derivatives, N -halamines, halonitriles, and heterocyclic amines[J]. Toxicology, 286: 1-19. DOI:10.1016/j.tox.2011.05.004 |
Burns C G, Milan D J, Grande E J, et al. 2005. High-throughput assay for small molecules that modulate zebrafish embryonic heart rate[J]. Nature Chemical Biology, 1(5): 263-264. DOI:10.1038/nchembio732 |
崔晓宇, 辛会博, 孙兴滨. 2019. 模拟泳池水中氯化消毒副产物的生成规律[J]. 中国环境科学, 39(4): 143-150. |
Du H Y, Li J H, Birget M, et al. 2013. Cytotoxicity and oxidative damage induced by halobenzoquinones to T24 bladder cancer cells[J]. Environmental Science & Technology, 47: 2823-2830. |
杜青平, 彭润, 刘伍香, 等. 2012. 四溴双酚A对斑马鱼胚胎体内外发育的毒性效应[J]. 环境科学学报, 32(3): 739-744. |
高丹, 张圣虎, 郭敏, 等. 2018. 四种典型羟基化多溴联苯醚对斑马鱼胚胎的毒性和生物富集性[J]. 环境科学学报, 38(1): 425-436. |
国家环保局.1990.危险化学品鱼类急性毒性分级试验方法.GB/T21281-2007[S].北京: 中国国家标准化管理委员会.260-269
|
韩慧慧, 缪恒锋, 张雅晶, 等. 2017. 污水再生过程中消毒副产物前体物转化规律[J]. 环境科学, 38(7): 2883-2892. |
Ho C H, Hsiao C D, Kawakami K, et al. 2016. Triclosan(TCS) exposure impairs lipid metabolism in zebrafish embryos[J]. Aquatic Toxicology, 173: 29-35. DOI:10.1016/j.aquatox.2016.01.001 |
黄凯, 林匡飞, 张卫, 等. 2011. 水溶性CdTe量子点对斑马鱼胚胎发育的影响[J]. 环境科学学报, 31(4): 854-859. |
Livak K J, Schmittgen T D. 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 25: 402-408. DOI:10.1006/meth.2001.1262 |
罗小燕, 杨小立, 黎祖福, 等. 2016. 6种常见渔药对卵形鲳鲹的急性毒性[J]. 水产科学, 35(5): 480-485. |
Qin F, Zhao Y Y, Zhao Y L, et al. 2010. A toxic disinfection by-product, 2, 6-dichloro-1, 4-benzoquinone, identified in drinking water[J]. Angewandte Chemie, 49: 790-792. DOI:10.1002/anie.200904934 |
Soares J, Coimbra A M, Reis-Henriques M A, et al. 2009. Disruption of zebrafish(Danio rerio)embryonic development after full life-cycle parental exposure to low levels of ethinylestradiol[J]. Aquatic Toxicology, 95: 330-338. DOI:10.1016/j.aquatox.2009.07.021 |
Sobanska M, Scholz S, Nyman A M, et al. 2018. Applicability of fish embryo acute toxicity test(OECD236)in the regulatory context of registration, evaluation, authorisation, and restriction of chemicals[J]. Environmental Toxicology and Chemistry, 37(3): 657-670. DOI:10.1002/etc.4055 |
Sun H J, Zhang Y, Zhang J Y, et al. 2019. The toxicity of 2, 6-dichlorobenzoquinone on the early life stage of zebrafish:A survey on the endpoints at developmental toxicity, oxidative stress, genotoxicity and cytotoxicity[J]. Environmental Pollution, 245: 719-724. DOI:10.1016/j.envpol.2018.11.051 |
Tardif R, Catto C, Haddad S, et al. 2016. Assessment of air and water contamination by disinfection by-products at 41 indoor swimming pools[J]. Environmental Research, 148: 411-420. DOI:10.1016/j.envres.2016.04.011 |
USEPA.1985.National Primary Drinking Water Regulations.Disinfection Byproducts[S].Washington D.C.: United States Environmental Protection Agency
|
Wang C, Yang X, Zheng Q, et al. 2018. Halobenzoquinone-induced developmental toxicity, oxidative stress, and apoptosis in zebrafish embryos[J]. Environmental Science & Technology, 52: 10590-10598. DOI:10.1021/acs.est.8b02831 |
许慧慧, 胡晓晴, 董晨, 等. 2009. 饮水氯化消毒副产物氯仿和一溴二氯甲烷对斑马鱼胚胎发育的毒性作用[J]. 环境与职业医学, 26(1): 1-4. |
Yang L, Ho N Y, Alshut R, et al. 2009. Zebrafish embryos as models for embryotoxic and teratological effects of chemicals[J]. Reproductive Toxicology, 28: 245-253. DOI:10.1016/j.reprotox.2009.04.013 |
Yang W, Xiang F H, Liang L G, et al. 2010. Toxicity of ammonia and its effects on oxidative stress mechanisms of juvenile crucian carp(Carassius auratus)[J]. Journal of freshwater Ecology, 25(2): 297-302. DOI:10.1080/02705060.2010.9665080 |
赵玉丽, 李杏放. 2011. 饮用水消毒副产物:化学特征与毒性[J]. 环境化学, 30(1): 20-33. |
 2020, Vol. 40
2020, Vol. 40


