2. 福建师范大学湿润亚热带生态-地理过程教育部重点实验室, 福州 350007;
3. 福建师范大学环境科学学院, 福州 350007
2. Key Laboratory of Humid Sub-tropical Eco-geographical Process of Ministry of Education, Fujian Normal University, Fuzhou 350007;
3. School of Environmental Science and Engineering, Fujian Normal University, Fuzhou 350007
河口湿地是位于海陆交互地带的生态系统, 对全球气候变化和人类活动响应较为敏感(Simas et al., 2001), 在全球生物地球化学循环中扮演着重要角色(高建华等, 2004; Hu et al., 2014).随着全球变暖的加速, 预计21世纪末全球平均海平面将上升0.55 m(IPCC, 2013), 尤其是河口潮汐淡水湿地将受到海平面上升引起的盐水入侵的长期影响, 盐分胁迫不仅影响河口地区动植物的生存环境, 同时土壤微生物群落结构也将受到影响(Sharpe et al., 2012).除了受到海平面上升诱发的盐水入侵的长期影响, 台风作为极端天气事件也严重影响着我国东南沿海地区, 风暴潮不仅会带来短期脉冲式的盐水入侵, 同时由于台风暴雨造成的流域上游森林和农田生态系统水土流失使得土壤中大量的Fe(Ⅲ)随地表径流进入河流, 并被携带到下游河口地区(Gao et al., 1999; 周国华等, 2012).盐水入侵带来大量的SO42-, 以及河流上游径流带来的大量Fe(Ⅲ)在河口区域汇聚, 必将打破该区域生物地球化学循环的原有平衡, 特别是对甲烷产生和硫酸盐异化还原和铁异化还原过程产生剧烈的影响(Chamber et al., 2013; Dijk et al., 2015).
产甲烷菌是介导自然湿地土壤甲烷产生的重要功能菌群, 深入探索自然湿地土壤产甲烷菌的多样性及群落特征有助于正确评估自然湿地甲烷代谢循环及其排放通量的变化规律, 为人类最终有效调控湿地甲烷代谢, 减少甲烷排放提供科学依据(佘晨兴等, 2012).在富含硫酸盐的河口盐沼湿地土壤中, 硫酸盐还原菌与产甲烷菌共存, 并竞争和共同使用着相同的基质(Nedwell et al., 2004).研究发现, 随着盐度的增加, 产甲烷菌群落多样性普遍降低, 一些乙酸营养型的产甲烷菌物种只在低盐度土壤中出现, 而在高盐度土壤中未被检测到(Baldwin et al., 2006).目前, 多数研究已经证实钠盐、硫酸盐和硝酸盐对微生物的活动具有明显的抑制作用, 盐度越高对微生物的抑制作用越强(Chambers et al., 2011);但也有研究者通过对淡水湿地土壤添加海水发现, 细菌和古菌的群落结构均没有随着盐度的增加而发生改变(Edmond et al., 2009).因此, 潮汐沼泽湿地土壤产甲烷菌及硫酸盐还原菌的群落结果是否与盐度有关还待于进一步研究.
闽江口湿地是闽江入海携带的物质流、能量流的必经之地, 受到来自流域中、上游输送的Fe(Ⅲ)及台风风暴潮引起的短期脉冲式盐水入侵的影响(牟晓杰等, 2013; 胡敏杰等, 2014).本研究以闽江河口塔礁洲感潮淡水沼泽湿地为研究对象, 设计原位脉冲式盐水添加和Fe(Ⅲ)添加模拟实验, 通过分析不同施加处理下河口感潮淡水沼泽湿地间隙水地球化学特征、土壤产甲烷菌和硫酸盐还原菌多样性及群落结构的变化, 以期为认识脉冲式盐水入侵和Fe(Ⅲ)浓度增加情景下的河口感潮淡水沼泽湿地土壤产甲烷和硫酸盐还原菌的群落结构和多样性的响应提供基础数据.
2 材料与方法(Materials and methods) 2.1 研究样地概况塔礁洲(119°19′55″~119°22′45″E, 25°56′56″~25°57′36″N)是由闽江河流从上游携带泥沙在闽江口淤积而成的天然湿地, 面积约为878 hm2(图 1).该地属中亚热带与南亚热带海洋季风气候的过渡地带, 气候温暖湿润, 年均温度为19.7 ℃, 年降水量约为1346 mm.塔礁洲湿地受潮汐作用明显, 表现为非正规的半日浅潮, 分布的主要湿地植物有短叶茳芏(Cyperus malaccensis Lam. var. brevifolius Bocklr.)和野慈姑(Sagittaria trifolia Linn.).本研究选取位于塔礁洲南侧的感潮淡水野慈姑沼泽湿地(盐度:0.10‰±0.4‰)为研究样地(图 1), 该样地年平均淹水频率为24.5%, 土壤为粉砂质壤土(粘粒为9.85%~12.02%, 粉粒为46.00%~52.75%, 砂粒为36.36%~42.87%), 土壤全碳含量为(18.0±1.7) g · kg-1, 全氮含量为(1.60±0.1) g · kg-1, pH为5.35±0.33.
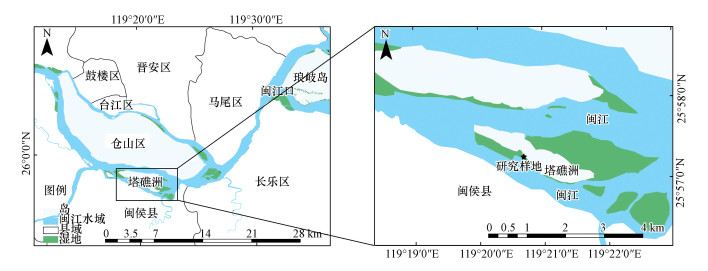 |
| 图 1 闽江河口塔礁洲研究样地位置示意图 Fig. 1 Location of study site in the Tajiaozhou of the Min River estuary |
为了收集间隙水和土壤样本, 本课题组在研究样地沿河流岸线平行方向等距离布设了12个样方框(35 cm×35 cm×40 cm), 各样方框间距约1 m, 材质为PVC板.分别设置对照(CK)、盐水施加(Salt)、Fe(Ⅲ)施加(Fe(Ⅲ))、Fe(Ⅲ)施加+盐水施加(Fe(Ⅲ)+Salt)4种处理, 各处理均包含3个重复.为避免实验添加盐水的表层横向流动, 样方框压入地下35 cm, 露出地表部分约5 cm.施加的人造海水(盐度15‰)由热带海水珊瑚礁盐(Cnsic Marine Biotechnology Co., Ltd.)配制而成, 主要成分包括0.56 mol · L-1 Cl-、0.03 mol · L-1 SO42-、0.01 mol · L-1 Ca2+、0.05 mol · L-1 Mg2+、0.01 mol · L-1 K+和0.47 mol · L-1 Na+.Fe(Ⅲ)以氢氧化铁(Fe(OH)3)悬浊液的形式施加, 以塔礁洲样地0~30 cm可还原态铁含量的3倍为年施加量, 即年添加量约为3000 g · m-2 · a-1, 对照处理仅施加等量的淡水.从2015年12月开始, 每月选择两个连续的小潮日, 每日往各处理组样方框内分别缓慢施加1 L上述溶液, 施加时段及随后的数小时地表出露且无潮水水淹, 每个样方框原位施加的时间约为45 min, 以保障施加的溶液充分入渗到土壤中, 在一年的周期内一共施加24次.2016年10月, 在溶液施加第2 d结束后的下午, 在每个处理样方中利用自制圆柱型取土器(直径5 cm)采集1个土芯样(深度10 cm), 共12个土芯样;在每个样方框内利用提前布置好的间隙水采集器, 采集深度10 cm处的间隙水样, 采集到的间隙水分别装到60 mL透明聚乙烯塑料瓶中, 加入1 mL饱和HgCl2溶液, 盖上瓶盖, 遮光4 ℃保存.
2.3 间隙水和土壤理化性质测定用于测定间隙水理化性质的水样运回实验室后立即用孔径为0.45 μm滤膜过滤.水样过滤后, 装置于清洁的60 mL透明聚乙烯塑料瓶中.采用连续流动分析仪(SKALAR San++, Netherlands)分析水样中铵态氮(NH4+)、硝态氮(NO3-)的含量, 采用离子色谱仪(Dionex ICS-2100, Japan)测定水样中的Cl-、SO42-等理化指标.土壤电导率使用便携式电导计(2265FS, USA)进行测定, 土壤Fe(Ⅲ)的含量采用萃取法进行测定(Kostka et al., 1994).
2.4 土壤DNA提取与PCR扩增土壤样品总DNA采用Power soil DNA Isolation Kit(MOBIO公司, 美国)试剂盒进行提取.利用Nanodrop 2000c检测DNA的质量, 之后分别使用引物mcrA-F(GGTGGTGTMGGATTCACACARTAYGCW ACAGC)/mcrA-R(TTCATTGCRTAGTTWGGRTAGTT)和DSR-F(ACSCACTGGAAGCACGGCGG)/DSR-R(GTGGMRCCGTGCAKRTTGG)分别对产甲烷菌和硫酸盐还原菌进行PCR扩增(Luton et al., 2002; Kondo et al., 2004).扩增分两阶段进行, 在第一阶段PCR反应中, PCR反应体系为30 μL:基因组DNA 10~20 ng, 2×Taq master Mix 15 μL, 1 μL的引物(10 μm)(正、反向引物), 添加蒸馏水至30 μL.PCR反应条件如下:94 ℃预变性3 min;94 ℃变性30 s, 45 ℃退火20 s, 65 ℃延伸30 s, 5个循环;然后94 ℃预变性20 s;55 ℃退火20 s, 72 ℃延伸30 s, 20个循环;最后72 ℃延伸5 min.PCR反应在T100TM PCR热循环仪(BIO-RAD, USA)上进行.第二阶段的PCR反应体系(30 μL)包括:基因组DNA 10~20 ng, 2×Taq master Mix 15 μL, 1 μLBar-PCR引物F(10 μm)及引物R(10 μm), 添加蒸馏水至30 μL.PCR反应条件如下:95 ℃预变性3 min;95 ℃变性15 s, 55 ℃退火15 s, 72 ℃延伸30 s, 5个循环;最终在72 ℃延伸55 min.PCR产物使用Agencourt AMPure XP(Beckman, USA)进行纯化, 然后使用Qubit2.0 DNA测试盒(Life, USA)进行量化测定.最后, 所有样品的扩增子由生工生物工程(上海)股份有限公司利用Illumina Miseq测序平台进行高通量测序操作.
2.5 实时定量分析利用PCR实时荧光定量系统(Takara, 日本)对功能基因(mcrA和dsrA)进行实时荧光定量PCR分析, 测定产甲烷菌和硫酸盐还原菌的丰度.采用SYBR Green I荧光染料嵌合并利用克隆转换的方法构建标准品质粒, 然后用EASY Dilution将构建的DNA标准品梯度稀释(107、106、105、104、103 copies · μL-1)作为模板进行Rteal Time PCR反应, 制作DNA标准曲线.mcrA基因和dsrA基因反应体系均为25 μL:SYBR premix Ex Taq Ⅱ(2×)12.5 μL, Primer F(10 μmol · L-1)1 μL, Primer R(10 μmol · L-1)1 μL, DNA 1 μL, dH2O 9.5 μL.其中, mcrA基因的反应条件为:95 ℃预变性30 s;95 ℃变性5 s, 55 ℃退火10 s, 72 ℃延伸30 s, 40个循环;dsrA基因的反应条件为:95 ℃预变性30 s;95 ℃变性5 s, 60 ℃延伸30 s, 40个循环.利用标准曲线分别对样品中的mcrA和dsrA基因进行定量, 得出基因丰度, 结合基因组DNA样品的浓度最终换算成copies · ng-1进行分析.
2.6 系统发育分析结合高通量测序结果, 选取OTU的代表序列构建系统发育树.每一类菌目中, 选择典型代表性序列, 同时为了对未知菌目的分类地位进行分析, 从GenBank中选取具有代表性的产甲烷菌和硫酸盐还原菌基因序列作为参考序列进行系统发育分析.通过Clustal软件进行多序列比对, 运用MEGA5.0软件中的Neighbor-Joining法构建产甲烷菌与硫酸盐还原菌的系统发育树, 设置1000次重复的自展值(Bootstrap)进行分析.
2.7 统计分析根据UCLUST按照97%相似性将全部基因序列聚类, 去除singleton的OTU, 得到代表性OTU序列.应用软件Mothur中的summary.single命令, 计算种群丰富度Chao1指数、Shannon和Simpson多样性指数.将代表性OTU序列与功能基因数据库进行对比, 得到物种信息, 然后分别在目、属水平进行分析得到物种分布图.在此基础上, 通过Venn图找到核心群落.运用Canoco 4.5生态学多元统计分析模型分析样本的空间差异特征, 分析环境因子对微生物群落影响的显著性水平.所有数据在分析前先进行正态分布检验, 采用单因素方差分析(One-way ANOVA)检验两组变量之间的差异性, 对于有显著性差异的结果, 组间的差异性利用Tukey事后检验分析.以上数据分析显著性水平p均设为0.05, 统计分析在SPSS 22.0软件中进行.
3 结果(Results) 3.1 土壤及间隙水理化性质由图 2可知, 单独Fe(Ⅲ)施加显著提高了土壤样品中Fe(Ⅲ)含量(p < 0.05), 与对照相比, Fe(Ⅲ)+盐水处理的土壤Fe(Ⅲ)增加量更为明显, 单独Fe(Ⅲ)施加显著增加了间隙水中NO3-含量, 却减少了NH4+含量(p < 0.05).单独盐水施加与对照相比显著提高了土壤电导率, 以及间隙水中SO42-、Cl-、NH4+浓度(p < 0.01), 降低了NO3-含量.Fe(Ⅲ)+盐水施加共同影响下的湿地土壤NO3-含量显著低于单独施加Fe(Ⅲ)和对照处理(p < 0.05).
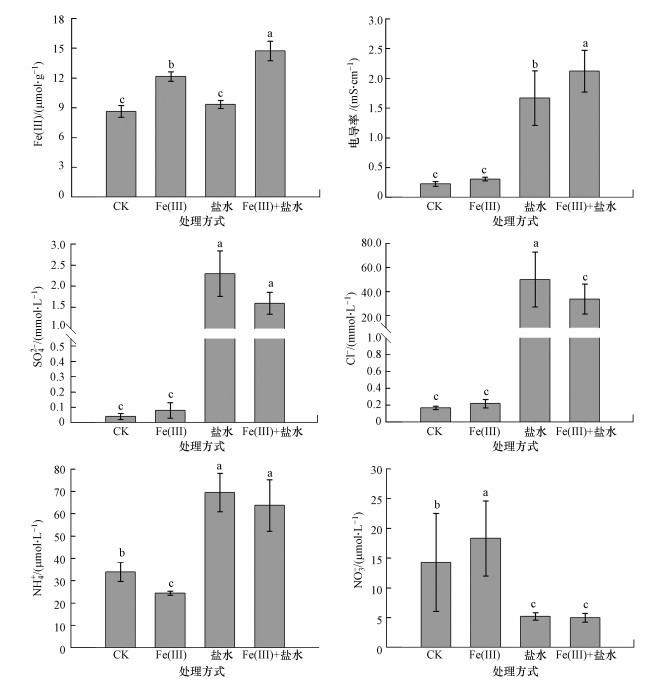 |
| 图 2 脉冲式盐水和Fe(Ⅲ)施加对土壤及间隙水理化性质的影响 (不同小写字母代表不同处理两两之间具有显著差异性, p<0.05, 下同) Fig. 2 Effects of saltwater and Fe(Ⅲ) pulses on physical and chemical properties of soil and pore water chemistry |
通过荧光定量PCR技术获得土壤产甲烷菌(mcrA)及硫酸盐还原菌(dsrA)的基因拷贝数(表 1).整体来看, 产甲烷菌的基因拷贝数较硫酸盐还原菌高出约一个数量级, 在土壤中占有优势.脉冲式盐水及Fe(Ⅲ)施加对河口感潮淡水沼泽湿地土壤产甲烷菌和硫酸盐还原菌的数量均未产生显著的影响(p>0.05).
| 表 1 不同处理中产甲烷菌和硫酸盐还原菌基因丰度 Table 1 Abundance of methanogens and SRB in the different treatments |
单样本的多样性分析(α多样性)可以评估样品内(Within-Community)微生物群落的丰富度和多样性, 稀释曲线反映了样品的取样深度, 可以用来评价测序量是否足以覆盖所有类群.本研究所获得产甲烷菌(图 3a)和硫酸盐还原菌(图 3b)的生物信息在种水平上还不能完全地代表真实环境中微生物的多样性, 说明这些样品中还包含着更多的有待于进一步挖掘的微生物数据, 增加取样量可能会得到更大的多样性.α多样性指数表明(表 2), 各处理之间多样性指数差异较小, Fe(Ⅲ)和盐水施加对微生物α多样性影响均不明显.
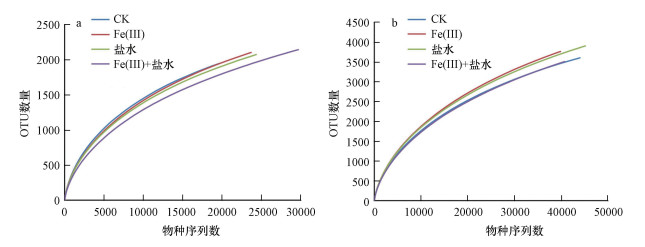 |
| 图 3 物种相对丰度稀释曲线 (a.产甲烷菌;b.硫酸盐还原菌) Fig. 3 Rarefaction curves of species relative abundance |
| 表 2 产甲烷菌和硫酸盐还原菌α多样性指数分析 Table 2 The α diversity of methanogens and SRB |
β多样性是对不同样品的微生物群落构成进行比较分析.基于Unifrac距离矩阵的PCoA分析中, 不同形状的点代表了不同的处理样品, 产甲烷菌(图 4a)和硫酸盐还原菌(图 4b)分别解释了79.5%和48.7%的变量, 不同处理样品间的空间距离较远且相似度较低.对照、单独Fe(Ⅲ)施加、单独盐水施加及Fe(Ⅲ)+盐水混合施加4个处理之间整体差异性不明显.此外, 结合非参数检验相似性分析(Anosim)对不同添加处理下的样品两两比较发现(表 3), 虽然硫酸盐还原菌不同添加处理下组内差异大于组间差异, 但整体差异均不显著(p>0.05).
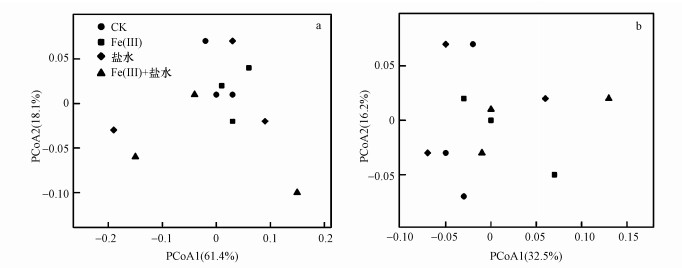 |
| 图 4 产甲烷菌(a)与硫酸盐还原菌(b)群落结构β多样性分析 Fig. 4 The β diversity of the methanogens(a) and SRB(b) |
| 表 3 Anosim统计结果 Table 3 The results of Anosim statistics |
不同添加处理下, 目分类水平上的产甲烷菌和硫酸盐还原菌差异不明显(图 5a, 5b), 其中, 产甲烷菌主要有甲烷微菌目(Methanomicrobiales, 77.49%)、甲烷八叠球菌目(Methanosarcinales, 10.31%)、Methanomassiliicoccales(0.94%)和甲烷杆菌目(Methanobacteriales, 0.76%), 硫酸盐还原菌主要有脱硫弧菌目(Desulfovibrionales, 19.60%)、脱硫杆菌目(Desulfobacterales, 3.35%)、互营杆菌目(Syntrophobacterales, 2.57%)和梭菌目(Clostridiales, 1.12%).与目水平相比, 硫酸盐还原菌在属分类水平上各添加处理之间的差异较为明显(图 5c, 5d), 其中, Fe(Ⅲ)+盐水处理中较单独施加Fe(Ⅲ)和盐水拥有更多的Desulfatibacillum和Desulfovirga, 而Desulfovibrio和脱硫念珠菌属(Desulfomonile)却显著减少.除此之外, 样品中未鉴定的产甲烷属所占比例依然很大, 检测到的产甲烷菌比例较少, 且所有处理中产甲烷菌群结构单一, 具有相近的同源关系.
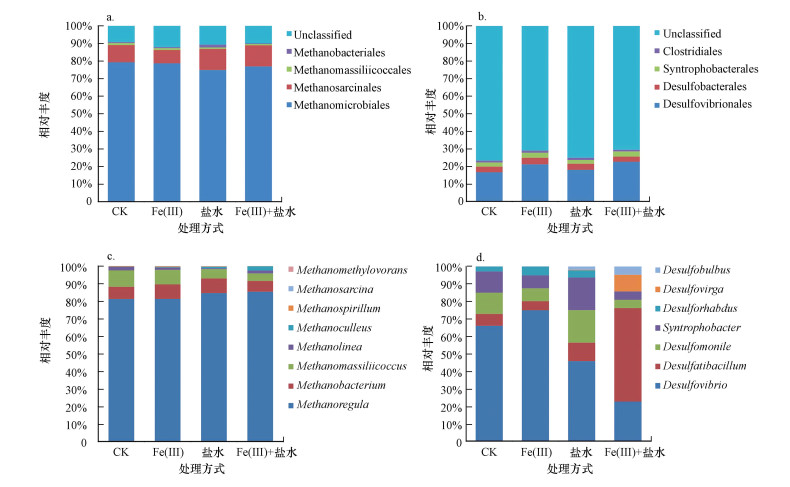 |
| 图 5 产甲烷菌与硫酸盐还原菌在目水平和属水平的群落结构 (a.产甲烷菌(目水平); b.硫酸盐还原菌(目水平); c.产甲烷菌(属水平); d.硫酸盐还原菌(属水平)) Fig. 5 Methanogens and SRB Community compositions at the order and genus levels |
由于功能基因文库容量的制约, 检验样品中包含很多未知序列, 为了更加准确地鉴定群落的产甲烷途径, 对所有菌群进行了系统发育分析(图 6).根据测序结果和聚类同源性分析比较发现, 研究样地土壤中检测到的产甲烷菌类群包括:甲烷杆菌目(Methanobacteriales)、甲烷微菌目(Methanomicrobiales)、甲烷八叠球菌目(Methanosarcinales)及Methanomassiliicoccales.其中, Methanomicrobiales普遍存在于对照、单独添加Fe(Ⅲ)、添加盐水及Fe(Ⅲ)+盐水混合添加样品中, 同时发现在测序结果中无法确定其分类水平的OTU大多与其相似.因此, 从上述数据可以看出, 不考虑样品来源, 未明确地位的菌目主要与甲烷微菌目有较好的亲缘关系.另外, 在硫酸盐还原菌中除了比对出与测序结果相似的群落结构信息外, 本研究还发现那些无法获取物种信息的OTU依然占据较大比例.另外, 结合已获得的产甲烷菌属、硫酸盐还原菌属与未鉴定属的亲缘分析, 从而说明4种处理样品中的产甲烷菌和硫酸盐还原菌除菌属所占比例不同外, 检测到的菌属类别大致相同.
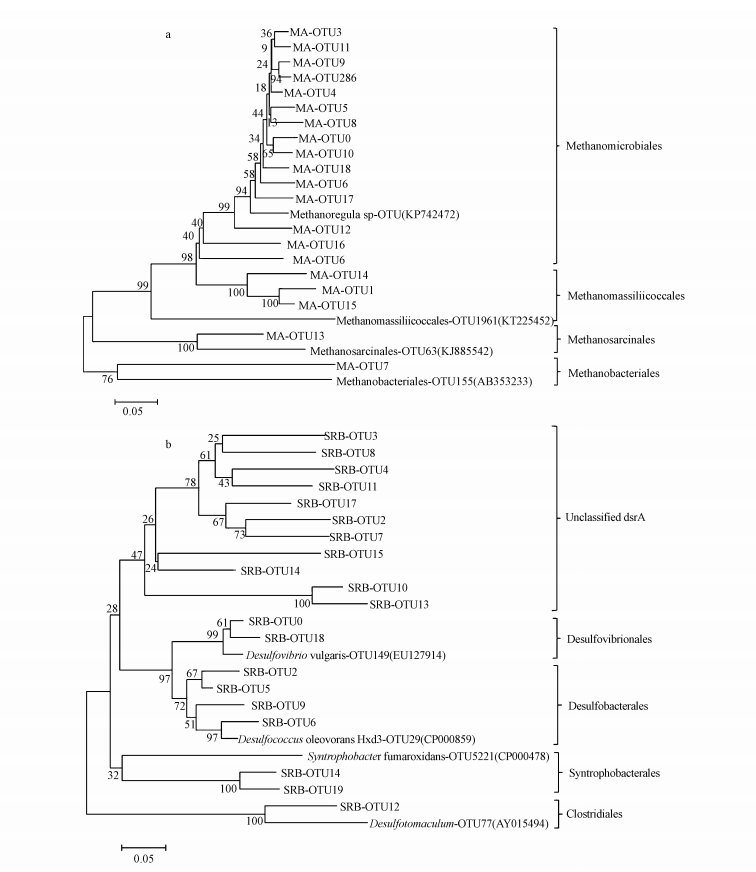 |
| 图 6 产甲烷菌(a)与硫酸盐还原菌(b)的系统发育树 Fig. 6 Phylogenetic tree of methanogens(a) and SRB(b) |
为了深入分析不同处理下的土壤菌群结构差异, 本研究对CK、单独添加Fe(Ⅲ)、单独添加盐水及Fe(Ⅲ)与盐水混合添加4种处理中的产甲烷菌与硫酸盐还原菌进行了OTUs韦恩图分析, 发现产甲烷菌(图 7a)与硫酸盐还原菌(图 7b)共有的OTU数目分别为213和393个, 约占总数的35.6%和36.2%.另外, 通过对单独Fe(Ⅲ)添加、单独盐水添加和Fe(Ⅲ)与盐水混合添加的土壤样品分别与对照进行Venn分析, 进而得出OTU在不同处理下的重叠状况.产甲烷菌结果显示, 单独盐水添加的特有真菌OTU数目最多, 为99个, 占总量的19.0%, 而单独Fe(Ⅲ)与对照样品共有OTU数目最多, 为308个, 占总量的61.7%.而硫酸盐还原菌韦恩图显示, 对照和单独Fe(Ⅲ)施加中共有的OTU数目最多, 约占总数的55.2%, 与此同时, 单独Fe(Ⅲ)施加中特有的OTU数目也远大于单独盐水添加和Fe(Ⅲ)与盐水混合添加处理.
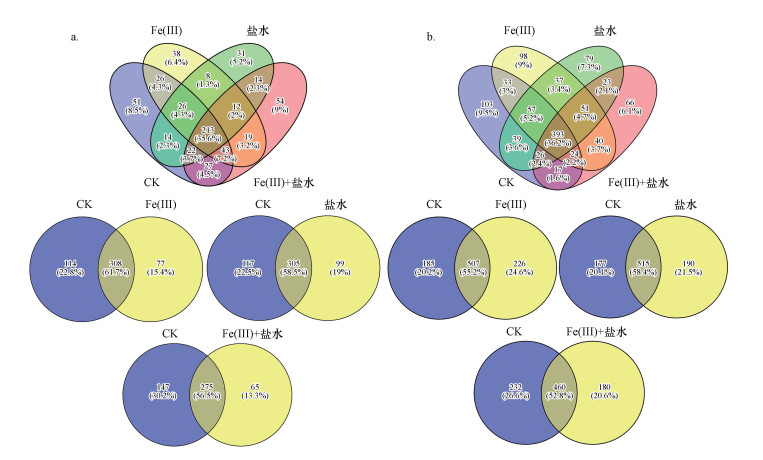 |
| 图 7 产甲烷菌(a)与硫酸盐还原菌(b)OTU分布Venn图 Fig. 7 Venn chart of methanogens(a) and SRB(b) OTU distributions |
RDA排序统计结果反映了在属分类水平上不同丰度的土壤微生物对土壤条件的相似适应性及土壤微生物与理化因子在梯度上的分布格局.产甲烷菌(图 8a)与硫酸盐还原菌(图 8b)第一轴特征值分别为45.5%和59.0%, 包含了大部分的土壤环境信息和微生物群落信息, 可以较好地解释各环境因子及样本之间的关系.其中, 土壤电导率对产甲烷菌微生物群落结构的影响最为显著(p < 0.01), 且产甲烷菌优势菌群Methanoregula与电导率、NH4+和Fe(Ⅲ)具有明显的正相关关系.与此同时, Fe(Ⅲ)是影响硫酸盐还原菌的重要环境因子, 且与多个物种(Desulfatibacillum、Desulfobulbus、Desulfovirga)具有明显的正相关关系.按物种来分, Desulfatibacillum、Desulfobulbus、Desulfovirga等物种分布较为集中且与土壤电导率、SO42-、NH4+和Fe(Ⅲ)所形成的夹角较小, 由此表明土壤中这些菌属对环境因子的响应较为敏感.
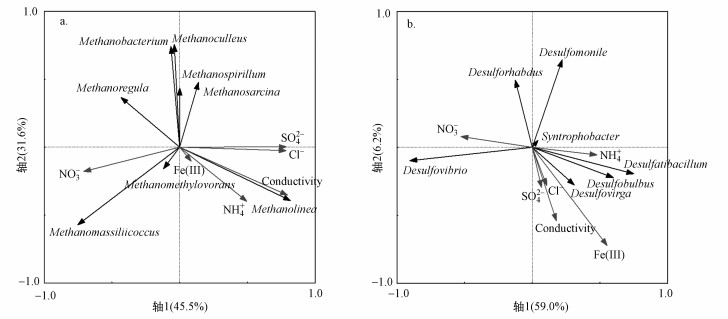 |
| 图 8 微生物属水平群落结构与环境因子的RDA分析 (a.产甲烷菌; b.硫酸盐还原菌) Fig. 8 RDA analyses linking the environmental factors and microbial community structures at the genus level |
闽江口塔礁洲感潮淡水沼泽湿地土壤主要的产甲烷菌为甲烷微菌目、八叠球菌目和甲烷杆菌目, 这一结果与Parkes等(2012)在英格兰河沼泽湿地的研究结果一致.本研究中, 无论是对照还是施加盐水或Fe(Ⅲ), 甲烷微菌目都是研究区域内的检测到的主要类群.湿地土壤中甲烷的产生途径主要有两条(Conrad et al., 1999; Whalen et al., 2005), 分别为:CH3COOH→CH4+CO2和CO2+4H2→CH4+2H2O.本研究中出现的以上3个主要的产甲烷目中的绝大多数产甲烷属均属于氢营养型的产甲烷菌类群, 推测闽江河口感潮淡水沼泽湿地土壤甲烷产生途径可能是以CO2+4H2 CH4+2H2O为主.本研究中隶属于甲烷八叠球菌目中的甲烷八叠球菌属(Methanosarcina), 属于既可以利用H2O/CO2, 也可以利用乙酸或甲基化合物产生甲烷的产甲烷菌类群(Ferry, 2010), 这说明除了H2O/CO2途径外, 在闽江口感潮淡水沼泽湿地土壤中同时还存在着乙酸发酵产甲烷途径和甲基营养型产甲烷途径.特别有趣的是, 本研究发现Methanoregula是研究样地最主要的产甲烷菌属类群, 占已分类属相对丰度的80%以上(图 5).据报道, Methanoregula主要分布在北方泥炭土壤中, 以及酸性泥炭藓占优势的藓类泥炭沼泽(Cadillo-Quiroz et al., 2006; Kotsyurbenko et al., 2007).然而, Xie等(2014)在珠江口的研究中也发现了该属, 而且发现随着盐度从31.2‰降低到0.1‰, Methanoregula的相对丰度明显下降.因此, 今后可加强对于Methanoregula菌属在我国滨海不同湿地类型和生境类型及北方草本沼泽湿地、泥炭湿地中分布的全面研究.
此外, 本研究还发现拥有独特代谢功能的第七产甲烷古菌目(Methanomassiliicoccales)中的Methanomassiliicoccus属, 与一般的专性甲基型产甲烷古菌不同, Methanomassiliicoccales目所属的产甲烷菌缺少将CO2还原为甲基辅酶M的完整路径, 因此, 这类菌需要额外添加氢气才能生长(Lang et al., 2014).张坚超等(2015)综述认为尽管目前在深海沉积物、水稻土、湖泊水体和沉积物及垃圾填埋场和厌氧反应器等介质中经常检测到与第七产甲烷古菌目十分相似的基因片段, 但它们是否在这些环境的甲烷产生和排放中起重要作用, 目前尚未形成较为明确的结论, 未来还有待进一步研究.
4.2 脉冲式盐水及Fe(Ⅲ)施加对河口感潮湿地土壤产甲烷菌的影响本研究中, 为期一年的脉冲式盐水及Fe(Ⅲ)施加对河口感潮淡水沼泽湿地土壤产甲烷菌群落组成和数量均未产生显著的影响.Vallcro等(2003)认为, 钠盐和硫酸盐对微生物的活动通常具有抑制作用, 盐度的增大可能影响厌氧发酵过程中电子受体的供应, 导致产甲烷菌可利用底物发生变化从而影响其群落结构.然而, Edmond等(2009)的研究却表明, 细菌和古菌的群落结构并没有随着盐度的增加而发生改变.本研究中施加的人造海水盐度高达为15‰, 单独盐水施加及Fe(Ⅲ)+盐水施加处理虽然均显著提高了土壤电导率值及间隙水中SO42-和Cl-浓度(图 2), 但土壤电导率值增加的幅度较低, 对照处理和单独盐水施加处理样地的土壤电导率分别为0.23 mS · cm-1(相当于盐度0.1‰)和1.67 mS · cm-1(相当于盐度0.8‰), 即盐水施加后样地土壤盐度值增加幅度很小.Neubauer等(2013)在美国河口感潮淡水湿地原位施加海水的实验也发现了同样的结果, 他认为施加的大多数盐水均被潮水或径流所冲走, 致使处理样地土壤盐度增加幅度很小.因此, 本研究认为脉冲式盐水入侵对于河口感潮淡水湿地土壤盐度的提升效应有限, 其对于河口感潮湿地土壤产甲烷菌群落组成和数量的影响也相对较弱.
本研究中, 虽然盐水施加未对产甲烷菌群落结构和数量产生显著的影响, 但RDA排序统计结果显示, 产甲烷菌群落结构和数量均与土壤电导率具有较强的相关性(图 8a), 这表明湿地土壤盐度仍然是一个影响湿地产甲烷菌群落结构和数量的重要环境因子.Webster等(2015)研究报道, 在英国河口从低盐的微盐水湿地到高盐的近海滩涂, 产甲烷菌的多样性指数逐渐降低.本课题组之前对于闽江河口从半咸水到淡水盐度梯度下的感潮湿地土壤产甲烷菌群落结构和数量的研究也表明, 产甲烷菌的多样性指数沿着淡水到半咸水的梯度在降低, 此外, 产甲烷菌的绝对数量为淡水感潮湿地显著高于半咸水沼泽湿地(Tong et al., 2017).以上河口区自然盐度梯度下的研究表明:湿地土壤产甲烷菌受到盐度的直接影响, 而盐水入侵干扰对于河口湿地土壤产甲烷菌的影响与入侵的时间尺度和方式密切相关.本研究中模拟的脉冲式盐水入侵对于湿地土壤产甲烷菌无显著影响, 今后可继续开展河口淡水湿地土壤产甲烷菌对于长期、持续性盐水入侵的响应研究.
目前还未见有关原位Fe(Ⅲ)施加对湿地土壤产甲烷菌群落组成和数量影响的文献报道.本研究中单独Fe(Ⅲ)施加及Fe(Ⅲ)+盐水施加处理均显著提高了土壤样品中Fe(Ⅲ)的含量(图 2), 但为期一年的脉冲式Fe(Ⅲ)施加对河口感潮淡水沼泽湿地土壤产甲烷菌群落组成和数量均未产生显著影响.推测可能因为土壤Fe(Ⅲ)含量增加幅度较低及土壤吸收时间很短, 由此造成以上结果.
4.3 河口感潮湿地硫酸盐还原菌及其对脉冲式盐水及Fe(Ⅲ)施加的响应硫酸盐还原菌广泛分布在海洋沉积物、河流、湖泊及一些泥沼等自然环境中(刘建丽等, 2016).本研究中, 闽江口塔礁洲感潮淡水沼泽湿地土壤主要的硫酸盐还原菌主要有脱硫弧菌目、脱硫杆菌目、互营杆菌目和梭菌目, 其中, 脱硫弧菌目在已分类的硫酸盐还原菌中占绝对优势(图 5b).脱硫弧菌目通常分布于淡水、淡咸水或海水下的污泥或沉积物中(李永峰等, 2013).一般来说, 脱硫弧菌的“食物”是硫酸盐, 当缺乏硫酸盐时脱硫弧菌的生长会变得十分缓慢(刘慧纬等, 2013).本研究湿地虽然属于河口区淡水湿地, 但每天均会受到上溯咸-淡混合水的影响, 湿地土壤间隙水中具有一定的SO42-含量, 故此造成研究样地对照组土壤中具有较多的属于脱硫弧菌目的硫酸盐还原菌存在.不同的天然湿地类型或不同区域的同一湿地类型由于生态环境各异, 导致土壤中硫酸盐还原菌的具体菌属和优势类群(或菌属)不尽相同(Moreau et al., 2010).佘晨兴等(2014)研究表明, 脱硫杆菌属、脱硫八叠菌属和脱硫线菌属是硫酸盐含量较高的河口半咸水沼泽湿地土壤中的优势菌属.在属水平上, 本研究主要的硫酸盐还原菌主要包括脱硫念珠菌属及Desulfatibacillum、Desulfovirga、Desulfovibrio等菌属.相对于单独施加Fe(Ⅲ)或盐水, Fe(Ⅲ)+盐水混合施加的样地土壤拥有更多的Desulfatibacillum和Desulfovirga, 以及较少的Desulfovibrio和脱硫念珠菌属, 由此表明Desulfatibacillum在盐水和Fe(Ⅲ)的交互作用下才能更好地激发.目前, 虽然已有相关研究表明硫酸盐浓度是控制硫酸盐还原效率的重要因素, 增加硫酸盐的浓度可能加速硫酸盐还原过程(Holmer et al., 2001);但通过我们对硫酸盐dsrA基因荧光定量分析显示, 基因丰度最高值出现在Fe(Ⅲ)施加样地中, 其次较高的是Fe(Ⅲ)+盐水施加样地.因此推断, Fe(Ⅲ)可能是影响dsrA基因丰度的主要因素, 这也与RDA排序结果中得到的Fe(Ⅲ)是影响硫酸盐还原菌的重要环境因子的结果相一致.
同样, 本研究为期一年的脉冲式盐水及Fe(Ⅲ)施加对河口感潮淡水沼泽湿地土壤硫酸盐还原菌群落组成和数量均未产生显著的影响.推测可能同样是因为土壤盐度及Fe(Ⅲ)含量增加的幅度较小及影响时间较短造成的.
5 结论(Conclusions)1) 脉冲式盐水施加改变了河口感潮淡水沼泽湿地土壤间隙水理化性质, 显著提高了土壤间隙水中SO42-、Cl-、NH4+的浓度, 降低了NO3-浓度.
2) 脉冲式盐水及Fe(Ⅲ)施加对产甲烷菌和硫酸盐还原菌物种多样性和群落结构未产生显著影响, 与门水平相比, 硫酸盐还原菌在属水平上的差异更为明显, 未明确地位的菌目主要与甲烷微菌目有较好的亲缘关系.
3) 土壤电导率对产甲烷菌微生物群落结构的影响最为显著(p < 0.01), Fe(Ⅲ)是影响硫酸盐还原菌的重要环境因子.另外, Desulfatibacillum、Desulfobulbus、Desulfovirga等物种分布较为集中且对土壤电导率、SO42-、NH4+和Fe(Ⅲ)等环境因子的响应更为敏感.
Baldwin D S, Rees G N, Mitchell A M, et al. 2006. The short-term effects of salinization on anaerobic nutrient cycling and microbial community structure in sediment from a freshwater wetland[J]. Wetlands, 26(2): 455-464. |
Cadillo-Quiroz H, Brauer S, Yashiro E, et al. 2006. Vertical profiles of methanogenesis and methanogens in two contrasting acidic peatlands in central New York State, USA[J]. Environmental Microbiology, 8(8): 1428-1440. DOI:10.1111/j.1462-2920.2006.01036.x |
Chambers L G, Osborne T Z, Reddy K R. 2013. Effect of salinity-altering pulsing events on soil organic carbon loss along an intertidal wetland gradient:a laboratory experiment[J]. Biogeochemistry, 115(1): 363-383. |
Chambers L G, Reddy K R, Osborne. 2011. Short-Term response of carbon cycling to salinity pulses in a freshwater wetland[J]. Soil Science Society of America Journal, 75(5): 2000-2007. DOI:10.2136/sssaj2011.0026 |
Conrad R. 1999. Contribution of hydrogen to methane production and control of hydrogen concentrations in methanogenic soils and sediments[J]. FEMS Microbiology Ecology, 28(3): 193-202. DOI:10.1111/j.1574-6941.1999.tb00575.x |
Dijk G V, Smolders A J P, Loeb R, et al. 2015. Salinization of coastal freshwater wetlands, effects of constant versus fluctuating salinity on sediment biogeochemistry[J]. Biogeochemistry, 126(1): 71-84. |
Edmonds J W, Weston N B, Joye S B, et al. 2009. Microbial community response to seawater amendment in low-salinity tidal sediments[J]. Microbial Ecology, 58(3): 558-568. DOI:10.1007/s00248-009-9556-2 |
Ferry J G. 2010. How to make a living by exhaling methane[J]. Annual Review of Microbiology, 64(1): 453-473. |
高建华, 欧维新, 杨桂山. 2004. 潮滩湿地N、P生物地球化学过程研究[J]. 湿地科学, 2(3): 220-227. DOI:10.3969/j.issn.1672-5948.2004.03.010 |
Gao J H, Zhu X D, Yu Y S, et al. 1999. Study of the impact of typhoon disaster on coastal region of China[J]. Journal of Catastrophology, 14(2): 73-77. |
Holmer M, Storkholm P. 2001. Sulphate reduction and sulphur cycling in lake sediments:a review[J]. Freshwater Biology, 46(4): 431-451. DOI:10.1046/j.1365-2427.2001.00687.x |
胡敏杰, 邹芳芳, 仝川, 等. 2014. 闽江河口湿地沉积物生源要素含量及生态风险评价[J]. 水土保持学报, 28(3): 119-124. |
Hu Y, Wang L, Tang Y, et al. 2014. Variability in soil microbial community and activity between coastal and riparian wetlands in the Yangtze River estuary-Potential impacts on carbon sequestration[J]. Soil Biology & Biochemistry, 70: 221-228. |
IP CC. 2013. Climate Change 2013:The Physical Science Basis.Contribution of Working Group Ⅰ to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change[M]. United Kingdom and New York, NY, USA: Cambridge University Press.
|
Kondo R, Nedwell D B, Purdy K J, et al. 2004. Detection and enumeration of sulphate-reducing bacteria in estuarine sediments by competitive PCR[J]. Geomicrobiology Journal, 21(3): 145-157. DOI:10.1080/01490450490275307 |
Kostka J E, Luther III G W. 1994. Partitioning and speciation of solid phase iron in saltmarsh sediments[J]. Geochimica et Cosmochimica Acta, 58(7): 1701-1710. DOI:10.1016/0016-7037(94)90531-2 |
Kotsyurbenko O R, Friedrich M W, Simankova M V, et al. 2007. Shift from acetoclastic to H2-dependent methanogenesis in a west siberian peat bog at low ph values and isolation of an acidophilic methanobacterium strain[J]. Applied & Environmental Microbiology, 73(7): 2344-8. |
Lang K, Schuldes J, Klingl A, et al. 2014. Comparative genome analysis of "Candidatus Methanoplasma termitum" indicates a new mode of energy metabolism in the seventh order of methanogens[J]. Applied & Environmental Microbiology, 81(4): 1338-1352. |
刘建丽, 赵吉, 武琳慧. 2016. 乌梁素海湖滨湿地硫酸盐还原菌种群分布[J]. 农业环境科学学报, 35(2): 358-363. |
李永峰, 刘晓晔, 杨传平. 2013. 硫酸盐还原菌细菌学[M]. 哈尔滨: 东北林业大学出版社.
|
Luton P E, Wayne J M, Sharp R J, et al. 2002. The mcrA gene as an alternative to 16S rRNA in the phylogenetic analysis of methanogen populations in landfillb[J]. Microbiology, 148: 3521-3530. DOI:10.1099/00221287-148-11-3521 |
Moreau J W, Zierenberg R A, Banfield J F. 2010. Diversity of dissimilatory sulfite reductase genes (dsrAB) in a salt marsh impacted by long-term acid mine drainage[J]. Applied and Environmental Microbiology, 76(14): 4819-4828. DOI:10.1128/AEM.03006-09 |
牟晓杰.2013.闽江河口湿地碳氮循环关键过程对氮输入的响应[D].长春: 中国科学院研究生院(东北地理与农业生态研究所) http://cdmd.cnki.com.cn/Article/CDMD-80062-1013025752.htm
|
Nedwell D B, Embley T M, Purdy K J. 2004. Sulphate reduction, methanogenesis and phylogenetics of the sulphate reducing bacterial communities along an estuarine gradient[J]. Aquatic Microbial Ecology, 37: 209-217. DOI:10.3354/ame037209 |
Neubauer S C. 2013. Ecosystem responses of a tidal freshwater marsh experiencing saltwater intrusion and altered hydrology[J]. Estuar Coast, 36: 491-507. DOI:10.1007/s12237-011-9455-x |
Parkes R J, Brock F, Banning N, et al. 2012. Changes in methanogenic substrate utilization and communities with depth in a salt-marsh, creek sediment in southern England[J]. Estuarine Coastal & Shelf Science, 96(1): 170-178. |
Sharpe P J, Baldwin A H. 2012. Tidal marsh plant community response to sea-level rise:A mesocosm study[J]. Aquatic Botany, 101(4): 34-40. |
佘晨兴.2014.闽江河口潮汐沼泽湿地土壤产甲烷菌和硫酸盐还原菌群落结构和丰度的研究[D].福州: 福建师范大学 http://cdmd.cnki.com.cn/Article/CDMD-10394-1015523537.htm
|
佘晨兴, 仝川. 2012. 闽江口芦苇沼泽湿地土壤产甲烷菌群落结构的垂直分布[J]. 生态学报, 32(17): 5299-5308. |
Simas T, Nunes J P, Ferreira J G. 2001. Effects of global climate change on coastal salt marshes[J]. Ecological Modelling, 139(1): 1-15. DOI:10.1016/S0304-3800(01)00226-5 |
Tong C, Cadillo-Quiroz H, Zeng Z H, et al. 2017. Changes of community structure and abundance of methanogens in soils along a freshwater-brackish water gradient in subtropical estuarine marshes[J]. Geoderma, 299: 101-110. DOI:10.1016/j.geoderma.2017.03.026 |
Vallcro M V G, Pol L W H, Lettinga G, et al. 2003. Effect of NaCl on thermophilic (55℃) methanol degradation in sulfate reducing granular sludge reactors[J]. Water Research, 37(10): 2269-2280. DOI:10.1016/S0043-1354(03)00024-1 |
Webster G, O'Sullivan L A, Meng Y, et al. 2015. Archaeal community diversity and abundance changes along a natural salinity gradient in estuarine sediments[J]. FEMS Microbiology Ecology, 91(2): 1-18. |
Whalen S C. 2005. Biogeochemistry of methane exchange between natural wetlands and the atmosphere[J]. Environmental Engineering Science, 22(1): 73-94. DOI:10.1089/ees.2005.22.73 |
Xie W, Zhang C, Zhou X, et al. 2014. Salinity-dominated change in community structure and ecological function of Archaea from the lower Pearl River to coastal South China Sea[J]. Applied Microbiology and Biotechnology, 98(18): 7971-7982. DOI:10.1007/s00253-014-5838-9 |
徐慧纬, 张旭, 李立明, 等. 2013. 不同基质条件下透性处理对脱硫弧菌硫酸盐还原活性的影响[J]. 环境科学, 34(1): 179-183. |
张坚超, 徐镱钦, 陆雅海. 2015. 陆地生态系统甲烷产生和氧化过程的微生物机理[J]. 生态学报, 35(20): 26-37. |
周国华, 孙彬彬, 曾道明, 等. 2012. 中国东部主要入海河流河口区地球化学特征:理化指标与水溶态元素浓度[J]. 中国地质, 39(2): 283-294. DOI:10.3969/j.issn.1000-3657.2012.02.002 |
 2020, Vol. 40
2020, Vol. 40


