2. 中国科学院生态环境研究中心, 中国科学院饮用水科学与技术重点实验室, 北京 100085
2. Key Laboratory of Drinking Water Science and Technology, Research Center for Eco-Environment Sciences, Chinese Academy of Sciences, Beijing 100085
好氧硝化过程是氮循环中的关键步骤, 此前通常被认为分两步进行:氨首先被氨氧化细菌(AOB)和氨氧化古菌(AOA)氧化成亚硝酸盐(Könneke et al., 2005), 然后亚硝酸盐被亚硝酸盐氧化细菌(NOB)氧化成硝酸盐(Teske et al., 1994).2015年, 科学家们分别在不同环境中发现了可以独立将NH4+氧化为NO3-的细菌(van Kessel et al., 2015; Daims et al., 2015; Pinto et al., 2015), 这些细菌被称为全程氨氧化微生物(complete ammonia oxidizers, comammox).全程氨氧化微生物与AOA和AOB的区别在于, 全程氨氧化微生物不需要NOB的参与, 便能独立地完成整个好氧硝化过程.全程氨氧化微生物与AOA和AOB的联系在于, 其都属于好氧氨氧化微生物, 均能直接利用环境中的氨.全程氨氧化微生物的发现改变了科学界100多年来对于硝化作用分2步进行的认识, 使得硝化作用再一次引起科学界的关注.
目前已证实comammox细菌分布于许多自然环境、农业系统以及工程系统中(Daims et al., 2015; van Kessel et al., 2015; Bartleme et al., 2017; Pinto et al., 2018).而人们对于comammox细菌在人工湿地生态系统中的分布和群落结构尚缺乏系统了解.湿地作为水体与陆地之间的过渡地带, 具有独特的生态环境特性, 是氮循环反应的关键区域.研究湿地生态系统中的全程氨氧化过程, 解析该区域中comammox细菌的分布与群落结构特征, 探究影响comammox细菌分布和群落结构的关键因素, 补充了此前该新型氨氧化微生物在湿地生态系统中分布特征的研究空白, 对于完善comammox细菌在各种不同生态系统中分布情况研究具有重要的意义.
2 材料与方法(Materials and methods) 2.1 研究区域概况与样品采集方法为了解决嘉兴市内水源地污染问题, 嘉兴市与中国科学院生态环境研究中心合作, 利用生态修复理念, 建设了以构筑根孔技术为核心的规模性“水源保护生态治理湿地工程”—石臼漾构筑根孔湿地(30°46′12.57″~30°47′02.31″ N, 120°41′52.43″~120°42′41.31″ E)(张炜等, 2011).湿地紧邻石臼漾水厂, 总占地面积为108.7 hm2, 其中陆地面积为45.4 hm2, 水域面积为63.3 hm2.北郊河以东区域于2008年7月2日投入试运行, 北郊河以西区域于2009年1月20日投入试运行, 目前已稳定运行超过10年, 每日提供净化源水25万吨并贮存超过120万吨水厂备用水.石臼漾人工湿地的核心功能区是植物床-沟壕系统, 水流通过水力驱动流过人工埋设的根孔和自然生长的植物根孔, 对污染物产生截留效果, 也为微生物降解创造氧化-还原交替的环境条件.根孔生态净化区周围是25 m宽的大沟壕, 通过蜿蜒曲折的形状增加水域面积和水流通过的长度.其间共分布有61个植物床、62条小沟壕, 单个植物床长50~200 m, 宽16.3 m, 上方主要种植芦苇等大型挺水植物, 两个植物床之间的小沟壕宽10 m, 目的是增加陆地和水体的接触界面面积, 产生“边界效应”(王宇等, 2014).本人于2019年1月4日和2019年7月17日采集石臼漾人工湿地南区大沟中心、大沟边缘、小沟中心和小沟边缘4个区域的沉积物样品.使用沉积物采样器(Hydro-Bios, Kiel, Germany)采集沉积物样品约1 kg.为保证所采集的样品能代表该区域, 在大沟中心选取3个采样点, 大沟边缘选取3个采样点, 小沟中心选取3个采样点, 小沟边缘选取3个采样点.共采集4个区域, 12个地点样品.采集后的样品保藏在储有冰袋的保温箱中尽快运回实验室.一部分分装在4 ℃冷藏保存, 用于测定理化性质;另一部分冷冻干燥后过100目尼龙筛, 于-80 ℃冷冻保存, 用于提取DNA并进行分子生物学实验.
 |
| 图 1 石臼漾人工湿地采样点示意图 Fig. 1 The sampling sites in Shijiuyang constructed wetland |
按照标准检测方法《土壤农化分析》(鲍士旦, 2000)进行理化因子测定.含水率(moisture content, MC)和有机质(organic matter, OM)的测定使用烧失量(loss of ignition, LOI)法(张文河等, 2007).按超纯水/沉积物为5 : 1的质量比, 往沉积物中加入超纯水, 浸提1 h后测定其pH值.用2 mol · L-1的KCl溶液对沉积物样品进行浸提(于向华等, 2013), 使用连续流动分析仪(SAN plus, Skalar Analytical B.V., Breda, the Netherlands)测定沉积物中氨氮(NH4+-N)、硝酸盐氮(NO3--N)和亚硝酸盐氮(NO2--N)浓度.总碳(TC)、总氮(TN)、总硫(TS)的测定:将冷冻干燥后的样品过100目筛后用锡箔纸包好后, 放入元素分析仪(Elementar Vario EL III analyzer, Germany)燃烧测定.所有样品均进行3次平行测定后取均值.
2.3 DNA提取与PCR扩增使用FastDNA® Spin Kit for Soil土壤DNA提取试剂盒(MP Biomedicals, USA), 参照说明书步骤提取样品总DNA.用1%琼脂糖凝胶对提取DNA进行检测, 并用Nano Drop 2000 UV-Vis Spectrophotometer (Thermo Fisher Scientific, USA)测定DNA浓度.针对comammox细菌功能基因amoA, 使用ABI GeneAmp® 9700型PCR仪进行特异性扩增, 扩增体系采用20 μL体系:5×FastPfu Buffer 4 μL, 2.5 mmol · L-1 dNTPs 2 μL, Forward Primer(pmoA-189b-F, GGN GACTGGGACTTYTGG)0.8 μL, Reverse Primer(com-amoA-1R, CGAGATCATGGTGCTG TGAC)0.8 μL, FastPfu Polymerase 0.4 μL, BSA 0.2 μL, Template DNA 10 ng, 补充ddH2O至20 μL.扩增程序采用:95 ℃预变性3 min;95 ℃变性30 s, 55 ℃退火30 s, 72 ℃延伸45 s, 共35个循环;72 ℃延伸10 min(Bartelme et al., 2017).PCR扩增产物用1%琼脂糖凝胶电泳确定DNA片段大小.
2.4 荧光定量PCR实时荧光定量PCR采用SYBR Green法, 采用试剂为SYBR Premix Ex Taq TM试剂盒(TaKaRa, 大连).AOA定量采用引物为Arch-amoA F(STAATGGTCTGGCTTAGACG)和Arch-amoA R(GCGG CCATCCATCTGTATGT)(Francis et al., 2005), AOB定量采用引物为amoA-1F9(GGGG TTTCTACTGGTGGT)和amoA-2R5(CCCCTCKGSA AAGCCTTCTTC)(Rotthauwe et al., 1997), comammox定量采用comammox定性PCR所用引物(Bartelme et al., 2017).扩增体系如下:SYBRs Premix Ex Taq酶(TAKARA, 大连)10 μL, ROX 0.4 μL, 正反向引物各0.1 μL, 稀释10倍的DNA模板2 μL, 用ddH2O补足至20 μL.使用ABI 7500 Real-Time PCR System扩增仪(Applied Biosystems, CA, USA)进行扩增, 定量PCR扩增程序如下:95 ℃预变性30 s;95 ℃变性10 s, 53 ℃(AOA)、55 ℃(AOB)和55 ℃(comammox)退火30 s, 72 ℃延伸35 s, 共35个循环;72 ℃延伸1 min(Wang et al., 2011; Bartelme et al., 2017).实验设置阴性对照, 按10倍梯度稀释已知拷贝数的质粒, 得到8个标准样品和DNA样品同时进行定量扩增, 每个样品做3个平行.用7500 SDS System配套软件进行分析计算, 得到AOA、AOB和comammox细菌的拷贝数.其中, 阴性对照组定量结果均未检测到(ND), 标准样品扩增效率在90%~110%, 标准曲线相关性大于0.99, 扩增溶解曲线为单一峰.
2.5 功能基因高通量测序及分析高通量测序时用带有Barcode信息的引物针对comammox功能基因amoA进行PCR扩增.通过Illumina HiSeq平台(上海美吉生物医药科技有限公司)完成高通量测序.公司返回Fasta格式序列文件, 进行后续处理, 步骤如下:①运用QIIME软件(Quantitative Insights Into Microbial Ecology)对序列进行质量控制, 并通过Mothur软件得到非冗余的核酸序列(CAPORASO J G et al., 2010).②用Bioedit软件将非冗余核酸序列翻译成氨基酸序列, 通过Uclust软件将氨基酸序列按照97%的相似度进行聚类(Edgar, 2010; Wang et al., 2018), 得到可操作分类单元(operational taxonomic units, OTUs)的结果.③将每个OTU的代表序列在Genbank数据库进行Blast比对, 得到对应的分类学信息.④通过自写的Perl脚本计算各样品的覆盖率(coverage)、丰富度指数(Chao1)和多样性指数(Shannon、Simpson)、微生物的alpha多样性和beta多样性等(庄林杰等, 2017).
2.6 数据分析本研究中主要利用SPSS 21.0软件(Statistical Product and Service Solutions)进行相关性分析(均采用Person相关系数);群落的排序均基于Bray-Curtis差异度指数, 排序采用主坐标分析(Principle Coordinate Analysis, PCoA);利用Origin 2020及Microsoft Office 2016进行相关图表的绘制;使用冗余分析(RDA)来确定这些环境变量解释的方差和comammox群落结构的分布;利用Gephi0.9.2绘制网络分析图.
3 结果与分析(Results and analysis) 3.1 基本理化性质针对4个地点共12个沉积物样品在冬夏2个季节的理化性质分析发现(表 1), pH值在各采样点各季节差异很小, 为6.15~6.74, 说明人工湿地沉积物呈弱酸性.沉积物有机质(OM)为43.07~98.32 g · kg-1, 有机质含量整体较高, 各采样点上夏季的有机质含量均高于冬季.在各采样点上, 冬季的含水率(MC)与夏季相差不大. NH4+-N含量在不同区域不同季节有明显区别, 小沟边缘冬季(108.99 mg · kg-1)最高, 小沟边缘夏季(31.32 mg · kg-1)最低.NO3--N含量在不同区域不同季节同样也有很明显的差异, 小沟边缘冬季(238.09 mg · kg-1)最高, 大沟中心(4.16 mg · kg-1)最低, 各采样点上冬季NO3--N含量均高于夏季.NO2--N含量低于检测限.总氮(TN)、总碳(TC)和总硫(TS)在各样点上均是冬季高于夏季;且在冬夏两季, 大沟和小沟中, 沟中心的TN、TC、TS含量均高于沟边缘.
| 表 1 石臼漾湿地沉积物样品理化特性 Table 1 Physicochemical factors of samples in Shijiuyang wetland |
采用荧光定量PCR技术, 对石臼漾人工湿地沉积物样品分别进行comammox、AOA和AOB的定量分析, 结果表明4个区域在冬夏两季中均检测到了comammox、AOA和AOB.Comammox在人工湿地中的整体丰度为1.77×105~4.07×107 copies · g-1, 而AOA和AOB分别为6.03×105~5.11×106 copies · g-1和8.61×103~3.57×106 copies · g-1, 并且AOA、AOB和comammox细菌的丰度在夏季均高于冬季.在冬季样品中, 大沟中心和大沟边缘中均是comammox细菌丰度最高(4.06×106 copies · g-1;1.61×106 copies · g-1), AOA丰度其次(1.94×106 copies · g-1;8.18×105 copies · g-1), AOB丰度最低(2.23×105 copies · g-1;2.27×104 copies · g-1);小沟中心和小沟边缘中均是AOA丰度最高(6.03×105 copies · g-1;6.13×105 copies · g-1), comammox细菌丰度其次(1.81×105 copies · g-1;1.77×105 copies · g-1), AOB丰度最低(8.61×103 copies · g-1;9.18×103 copies · g-1).在冬季, 4个采样区域中, AOB丰度均低于AOA和comammox细菌丰度.在夏季样品中, 大沟中心、大沟边缘和小沟中心这3个采样区域中均是comammox细菌丰度最高(8.94×106、1.62×107、7.77×106 copies · g-1), AOB丰度其次(3.57×106、1.58×106、2.79×106 copies · g-1), AOA丰度最低(3.16×106、9.22×105、1.95×106 copies · g-1);小沟边缘则是comammox细菌丰度最高(4.07×107 copies · g-1), AOA丰度其次(5.11×106 copies · g-1), AOB丰度最低(1.60×106 copies · g-1).在夏季, 4个采样区域中, comammox细菌丰度均高于AOA和AOB丰度.此外, 在冬季, 大沟沉积物中comammox细菌丰度高于小沟;在夏季, 沟渠边缘comammox细菌丰度高于沟渠中心.
3.3 comammox、AOA和AOB的丰度与底物沉积物中理化因子的相关性分析采用Pearson相关性分析方法, 分析氨氧化微生物comammox、AOA和AOB丰度与理化指标之间的相关性(表 2).结果表明, 在冬季, comammox细菌丰度与NO3--N呈显著性负相关(p < 0.01);AOA丰度与NO3--N呈显著性负相关(p < 0.01);AOB丰度与有机质含量呈显著性正相关(p < 0.05)、与NO3--N呈显著性负相关(p < 0.05).在夏季, comammox细菌丰度与含水率、NH4+-N、TC呈显著性负相关(p < 0.05);AOB丰度与NH4+-N呈显著性正相关(p < 0.05).冬夏两季的相关性分析都显示comammox细菌丰度与底物NH4+-N浓度呈负相关, 其中夏季样品呈显著的负相关, 说明底物NH4+-N的增加可能会抑制comammox细菌的生长增殖.
| 表 2 石臼漾湿地沉积物的理化指标与氨氧化微生物丰度Pearson相关系数矩阵 Table 2 Pearson correlation coefficients matrix among physico-chemical indexes and ammonia oxidizers abundance in Shijiuyang wetland |
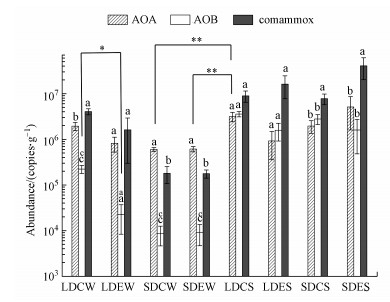 |
| 图 2 石臼漾湿地沉积物中comammox、AOA和AOB丰度分布特征 (其中, LDCW表示大沟中心冬季采样点;LDEW表示大沟边缘冬季采样点;SDCW表示小沟中心冬季采样点;SDEW表示小沟边缘冬季采样点;LDCS表示大沟中心夏季采样点;LDES表示大沟边缘夏季采样点;SDCS表示小沟中心夏季采样点;SDES表示小沟边缘夏季采样点) Fig. 2 The abundance of comammox, AOA and AOB in Shijiuyang constructed wetland (LDCW represents the large ditch center winter sample; LDCW represents the large ditch edge winter sample; SDCW represents the small ditch center winter sample; SDEW represents the small ditch edge winter sample; LDCS represents the large ditch center summer sample; LDES represents the large ditch edge summer sample; SDCS represents the small ditch center summer sample; SDES represents the small ditch edge summer sample) |
选取Chao1指数、Ace指数、Shannon指数和Simpson指数为参数, 对comammox Nitrospira菌群进行Alpha多样性分析(表 3).Alpha多样性反映的是单个样品物种丰度及物种多样性.Chao1和Ace指数衡量物种丰度即物种数量的多少;Shannon和Simpson指数用于衡量物种多样性.计算群落Alpha多样性指数可知, Chao1指数最高的是大沟中心冬季样点(1146.17), 最低的是小沟中心夏季样点(259.08);Ace指数最高的是大沟中心冬季样点(1385.74), 最低的是小沟中心夏季样点(262.76);Shannon指数最高的是大沟边缘冬季和小沟中心冬季样点(3.54), 最低的是小沟中心夏季样点(1.69);Simpson指数最低的是小沟中心冬季样点(0.09), 最高的是小沟中心夏季样品(0.36).通过分析Chao1指数和Ace指数可知, 在冬夏两季大沟的群落丰富度均高于小沟, 且在4个采样点上冬季的群落丰富度高于夏季;通过分析Shannon指数和Simpson指数可知, 在4个采样点中冬季comammox细菌的物种多样性均高于夏季.
| 表 3 石臼漾湿地沉积物中comammox细菌的Alpha多样性指数 Table 3 Alpha diversity index of comammox in Shijiuyang wetland |
在OTUs水平计算人工湿地沉积物样品的Bray-Curtis差异度矩阵, 利用Qiime软件做主坐标轴图(Principal Coordinate Axis Analysis, PCoA)(图 3).如图 3a所示, 两轴对冬季样品排序结果的解释度分别为36.06%和25.32%;如图 3b所示, 两轴对夏季样品排序结果的解释度分别为48.05%和17.70%.从图中可以看出, 无论是冬季样本还是夏季样本, 其中大沟中心与大沟边缘、小沟中心与小沟边缘均距离较远, 其中, 小沟的距离差异更为明显.说明即使是同一条沟渠中的沉积物, comammox细菌群落结构依然显示出较大差异, 这表明空间距离的远近并不是影响人工湿地中comammox细菌群落结构的重要因素.
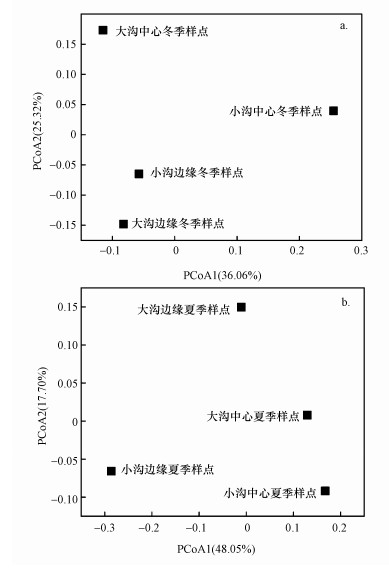 |
| 图 3 石臼漾湿地沉积物中comammox细菌群落的PCoA排序 (a.冬季;b.夏季) Fig. 3 Principal coordinates analysis of four sites in Shijiuyang wetland displayed with Bray-Curtis distances (a. winter s, b. summer) |
在Uclust软件以97%相似度下进行聚类得到OTUs, 挑出每个OTUs的代表氨基酸序列, 通过序列比对分析做出相对丰度图(图 4).按照种水平的分类, 冬季样品的OTUs注释为7个种, Candidatus Nitrospira nitrosa、Flavobacteriaceae bacterium DSL-48、Nitrospira cf. moscoviensis SBR1015、Nitrospira sp. (sediment metagenome)、Nitrospira sp. CG24B、Nitrospira sp. SG-bin1和Nitrospira sp. UW-LDO-01.夏季样品的OTUs注释为9个种, Candidatus Nitrospira inopinata、Candidatus Nitrospira nitrificans、Candidatus Nitrospira nitrosa、Flavobacteriaceae bacterium DSL-48、Nitrospira cf. moscoviensis SBR1015、Nitrospira sp. (sediment metagenome)、Nitrospira sp. CG24B、Nitrospira sp. SG-bin1和Nitrospira sp. UW-LDO-01.
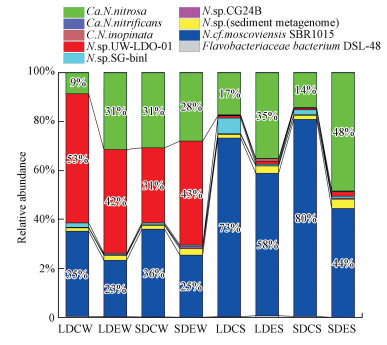 |
| 图 4 石臼漾湿地comammox细菌的相对丰度图 Fig. 4 Relative abundance of comammox bacteria in Shijiuyang wetland |
冬季样品中, 相对丰度最高的3个种是Nitrospira sp. UW-LDO-01、Nitrospira cf. moscoviensis SBR1015和Candidatus Nitrospira nitrosa, 这3个种相对丰度之和在人工湿地沉积物所得序列中均占据95%以上;夏季样品中, 相对丰度最高的有2个种, 分别为Nitrospira cf. moscoviensis SBR1015和Candidatus Nitrospira nitrosa, 其相对丰度之和在人工湿地沉积物中均占据90%以上.由图可知, 按照种水平划分, 各样点各季节之间菌种的组成和相对丰度各有不同.其中冬季样品中仅测得Candidatus Nitrospira nitrosa这一个全程氨氧化细菌的种, 而夏季样品中Candidatus Nitrospira inopinata、Candidatus Nitrospira nitrificans和Candidatus Nitrospira nitrosa这3个全程氨氧化细菌的种均有测到.冬季样品中相对丰度最高的种Nitrospira sp. UW-LDO-01在夏季样品中则占比极低.由此可见, 不同季节沉积物中的comammox细菌组成有明显的差别.
构建石臼漾湿地冬季样点(n=12)网络分析图(图 5a).从图中可知, Nitrospira cf. moscoviensis SBR1015在7个模块中占36.36%, Candidatus Nitrospira nitrosa占34.55%, Nitrospira sp. UW-LDO-01占17.27%, Nitrospira sp. (sediment metagenome)占7.27%, Nitrospira sp. SG-bin1占2.73%, Nitrospira sp. CG24B占0.91%, Flavobacteriaceae bacterium DSL-48占0.91%.说明Nitrospira cf. moscoviensis SBR1015、Candidatus Nitrospira nitrosa和Nitrospira sp. UW-LDO-01这3个种在微生物群落结构中占据主导优势, 是冬季样品中的关键种.图中正相关连线占59.71%, 负相关连线占40.29%, 说明菌种之间正相关关系占据优势.
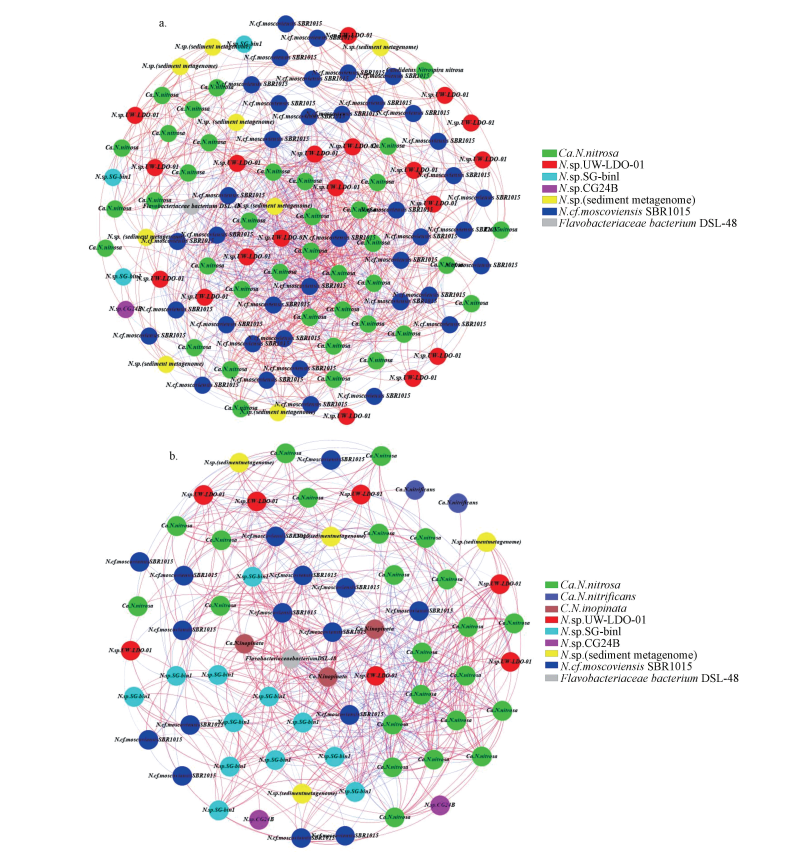 |
| 图 5 石臼漾湿地冬季和夏季样品网络分析图 (a冬季;b夏季.红色连线代表正相关关系, 蓝色连线代表负相关关系) Fig. 5 Network analysis of Shijiuyang wetland (a. winter, b. summer. Red links represents positive correlation, blue links represents negative correlation) |
构建石臼漾湿地夏季样点(n=12)网络分析图(图 5b), 从图中可得, Candidatus Nitrospira nitrosa在9个模块中占32.86%, Nitrospira cf. moscoviensis SBR1015占22.86%, Nitrospira sp. SG-bin1占17.14%, Nitrospira sp. UW-LDO-01占10.00%, Nitrospira sp. (sediment metagenome)占5.71%, Candidatus Nitrospira inopinata占4.29%, Nitrospira sp. CG24B占2.86%, Candidatus Nitrospira nitrificans占2.86%, Flavobacteriaceae bacterium DSL-48占1.43%.说明Nitrospira cf. moscoviensis SBR1015、Candidatus Nitrospira nitrosa和Nitrospira sp. SG-bin1这3个种在微生物群落结构中占据主导优势, 是夏季样品中的关键种.图中正相关连线占63.94%, 负相关连线占36.06%, 说明菌种之间以正相关关系为主.由图中可知, 冬季样品的网络结构比夏季样品复杂, 这可能是因为夏季某些微生物在环境中占据了较大的竞争优势, 导致群落结构复杂程度下降.
3.6 Comammox细菌与环境理化因子的相关性分析将高通量测序得出的comammox细菌的相对丰度与重要的理化因子作矩阵, 研究其与环境因子之间的关系.通过SPSS和RDA分析(表 4、图 6)可知, 在冬季, Candidatus Nitrospira nitrosa与NO3--N含量呈显著性正相关(p < 0.01);Flavobacteriaceae bacterium DSL-48与OM呈显著性正相关(p < 0.05);Nitrospira cf. moscoviensis SBR1015与NO3--N呈显著性负相关(p < 0.05), 与TN呈显著性正相关(p < 0.05);Nitrospira sp. (sediment metagenome)与OM、TN.TC、TS呈显著性负相关(p < 0.05);Nitrospira sp. CG24B与NH4+-N、NO3--N呈显著性正相关(p < 0.05);Nitrospira sp. SG-bin1与NO3--N呈显著性负相关关系(p < 0.05), 与TS呈显著性正相关(p < 0.05).
| 表 4 石臼漾湿地沉积物comammox菌群与环境因子相关性分析 Table 4 Correlation analysis between community structure of comammox bacteria and chemical characters of Shijiuyang wetland |
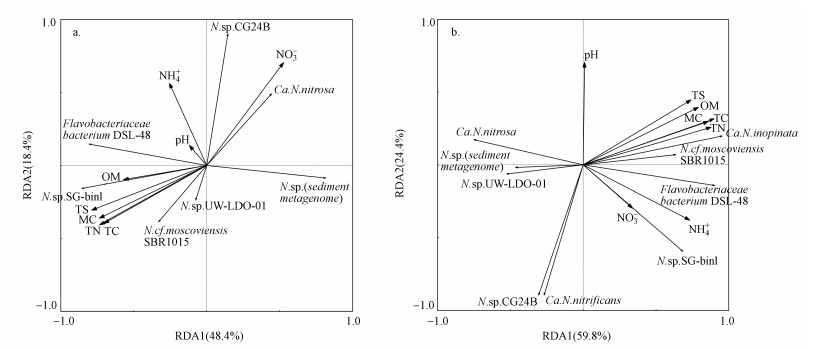 |
| 图 6 石臼漾湿地沉积物冬季和夏季RDA图 (a.冬季;b.夏季) Fig. 6 RDA analysis of comammox bactreial community and environmental factors of Shijiuyang wetland in winter(a) and summer(b) |
在夏季, Candidatus Nitrospira inopinata与MC、OM、TN、TC、TS呈显著性正相关(p < 0.05);Candidatus Nitrospira nitrosa与MC、NH4+-N、TN、TC呈显著性负相关(p < 0.05);Flavobacteriaceae bacterium DSL-48与MC、OM、TN、TC、TS呈显著性正相关(p < 0.05);Nitrospira cf. moscoviensis SBR1015与NH4+-N、TN、TC呈显著性负相关(p < 0.05);Nitrospira sp. (sediment metagenome)与MC、NH4+-N、TN、TC呈显著性负相关(p < 0.05);Nitrospira sp. CG24B与NO3--N呈显著性正相关(p < 0.05);Nitrospira sp. UW-LDO-01与NH4+-N、TC呈显著性负相关(p < 0.05).
4 讨论(Discussion)本文选择石臼漾人工湿地作为研究对象, 分别在时间和空间尺度的变异下, 运用PCR、qPCR和功能基因高通量测序等技术, 对石臼漾人工湿地4个区域表层沉积物中的comammox细菌, 于冬季和夏季进行了研究.分析了comammox细菌在人工湿地系统中的分布规律、群落结构及交互机制等, 并结合理化因子进行了相关性分析.完善了comammox细菌在人工湿地生态系统中的分布情况.
在大多数自然环境中NH4+-N浓度很低, 因此对NH4+-N的竞争是导致氨氧化微生物生态位分化的一个关键因素(Kuypers, 2017).之前的研究结果普遍认为相较于AOB, AOA在低NH4+-N环境下更具竞争优势, 而AOB比AOA更适合在高NH4+-N环境下生长(Taylor et al., 2006; Martens-Habbena et al., 2009).本研究中, 冬夏两季4个采样区域中的底物NH4+-N浓度均较高, 在冬季4个采样区域中, AOA的丰度均大于AOB;在夏季4个采样区域中, 大沟中心、大沟边缘以及小沟中心AOA的丰度均略低于AOB, 小沟边缘AOA的丰度高于AOB.这说明在较高的底物NH4+-N浓度下, AOA也有可能比AOB更适合生长, 这可能是由于目前可培养的AOA种类数量不足, 对AOA氨亲和力了解不够全面造成的.因此, 从本研究结果来看, 该结论的普遍性尚待进一步验证.
Kits等的研究发现, 全程氨氧化细菌Nitrospira inopinata比大多数可培养的AOA物种对氨具有更高的亲和力, 能够更好地适应极低氨浓度的环境(Kits et al., 2017).本研究中, comammox细菌丰度均较高, 说明comammox细菌在较高NH4+-N浓度的环境中也可以具有生长优势.因此, 未来也需要得到更多可纯培养的comammox种类, 并对其氨亲和力进行检测, 从而完善目前的研究.在冬季与夏季的研究中, comammox细菌与底物NH4+-N浓度均呈负相关关系, 其中夏季呈显著性负相关关系, 证明在底物NH4+-N浓度较高的情况下, comammox细菌的物种丰度受到NH4+-N浓度的负反馈调节.但是NH4+-N浓度对于comammox细菌的调节机制尚不明确, 未来需要进行更加深入的探究.
本研究评估了冬季和夏季2个不同季节, 人工湿地生态系统中comammox细菌的群落结构及生物多样性.研究发现, 在冬夏两季4个沉积物取样点中, Alpha多样性指数均呈现出冬季样点高于夏季样点的特点.有研究表明, 温度的变化决定了微生物的物种组成与群落结构的变化(Ogilivie et al., 1997).本研究发现冬季和夏季两个不同的季节中, comammox细菌物种组成不完全一致, 且comammox细菌群落结构表现出较大差异, 表明温度差异可能是影响comammox细菌物种组成和群落结构的一个重要因素.此前有报道Candidatus Nitrospira nitrificans和Candidatus Nitrospira nitrosa在23 ℃富集培养, 而Candidatus Nitrospira inopinata在46 ℃富集培养(Daims et al., 2015).本研究在冬季样品中仅检测到了Candidatus Nitrospira nitrosa, 而在夏季样品中Candidatus Nitrospira nitrificans、Candidatus Nitrospira nitrosa和Candidatus Nitrospira inopinata均有检测到.因此猜测, 温度可能是影响comammox细菌分布的主要因素之一.
本文运用qPCR和高通量测序技术对石臼漾人工湿地表层沉积物中comammox细菌进行研究发现, 过高的底物氨浓度可能影响comammox细菌的丰度;夏季comammox细菌的丰度高于冬季.在一定程度上揭示了comammox细菌的分布具有空间异质性, 且在较高氨氮浓度环境中相比于传统氨氧化微生物可能更具有生长优势, 为更好地研究人工湿地生态系统中氨氧化过程提供了良好的基础.但comammox细菌各种属和关键理化因子间的生物调节机制, comammox细菌在氮循环中所占比重及comammox细菌在硝化过程中的实际贡献等均有待进一步研究.
5 结论(Conclusions)1) 在石臼漾人工湿地冬夏季所有样品中均检测到了comammox细菌, 其丰度为1.77×105~ 4.07×107 copies · g-1.AOA和AOB的丰度分别为6.03×105~5.11×106 copies · g-1和8.61×103~3.57×106 copies · g-1.
2) 在夏季所有样品中, comammox细菌丰度高于AOA和AOB;在冬季大沟样品中, comammox细菌丰度高于AOA和AOB, 在冬季小沟样品中, comammox细菌丰度高于AOB低于AOA.说明在底物氨浓度相对较高的情况下, comammox细菌相较于AOA和AOB也可以更具有生长优势.
3) 在冬夏季样品中, comammox细菌丰度与底物氨浓度呈负相关关系, 其中夏季样品中呈显著性负相关.推测在氨浓度较高的情况下, 氨浓度对comammox细菌生长起到负反馈调节作用.
4) 冬季样品中的comammox细菌物种多样性高于夏季, 且发现冬夏季样品之间comammox细菌物种组成和群落结构之间有所差异.因此推测环境温度可能是影响comammox细菌群落结构的关键性因素之一.
Alvarze-Cobelas M, Velasco J L, Valladolid M, et al. 2005. Daily patterns of mixing and nutrient concentrations during early autumn circulation in a small sheltered lake[J]. Freshwater Biology, 50(5): 813-829. DOI:10.1111/j.1365-2427.2005.01364.x |
Annavajhala M K, Kapoor V, Santo-Domingo J, et al. 2018. Comammox functionality identified in diverse engineered biological wastewater treatment systems[J]. Environmental Science and Technology Letters, 5(2): 110-116. |
鲍士旦. 2000. 土壤农化分析(第3版)[M]. 北京: 中国农业出版社.
|
Bartleme R P, Mclellan S L, Newton R J. 2017. Freshwater recirculating aquaculture system operations drive biofilter bacterial community shifts around a stable nitrifying consortium of ammonia oxidizing archaea and comammox nitrospira[J]. Frontiers in Microbiology, 8: 101. |
Caporaso J G, Kuczynski J, Stombaugh J, et al. 2010. QIIME allows analysis of high-throughput community sequencing data[J]. Nature Methods, 7(5): 335-336. |
Chao Y Q, Mao Y P, Yu K, et al. 2016. Novel nitrifiers and comammox in a full-scale hybrid biofilm and activated sludg e reactor revealed by metagenomic approach[J]. Applied Microbiology and Biotechnology, 100(18): 8225-8237. DOI:10.1007/s00253-016-7655-9 |
Costa E, Pérez J, Kreft J U. 2006. Why is metabolic labour divided in nitrification?[J]. Trends in Microbiology, 14(5): 213-219. DOI:10.1016/j.tim.2006.03.006 |
Daims H, Lebedeva E V, Pjevac P, et al. 2015. Complete nitrification by Nitrospira bacteria[J]. Nature, 528(7583): 504-509. DOI:10.1038/nature16461 |
Edgar R C. 2010. Search and clustering orders of magnitude faster than BLAST[J]. Bioinformatics, 26(19): 2460. DOI:10.1093/bioinformatics/btq461 |
Fan X, Gao J, Pan K, et al. 2017. Temporal dynamics of bacterial com munities and predicted nitrogen metabolism genes in a full-scale waste watertreatment plant[J]. RSC Advances, 7(89): 56317-56327. DOI:10.1039/C7RA10704H |
Fowler S J, Palomo A, Dechesne A, et al. 2018. Comammox Nitrospira are abundant ammonia oxidizers in diverse groundwater-fed rapid sand filter communities[J]. Environmental Microbiology, 20(3): 1002-1015. DOI:10.1111/1462-2920.14033 |
Francis C A, Roberts K J, Beman J M, et al. 2005. Ubiquity and diversity of ammonia-oxidizing archaea in water columns and sediments of the ocean[J]. Proceedings of the National Academy of Sciences of the United States of America, 102: 14683-14688. DOI:10.1073/pnas.0506625102 |
Gonzalez-Martinez A, Rodriguez-Sanchez A, van Loosdrecht M C M, et al. 2016. Detection of comammox bacteria in full-scale wastewater treatment bioreactors using tag-454-pyrosequencing[J]. Environmental Science and Pollution Research, 23(24): 25501-25511. DOI:10.1007/s11356-016-7914-4 |
Heinrich R, Schuster S. 1996. The regulation of cellular systems[M]. Berlin: Springer.
|
Hu H W, He J Z. 2017. Comammox a newly discovered nitrification process in the terrestrial nitrogen cycle[J]. Journal of Soils & Sediments, 17(12): 2709-2717. |
Jetten M S, Lv N, Strous M, et al. 2009. Biochemistry and molecular biology of anammox bacteria[J]. Critial Reviews Biochem Molecular Biology, 44(2/3): 65-84. |
Kits K D, Sedlacek C J, Lebededeva E V, et al. 2017. Kinetic Analysis of a finished nitrifier revolutionary styles[J]. Nature, 549(7671): 269-272. DOI:10.1038/nature23679 |
Könneke M, Bernhard A E, José R, et al. 2005. Isolation of an autotrophic ammonia-oxidizing marine archaeon[J]. Nature, 437(7058): 543. DOI:10.1038/nature03911 |
Luesken F, Alen T A V, Biezen E V D, et al. 2011. Diversity and enrichment of nitrite-dependent anaerobic methane oxidizing bacteria from wastewater sludge[J]. Applied Microbiology and Biotechnology, 92(4): 845. |
Maixner F, Noguera D R, Anneser B, et al. 2010. Nitrite concentration influences the population structure of Nitrospira-like bacteria[J]. Environmental Microbiology, 8(8): 1487-1495. |
McClain M E, Boyer E W, Dent C L, et al. 2003. Biogeochemical hot spots and hot moments at the interface of terrestrial and aquatic ecosystems[J]. Ecosystems, 6(4): 301-312. DOI:10.1007/s10021-003-0161-9 |
Ogilvie B G, Rutter M, Nedwell D B. 1997. Selection by temperature of nitrate-reducing bacteria from estuarine sediments:species composition and competition for nitrate[J]. FEMS Microbiology Ecology, 23(1): 11-22. |
Palmo A, Jane F S, Gülay A, et al. 2016. Metagenic Analysis of rapid gravity and filter microbiotic communities survey novel physics of Nitrospira.spp[J]. ISME Journal, 10(11): 2569-2581. DOI:10.1038/ismej.2016.63 |
Pan K L, Gao J F, Fan X Y, et al. 2018. The more important role of archaea than bacteria in nitrification of wastewater treatment plants in cold season despite their numerical relationships[J]. Water Research, 145: 552. DOI:10.1016/j.watres.2018.08.066 |
Pfeiffer T, Bonhoeffer S. 2004. Evolution of cross feeding in microbial populations[J]. The American Naturalist, 163: 126-135. DOI:10.1086/383593 |
Pinto A J, Marcus D N, Zeeshan I U, et al. 2016. Metagenomic Evidence for the Presence of Comammox Nitrospira-Like Bacteria in a Drinking Water System[J]. Msphere, 1(1): e00054-15. |
Pjevac P, Schauberger C, Poghosyan L, et al. 2017. AmoA-targeted polymerase chain reaction primers for the specific detection and quantification of comammox nitrospirain the environment[J]. Frontiers in Microbiology, 8: 1508. DOI:10.3389/fmicb.2017.01508 |
Rotthauwe J H, Witzel K P, Liesack W. 1997. The ammonia monooxygenase structural gene amoA as a functional marker:Molecular fine-scale analysis of natural ammonia-oxidizing populations[J]. Applied and Environmental Microbiology, 63: 4704-4712. DOI:10.1128/AEM.63.12.4704-4712.1997 |
Schloss P D, Westcott S L, Ryabin T, et al. 2009. Introducing mothur:open-source, platform-independent, community-supported software for describing and comparing microbial communities[J]. Apply and Environmental Microbiol, 75(23): 7537-7541. DOI:10.1128/AEM.01541-09 |
Shi X, Hu H W, Wang J, et al. 2018. Niche separation of comammox Nitrospira and canonical ammonia oxidizers in an acidic subtropical forest soil under long-term nitrogen deposition?[J]. Soil Biology and Biochemistry, 126: 114-122. DOI:10.1016/j.soilbio.2018.09.004 |
苏瑜, 王为东. 2017. 国北方四类土壤中氨氧化古菌和氨氧化细菌的活性及对氨氧化的贡献[J]. 环境科学学报, 37(9): 3519-3527. |
Tatari K, Musovic S, Gülay A, et al. 2017. Smets density and distribution of nitrifying guilds in rapid sand filters for drinking water production:dominance of nitrospira spp[J]. Water Research, 127: 239-248. DOI:10.1016/j.watres.2017.10.023 |
Teske A, Alm E, Regan J M, et al. 1994. Evolutionary relationships among ammonia-and nitrite-oxidizing bacteria[J]. Journal of Bacteriology, 176(21): 6623-6630. DOI:10.1128/JB.176.21.6623-6630.1994 |
Tobias C, Giblin A, McClelland J, et al. 2003. Sediment DIN fluxes and preferential recycling of benthic microalgal nitrogen in a shallow macrotidal estuary[J]. Marine Ecology Progress Series, 257: 25-36. DOI:10.3354/meps257025 |
Van Kessel M A, Speth D R, Albertsen M, et al. 2015. Complete nitrification by a single microorganism[J]. Nature, 528(7583): 555. DOI:10.1038/nature16459 |
Wang S Y, Wang W D. 2018. Microbial nitrogen cycle hotspots in the plant-bed/ditch system of a constructed wetland with N2O mitigation[J]. Environmental Science & Technology, 52(11): 6226-6236. |
Wang Y L, Ma L P, Mao Y P, et al. 2017. Comammox in drinking water systems[J]. Water Research, 116: 332-341. DOI:10.1016/j.watres.2017.03.042 |
王宇, 王宝玲, 王为东. 2014. 构筑根孔湿地中金属元素的来源、分布及其累积效应[J]. 环境科学学报, 34(1): 168-185. |
Wang Z, Cao Y, Zhu-Barker X, et al. 2019. Comammox Nitrospira clade B contributes to nitrification in soil[J]. Soil Biology and Biochemistry, 135: 392-395. DOI:10.1016/j.soilbio.2019.06.004 |
Winogradsky S. 1890. The morphology of the contributions of nitrification system[J]. Archives of Biological Sciences, 4: 257-275. |
徐栎亚, 赵雪, 庄林杰, 等. 2017. 基于hzsB功能基因研究典型湿地沉积物中厌氧氨氧化细菌的群落结构[J]. 环境科学学报, 37(12): 191-200. |
于向华, 张明. 2013. 测定土壤中铵态氮含量条件研究[J]. 农业科技与装备, 225(3): 11-12. DOI:10.3969/j.issn.1674-1161.2013.03.006 |
张玮, 王为东, 王丽卿, 等. 2011. 嘉兴石臼漾湿地冬季浮游植物群落结构特征[J]. 应用生态学报, 22(9): 2431-2437. |
张文河, 穆桂金. 2007. 烧失法测定有机质和碳酸盐的精度控制[J]. 干旱区地理(汉文版), 30(3): 137-141. |
周磊榴, 祝贵兵, 王衫允, 等. 2013. 边带沉积物氨氧化古菌的丰度、多样性及对氨氧化的贡献[J]. 环境科学学报, 33(6): 1741-1747. |
周利, 李怡潇, 庄林杰, 等. 2017. 旱地土壤反硝化厌氧甲烷氧化菌的垂向分布特性与活性分析[J]. 环境科学学报, 37(2): 302-310. |
周利, 王晓侠, 周立光, 等. 2019. 旱地作物根际和非根际土壤硝酸盐异化还原成铵细菌群落组成的研究[J]. 环境科学学报, 39(2): 252-261. |
Zhu G, Wang S, Wang Y, et al. 2011. Anaerobic ammonia oxidation in a fertilized paddy soil[J]. Isme Journal, 5(12): 1905-1912. DOI:10.1038/ismej.2011.63 |
庄林杰, 夏超, 田晴, 等. 2017. 高通量测序技术研究典型湖泊岸边陆向深层土壤中厌氧氨氧化细菌的群落结构[J]. 环境科学学报, 37(1): 261-271. |
 2020, Vol. 40
2020, Vol. 40


