2. 中国科学院生态环境研究中心环境水质学国家重点实验室, 北京 100085
2. State Key Laboratory of Environmental Aquatic Chemistry, Research Centre for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085
微污染水体是指以氮、磷营养元素和有机物超标为主要特征, 无法达到《地表水环境质量标准》(GB3838—2002)Ⅲ类水体要求的水体(左金龙, 2012;李政剑等, 2013), 微污染水的处理回用对缓解饮用水资源紧张具有重要意义(Tortajada et al., 2019).近年来对微污染水的处理研究包括对混凝、沉淀等常规净水工艺的强化, 以及前置预氧化、生物处理等预处理或后置臭氧-活性炭等深度处理多个方面.其中, 生物活性炭由于对氨氮和小分子有机物具有良好的处理效果得到了广泛的研究和应用(Terry et al., 2018), 与超滤工艺组合可以同步去除氨氮和绝大部分有机物.且膜截留可以保留生物质并进一步提高有机物底物浓度从而强化生物预处理, 二者具有耦合效果, 工艺形式“绿色”, 具有广阔的应用发展前景.
生物电化学系统是指包含可以从电极接受或供给电子的微生物的一类装置的统称(Logan et al., 2019).不同电极电势与电活性菌胞外电子传递过程和增殖代谢过程的相互影响是生物电化学系统设计的核心问题.Hirose等(2018)研究发现, 电活性菌可以感知外部电极电势并调整自己的代谢通路, 厌氧条件下试验电活性菌S. oneidensis MR-1对乳酸的代谢仅通过甲酸依赖型通路, 但在0.5 V较高阳极电势下会激活好氧呼吸相关NADH依赖型通路, 虽然总体代谢通路仍以甲酸依赖型通路为主, 但其胞外电子传递效率提升了3倍.这启示对电活性菌外加弱电压改变其电极电势可以强化对污染物的代谢能力.另有研究表明(Yang et al., 2019), G.soli菌生物膜在较低阳极电势(-0.2 V和0 V)下具有更高的胞外电子传递效率, 在0.2~0.6 V较高电势下反而会分泌更多以多糖为主的胞外聚合物(Extracellular Polymeric Substance, EPS)以应对氧化胁迫作用, 这显然会对膜处理工艺的稳定运行造成不利影响.在污水处理中有研究表明(Yu et al., 2019)在一定阳极电势下构建厌氧电化学膜生物反应器, 利用微生物对多糖蛋白等物质的阳极催化氧化作用可以实现工艺在长期运行下的零污染运行.然而在实际地表水处理过程中, 外加弱电压改变电极电势能否强化生物处理, 对低压膜分离工艺运行是否有不利影响目前尚无相关研究.
基于此, 本研究通过外加弱电压构建生物电耦合活性炭-超滤工艺, 从工艺角度试探讨在地表微污染水处理中, 弱电压对天然水体复杂微生物群代谢活动的生物电效应及生物电耦合活性炭-超滤系统的运行能力和处理效能, 以期为构建绿色可持续的生物电化学组合工艺提供理论依据和工程借鉴.
2 材料与方法(Materials and methods) 2.1 原水与材料试验以北京市奥林匹克森林公园龙形水系湖水为配置水主体, 另添加5.0 mg·L-1腐殖酸钠(Sigma-Aldrich有限责任公司)、1.0 mg·L-1 NH4+-N(以N计, 合3.82 mg·L-1 NH4Cl, 优级纯, 国药集团化学试剂有限公司)、0.1 mg·L-1 PO43--P(以P计, 合0.387 mg·L-1 NaH2PO4, 优级纯, 国药集团化学试剂有限公司), 以模拟微污染地表水.装置运行期间供水水质情况见表 1.
| 表 1 试验期间模拟微污染水原水水质 Table 1 Main parameters of the simulated micro-polluted water during the experiment |
试验选用100 kDa聚偏氟乙烯(Polyvinylidene Fluoride, PVDF)膜片(北京赛普瑞特设备有限公司), 膜片直径7.4 cm, 使用前在无水乙醇中浸泡12 h并用纯水洗净, 然后浸泡于纯水中备用.选用粒径3~5 mm的煤质颗粒活性炭, 比表面积为1050~1300 m2·g-1, 碘吸附值为1100 mg·g-1, 使用前分别用0.1 mol·L-1氢氧化钠及盐酸浸泡12 h, 然后用清水洗至中性, 60 ℃烘干备用.选用粒径8~16 mm的天然沸石, 使用前用清水洗净, 60 ℃烘干备用.使用60目TA1型钛网作为集流体, 钛网直径为7.4 cm, 丝粗0.14 mm, 使用前分别用0.1 mol·L-1盐酸和纯水清洗, 60 ℃烘干备用.所用碳刷直径6 cm, 长度5 cm.
2.2 试验装置与流程本试验采用自主设计的一体式生物活性炭-超滤装置(图 1), 试验装置分外加弱电压(1.0 V)的试验系统(记为“BES系统”)及无外加电压的控制对照系统(记为“CK系统”).具体而言:两系统池体均由公称直径6 cm的两中空圆柱形有机玻璃柱通过法兰连接而成, 选用的100 kDa PVDF膜片置于法兰连接处, 膜上填放80 g约3.5 cm高的颗粒活性炭层并用0.5 cm高沸石层固定;钛网作为集流体置于活性炭层与膜片之间并接以直流电源正极, 沸石层上部放置碳刷并接以直流电源负极, 正负极间接以电阻10 Ω构成回路.池体下部连接真空表.配置好的试验用水加入高位水箱, 经恒位水箱调节后供给平行运行的两处理系统, 通过蠕动泵调节以恒通量(3.5 L·m-2·h-1)模式运行.试验装置共设5个取样点, 恒位水箱设置一个取样点, 两处理系统活性炭层底部取样口和系统出水口各设两个取样点.装置运行周期约50 d, 每日在线监测温度、跨膜压差、电极电势及电路电流.每周两次采样检测水质指标, 进行有机物的表征分析.装置运行起始和结束时对BES系统和CK系统进行循环伏安(Cyclic Voltammetry, CV)特性曲线测定.运行结束后将超滤膜和活性炭取出, 分别提取其表面粘附的EPS并进行相关表征分析, 同时提取活性炭表面微生物细胞, 并进行细胞活性检测.膜表面污染物中EPS具体的提取方法为:剪取一定面积的膜片, 用20 mL 0.05%的氯化钠溶液将膜表面污染物洗脱, 洗脱液于60 ℃下水浴加热30 min, 然后以8000 r·min-1离心15 min, 取上清液在4 ℃下保存.活性炭表面EPS采用类似方法提取, 提取液体积6 mL.活性炭表面微生物细胞提取方法:取1 g活性炭, 加入2 mL沸双蒸水, 制成匀浆液, 沸水浴10 min, 取出涡旋混合1 min, 然后在3500 r·min-1下离心10 min, 取上清液待测.
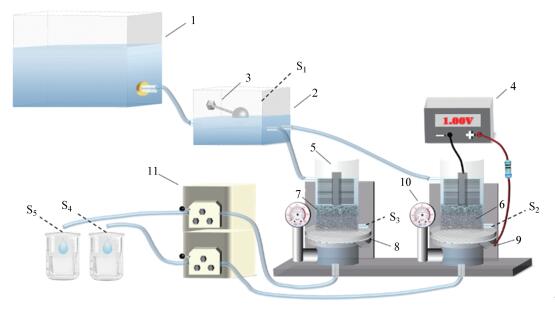 |
| 图 1 一体式生物活性炭-超滤工艺实验装置示意图(1.高位水箱;2.恒位水箱;3.浮球阀;4.直流稳压电源;5.碳刷;6.颗粒活性炭;7.沸石;8. PVDF膜片;9.钛网;10.压力表;11.蠕动泵;S1:试验原水取样点;S2:BES系统膜前水取样点;S3:CK系统膜前水取样点;S4:BES系统出水取样点;S5:CK系统出水取样点) Fig. 1 Schematic diagram of the bench-scale biological activated carbon integrated ultrafiltration process |
系统正式运行后每天采集温度、压力表读数、电极电势和电路电流, 其中, 电极电势通过相对标准Ag/AgCl参比电极获取, 电路电流通过测量电阻两端电压计算获取.
如无特殊说明, 所有水样经过0.45 μm醋酸纤维微孔滤膜过滤后进行水质分析, 其中, PO43--P采用钼酸铵分光光度法测定(GB11893-89), NH4+-N采用纳氏试剂分光光度法测定(GB7479-87), 总有机碳(Total Organic Carbon, TOC)使用总有机碳分析仪(TOC-Vwp, 岛津, 日本)测定, UV254使用紫外可见分光光度计(UV-2600, 岛津, 日本)测定, 比紫外吸光度(Specific Ultraviolet Absorbance, SUVA)根据Weishaar等(2003)的方法按式(1)计算.
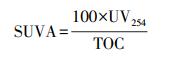
|
(1) |
三维荧光光谱(Excitation-Emission-Matrix, EEM)使用荧光光谱仪(F-4600FL, 日立, 日本)测定, 设置扫描增倍电压500 V, 扫描速度为2400 nm·min-1, 发射波长(Emission, λEm)扫描范围为250~500 nm, 激发波长(Excitation, λEx)扫描范围为200~400 nm, 扫描间隔均为5 nm.
有机物表观分子量(Apparent Molecular Weight, AMW)分布通过尺寸排阻色谱法(Size Exclusion Chromatography, SEC)测定, 测定采用美国沃特世1525型二进制高效液相色谱泵、2701型自动进样器、2998型光电二极管阵列检测器、英国飞诺美BIOSEP-SEC-S3000型色谱柱, 流动相使用10 mmol·L-1乙酸钠溶液.
多糖含量通过苯酚-硫酸法测定, 蛋白质含量通过Braford法测定, 微生物细胞腺嘌呤核苷三磷酸(Adenosine Triphosphate, ATP)含量使用ATP含量测定试剂盒测定(序号A095-1-1, 南京建成生物工程研究所).
CV曲线的扫描在上海辰华CHI660E型电化学工作站上进行, 采用三电极体系, 扫描速度为10 mV·s-1, 扫描范围为-0.8 ~0.8 V.
3 结果与讨论(Results and discussion) 3.1 弱电压作用对生物活性炭-超滤组合工艺的运行影响 3.1.1 跨膜压差分析在恒通量运行模式下, TMP可以准确直观地反映膜污染情况.试验期间两系统的TMP变化如图 2所示.随着过滤时间增加, BES系统和CK系统TMP的变化历程大致可分为3部分:阶段Ⅰ(0~5 d)两系统TMP基本保持不变;阶段Ⅱ(5~25 d)两系统TMP快速增长, 且BES系统稍快于CK系统, 表明膜污染的快速累积过程;阶段Ⅲ(25~50 d)CK系统TMP增速放缓, 但BES系统仍保持较高增速.
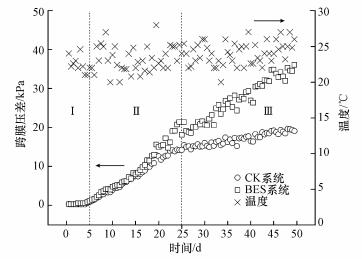 |
| 图 2 运行期间BES系统和CK系统跨膜压差变化情况 Fig. 2 Variation of TMP profiles of BES system and CK system along the operation |
阶段Ⅰ活性炭凭借其高吸附性能去除了原水中大部分悬浮颗粒和有机质, 大大降低了膜污染负荷, 使膜滤总阻力与膜自身阻力大小相当, 符合Field等提出的临界通量的强形式(Field et al., 1995; Miller et al., 2014), TMP基本不增长.阶段Ⅱ随着微生物和有机物在活性炭表面富集, 生物膜开始生长, 导致吸附作用减弱, 膜污染负荷增大, 污染物在膜孔沉积并在膜表面快速累积, 膜污染明显加重.其中, 第5~15 d期间, 两系统TMP增长曲线重合, 说明膜污染程度和模式相近.弱电压未对活性炭的吸附过程及膜污染过程产生明显影响.而在第15~25 d, BES系统和CK系统的TMP增长速率出现显著差异, 分别为1.02 kPa·d-1和0.67 kPa·d-1, 表明在此期间弱电压作用对膜污染产生显著影响.由于弱电压作用对活性炭吸附过程无明显影响, BES系统膜污染加重应是由弱电压对活性炭表面生物膜的刺激导致.在阶段Ⅲ, CK系统TMP增速下降, 而BES系统仍保持较高增速, 两系统TMP差距逐渐扩大, 运行结束时TMP分别为19.1 kPa和36.1 kPa.CK系统TMP增长放缓并以稳态增长模式持续到装置运行结束, 相比之下, BES系统仍保持较高的TMP增长速率.装置运行结束时, CK系统和BES系统的跨膜压差分别是19.1 kPa和36.1 kPa.Wang等(2013)认为在膜滤初始阶段, 污染物在膜表面和膜孔快速吸附引起的膜孔窄化和堵塞会造成膜通量的快速下降或TMP的快速升高, 随着滤饼层在膜表面的形成, 膜污染逐渐会达到假稳态, 其后膜污染的变化趋势主要取决于滤饼层的结构和致密性.低通量运行可以减弱污染物与膜及污染物之间的相互作用, 避免强相互作用的产生(Huber et al., 2019), 有助于形成一个相对松散的膜污染层(Hong et al., 2019; Shao et al., 2019), 因此到阶段Ⅲ, CK系统最终达到相对稳态, TMP保持在较低增长速率(0.19 kPa·d-1).相比之下, BES系统仍保持较高的TMP增长速率(0.72 kPa·d-1), 其原因可能是外加弱电压刺激微生物产生了更多的EPS, 形成多糖凝胶层, 导致污染层孔隙度减少, 致密性增加, 水头阻力增大(Hwang et al., 2008).
3.1.2 电化学特性分析装置运行过程中BES系统电流和电极电势如图 3a所示.在装置运行前20 d, BES系统的阳极和阴极电势及回路电流呈降低趋势, 表明活性炭表面生物膜逐渐生长.在整个运行过程中, 阳极电势为(0.68±0.08) V, 阴极电势为(-0.32±0.06) V.电流略有起伏但基本保持恒定, 为(0.27±0.01) mA.CV曲线可反映两系统运行开始和结束时电化学性能的变化, 如图 3b所示.装置运行开始时, 两系统活性炭电化学性质均一稳定, CV曲线相似, 表现为高电阻、低电容, 表明活性炭在无生物积累的情况下表面无相关氧化还原反应的进行.运行结束后, 两系统CV曲线比电容均明显增大(Yang et al., 2020), 表明生物膜生长, 活性炭转变为生物活性碳, 具备了一定的生物电容能力(Yu et al., 2019; Richter et al., 2009).其中, BES系统比电容明显大于CK系统, 并且有轻微的氧化还原峰出现, 表明BES系统生物膜生长更旺盛, 微生物电活性更显著(Xiao et al., 2017), 进一步说明弱电压可刺激微生物分泌更多具有氧化还原活性的EPS.
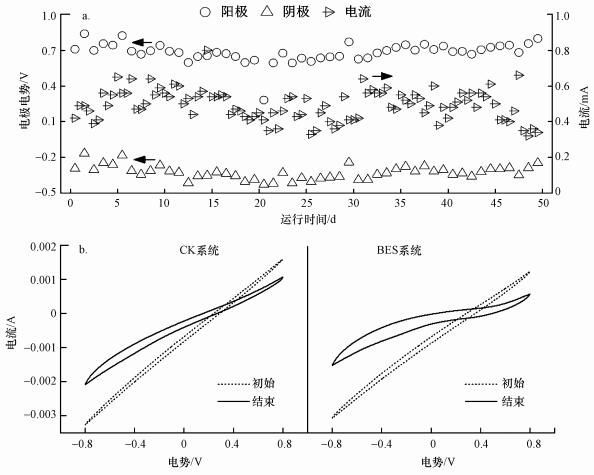 |
| 图 3 运行期间BES系统和CK系统的电化学特性变化情况(a.BES系统的电极电势和电流变化情况;b. BES系统和CK系统运行初始和结束时的循环伏安特性曲线) Fig. 3 Variation of electrochemical characteristics of BES system and CK system along the operation(a.Variation of electrode potential and voltage of BES system, b.Cyclic voltammetry characteristic curves of CK and BES systems measured at the beginning and end of the operation) |
图 4a为试验期间沿程各取样点TOC和SUVA去除情况.TOC代表水体有机碳的总量, 是反映水体有机污染程度的重要指标.试验期间BES系统和CK系统对TOC均取得了较好的去除效果, 总去除率分别为73.3%和77.6%, 系统出水TOC分别为2.58 mg·L-1和2.16 mg·L-1, 可稳定达到《生活饮用水卫生质量标准》(GB5749—2006)5.0 mg·L-1限值的要求.相比而言, BES系统对TOC的去除效果稍差于CK系统, 其膜前水去除率相比CK系统降低了7.8%.这一方面是因为弱电压刺激并加速了活性炭表面微生物的代谢, 致使其产生更多的溶解性微生物产物扩散溶解至水中;另一方面, 弱电压刺激生物膜加速生长显著削弱了活性炭吸附性能, 造成对TOC总体去除效果的减弱(Terry et al., 2018).SUVA与水体溶解性有机物的芳香性、反应性及可处理性有着密切的联系, 近年来作为溶解性有机物迁移、转化和去除的重要指标被广泛应用(Weishaar et al., 2003; Hohner et al., 2019).待处理原水的SUVA为2.2 L·m-1·mg-1, 表明原水芳香性较低, 亲水性较强.有研究显示(Hussain et al., 2013), 地表水SUVA小于2.0 L·m-1·mg-1时, 难以通过混凝去除其中有机物, 故试验原水的常规工艺可处理性较差.经处理, BES系统和CK系统对SUVA的总去除率分别达87.68%和86.25%, 出水SUVA分别仅为0.27 L·m-1·mg-1和0.31 L·m-1·mg-1, 证明生物活性炭-超滤工艺组合对降低地表水芳香性、控制消毒副产物(Jiang et al., 2017)具有明显优势.BES系统对SUVA的去除效果稍好于CK系统, 表明弱电压作用对芳香性有机物的去除具有一定的促进作用.
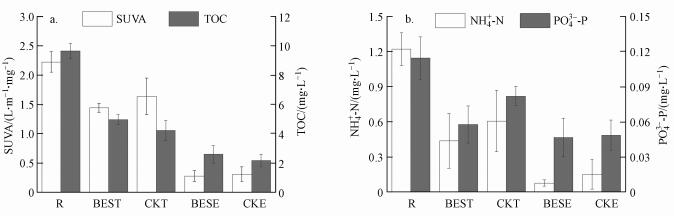 |
| 图 4 运行期间BES系统和CK系统对TOC和SUVA(a)及NH4+-N和PO43-P(b)去除情况(n=10)(图中横坐标的“R”为S1取样点样品, 代表试验原水;“BEST”和“CKT”分别为S2、S3取样点样品, 代表BES系统和CK系统经活性炭预处理后的膜前水;“BESE”和“CKE”分别为S4、S5取样点样品, 代表BES系统和CK系统膜后出水, 下同) Fig. 4 Removal of TOC and SUVA(a), NH4+-N and PO43--P(b) by BES system and CK system during the operation (n=10) |
氮、磷作为营养元素, 其在水中的丰度和比例对微生物的增殖代谢有重要影响(Huang et al., 2019).图 4b为运行期间BES系统和CK系统NH4+-N和PO43--P的去除情况.BES系统和CK系统膜后水NH4+-N分别为(0.08±0.03) mg·L-1和(0.15±0.13) mg·L-1, 稳定达到《生活饮用水卫生质量标准》(GB5749—2006)中0.5 mg·L-1的限值要求;PO43--P分别为(0.047±0.016) mg·L-1和(0.049±0.013) mg·L-1, 可稳定达到《地表水环境质量标准》(GB3838—2002)所规定Ⅱ类水体0.10 mg·L-1的排放要求.相比于CK系统, BES系统膜池水NH4+-N和PO43--P去除率分别提高了13.9%和21.2%.相关研究表明(Chadwick et al., 2019), 电化学活性菌在生物膜-阳极界面处具有最高的营养元素同化活性, 在本研究构建的生物活性炭-超滤系统中, 生物活性炭作为阳极提供了巨大的阳极界面, 为微生物附着并保持高营养元素同化活性创造了条件, 增强了对NH4+-N和PO43--P的摄取.此外, EPS可看作海绵状吸附剂, 为微生物捕获环境中的营养物(Flemming et al., 2016), 因此, 弱电压刺激微生物过量分泌EPS的同时也强化了对原水中NH4+-N和PO43--P的吸附.
3.2.2 三维荧光光谱分析EEM被广泛用于检测、表征水中腐殖质、蛋白质等具有荧光特性的溶解性有机质(何伟等, 2016).Chen等(2003)在调研大量文献基础上将其大致划分为5个区域并对每个区域所代表的典型溶解性有机质进行分类.如图 5所示, Ⅰ区和Ⅱ区与低激发的芳香性蛋白、氨基酸类有机物的含量相关, Ⅲ区与富里酸类物质含量相关, Ⅳ区与溶解性微生物产物相关, Ⅴ区与腐殖酸类有机物相关.图 5为两系统运行初始和结束时原水和膜池水的EEM.由图可知, 原水在5个区域均有明显的荧光响应, 主峰大致位于λEx/λm为225/325、275/325、225/415和260/425 nm4处.运行初期, 两系统膜池水荧光响应强度相比原水均有明显降低, 但两系统之间无明显差异, 表明运行初期弱电压对活性炭的吸附作用无明显影响.经过50 d的运行后, 两系统膜池水Ⅰ、Ⅱ、Ⅳ区荧光响应均显著增强, 这一方面是由于长期运行后荧光性蛋白类大分子聚合物在膜池中发生浓缩;另一方面由于生物膜中EPS水解或细胞裂解产生溶解性微生物产物扩散溶解到膜池水中使其浓度增大.相比CK系统, BES系统Ⅰ、Ⅱ、Ⅳ区荧光更强, 且λEx/λEm=225/325 nm和275/325 nm的两处峰值相比运行初期分别提高了41.7%和31.9%, 说明弱电压刺激产生了更多蛋白类生物聚合物.而在Ⅲ、Ⅴ区, BES系统荧光强度明显弱于CK系统, λEx/λEm=225/415 nm和260/425 nm的两处峰值相比运行开始时分别降低了36.8%和30.4%.这与SUVA的分析结果一致, 印证了弱电压作用对腐殖质类有机物去除的促进作用.其去除机理可能是:在弱电压刺激下, 微生物在产生更多用于加速胞外电子传递, 增强生物活性的细胞色素、菌毛, 黄素等蛋白类物质(Marsili et al., 2008; Kumar et al., 2017)的同时, 也利用这些蛋白类有机物产生的生物电效应促进了对腐殖质类有机物的去除, 特别是对其中醌类物质的同化和利用(Newman et al., 2000; Van Der Zee et al., 2003).
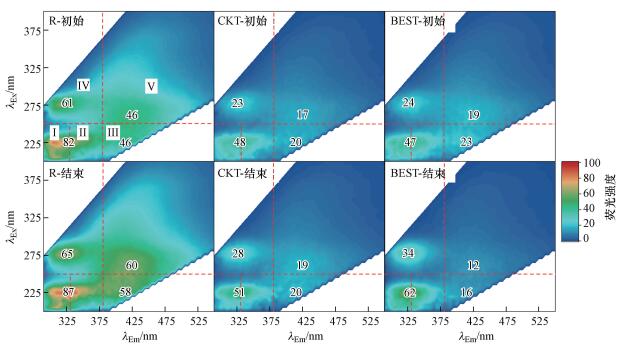 |
| 图 5 BES系统和CK系统运行开始和结束时的三维荧光光谱图 Fig. 5 EEMs of BES and CK systems at the beginning and end of the operation |
SEC可以准确直观地反映溶解性有机物AMW分布情况.就地表水而言, 所用紫外检测器可反映水中大分子生物聚合物(MW>30 kDa)、腐殖质类有机物(1 kDa < MW < 10 kDa)和其他小分子有机物(MW < 1 kDa)3类具有紫外吸收活性的有机物(Yu et al., 2018).图 6为装置运行初期和后期各取样点有机物AMW分布情况.装置运行初期, 两系统有机物去除情况基本一致:经活性炭预处理后膜池水中腐殖质类有机物和小分子量有机物(MW < 10 kDa)均能达到70%以上的去除率, 大分子生物聚合物(MW>30 kDa)略有减少.经超滤膜表面活性炭的进一步吸附和超滤膜截留后, 两系统均无明显紫外吸收响应出现, 证明生物活性炭-超滤组合工艺对各个分子量段有紫外吸收活性的有机物均有理想的去除效果.装置运行后期, 两系统膜池水腐殖质类有机物和小分子量有机物(MW < 10 kDa)仍保持较低水平.值得注意的是, BES系统对腐殖质类有机物(1 kDa < MW < 10 kDa)表现出了更好的去除效果, 这与SUVA和EEM结果一致, 证实长期运行下, 弱电压促进了生物活性炭对腐殖质类有机物的去除.大分子生物聚合物(MW>30 kDa)方面, 装置运行后期BES系统膜池中具有紫外吸收活性的大分子生物聚合物明显多于CK系统, 这与TOC和EEM的结果一致, 证明弱电压作用刺激微生物产生了更多的溶解性微生物产物.从膜后水来看, 无论BES系统或CK系统, 膜后水均未有明显紫外吸收响应出现, 表明在长期运行后生物活性炭-超滤工艺仍能保证理想的有机物去除效果.
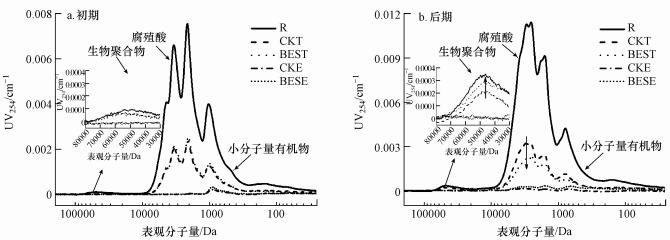 |
| 图 6 BES系统和CK系统运行初期(a)和后期(b)有机物表观分子量分布的变化情况 Fig. 6 Variation of AMW distribution at the beginning(a) and end(b) of the operation of BES and CK systems |
生物膜由EPS和微生物细胞组成, 对两系统活性炭表面EPS组分和微生物细胞生物活性进行表征可以更清晰地认识弱电压作用对活性炭表面生物膜的影响.从两系统活性炭表面EPS的含量来看, BES系统荧光性蛋白类有机物的荧光响应强度(图 7a), 以及蛋白质和多糖的绝对含量均显著高于CK系统, EPS含量约是CK系统的1.42倍, 这与装置运行后期BSE系统膜前水TOC、EEM和SEC的分析结果一致, 证实了在弱电压刺激下, 活性炭表面会产生并累积更多的EPS.微生物细胞生物活性方面, 两系统相差悬殊, BES系统ATP含量约是CK系统的5.72倍.说明弱电压作用显著增强了微生物的代谢活性.相比EPS含量的增加, 微生物细胞活性的提高更为显著, 这一定程度上促进了其对腐殖质类有机物和NH4+-N和PO43--P的去除.
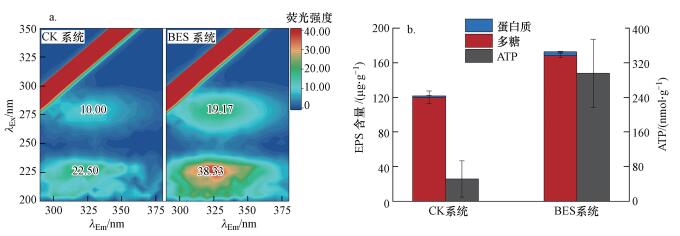 |
| 图 7 BES系统和CK系统活性炭表面生物膜的表征(a.生物膜中EPS的三维荧光光谱分析, b.生物膜中EPS含量和微生物活性分析)(n=3) Fig. 7 Characterization of biofilms on activated carbon surface of BES system and CK system (a.EEMs analysis of EPS in biofilm, b.Analyses of EPS contents and microbe activity in biofilm) (n=3) |
将膜表面富集的污染物提取后进行相关检测分析, 结果如图 8所示.从EEM来看(图 8a、8b), 膜表面污染物的荧光反应集中在Ⅰ、Ⅱ、Ⅳ区, 代表以溶解性微生物产物为主的蛋白类有机物, 未检出腐殖酸、富里酸类物质的累积.从有机物AMW分布来看(图 8c), 两组膜表面污染物以具有紫外吸收活性的大分子生物聚合物(MW>30 kDa)为主, 腐殖质类和其他小分子量有机物(MW < 10 kDa)无明显响应.BES系统膜表面具有紫外吸收活性的大分子生物聚合物的相对含量约为CK系统的2倍(图 8a), 说明超滤膜污染加重的关键在于大分子生物聚合物在膜表面的累积.相关研究表明(Yu et al., 2018), 超滤膜长期运行后膜表面大分子生物聚合物主要是微生物胞外聚合物, 其组成成分以蛋白质、多糖为主(Flemming et al., 2010).因此, 实验通过检测膜表面多糖、蛋白的绝对含量来进一步分析弱电压作用对微生物分泌的胞外聚合物的影响.如图 8d所示, BES系统多糖和蛋白质的总量明显高于CK系统, 且多糖含量在两系统膜表面污染物中均占主导, 这与活性炭表面EPS的累积情况相似.活性炭作为阳极, 装置运行期间其电势为(0.68±0.08) V, 这给附着在其上的微生物造成了一定的氧化胁迫, 致使微生物处于氧化应激状态产生了更多的多糖保护自己(Gambino et al., 2016; Yang et al., 2019).因此, BES系统膜表面污染物以多糖为主.另一方面, 除产生多糖保护自己, 对胞外电子的快速转移和传递可能是微生物应对氧化胁迫的另一种方式, 这使得微生物产生了更多具有氧化还原活性的蛋白类物质(Hirose et al., 2018).
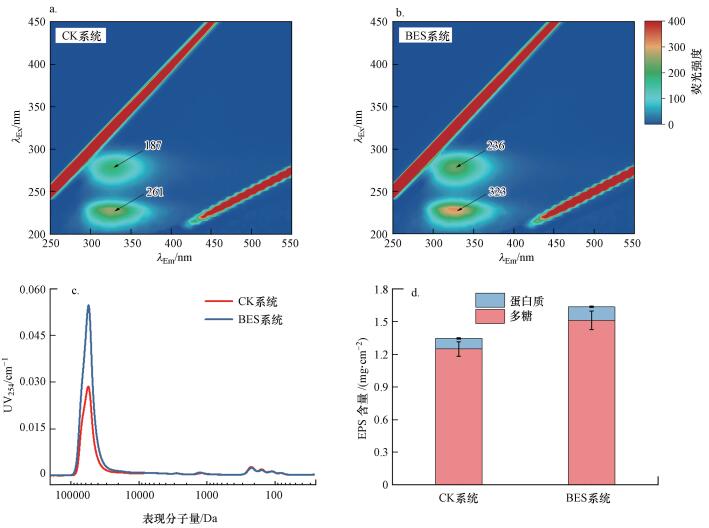 |
| 图 8 BES系统和CK系统膜表面污染物的比较(a.CK系统膜表面污染物EEMs的表征;b.BES系统表面污染物EEMs的表征;c.BES系统和CK系统膜表面污染物表观分子量分布的比较;d.BES系统和CK系统膜表面EPS含量的比较) (n=3) Fig. 8 Comparison of membrane surface foulants between BES and CK systems (a.EEMs of the membrane surface foulants in CK system, b.EEMs of the membrane surface foulants in BES system, c.Comparison of the apparent molecular weight distribution of the membrane surface foulants between BES and CK systems, d.Comparison of EPS contents on membrane surface between BES and CK systems) (n=3) |
1) 在50 d的运行周期内, 无论是否外加弱电压, 生物活性炭-超滤处理系统对微污染水都具有理想的处理效果.出水可稳定达到《生活饮用水卫生质量标准》(GB5749—2006)对NH4+-N和TOC规定的0.5 mg·L-1和5 mg·L-1的限值要求, PO43--P可稳定达到《地表水环境质量标准》(GB3838—2002)Ⅱ类水体0.10 mg·L-1的排放要求.同时出水SUVA较低, 消毒副产物生成风险大大降低.
2) 外加弱电压刺激了生物膜的生长, 增强了活性炭表面生物膜活性, 通过耦合生物电提高了微生物对腐殖质类有机物的利用, 促进了其去除.同时, 依赖生物作用对膜前水NH4+-N和PO43--P的平均去除率分别提高了13.9%和21.2%.但相对地, BES系统溶解性微生物产物增多, 致使TOC去除率略有降低.
3) BES系统发生了更为严重的膜污染, 从装置运行第15 d后, 其膜污染速率明显快于CK系统, 50 d运行周期后, CK系统和BES系统跨膜压差分别为19.1 kPa和36.1 kPa.
4) 对膜表面污染物的检测分析表明, 以多糖蛋白为主的胞外聚合物在膜表面的富集是导致膜污染的直接原因, 其中多糖在胞外聚合物中占主导, 并且弱电压作用进一步提高了多糖的比重.
本研究证实:在水处理工艺中对天然水体中复杂微生物群施加弱电压会产生一定的生物电效应, 增强微生物活性并加速其代谢活动, 一方面可以提高对氮磷营养元素和具有芳香结构的腐殖质类物质的利用和去除, 另一方面也会产生更多胞外聚合物, 对膜分离工艺产生不利影响.因此, 有必要通过改进工艺形式和工艺组合方式趋利避害, 发挥生物电耦合的优势, 最大化提升组合工艺在微污染水处理方面的工艺效能.本研究可为生物电化学技术在水处理工程上的应用提供新的见解和思考.
Chadwick G L, Otero F J, Gralnick J A, et al. 2019. NanoSIMS imaging reveals metabolic stratification within current-producing biofilms[J]. Proceedings of the National Academy of Sciences, 116(41): 20716-20724. DOI:10.1073/pnas.1912498116 |
Chen W, Westerhoff P, Leenheer J A, et al. 2003. Fluorescence excitation-emission matrix regional integration to quantify spectra for dissolved organic matter[J]. Environmental Science & Technology, 37(24): 5701-5710. |
Field R W, Wu D, Howell J A, et al. 1995. Critical flux concept for microfiltration fouling[J]. Journal of Membrane Science, 100(3): 259-272. DOI:10.1016/0376-7388(94)00265-Z |
Flemming H C, Wingender J. 2010. the biofilm matrix[J]. Nature Reviews Microbiology, 8(9): 623-633. DOI:10.1038/nrmicro2415 |
Flemming H C, Wingender J, Szewzyk U, et al. 2016. Biofilms:an emergent form of bacterial life[J]. Nature Reviews Microbiology, 14(9): 563-575. DOI:10.1038/nrmicro.2016.94 |
Gambino M, Cappitelli F. 2016. Mini-review:biofilm responses to oxidative stress[J]. Biofouling, 32(2): 167-178. DOI:10.1080/08927014.2015.1134515 |
何伟, 白泽琳, 李一龙, 等. 2016. 溶解性有机质特性分析与来源解析的研究进展[J]. 环境科学学报, 36(2): 359-372. |
Hirose A, Kasai T, Aoki M, et al. 2018. Electrochemically active bacteria sense electrode potentials for regulating catabolic pathways[J]. Nature communications, 9: 1083. DOI:10.1038/s41467-018-03416-4 |
Hohner A K, Rhoades C C, Wilkerson P, et al. 2019. Wildfires alter forest watersheds and threaten drinking water quality[J]. Accounts of Chemical Research, 52: 1234-1244. |
Hong P N, Noguchi M, Matsuura N, et al. 2019. Mechanism of biofouling enhancement in a membrane bioreactor under constant trans-membrane pressure operation[J]. Journal of Membrane Science, 592: 117391. DOI:10.1016/j.memsci.2019.117391 |
Huang S, Voutchkov N, Jiang S. 2019. Balancing carbon, nitrogen and phosphorus concentration in seawater as a strategy to prevent accelerated membrane biofouling[J]. Water Research, 165: 114978. DOI:10.1016/j.watres.2019.114978 |
Huber F, Berwanger J, Polesya S, et al. 2019. Chemical bond formation showing a transition from physisorption to chemisorption[J]. Science, 366(6462): 235-238. DOI:10.1126/science.aay3444 |
Hussain S, Van Leeuwen J, Chow C, et al. 2013. Removal of organic contaminants from river and reservoir waters by three different aluminum-based metal salts:Coagulation adsorption and kinetics studies[J]. Chemical Engineering Journal, 225: 394-405. DOI:10.1016/j.cej.2013.03.119 |
Hwang B K, Lee W N, Yeon K M, et al. 2008. Correlating TMP increases with microbial characteristics in the bio-cake on the membrane surface in a membrane bioreactor[J]. Environmental Science & Technology, 42(11): 3963-3968. |
Jiang J, Zhang X, Zhu X, et al. 2017. Removal of intermediate aromatic halogenated DBPs by activated carbon adsorption:a new approach to controlling halogenated DBPs in chlorinated drinking water[J]. Environmental Science & Technology, 51(6): 3435-3444. |
Kumar A, Hsu L H H, Kavanagh P, et al. 2017. The ins and outs of microorganism-electrode electron transfer reactions[J]. Nature Reviews Chemistry, 1(3): 0024. DOI:10.1038/s41570-017-0024 |
Logan B E, Rossi R, Saikaly P E. 2019. Electroactive microorganisms in bioelectrochemical systems[J]. Nature Reviews Microbiology, 17(5): 307-319. DOI:10.1038/s41579-019-0173-x |
李政剑, 石宝友, 王东升. 2013. 不同粒径粉末活性炭对水中天然有机物吸附性能的比较研究[J]. 环境科学, 34(11): 4319-4324. |
Marsili E, Baron D B, Shikhare I D, et al. 2008. Shewanella secretes flavins that mediate extracellular electron transfer[J]. Proceedings of the National Academy of Sciences, 105(10): 3968-3973. DOI:10.1073/pnas.0710525105 |
Miller D J, Kasemset S, Paul D R, et al. 2014. Comparison of membrane fouling at constant flux and constant transmembrane pressure conditions[J]. Journal of Membrane Science, 454: 505-515. DOI:10.1016/j.memsci.2013.12.027 |
Newman D K, Kolter R. 2000. A role for excreted quinones in extracellular electron transfer[J]. Nature, 405(6782): 94-96. DOI:10.1038/35011098 |
Richter H, Nevin K P, Jia H, et al. 2009. Cyclic voltammetry of biofilms of wild type and mutant Geobacter sulfurreducens on fuel cell anodes indicates possible roles of OmcB, OmcZ, type IV pili, and protons in extracellular electron transfer[J]. Energy & Environmental Science, 2(5): 506-516. |
Shao S, Li Y, Jin T, et al. 2019. Biofouling layer maintains low hydraulic resistances and high ammonia removal in the UF process operated at low flux[J]. Journal of Membrane Science, 596: 117612. DOI:10.1016/j.memsci.2019.117612 |
Terry L G, Summers R S. 2018. Biodegradable organic matter and rapid-rate biofilter performance:A review[J]. Water Research, 128: 234-245. DOI:10.1016/j.watres.2017.09.048 |
Tortajada C, Van Rensburg P. 2019. Drink more recycled wastewater[J]. Nature, 577: 26-28. |
Van Der Zee F P, Bisschops I A E, Lettinga G, et al. 2003. Activated carbon as an electron acceptor and redox mediator during the anaerobic biotransformation of azo dyes[J]. Environmental Science & Technology, 37(2): 402-408. |
Wang L, Miao R, Wang X, et al. 2013. Fouling behavior of typical organic foulants in polyvinylidene fluoride ultrafiltration membranes:Characterization from microforces[J]. Environmental Science & Technology, 47(8): 3708-3714. |
Weishaar J L, Aiken G R, Bergamaschi B A, et al. 2003. Evaluation of specific ultraviolet absorbance as an indicator of the chemical composition and reactivity of dissolved organic carbon[J]. Environmental Science & Technology, 37(20): 4702-4708. |
Xiao Y, Zhang E, Zhang J, et al. 2017. Extracellular polymeric substances are transient media for microbial extracellular electron transfer[J]. Science Advances, 3(7): e1700623. DOI:10.1126/sciadv.1700623 |
Yang G, Huang L, Yu Z, et al. 2019. Anode potentials regulate Geobacter biofilms:New insights from the composition and spatial structure of extracellular polymeric substances[J]. Water Research, 159: 294-301. DOI:10.1016/j.watres.2019.05.027 |
Yang Q, Zhao N, Wang H, et al. 2020. Electrochemical and biochemical profiling of the enhanced hydrogenotrophic denitrification through cathode strengthening using bioelectrochemical system (BES)[J]. Chemical Engineering Journal, 381: 122686. DOI:10.1016/j.cej.2019.122686 |
Yu Q, Zhang Y. 2019. Fouling-resistant biofilter of an anaerobic electrochemical membrane reactor[J]. Nature Communications, 10(1): 4860. DOI:10.1038/s41467-019-12838-7 |
Yu W, Liu T, Crawshaw J, et al. 2018. Ultrafiltration and nanofiltration membrane fouling by natural organic matter:Mechanisms and mitigation by pre-ozonation and pH[J]. Water Research, 139: 353-362. DOI:10.1016/j.watres.2018.04.025 |
Yu W, Graham N, Liu T. 2019. Prevention of UF membrane fouling in drinking water treatment by addition of H2O2 during membrane backwashing[J]. Water Research, 149: 394-405. DOI:10.1016/j.watres.2018.11.006 |
左金龙. 2012. 微污染水源水水质特点及其处理工艺选择[J]. 中国给水排水, (16): 22-25. DOI:10.3969/j.issn.1000-4602.2012.16.007 |
 2020, Vol. 40
2020, Vol. 40


