当前, 全球面临的臭氧污染问题不容忽视.一方面, 1990—2010年北半球臭氧平均浓度呈上升的趋势(Li et al., 2015);另一方面, 随着全球气温逐年攀升, 气候变化引起的温度升高会加快了臭氧形成的二次光化学反应速率, 导致臭氧前体消耗更快, 从而增加地表臭氧浓度, 形成“气候惩罚效应”(Dawson et al., 2007;Lee et al., 2015).目前, 臭氧已成为继颗粒物之后影响城市空气质量的一种重要二次污染物.
中国城市同样面临着臭氧污染日益加重的巨大压力, 以城市为中心的区域性污染特征突出.2016年中国338个城市的臭氧每日最大8 h平均浓度达到138 μg·m-3, 37.8%的城市超过了《环境空气质量标准》(GB3095—2012)中的二级标准.虽在2018年总体空气质量有所好转, 各项污染物的浓度和超标天数均呈下降趋势, 但臭氧浓度却不降反增, 浓度增长了1.3%, 超标天数增加了0.8%.
国内外已有大量的流行病学研究表明臭氧对人体健康的不利影响, 并证实短期的臭氧暴露与总死亡、心血管系统疾病死亡、呼吸系统疾病死亡之间的相关关系.由于我国与国外社会环境、经济基础、人群行为方式不同, 因此, 两者在环境臭氧浓度和个体暴露浓度的差异是不相同的, 故本文只探讨我国臭氧短期暴露与人群死亡的关系.中国目前在此方面的单篇研究相对较多, 但由于气候特征、人群敏感性、分析方法、数据质量和测量误差等存在差异, 有关暴露-反应系数的研究结论并不一致.为此, 合并单篇研究结果的估计值是估计总体关系的一种合理方法, 能大大减少由于采用单篇的暴露-反应系数进行健康效应评估的不确定性.但目前国内有关臭氧暴露与人体健康关系的一致性研究证据仍然较少且存在不足.具体而言, 世界卫生组织在2000年提出最大8 h平均水平是研究环境O3暴露与健康关系的适当指标, 也有研究指出最大8 h平均臭氧浓度与死亡率有更密切的关系(Li et al., 2015).而先前的汇总分析研究未将臭氧暴露的测量指标作为文献筛选标准(董继元等, 2016), 这会影响结论的准确性.此外, 近年来随着单篇研究的增多, 也有必要对其结论的一致性进行再次评估.
基于此, 本文通过系统回顾我国已发表的臭氧与总死亡、心血管系统疾病死亡和呼吸系统疾病死亡关系的流行病学研究, 对暴露-反应关系进行Meta分析, 同时探讨温度、年龄、性别、季节的效应修饰作用.
2 材料与方法(Materials and methods) 2.1 研究总体思路搜索截止至2020年1月1日公开发表的中国地区臭氧污染与人群死亡“暴露-反应”关系的研究文献.Meta分析的软件及版本为Stata 15, 利用metan命令对相对危险度效应量RR及95%置信区间进行合并.此外, 应用Q统计量与I2对异质性进行定性与定量检验, 应用metaninf命令进行敏感性分析.
2.2 文献检索策略英文文献检索数据库为Web of Science和PubMed, 中文文献检索数据库包括中国知网(CNKI)、万方医学网、维普中文期刊.检索截止日期为1990年1月1日—2020年1月1日.检索关键词分为4个类型, 分别为:①研究对象:O3/臭氧(ozone)、空气污染(air pollution);②研究终端:死亡率(mortality);③研究设计:时间序列(time series、time-series)、病例交叉(case-crossover);④研究地区:包括中国(China)、长三角(Yangtze River Delta)、珠三角(Pearl River Delta)、京津冀(Beijing-Tianjin-Hebei)、台湾(Taiwan)、香港(Hong Kong)、澳门(Macao).对以上关键词进行排列组合检索.
2.3 文献纳入标准围绕研究设计的各个关键步骤设计文献纳入标准, 步骤包括:①确定研究边界:保留中国(包括港澳台)城市地区的研究, 剔除非中国地区和非城市地区的研究;②明确研究对象:保留O3相关的研究, 剔除其他污染物如细颗粒物(PM2.5)、可吸入颗粒物(PM10)、二氧化氮(NO2)等的研究;③选定文献类型:保留原始研究, 剔除综述或二次研究;④审核污染物数据来源:保留来自正规监测单位, 如环境监测站、环境空气质量报告等的研究, 剔除其他来源的研究;⑤框定建模方法:保留时间序列和病例交叉设计研究, 剔除其他设计.
此外, 为控制纳入文献的质量, 需设置文献质量控制标准:①剔除重复报告, 如同一研究以不同语言发表或同时发表在期刊和会议报告上的文献;②剔除缺少研究相关信息, 只有研究结果的文献, 如没有介绍污染物数据、死亡数据、研究方法模型等的文献;③剔除缺乏混杂变量控制的文献, 如时间序列设计研究中缺乏对时间趋势、温度、相对湿度、星期等混杂变量的控制.
2.4 数据提取标准及效应量转换数据提取标准包括:①O3是否为独立作用, 保留有独立作用结果的数据, 剔除没有独立作用的结果, 如与其他污染物交互作用的数据;②是否为完整年份或整体温度下的效应结果, 如是则保留, 否则剔除(如仅有某一季节的数据);③是否以死亡率(如总死亡、心血管系统疾病死亡或呼吸系统疾病死亡)为健康效应终端, 如是则保留, 否则剔除文献;④是否能定量表示为污染物每升高10 μg·m-3, 总死亡增加的百分比, 即ER(超额危险度, Excess Risk)或RR(相对危险度, Relative Risk)及95%CI(置信区间, Confidence Interval), 如是则保留, 否则剔除(如不能转化为RR或缺少95%CI的数据);⑤臭氧暴露测量指标是否为每日8 h最大平均浓度, 如是则保留, 排除使用其它度量方式的文献, 不采用美国环保署制定的标准转换系数进行转换.
将通过筛选标准的文献纳入分析数据库, 参照以上数据提取标准分别提取文献中的以下3部分数据:①研究信息:研究名称、第一作者、发表年份、发表期刊;②研究方法:研究地点、数据年份、研究设计(时间序列或病例交叉)、研究模型(广义相加模型或广义线性模型);③研究结果:污染物每升高一定浓度时, 死亡人数增加的百分比/相对危险度(RR)及各效应量的95%置信区间(95%CI:LCI~UCI)、模型所选择的滞后天数(lag)、结果是否显著.为保证数据录入的准确性, 录入数据至少核对3次.
研究结果最终均需要转化为“污染物浓度每升高10 μg·m-3, 对应的RR及其95%CI”的表达形式.ER与RR的转换公式见式(1);暴露-反应系数β(污染物浓度每升高1 μg·m-3, 死亡率增加的百分比)与RR的转化公式见式(2);污染物升高不同浓度(设为△X1和△X2)时, 对应RR1与RR2的转化公式见式(3).
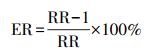
|
(1) |
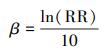
|
(2) |
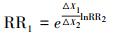
|
(3) |
汇总臭氧对总死亡、心血管系统疾病死亡和呼吸系统疾病死亡的暴露-反应关系, 通过Stata 15.0软件进行Meta分析.利用随机效应模型(Dersimonian-Laird法)合并统计量.采取Z检验判断合并统计量的显著性, p < 0.05表示差异有统计学意义.以每个研究文献的效应量为横坐标, 效应量标准误为纵坐标绘制Meta分析漏斗图;并通过Begg法和Egger法检验分析中的偏倚, p>0.05表明无显著发表偏倚.敏感性分析则采用逆方差计算个体估计加权值, 检测合并估计是否受到单个研究较大影响, 同时探讨温度、年龄、性别、季节的修饰效应.
3 结果(Results) 3.1 文献检索结果依据上述纳入/排除标准对相关文献进行筛选后, 本文共纳入12篇文献, 共计30个暴露-反应系数, 涉及北京市、安徽省、江苏省、上海市、台湾省、广东省、香港特别行政区等地区, 实验设计全部为时间序列, 研究模型包含广义相加模型(Generalized Additive Model, GAM)和广义线性模型(Generalized Linear Model, GLM)两种, 研究时间跨度为1994—2017年共24年.关于总死亡的文献有10篇, 效应估计值有15个, 关于心血管系统疾病死亡的文献有6篇, 效应估计值有8个, 关于呼吸系统疾病死亡的文献有5篇, 效应估计值有7个.
3.2 Meta分析结果基于臭氧对中国人群总死亡影响的各项研究结果(表 1), 采用随机效应模型进行分析, 得到合并值RR=1.0040(95%CI:1.0028~1.0052), 即臭氧每上升10 μg·m-3, 人群的总死亡率平均上升0.40%.
| 表 1 我国臭氧与人群总死亡关系研究的文献信息 Table 1 Selected literatures on the associations between short-term ozone exposure and total mortality |
基于臭氧对中国人群心血管系统疾病死亡影响的各项研究结果, 采用随机效应模型进行分析, 得到合并值RR=1.0067(95%CI:1.0046~1.0088), 即臭氧每上升10 μg·m-3, 人群心血管系统疾病的死亡率平均上升0.67%.
| 表 2 我国臭氧与人群心血管系统疾病死亡关系研究的文献信息 Table 2 Selected literatures on the associations between short-term ozone and cardiovascular mortality |
基于臭氧对中国人群呼吸系统疾病死亡影响的各项研究结果(表 3), 采用随机效应模型进行分析, 得到合并值RR=1.0023(95%CI:0.9980~1.0066), 是合并值并不显著, 也即臭氧对呼吸系统疾病死亡率无显著影响.
| 表 3 我国臭氧与人群呼吸系统疾病死亡关系研究的文献信息 Table 3 Selected literatures on the associations between short-term ozone and respiratory mortality |
采用留一交叉验证法进行敏感性分析, 即每次去除一篇文献结果后再进行Meta分析并与原统计结果比较.该法样本利用率高, 适用于小样本情况.检验结果表明, 臭氧短期暴露与人群总死亡、心血管系统疾病死亡和呼吸系统疾病死亡关系的结果稳定, 可以支持总样本研究结果(图 1).
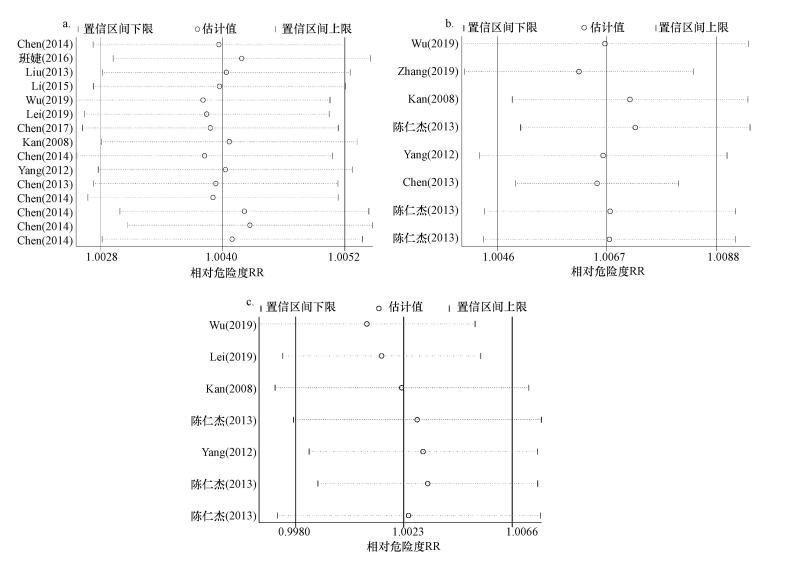 |
| 图 1 臭氧对总死亡(a)、心血管疾病死亡(b)和呼吸系统疾病死亡(c)影响合并值的敏感性分析 Fig. 1 Sensitivity analysis of the impacts of ozone on total mortality(a), cardiovascular mortality(b) and respiratory mortality(c) |
对纳入Meta分析的10篇有关总死亡的文献、6篇有关心血管系统疾病的文献、5篇有关呼吸系统疾病死亡的文献进行发表偏倚检验, 检验结果如表 4及图 2所示.可以看出, 漏斗图两侧基本对称, Begg秩相关检验和Egger法检验均为p>0.05, 表明不存在显著的发表偏倚.
| 表 4 Begg秩相关法和Egger直线回归法对文献发表偏倚的显著性检验 Table 4 Publication bias inspection by Begg rank correlation method and Egger linear regression method |
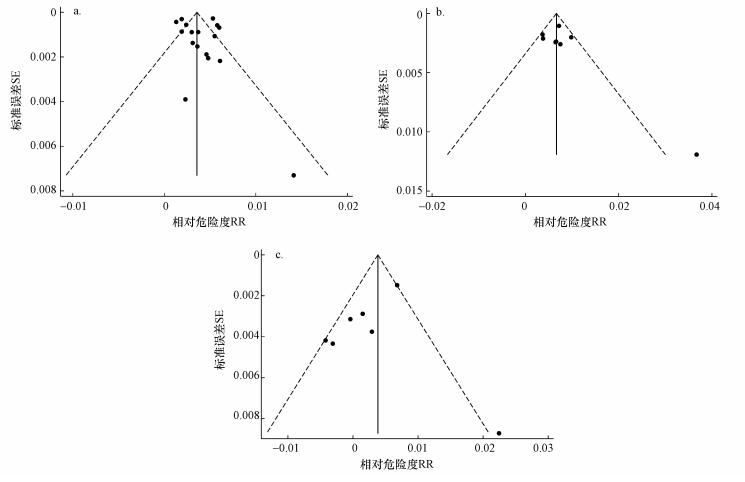 |
| 图 2 臭氧暴露对总死亡(a)、心血管疾病死亡(b)和呼吸系统疾病死亡(c)风险影响的漏斗图 Fig. 2 Funnel plot of the impacts of ozone on total mortality(a), cardiovascular mortality(b) and respiratory mortality(c) |
对纳入的有关总死亡的研究按温度分为高温、中温、低温3个亚组(在臭氧短期暴露急性健康效应中, 以日均温度序列的百分位数划分温度组);按年龄分为0~64岁、65岁及以上两个亚组;按性别分为男性和女性两个亚组;按季节分为冷季、暖季两个亚组.之后, 对各亚组进行合并效应值的比较.如表 5所示, 处于高温和低温下的人群风险高于中温下的人群风险, 但处于中温和高温下的人群相对风险值与1没有显著差异, 仅在低温度下臭氧表现出较强的急性死亡效应.关于人口学特征的修饰效应, 65岁以上老年群体的脆弱性可能更高, 女性比男性风险可能更大, 但无统计学意义.处于冷季下的人群风险高于暖季且具有显著差异, 提示短期臭氧暴露与死亡的关系之间存在季节模式.
| 表 5 不同修饰效应下臭氧暴露对人群总死亡风险影响 Table 5 Different effects modify the impacts of ozone on total mortality |
短期臭氧暴露的急性死亡效应是近年来的研究热点之一, 已经在全球不同地点、不同时间、不同人群取得了结果, 并得到初步证实.本研究更新了适用于中国本地化的暴露-反应系数, 不仅通过了Begg秩相关检验和Egger法检验, 而且敏感性分析进一步论证了本文结论的可靠性.同时, 还探讨了温度、年龄、性别、季节的修饰效应, 可以为城市大气污染健康风险精细化评估工作提供依据.
本研究结果表明, 臭氧浓度每上升10 μg·m-3会导致人群总死亡风险增加0.40%(95%CI:0.28%~0.52%).对比原始文献, 除Liu等(2013)的研究结果, 其余14组数据均表明臭氧短期暴露有显著的健康风险.此外, 相对风险值的分布没有出现明显的地区或时间规律.对比国内多城市研究结果, Sun等(2017)基于2013—2015年中国10个省共计34个县的数据利用分布滞后非线性模型得出的结果为0.37%(95%CI:0.20%~0.55%).同年, Yin等(2017)对2013—2015年中国272个城市分别进行分析, 并利用贝叶斯分层模型合并估计值, 合并结果为0.24%(95%CI:0.13%~0.35%).本文结果高于Sun等(2017)和Yin等(2017)的结果但不具有显著性差异.与国内Meta分析研究结果相比, 数值较为接近, 分别为0.42%、0.42%、0.45%、0.40%(Yan et al., 2013;Lai et al., 2013;廖志恒等, 2015;董继元等, 2016).国外Meta分析研究结果(Thurston et al., 2001;Stieb et al., 2002;Levy et al., 2005;Ito et al., 2005;Bell et al., 2005)涉及1985—2004年北美、欧洲等地区发表的文献, 与之相比本研究观察到臭氧短期暴露对人群总死亡风险的影响明显更大.为增加本研究涉及的城市数量, 将两篇多城市研究结果(Sun et al., 2017;Yin et al., 2017)纳入本研究进行效应值合并以增强本文结论的代表性, 合并结果为0.38%(95%CI:0.28%~0.49%), 与上述结论一致.此外, 将有关O3其它度量方式的文献也纳入后(共计26个估计值)的合并结果为0.40%(95%CI:0.30%~0.49%), 结论未发生明显变化.
此外, 本研究发现臭氧浓度每上升10 μg·m-3会导致人群心血管系统疾病死亡风险增加0.67%(95%CI:0.46%~0.88%).对比原始文献, 除Kan等(2008)的研究结果, 其余7组数据均具有较强的显著性.对比国内外多城市及Meta分析研究, 大气臭氧浓度每增加10 μg·m-3, 死亡风险增加百分比分别为0.27%(95%CI:0.10%~0.44%)、0.44%(95%CI:0.17%~0.70%)、0.51%(95%CI:0.25%~0.77%)、0.70%(95% CI:0.57%~0.86%)、0.49%(95%CI:0.17%~0.72%)、0.42%(95% CI:0.26%~0.58%)、0.45%(95% CI:0.15%~0.76%) (Stieb et al., 2002;Bell et al., 2005;Yan et al., 2013;Lai et al., 2013;廖志恒等, 2015;董继元等, 2016;Yin et al., 2017).可以看出, 本研究得出的效应值较高, 原因在于纳入了Wu等(2019)和Zhang等(2019)发表文献的结论(分别为0.72%(95%CI:0.52~0.93)、0.99%(95CI%:0.59%~0.139%)), 拉高了本文的合并结果.去掉这两篇文献后得到的合并结果降低至0.59%(95%CI:0.30%~0.87%), 与当前多城市研究及国内外Meta分析结果不存在显著差异.同样, 将国内多城市研究与本研究进行合并的结果为0.61%(95%CI:0.38%~0.83%), 与其他同类型Meta分析研究结果也更为接近.当纳入O3其他度量方式的文献后(估计值共计19个), 合并结果为0.56%(95%CI:0.39%~0.73%), 得出的结论更小.
本研究发现臭氧浓度每上升10 μg·m-3会导致人群呼吸系统疾病死亡风险增加0.23%(95%CI: -0.20%~0.66%), 但没有统计学意义.对比原始文献, 除Wu等(2019)和Lei等(2019)的研究结果, 其余5组数据均不存在显著的健康效应.与国内多城市研究结果比较, 发现数值较为接近且无显著性差异, 分别为0.22%(95%CI:-0.28%~0.72%)、0.18%(95%CI:-0:11%~0.47%)(Sun et al., 2017;Yin et al., 2017), 进行合并后的结果为0.23%(95%CI:-0.06%~0.51%), 即臭氧对呼吸系统疾病死亡率无显著影响.若纳入O3其他度量方式的文献(共计18个估计值), 则合并结果为0.36%(95%CI:0.14%~0.57%), 即臭氧短期暴露对人群呼吸系统疾病死亡风险具有显著的影响, 这与仅纳入臭氧最大8 h浓度的研究观察到的结论并不一致(Yan et al., 2013;Lai et al., 2013;廖志恒等, 2015;董继元等, 2016).可能是因为臭氧暴露测量指标选取的不同而造成了结论上的差异.
5 结论(Conclusions)本研究结果表明, 臭氧短期暴露会导致人群总死亡率、心血管系统疾病死亡率增加, 其中, 臭氧暴露与心血管系统疾病死亡风险的相关系数大于与总死亡风险的相关系数且具有显著性差异, 但未发现臭氧短期暴露与呼吸系统疾病死亡率之间的显著性关联.在效应修饰方面, 仅有季节因素存在明显的修饰作用.
Bell M L, Dominici F, Samet J M. 2005. A meta-analysis oftime-series studies of ozone and mortality with comparison to the national morbidity, mortality and air pollution study[J]. Epidemiology, 16(4): 436-445. DOI:10.1097/01.ede.0000165817.40152.85 |
班婕, 李湉湉. 2016. 北京市不同度量方式下臭氧短期暴露人群急性健康效应研究[J]. 环境与健康杂志, 33(4): 287-291. |
陈仁杰.2013.复合型大气污染对我国17城市居民健康效应研究[D].上海: 复旦大学 http://d.wanfangdata.com.cn/thesis/Y2702417
|
Chen K, Zhou L, Chen X, et al. 2017. Acute effect of ozone exposure on daily mortality in seven cities of Jiangsu Province, China:No clear evidence for threshold[J]. Environmental Research, 155: 235-241. DOI:10.1016/j.envres.2017.02.009 |
Chen K, Yang H B, Ma Z W, et al. 2013. Influence of temperature to the short-term effects of various ozone metrics on daily mortality in Suzhou, China[J]. Atmospheric Environment, 79: 119-128. DOI:10.1016/j.atmosenv.2013.06.004 |
Chen R J, Cai J, Xia M, et al. 2014. Ozone and daily mortality rate in 21 cities of East Asia:How does season modify the association?[J]. American Journal of Epidemiology, 180(7): 729-736. DOI:10.1093/aje/kwu183 |
董继元, 刘兴荣, 张本忠, 等. 2016. 我国臭氧短期暴露与人群死亡风险的Meta分析[J]. 环境科学学报, 36(4): 1477-1485. |
Dawson J P, Adams P J, Pandis S N. 2007. Sensitivity of ozone to summertime climate in the eastern USA:A modeling case study[J]. Atmospheric Environment, 41(7): 1494-1511. DOI:10.1016/j.atmosenv.2006.10.033 |
Ito K, De Leon S F, Lippmann M. 2005. Associations between ozone and daily mortality:analysis and meta-analysis[J]. Epidemiology, 16(4): 446-457. DOI:10.1097/01.ede.0000165821.90114.7f |
Kan H D, London S J, Chen G H, et al. 2008. Season, sex, age, and education as modifiers of the effects of outdoor air pollution on daily mortality in Shanghai, China:The Public Health and Air Pollution in Asia(PAPA) study[J]. Environmental Health Perspectives, 116(9): 1183-1188. DOI:10.1289/ehp.10851 |
Lai H K, Tsang H, Wong C M. 2013. Meta-analysis of adverse health effects due to air pollution in Chinese populations[J]. BMC Public Health, 13(1): 360. DOI:10.1186/1471-2458-13-360 |
廖志恒, 范绍佳. 2015. 2006-2012年珠江三角洲地区O3污染对人群健康的影响[J]. 中国环境科学, 35(3): 897-905. |
Lee J B, Cha J S, Hong S C, et al. 2015. Projections of summertime ozone concentration over East Asia under multiple IPCC SRES emission scenarios[J]. Atmospheric Environment, 106: 335-346. DOI:10.1016/j.atmosenv.2015.02.019 |
Lei R, Zhu F, Cheng H, et al. 2019. Short-term effect of PM2.5/O3 on non-accidental and respiratory deaths in highly polluted area of China[J]. Atmospheric Pollution Research, 10(5): 1412-1419. DOI:10.1016/j.apr.2019.03.013 |
Levy J I, Chemerynski S M, Sarnat J A. 2005. Ozone exposure and mortality:An empiric Bayes metaregression analysis[J]. Epidemiology, 16(4): 458-468. DOI:10.1097/01.ede.0000165820.08301.b3 |
Li T T, Yan M L, Ma W J, et al. 2015. Short-term effects of multiple ozone metrics on daily mortality in a megacity of China[J]. Environmental Science and Pollution Research, 22(11): 8738-8746. DOI:10.1007/s11356-014-4055-5 |
Liu T, Li T T, Zhang Y H, et al. 2013. The short-term effect of ambient ozone on mortality is modified by temperature in Guangzhou, China[J]. Atmospheric Environment, 76(Sp.Iss.SI): 59-67. |
Stieb D M, Judek S, Burnett R T, et al. 2002. Meta-analysis of time-series studies of air pollution and mortality:effects of gases and particles and the influence of cause of death, age, and season[J]. Journal of the Air and Waste Management Association, 52(4): 470-484. DOI:10.1080/10473289.2002.10470794 |
Sun Q H, Wang W T, Chen C, et al. 2017. Acute effect of multiple ozone metrics on mortality by season in 34 Chinese counties in 2013-2015[J]. Journal of Internal Medicine, 283(5): 481-488. |
Thurston G D, Ito K. 2001. Epidemiological studies of acute ozone exposures and mortality[J]. Journal of Exposure Analysis and Environment Epidemiolog, 11(4): 286-294. DOI:10.1038/sj.jea.7500169 |
Wu R S, Song X M, Chen D H, et al. 2019. Health benefit of air quality improvement in Guangzhou, China:Results from a long time-series analysis(2006-2016)[J]. Environment International, 126: 552-559. DOI:10.1016/j.envint.2019.02.064 |
Yan M L, Liu Z R, Liu X T, et al. 2013. Meta-analysis of the Chinese studies of the association between ambient ozone and mortality[J]. Chemosphere, 93(6): 899-905. DOI:10.1016/j.chemosphere.2013.05.040 |
Yang C X, Yang H B, Guo S, et al. 2012. Alternative ozone metrics and daily mortality in Suzhou:The China Air Pollution and Health Effects Study(CAPES)[J]. Science of the Total Environment, 426: 83-89. DOI:10.1016/j.scitotenv.2012.03.036 |
Yin P, Chen R, Wang L, et al. 2017. Ambient ozone pollution and daily mortality:A nationwide study in 272 Chinese cities[J]. Environmental Health Perspectives, 125(11): 117006. DOI:10.1289/EHP1849 |
Zhang J Y, Chen Q, Wang Q Q, et al. 2019. The acute health effects of ozone and PM2.5 on daily cardiovascular disease mortality:A multi-center time series study in China[J]. Ecotoxicology and Environmental Safety, 174: 218-223. DOI:10.1016/j.ecoenv.2019.02.085 |
 2020, Vol. 40
2020, Vol. 40


