头孢菌素类抗生素属于β-内酰胺类抗生素, 主要是通过抑制细菌细胞壁的合成来杀灭细菌(Alexandrino et al., 2017).由于其具有抗菌谱广、副作用小的特点, 因而在医疗领域被广为应用.近年来, 人们已经在地表水(Li et al., 2018;Ribeiro et al., 2018)、污水(Chen et al., 2016;Yu et al., 2016;Östman et al., 2019)中检出了头孢菌素类抗生素.水平基因转移(Horizontal Gene Transfer, HGT)是细菌耐药性传播的重要方式.接合作为最主要的HGT途径, 通常需要借助具有自主转移能力的质粒来进行(Lopatkin et al., 2016).
质粒介导的接合转移是一系列基因参与的复杂调控过程(伍彬宁, 2017).在接合过程中, 质粒DNA首先要穿过供体菌的细胞膜(Grahn et al., 2000).细菌外膜蛋白(Outer membrane proteins, Omp)作为阻止基因从供体细菌转移到受体细菌的重要屏障(Koebnik et al, 2000;Ozkanca et al., 2002;Knopp et al., 2015), 主要有维持外膜完整的跨膜蛋白OmpA、形成亲水性孔道摄入核酸的微孔蛋白OmpC和OmpF(Spector et al., 2010;Lin et al., 2016).细菌通过调节外膜蛋白基因的表达来适应其膜通透性(Zhang et al., 2018).
在供体和受体细菌之间形成接合桥才能发生接合转移, 细菌性菌毛是形成接合桥的关键(Agnesa et al., 2018), 主要通过性菌毛编码基因traA和trbC来控制(朱健铭等, 2012).细菌接合过程的调控需要整体调节基因、接合配对形成基因和质粒转移与复制基因的参与(Delcour et al., 2009).调控供体菌与受体菌接合配对形成的trbBp基因和traF基因主要负责细菌表面装置的编码与装配, 即供体菌和受体菌细胞的接近、细胞膜的融合及DNA跨膜转运过程所需要的蛋白通道(汪庆等, 2017;Zhang et al., 2017).调控质粒转移和复制的trfAp和traJ基因主要负责质粒在供体菌细胞内切割成单链, DNA单链在蛋白的牵引下实现跨膜转运及单链的质粒DNA在受体菌细胞内复制成双链DNA的过程(Antonenka et al., 2005;Zhang et al., 2017).这些调控接合转移的基因又受到整体调节基因korA、korB和trbA的抑制调控(Zatyka et al., 2001).
目前, 有关质粒接合转移的研究大都是使用RP4、PBHR1和pCM 184-Cm等商品化的耐药质粒作为载体, 通过构建含有耐药质粒的供体菌来进行(钱迪, 2013;Lin et al., 2016;Zhang et al., 2017;汪庆等, 2017);而对于自然水环境中的菌株耐药性质粒接合转移的研究报道则十分有限.具有景观娱乐功能的城市河湖与居民生活关系密切, 研究城市景观水体中耐药基因的菌的传播特性对于保障人群健康具有重要的意义.
因此, 本研究以从西安市5处典型景观水体中分离出的耐头孢噻肟(cefotaxime)菌株作为供体菌, 考察其与受体菌株发生质粒接合转移的状况, 确定可发生接合转移的供体菌的种类和接合转移频率, 研究这些菌株质粒上的抗性基因和I型整合子的分布, 阐明菌株上外膜蛋白基因及接合转移相关基因的mRNA表达检出情况.旨在揭示城市景观水体中β-内酰胺酶类抗性基因的接合转移特性, 为控制相关的健康风险提供科学依据.
2 材料与方法(Materials and methods) 2.1 实验菌株使用2018年4月—2019年4月从西安市5处景观水体(兴庆湖、丰庆湖、桃花潭、莲湖、思源湖)中分离筛选出来的216株头孢噻肟耐药菌作为备选供体菌.受体菌为大肠杆菌NK5449(购自中国普通微生物菌种保藏管理中心), 无质粒, 能在含有100 μg·mL-1萘啶酸和300 μg·mL-1利福平培养基中正常存活.
2.2 接合转移实验 2.2.1 菌株的筛选与鉴定首先将备选供体菌与受体菌分别接种在新鲜的LB培养液中, 37 ℃、150 r·min-1培养至OD600=0.8, 吸取菌液1 mL, 用PBS缓冲溶液洗涤, 4000 r·min-1(D-37520)离心6 min去掉上清液, 得到菌体.然后用1 mL LB培养液重悬菌体, 分别将各株备选供体菌与受体菌充分混合, 于37 ℃培养24 h.取100 μL的混合菌液涂布于含有头孢噻肟(4 μg·mL-1)、萘啶酸(100 μg·mL-1)和利福平(300 μg·mL-1)3种抗生素的营养琼脂平板上, 37 ℃倒置培养24 h.上述抗生素试剂均购自北京索莱宝科技有限公司.如果平板上能够生长出菌落, 表明它们对以上3种抗生素都具有抗性, 即为接合子.对应的备选供体菌即认定为可与受体菌发生接合转移的供体菌株.
按照上述方法从216株耐头孢噻肟菌中筛选出可与受体菌发生接合转移的供体菌株, 使用细菌基因组DNA提取试剂盒(TaKaRa, Japan)提取它们的总DNA, 交由上海生物工程有限公司对细菌16S rDNA测序, 测序结果通过NCBI网站的BLAST进行同源性检索对比, 从而确定菌株类型.
2.2.2 接合转移频率的测定将供体菌与受体菌(大肠杆菌NK5449)按2.2.1节所述方法进行接合.分别利用抗性平板测定接合子和受体菌的数量, 按照式(1)计算接合转移频率(η).
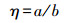
|
(1) |
式中, a为接合子的数量(CFU·mL-1), b为受菌体的数量(CFU·mL-1).
2.3 抗性基因和I型整合子的检测使用质粒提取试剂盒(TaKaRa, Japan)提取供体菌株的质粒.利用PCR方法测定质粒DNA中是否含有3种主要的β-内酰胺酶类抗性基因(blaCTX-M、blaTEM、blaSHV)和I型整合子整合酶基因(intI), 所使用的引物如表 1所示.PCR反应体系为:10×buffer(Mg2+)2.5 μL, dNTP(10 mmol·L-1)2.0 μL, 10 mmol·L-1上下游引物各1.0 μL, 5 U Taq mix 0.2 μL, ddH2O 16.3 μL, 模板2 μL.β-内酰胺酶类抗性基因的PCR扩增条件为:93 ℃预变性2 min;94 ℃变性30 s, 55 ℃退火30 s, 72 ℃延伸1.5 min, 30个循环;72 ℃延伸5 min.I型整合子的PCR扩增条件为:94 ℃预变性3 min;94 ℃变性30 s, 57 ℃退火30 s, 72 ℃延伸30 s, 44个循环;72 ℃延伸5 min.取5 μL PCR产物在200 V电压、1.5%琼脂糖凝胶浓度条件下进行核酸水平电泳.使用凝胶成像仪(Bio-Rad, America)拍照记录电泳结果, 确定特异性扩增片段.
| 表 1 β-内酰胺酶类抗性基因和Ⅰ型整合子引物序列和目的片段长度 Table 1 Primer sequences and target fragments of β-lactamase resistance genes and class I integron |
本研究考察3种外膜蛋白基因(ompA、ompC和ompF)和9种与接合转移相关的基因.按照功能可将这些与接合转移相关的基因分为四大类:编码性菌毛蛋白基因(trbC和traA)、供受体配对形成基因(trbBp和traF)、质粒转移及复制基因(trfAp和traJ)和整体调节基因(korA、korB、trbA).
使用TRNzol Universal(TIANGEN, China)试剂盒提取可接合转移菌株的RNA.运用RT-PCR技术考察可接合转移菌株外膜蛋白基因和接合转移相关基因的mRNA表达情况, 使用PrimeScriptTM RT Master Mix试剂盒(TaKaRa, Japan)将RNA逆转录为cDNA, 并将其作为模板进行PCR检测.外膜蛋白基因和接合转移相关基因的引物如表 2所示.PCR反应体系与2.3节所述相同, 反应条件为:95 ℃预变性5 min;95 ℃变性30 s, 55 ℃退火30 s, 72 ℃ 30 s, 35个循环;72 ℃延伸10 min.
| 表 2 外膜蛋白基因和接合转移相关基因引物序列和目的片段长度 Table 2 Primer sequences and target fragments of outer membrane proteins genes and conjugative transfer-related genes |
从5处景观水体分离出的216株头孢噻肟耐药菌中共筛选出12株可与大肠杆菌NK5449发生接合转移的供体菌, 占比为5.56%.单独从每处景观水体来看, 兴庆湖、丰庆湖、桃花潭、莲湖和思源湖中的可接合转移供体菌在其头孢噻肟耐药菌中的占比分别为4.35%、8.33%、4.35%、11.11%和2.50%.种属鉴定结果显示, 这12株菌属于大肠杆菌(Escherichia coli)、蜡状芽孢杆菌(Bacillus cereus)和维氏气单胞菌(Aeromonas veronii)(表 3).
| 表 3 供体菌种属鉴定结果 Table 3 Identification result of donor strains |
由图 1可知, 这12株供体菌都能与大肠杆菌NK5449发生接合转移, 但接合转移频率差别较大.大肠杆菌L414的接合转移频率最高, 可达3.07×10-3, 而大肠杆菌T418的接合转移频率则仅为5.86×10-7, 其余几株大肠杆菌(S422菌株、L424菌株、T413菌株、F405菌株)的接合转移频率为2.12×10-5~2.19×10-4.蜡状芽孢杆菌X424、L515、F428、X519与大肠杆菌NK5449的接合转移频率分别为8.50×10-7、2.05×10-7、5.97×10-8、3.95×10-8, 维氏气单胞菌F421、F424的接合转移频率分别为1.03×10-7和8.95×10-7.表 4列出了这些供体菌与大肠杆菌NK5449的接合转移频率统计结果.显而易见, 与蜡状芽孢杆菌和维氏气单胞菌相比, 大肠杆菌作为供体菌株更容易与大肠杆菌NK5449发生接合转移, 但大肠杆菌不同菌株的接合转移频率也有较大差异, 最大值与最小值竟相差4个数量级.
 |
| 图 1 供体菌与大肠杆菌NK5449的接合转移频率 Fig. 1 Conjugative transfer frequency of donor bacteria and Escherichia coli NK5449 |
| 表 4 供体菌与大肠杆菌NK5449接合转移频率的均值与标准差 Table 4 Mean and standard deviation of frequency of conjugative transfer from donor bacteria to Escherichia coli NK5449 |
以往人们认为细菌间的接合转移频率大约在10-5~10-4之间(方晔等, 2011), 但从本研究的结果来看, 细菌接合转移频率范围更宽广, 且受供体菌的影响很大.
3.3 可接合转移的耐头孢噻肟菌株质粒上抗性基因和I型整合子的分布在这12株可接合转移供体菌的质粒上, blaCTX-M和blaTEM基因的检出率均为58.33%(7/12), blaSHV基因的检出率为8.33%(1/12), 有2株菌未检出上述3种β-内酰胺酶类抗性基因中的任何1种.在有检出的10株菌中, β-内酰胺酶类抗性基因的构成如图 2所示, 有5株菌仅含有单一类型的β-内酰胺酶类抗性基因, 其中3株菌仅含有blaTEM基因, 2株菌仅含有blaCTX-M基因;其余5株菌均含有2种β-内酰胺酶类抗性基因, 其中4株含有blaCTX-M和blaTEM基因, 1株含有blaCTX-M和blaSHV基因.
 |
| 图 2 供体菌质粒上β-内酰胺酶类抗性基因的构成 Fig. 2 Proportions of β-lactamase resistance genes in plasmid of donor strains |
在这12株可接合转移耐头孢噻肟菌的质粒上全部检出了intI基因, 这表明I型整合子在可接合转移耐头孢噻肟菌株中普遍存在.整合子能够捕获外源性基因, 在抗生素抗性基因的水平转移中具有重要作用(Luigimaria et al., 2016), 本研究的结果证实了在头孢噻肟耐药菌中, β-内酰胺酶类抗性基因的接合转移也与I型整合子密切相关.
3.4 可接合转移供体菌株的外膜蛋白基因和接合转移相关基因mRNA表达在12株可接合转移的耐头孢噻肟菌株中, 外膜蛋白基因ompA、ompC和ompF的mRNA检出率分别为91.67%、83.33%、83.33%.从供体菌种属角度上来看, 在6株大肠杆菌和4株蜡状芽孢杆菌中, 3种外膜蛋白基因mRNA全部检出;而仅有1株维氏气单胞菌的ompA基因mRNA呈阳性(图 3).这表明可接合转移耐头孢噻肟菌株外膜蛋白基因的mRNA表达水平在很大程度上受到细菌种属的影响.
 |
| 图 3 供体菌中的外膜蛋白基因和与接合转移相关基因的mRNA表达 Fig. 3 mRNA expression of outer membrane proteins and conjugative transfer-related genes in donor strains |
在这12株供体菌中, 整体调节基因的mRNA表达全部为阴性, 仅有1株菌的质粒转移和复制调控基因mRNA为阳性, 而性菌毛蛋白编码基因和供受体配对形成调控基因的mRNA表达阳性率相对较多.对于每株供体菌而言, 在同一类别的接合转移相关基因中只有1种基因有mRNA表达.例如, 在性菌毛蛋白编码基因中, trbC基因mRNA为阳性, 而未检出traA基因mRNA;供受体配对形成调控基因中, trbBp基因mRNA呈阳性, 而traF基因mRNA则为阴性.
综合外膜蛋白基因和接合转移相关基因的mRNA检测结果来看, 外膜蛋白基因、性菌毛蛋白编码基因和供受体菌接合配对形成调控基因在供体菌株中的表达活跃, 这意味着头孢噻肟耐药菌主要通过性菌毛接触, 调节外膜通透性来实现耐药性质粒接合转移.
4 结论(Conclusions)1) 从西安市5处城市景观水体中分离出的216株头孢噻肟耐药菌, 有12株能通过接合将头孢噻肟耐药性转移到受体菌中.这些供体菌的种属为大肠杆菌、蜡状芽孢杆菌和维氏气单胞菌, 接合转移频率为3.95×10-8~3.07×10-3.
2) 在这12株可接合转移的耐头孢噻肟菌的质粒上, β-内酰胺酶类抗性基因blaCTX-M、blaTEM和blaSHV的检出率分别为58.33%、58.33%和8.33%, 全部检出了I型整合子.
3) 外膜蛋白基因(ompA、ompC、ompF)、性菌毛编码基因(trbC)和供受体菌接合配对形成调控基因(trbBp)在这些供体菌中具有较高的mRNA表达.
Alexandrino D A M, Mucha A P, Almeida C M R, et al. 2017. Biodegradation of the veterinary antibiotics enrofloxacin and ceftiofur and associated microbial community dynamics[J]. Science of the Total Environment, 581-582: 359-368. DOI:10.1016/j.scitotenv.2016.12.141 |
Antonenka U, Nlting C, Heesemann J, et al. 2005. Horizontal transfer of Yersinia high-pathogenicity island by the conjugative RP4 attB target-presenting shuttle plasmid[J]. Molecular Microbiology, 57(3): 727-734. DOI:10.1111/j.1365-2958.2005.04722.x |
Agnesa S L, Nicholas B, Roksana N D, et al. 2018. The interaction of TraW and TrbC is required to facilitate conjugation in F-like plasmids[J]. Biochemical and Biophysical Research Communications, 503: 2386-2392. DOI:10.1016/j.bbrc.2018.06.166 |
Delcour A H. 2009. Outer membrane permeability and antibiotic resistance[J]. Biochim Biophys Acta Proteins Proteom, 1794: 808-816. DOI:10.1016/j.bbapap.2008.11.005 |
Chen J B, Sun P Z, Zhang Y L, et al. 2016. Multiple roles of Cu(Ⅱ) in catalyzing hydrolysis and oxidation of β-lactam antibiotics[J]. Environ Science Technology, 50(22): 12156-12165. DOI:10.1021/acs.est.6b02702 |
方晔, 李向阳, 杨锦红, 等. 2011. 亚抑菌浓度三代头孢菌素对耐药质粒接合转移的影响[J]. 中国卫生检验杂志, 21(9): 2204-2206. |
Grahn A M, Haase J, Bamford D H, et al. 2000. Components of the RP4 conjugative transfer apparatus form an envelope structure bridging inner and outer membranes of donor cells:implications for related macromolecule transport systems[J]. Bacteriol, 182(6): 1564-1574. DOI:10.1128/JB.182.6.1564-1574.2000 |
何晓锋, 刘芳, 曹晋桂, 等. 2012. 多重耐药菌中Β-内酰胺酶基因监测[J]. 现代预防医学, 39(10): 97-99. |
Koebnik R, Locher K P, Van Gelder P. 2000. Structure and function of bacterial outer membrane proteins:Barrels in a nutshell[J]. Molecular Microbiology, 37(2): 239-253. DOI:10.1046/j.1365-2958.2000.01983.x |
Knopp M, Andersson D I. 2015. Amelioration of the fifitness costs of antibiotic resistance due to reduced outer membrane permeability by upregulation of alternative porins[J]. Molecular Biology Evolution, 32: 3252-3263. |
Luigimaria B, Klaus H, Pal J J, et al. 2016. Distribution of class 1 integrons in a highly impacted catchment[J]. Science of the Total Environment, 566-567: 1588-1594. DOI:10.1016/j.scitotenv.2016.06.054 |
Lopatkin A J, Huang S, Smith R P, et al. 2016. Antibiotics as a selective driver for conjugation dynamics[J]. Nature Microbiology, 1(6): 1-8. |
Lin W, Li S, Zhang S, et al. 2016. Reduction in horizontal transfer of conjugative plasmid by UV irradiation and low-level chlorination[J]. Water Research, 91: 331-338. |
Luo Y, Xu L, Rysz M, et al. 2011. Occurrence and transport of tetracycline, tulfonamide, quinolone, and macrolide antibiotics in the Haihe River basin, China[J]. Environmental Science & Technology, 45(5): 1827-1833. |
Li S, Shi W, Liu W, et al. 2018. A duodecennial national synthesis of antibiotics in China's major rivers and seas (2005-2016)[J]. The Science of the Total Environment, 615: 906-917. DOI:10.1016/j.scitotenv.2017.09.328 |
Östman M, Björlenius B, Fick J, et al. 2019. Effect of full-scale ozonation and pilot-scale granular activated carbon on the removal of biocides, antimycotics and antibiotics in a sewage treatment plant[J]. Science of the Total Environmental, 649: 1117-1123. DOI:10.1016/j.scitotenv.2018.08.382 |
Ozkanca R, Sahin N, Isik K, et al. 2002. The effect of toluidine blue on the survival, dormancy and outer membrane porin proteins (OmpC and OmpF) of Salmonella typhimurium LT2 in seawater[J]. Applied Microbiology, 92(6): 1097-1104. DOI:10.1046/j.1365-2672.2002.01642.x |
钱迪.2013.纳米二氧化钛对多重耐药质粒RP4接合转移的影响研究[D].合肥: 安徽大学.27-30
|
Ribeiro A R, Sures B, Schmidt T C. 2018. Cephalosporin antibiotics in the aquatic environment:a critical review of occurrence, fate, ecotoxicity and removal technologies[J]. Environmental Pollution, 241: 1153-1166. DOI:10.1016/j.envpol.2018.06.040 |
Spector J, Zakharov S, Lill Y, et al. 2010. Mobility of BtuB and OmpF in the Escherichia coli outer membrane:Implications for dynamic formation of a translocon complex[J]. Biophys, 99(12): 3880-3886. |
伍彬宁.2017.AHL——SdiA抑制大肠埃希菌质粒转移[D].广州: 广州中医药大学.2-3
|
汪庆, 罗义, 崔玉晓, 等. 2017. 离子液体[BMIm] [PF6]增强抗性质粒RP4介导的接合转移基因mRNA的表达水平[J]. 生态毒理学报, 12(3): 273-281. |
Yu X, Tang X, Zuo J, et al. 2016. Distribution and persistence of cephalosporins in cephalosporin producing wastewater using SPE and UPLC-MS/MS method[J]. Science of the Total Environmenal, 569: 23-30. |
Zatyka M, Bingle L, Jones A C, et al. 2001. Cooperativity between KorB and TrbA repressors of broad-host-range plasmid RK2[J]. Bacteriol, 183(3): 1022-1031. DOI:10.1128/JB.183.3.1022-1031.2001 |
朱健铭, 吴晋兰, 姜如金, 等. 2012. 多药耐药肺炎克雷伯菌噬菌体原/噬菌体、整合子、转座子、插入序列及质粒遗传标记分析[J]. 中华医院感染学杂志, 22(13): 2727-2730. |
Zhang Y, Gu A Z, Cen T, et al. 2018. Sub-inhibitory concentrations of heavy metals facilitate the horizontal transfer of plasmid-mediated antibiotic resistance genes in water environment[J]. Environmental Pollution, 237: 74-82. DOI:10.1016/j.envpol.2018.01.032 |
Zhang Y, Gu A Z, He M, et al. 2017. Subinhibitory concentrations of disinfectants promote the horizontal transfer of multidrug resistance genes within and across genera[J]. Environmental Science & Technology, 51(1): 570-580. |
 2020, Vol. 40
2020, Vol. 40


