2. 污染控制与资源化研究国家重点实验室, 南京 210023
2. State Key Laboratory of Pollution Control and Resources Reuse, Nanjing 210023
近年为了增加粮食产量, 越来越多的无机和有机氮肥被应用于农田, 而较低的氮肥利用率导致大量的氮流失, 并进入河流和湖泊(García-Díaz et al., 2017;Qin et al., 2019), 进而造成环境污染问题, 如湖泊富营养化(Dodds et al., 2016;Hou et al., 2018)、蓝藻水华暴发等(林玉清等, 2019).
目前, 反硝化和厌氧氨氧化被认为是水生生态系统中两个重要的微生物脱氮反应, 能通过产生N2和N2O来完成氮素去除(Spott et al., 2011;Long et al., 2012).其中, 反硝化作用是最主要的生物除氮反应, 占生态系统总氮去除量的50%以上(Dong et al., 2009), 厌氧氨氧化作用则占总氮去除量的0~35%(Hou et al., 2009).除此之外, 厌氧条件下三价铁还原耦合氨氧化(即铁氨氧化)反应是近年来新发现的微生物脱氮反应(Yang et al., 2012), 铁氨氧化(Feammox)反应是以N2、NO2-和NO3-为反应产物.早在2012年, Yang等(2012)就从热力学角度分析了铁氨氧化的可能, 同时使用同位素示踪技术在热带森林土壤中证明了铁氨氧化的存在.之后, 科研人员相继在多种自然生境中证明了这一过程的存在, 如水稻土、河岸带、河流沉积物、红树林湿地沉积物等(Ding et al., 2017; Ding et al., 2018;Ding et al., 2019;Guan et al., 2019).据估计, 铁氨氧化在水稻土和长江河口湿地的脱氮能力分别为8~61 kg · hm-2 · a-1和115~180 kg · hm-2 · a-1(Li et al., 2015;Ding et al., 2018).由此可见, 铁在生态系统的氮素循环机制中扮演着重要的角色.
太湖是我国第三大淡水湖, 随着周边农业集约化和工业的快速发展, 太湖的氮、磷流入量显著增加, 蓝藻水华全年出现, 且主要集中在北部, 如梅梁湾(Ma et al., 2016).蓝藻的出现可能为铁氨氧化反应提供有利的条件, 一方面蓝藻可以通过光合作用使水体产生富氧环境, 促进Fe(Ⅲ)的生成, 另一方面蓝藻衰亡分解后会显著增加水溶性有机碳和氨氮浓度(刘志迎等, 2019).而且前人研究表明, 有机物尤其是醌类物质, 能作为电子穿梭体促进铁氨氧化反应(Zhou et al., 2016).另外, 也有研究表明藻源性溶解有机质能与铁矿物发生反应, 可能会影响铁矿物的生物利用率(Bai et al., 2017).然而, 目前有关蓝藻暴发对太湖底泥中铁氨氧化速率的影响研究鲜见报道.
因此, 本研究选取太湖梅梁湾区域的十八湾作为研究地点, 通过15N的同位素示踪技术测定并比较聚藻区和无藻区底泥的铁氨氧化速率, 运用16S rRNA高通量测序技术分析底泥中微生物的群落结构, 研究富营养湖泊沉积物中的铁氨氧化过程及其对蓝藻暴发的响应规律, 这对进一步认识富营养化湖泊脱氮过程具有理论和实际意义.
2 材料与方法(Materials and methods) 2.1 研究区域及土壤样品的采集研究区域位于太湖梅梁湾的十八湾附近(31°31′39~31°32′30 N, 120°10′26~120°11′70 E)(图 1).通过柱状采泥器采集无藻区(W)和聚藻区(J1、J2、J3)的底泥, 共4个采样点, 其中, J1~J3采样点的藻密度越来越高, 叶绿素a浓度分别为0.128、0.193和0.205 mg · L-1.采样深度为0~30 cm, 采样时间是2019年9月.每个采样点采集3个样品, 共计12个样品.采集完成后, 将样品装入无菌塑料袋中, 并在4 h内运回实验室.到达实验室后, 去除样品中的碎石和杂物, 在氦气下将每个样品分为3份.第1份保存在4 ℃下用于土壤物理化学特征分析, 第2份用于同位素分析, 第3份储存在-80 ℃下用于分子微生物分析.
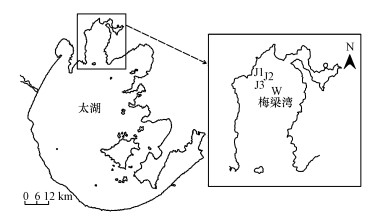 |
| 图 1 采样点位置图 Fig. 1 Location of sampling sites |
在60 ℃下干燥12 h测定底泥含水率.将冻干后的样品与去离子水以1 : 2.5(质量体积比, g/mL)混合, 使用pH计测量底泥pH.使用1 mol · L-1 HCl去除底泥中的无机碳后, 用元素分析仪(Elementar Vario MICRO, Germany)测定底泥中TOC的含量;使用2 mol · L-1 KCl溶液提取土壤中的NO-x-N和NH4+-N, 通过连续流分析仪(San++System, Skalar Analytic, Breda, The Netherlands)进行测定(Zhu et al., 2011);称取1.0 g土壤样品, 加入10 mL 0.5 mol · L-1 HCl进行提取, 采用紫外分光光度法在562 nm波长处测定Fe(Ⅱ)含量(Ding et al., 2017);称取1.0 g土壤样品, 加入5 mL 0.5 mol · L-1 HCl和0.25 mol · L-1盐酸羟胺提取, 同样采用紫外分光光度法在562 nm波长处测定总Fe含量, 叶绿素a的测定采用丙酮法(陈明华等, 2016).
2.3 同位素示踪培养将无菌厌氧去离子水和底泥样品以3 : 1(体积质量比, mL/g)的比例进行混合并摇匀, 制成均质泥浆, 然后通入高纯氦气以去除溶解氧, 在25 ℃下密封避光培养5 d以去除背景NO-x-N、NH4+-N和氧气.培养结束后取20 g均质泥浆加到150 mL血清瓶中, 加满厌氧去离子水, 并立即密封血清瓶.本研究进行2种处理:①控制组:添加厌氧去离子水;②处理组:添加 15NH4+, 添加的15N浓度为100 μmol · L-1.在同位素加入24 h后, 用100 μL饱和ZnCl2终止微生物活动, 并通过膜接口质谱仪(MIMS)测定30N2的浓度, 其中, 15NH4+处理组的30N2产生速率被认为是铁氨氧化速率(Yang et al., 2012).
2.4 微生物群落结构分析取0.5 g底泥样品, 通过Fast DNA Spin Kit(MP, Biomedicals, CA, USA)进行DNA的提取, 然后用Nanodrop 2000UV-Vis分光光度计(Thermo Scientific, USA)检测提取DNA的浓度和纯度.选取的细菌引物位于V4/V5高变区, 其中, 正向引物是515F(5′- GTG CCA GCM GCC GCG G-3′), 反向引物是907R(5′- CCG TCA ATT CMT TTR AGT TT-3′), 进行扩增(陈湜等, 2019).经过纯化后的PCR产物在Illumina MiSeq平台(美吉生物医药科技有限公司, 上海)进行测序.先通过Sickle软件将低质量的序列去除, 然后通过Mothur软件按照样品对测序数据进行筛分, 再根据Mothur软件提供的标准流程进行降噪处理, 对降噪数据进行对比分析, 最终获得底泥的微生物群落结构信息.
2.5 数据分析本研究中, 采用单因素方差分析(One Way ANOVA)来区分各样品的理化性质、铁氨氧化速率和细菌相对丰度之间的差异性;采用皮尔逊相关分析(Pearson Correlation)和邓肯(Duncan)法分别评价数据的相关性和显著性(显著性差异水平设置为p < 0.05);采用SPSS 17.0和Origin 9.0软件分别进行所有数据的处理和绘图制作.
3 结果与分析(Results and analysis) 3.1 底泥的物理化学性质不同区域底泥的物理化学性质如表 1所示.湖泊底泥的pH都偏碱性(7.26~7.43).底泥的叶绿素a含量有较大差异, 从最低的0.032 mg · L-1(W)到最高的0.205 mg · L-1(J3).不同区域底泥的NH4+-N和NO-x-N含量差异也较大, 分别为0.05~63.95 mg · kg-1和0.09~0.43 mg · kg-1.而聚藻区底泥的TOC含量显著高于无藻区(p < 0.05).二价铁的含量在不同藻密度的聚藻区底泥之间并没有明显差异(8.26~9.11 g · kg-1), 都高于无藻区.但无藻区底泥的三价铁含量(2.95 g · kg-1)高于聚藻区底泥(1.71~2.81 g · kg-1).
| 表 1 无藻区和聚藻区底泥的理化特征 Table 1 Physicochemical characteristics of sediments in algal free and algal accumulating areas |
本研究中, 15NH4+处理组的样品均检出了30N2的产生, 而控制组均未检出, 由此说明无藻区和聚藻区底泥中有铁氨氧化反应的发生(Ding et al., 2018).由图 2可知,铁氨氧化速率在无藻区和聚藻区之间呈现出显著差异, 无藻区底泥的铁氨氧化速率高达0.26 mg · kg-1 · d-1, 而聚藻区底泥的铁氨氧化速率为0.01(J1)~0.05 mg · kg-1 · d-1 (J3).在藻密度较高的区域(J2、J3)其底泥的铁氨氧化速率高于低藻密度区域(J1), 说明不同密度的蓝藻对铁氨氧化速率有影响.
 |
| 图 2 潜在的铁氨氧化速率(不同小写字母表示具有显著性差异(p < 0.05)) Fig. 2 Potential feammox rates |
在同位素示踪培养实验中发现了较明显的Fe(Ⅲ)还原和Fe(Ⅱ)氧化, 无论是无藻区还是聚藻区的底泥, 添加15NH4Cl的处理组的铁还原速率明显高于控制组(图 3, p < 0.05), 说明15NH4+的加入能促进Fe(Ⅲ)的还原.在15NH4+处理组中, 无藻区的三价铁还原速率为(0.286 ±0.006) g · kg-1 · d-1, 显著高于聚藻区的三价铁还原速率(p < 0.05).
 |
| 图 3 同位素示踪培养的底泥中三价铁还原速率(不同大小写字母表示具有显著性差异(p < 0.05)) Fig. 3 Fe(Ⅲ) reduction rates of the sediment slurries in the isotope tracer incubations |
高通量测序结果(图 4)表明, 检测到的主要铁还原菌属为Thiobacillus、Geobacter、Desulfobacca、Pseudomonas、Anaeromyxobacter和Desulfosporosinus.本研究中, 铁还原菌的相对丰度为3.25%~5.65%.与无藻区底泥相比(5.65%), 铁还原菌的相对丰度在聚藻区底泥(3.25%~4.44%)中略低, 表明蓝藻的暴发会降低铁还原菌的聚集程度.在所有的样品中, 铁还原菌Thiobacillus、Geobacter、Desulfobacca、Pseudomonas、Anaeromyxobacter和Desulfosporosinus的相对丰度分别为1.41%~4.06%、0.23%~0.68%、0.37%~0.52%、0.06%~0.37%、0.19%~0.27%、0.03%~0.09%.
 |
| 图 4 不同区域底泥中主要铁还原菌属 Fig. 4 The main iron reducing bacteria genera identified in different areas |
在厌氧培养期间, 15NH4+处理组中检测到30N2的产生, 说明淡水湖泊沉积物中发生了铁氨氧化反应.因为在厌氧条件下产生30N2的可能途径有:①直接从Feammox产生的N2;②Feammox产生的NO2-参与厌氧氨氧化;③Feammox生成的NO2-或NO3-参与反硝化(Li et al., 2015).无藻区的铁氨氧化速率明显高于聚藻区的铁氨氧化速率(图 2), 表明蓝藻的暴发不利于湖泊沉积物中铁氨氧化反应的发生.这可能是因为蓝藻暴发会大量消耗水体的溶解氧, 而低氧化还原电位条件下不利于Fe(Ⅲ)的生成, 这也可以从聚藻区(J1~J3)底泥中较低的Fe(Ⅲ)含量得到解释(表 1).此外, 前人研究表明, 铁氨氧化速率与Fe(Ⅲ)含量呈正相关(Li et al., 2015).这是因为一方面Fe(Ⅲ)是铁氨氧化反应的底物之一, 在反应中扮演电子受体的角色;另一方面, 丰富的Fe(Ⅲ)可能有利于铁氨氧化过程涉及的铁还原菌的生长(Ding et al., 2017).
前人研究认为, TOC含量高, 尤其是腐殖质中的醌类物质含量高, 可能有利于提高铁氨氧化速率(Zhou et al., 2016).但在本研究中, 铁氨氧化速率与TOC含量成显著负相关(r =-0.841, p < 0.01)(图 6).可能是因为蓝藻的大量衰亡提供了丰富的有机碳、S(Ⅱ)、SO42-等物质(乔煜琦等, 2018), 有机碳和还原态的有机硫可以与Fe(Ⅲ)反应, 导致Fe(Ⅲ)含量减少, 从而影响铁氨氧化反应.另外, 也有研究表明藻源性溶解有机质能与铁矿物发生反应, 可能会影响三价铁的生物利用率(Bai et al., 2017).除此之外, 有研究发现蓝藻会产生有毒的次级代谢产物, 如微囊藻毒素, 它能抑制细胞中蛋白磷酸酶活性从而消灭周围生物(Pimentel et al., 2014), 这些有毒的代谢物可能会影响铁氨氧化相关微生物的活性, 从而影响铁氨氧化反应.
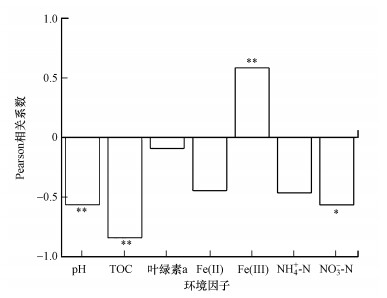 |
| 图 6 铁氨氧化速率与环境因子的相关性(*p < 0.05, **p < 0.01) Fig. 6 Correlations of Feammox rates with environmental factors |
本研究中, 三价铁还原速率与30N2产生速率存在显著的正相关关系(r=0.630, p < 0.05)(图 5), 这进一步证明了浅层富营养化湖泊沉积物中铁氨氧化反应的存在.然而在所有底泥样品中, 铁氨氧化速率与三价铁还原速率的摩尔比与铁氨氧化反应化学计量法有显著差异, 说明底泥中三价铁的还原并不完全来自于铁氨氧化(Ding et al., 2018), 根据理论计算, 仅有约1.63%~5.45%的三价铁还原与铁氨氧化相关, 这与前人在水稻土(Ding et al., 2018)和热带森林土壤(Yang et al., 2012)的研究结果类似.除此之外, 有机碳及其它还原性物质的氧化也会导致三价铁的还原(Kostka et al., 2002).
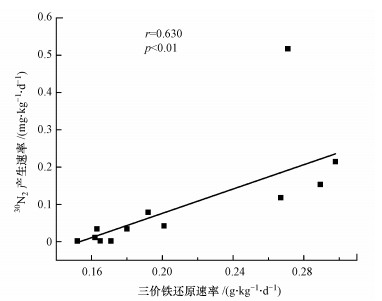 |
| 图 5 15NH4+处理组中三价铁还原速率与30N2的相关性 Fig. 5 Correlation between the reduction rates of iron and the 30N2 production rates in 15NH4+ treatment group |
高通量测序结果表明, 相较于聚藻区底泥(3.25%~4.44%), 无藻区底泥有较高丰度的铁还原菌(5.65%), 这说明蓝藻暴发不利于铁还原菌的生长.前人的研究表明, 土壤中铁还原菌丰度较高时, 铁氨氧化速率也会较高(Ding et al., 2019).这可能是因为铁还原菌会参与铁氨氧化反应中的三价铁还原(Li et al., 2015).目前研究较多的主要是Geobacter(地杆菌属), Geobacter、Thiobacillus等在底泥中检测出的铁还原菌能通过将有机物氧化与铁还原耦合来获得生长能量, 能够酶促还原Fe(Ⅲ)(Tan et al., 2005).除此之外, 铁还原菌还能参与氨的氧化(Li et al., 2015).尽管还原菌的功能菌目前能被直接鉴别的铁极少, 但铁还原菌与铁氨氧化速率的关系可能证明了铁还原菌在铁氨氧化反应发生中的重要性.铁氨氧化速率在无藻区和聚藻区之间的差异可能是多种因素综合作用的结果.迄今为止, 有关铁氨氧化的作用机制尚未完全弄清, 仍需要进一步的研究探索.
4.4 环境因子对铁氨氧化的影响不同的环境因子在生物脱氮过程中扮演着不同的角色, 本文探究了不同环境因子与铁氨氧化速率之间的相关性(图 6).pH被认为是影响微生物反应的重要因子, 因为根据铁氨氧化反应的热力学方程式, 铁氨氧化反应在偏酸性的条件下更容易发生(Kostka et al., 2002), 在本研究中铁氨氧化速率和pH之间呈现显著的负相关(r=-0.564, p < 0.01), 这说明pH越高, 越不利于铁氨氧化反应的发生.底泥的NH4+-N和叶绿素a含量与铁氨氧化速率之间没有显著的相关性.底泥的NOx--N与铁氨氧化速率呈现出显著的负相关性(r=-0.567, p < 0.05).底泥的TOC与铁氨氧化速率呈显著的负相关性(r=-0.841, p < 0.01).三价铁在铁氨氧化过程中具有极其重要的作用, 而在本研究中, Fe(Ⅲ)含量与铁氨氧化速率之间具有显著的正相关性(r=0.585, p < 0.01).然而, Fe(Ⅱ)含量与铁氨氧化速率并没有显著的相关性.
5 结论(Conclusions)1) 无藻区和聚藻区底泥的铁氨氧化速率之间具有显著的差异性, 无藻区底泥的铁氨氧化速率明显高于聚藻区底泥的铁氨氧化速率.
2) 铁氨氧化速率与三价铁还原速率呈显著正相关(r=0.630, p < 0.05), 同时表明丰富的三价铁有利于铁还原菌生长, 促进铁氨氧化反应.
3) 蓝藻的暴发会降低铁还原菌的相对丰度.
4) 底泥的铁氨氧化速率与pH、Fe(Ⅲ)和TOC均有显著的相关性.
Bai L, Cao C, Wang C, et al. 2017. Roles of phytoplankton- and macrophyte-derived dissolved organic matter in sulfamethazine adsorption on goethite[J]. Environmental Pollution, 230: 87-95. DOI:10.1016/j.envpol.2017.06.032 |
陈明华, 谢良国, 付志强, 等. 2016. 丙酮法和热乙醇法测定浮游植物叶绿素a的方法比对[J]. 环境监测管理与技术, 28(2): 46-48. |
陈湜, 李正魁, 覃云斌, 等. 2019. 农田沟道土壤中锰氨氧化(Mn-ANAMMOX)过程的探究[J]. 环境科学, 40(6): 458-463. |
Ding B J, Chen Z H, Li Z, et al. 2019. Nitrogen loss through anaerobic ammonium oxidation coupled to Iron reduction from ecosystem habitats in the Taihu estuary region[J]. Science of the Total Environment, 662(20): 600-606. |
Ding B J, Li Z, Qin Y B, et al. 2017. Nitrogen loss from anaerobic ammonium oxidation coupled to Iron(Ⅲ) reduction in a riparian zone[J]. Environmental Pollution, 231(1): 379-386. |
Ding L J, An X L, Li S, et al. 2018. Nitrogen loss through anaerobic ammonium oxidation coupled to iron reduction from paddy soils in a chronosequence[J]. Environmental Science & Technology, 48(18): 10641-10647. |
Dodds W, Smith V. 2016. Nitrogen, phosphorus, and eutrophication in streams[J]. Inland Waters, 6(2): 155-164. |
Dong L F, Smith C J, Papaspyrou S, et al. 2009. Changes in benthic denitrification, nitrate ammonification, and anammox process rates and nitrate and nitrite reductase gene abundances along an estuarine nutrient gradient (the Colne Estuary, United Kingdom)[J]. Applied and Environmental Microbiology, 75(10): 3171-3179. DOI:10.1128/AEM.02511-08 |
García-Díaz A, Bienes R, Blanca S, et al. 2017. Nitrogen losses in vineyards under different types of soil groundcover. A field runoff simulator approach in central Spain[J]. Agriculture, Ecosystems & Environment, 236: 256-267. |
an Q, Zhang Y L, Tao Y R, et al. 2019. Graphene functions as a conductive bridge to promote anaerobic ammonium oxidation coupled with iron reduction in mangrove sediment slurries[J]. Geoderma, 352: 181-184. DOI:10.1016/j.geoderma.2019.05.044 |
Hou L, Zheng Y L, Liu M, et al. 2009. Anaerobic ammonium oxidation and its contribution to nitrogen removal in China's coastal wetlands[J]. Scientific Reports, 5(1): 15621-15632. |
Hou X, Zhan X Y, Zhou F, et al. 2018. Detection and attribution of nitrogen runoff trend in China's croplands[J]. Environmental Pollution, 234: 270-278. DOI:10.1016/j.envpol.2017.11.052 |
Kostka J E, Britta G, Ellen P, et al. 2002. The rates and pathways of carbon oxidation in bioturbated saltmarsh sediments[J]. Limnology and Oceanography, 47(1): 230-240. |
Li H, Su Q J, Yang X R, et al. 2019. RNA stable isotope probing of potential Feammox population in paddy soil[J]. Environmental Science & Technology, 53(9): 4841-4849. |
Li X, Hou L J, Liu M, et al. 2015. Evidence of nitrogen loss from anaerobic ammonium oxidation coupled with ferric iron reduction in an intertidal wetland[J]. Environmental Science & Technology, 49(19): 11560-11568. |
林玉清, 焦聪聪, 施鸿昊, 等. 2019. 蓝藻暴发对莫愁湖水体和沉积物营养盐的影响[J]. 环境科学与技术, 42(2): 1-11. |
刘志迎, 许海, 詹旭, 等. 2019. 蓝藻水华对太湖水柱反硝化作用的影响[J]. 环境科学, 40(3): 1261-1269. |
Long A, Joshua H, Craig T, et al. 2012. Co-occurring anammox, denitrification, and codenitrification in agricultural soils[J]. Applied and Environmental Microbiology, 79(1): 168-176. |
Ma J R, Qin B Q, Paerl H W, et al. 2016. The persistence of cyanobacterial (Microcystis spp.) blooms throughout winter in Lake Taihu, China[J]. Limnology and Oceanography, 61(2): 711-722. DOI:10.1002/lno.10246 |
Pimentel S M, Alessandra G. 2014. Microbiology, microcystin production and regulation under nutrient stress conditions in toxic microcystis strains[J]. Applied and Environmental Microbiology, 80(18): 5836-5843. DOI:10.1128/AEM.01009-14 |
乔煜琦, 江海洋, 李星, 等. 2018. 蓝藻水华暴发和衰亡对太湖有色可溶性有机物的影响[J]. 湖泊科学, 30(4): 907-915. |
Qin Y B, Ding B J, Li Z K, et al. 2019. Variation of Feammox following ammonium fertilizer migration in a wheat-rice rotation area, Taihu Lake, China[J]. Environmental Pollution, 252(A): 119-127. |
Spott O, Rolf R, Claus F S, et al. 2011. Formation of hybrid N2O and hybrid N2 due to codenitrification:First review of a barely considered process of microbially mediated N-nitrosation[J]. Soil Biology and Biochemistry, 43(10): 1995-2011. DOI:10.1016/j.soilbio.2011.06.014 |
Tan W, Liu F. 2005. Adsorption and redox reactions of heavy metals on Fe-Mn nodules from Chinese soils[J]. Journals of Colloid and Interface Science, 284(2): 600-605. DOI:10.1016/j.jcis.2004.10.049 |
Yang W H, Weber K A, Silver W L, et al. 2012. Nitrogen loss from soil through anaerobic ammonium oxidation coupled to iron reduction[J]. Nature Geoscience, 5(8): 538-541. DOI:10.1038/ngeo1530 |
Zhou G, Yang X R, Li H, et al. 2016. Electron shuttles enhance anaerobic ammonium oxidation coupled to iron(Ⅲ) reduction[J]. Environmental Science & Technology, 50(17): 9298-9307. |
Zhu G, Wang S Y, Risgaard N, et al. 2011. Anaerobic ammonia oxidation in a fertilized paddy soil[J]. ISME, 5(12): 1905-1912. DOI:10.1038/ismej.2011.63 |
 2020, Vol. 40
2020, Vol. 40


