2. 广东省环境科学研究院, 广州 510045;
3. 生态环境部环境工程评估中心, 北京 100012;
4. 临沂市人民医院网络与信息部, 临沂 276000;
5. 山东师范大学地理与环境学院, 济南 250014
2. Guangdong Provincial Academy of Environmental Science, Guangzhou 510045;
3. Appraisal Center for Environment and Engineering, Ministry of Ecology and Environment, Beijing 100012;
4. Network Information Department, Linyi People's Hospital, Linyi 276000;
5. College of Geography and Environment, Shandong Normal University, Jinan 250014
随着我国经济快速发展和城市化进程的不断加快, 城市大气污染及其对人群健康的影响已成为倍受关注的公共环境与健康问题(方叠, 2014;Jing et al., 2018).城市大气污染与城市的人口密度、工业企业类别、能源种类与数量、季节、地理环境和气象条件等因素有关(鲍孟盈等, 2017).以化石燃料为主要能源的城市, 氮氧化物、硫氧化物和大气颗粒物(PM10、PM2.5)等是其主要大气污染物(陈军等, 2017), 其中, 大气颗粒物污染呈冬季比夏季严重, 采暖期较非采暖期严重的特征(刘林瑶, 2017).研究表明, 大气污染是影响暴露人群健康的主要环境危害因素之一(Davalos et al., 2017), 会对暴露人群的呼吸系统和心血管系统产生伤害, 并引发相关急性健康效应(李雯婧, 2016;Nathan et al., 2016)和慢性健康效应(Beelen et al., 2016).目前, 有关城市大气污染特征及对暴露人群健康影响的研究报道比较多(Yang et al., 2015;Wang et al., 2016;陈献, 2016;刘准等, 2018).但由于不同城市经济发展水平、大气污染物的种类、成分与污染水平、地理环境和气象条件等存在地区性差异, 以及受暴露人群的种族、性别、年龄构成和耐受程度等诸多因素的影响, 某个城市大气污染及其人群健康效应的研究结果不宜直接用于其他城市大气污染及其人群健康效应的评估(Su et al., 2019).因此, 有必要针对具体城市大气污染特征及其对人群健康影响开展研究, 为具体城市的大气污染控制决策、大气污染健康效应评估和易感人群健康防护等提供科学依据.
基于此, 本研究于2015年1月1日—12月31日收集山东省临沂市市区(简称“临沂市区”)一大型三级甲等综合医院的呼吸系统疾病和心脑血管疾病的门诊资料、临沂市区空气质量监测数据和气象数据, 采用国际通用的广义相加模型(Generalized Additive Model, 简称GAM)的时间序列分析方法, 研究临沂市区2015年主要大气污染物(PM2.5、PM10、SO2、NO2、CO、O3)的污染特征、污染物之间及污染物与气象因子之间的相关性和污染物对暴露人群呼吸、循环系统的急性健康效应及其在不同人群中的差异性, 以期为临沂市进一步控制大气污染物排放、针对性地采取大气污染应急响应和暴露人群健康防护措施提供科学依据.
2 资料与方法(Materials and methods) 2.1 大气污染物资料收集了临沂市区4个国控监测站点2015年全年(共365 d)的PM10、PM2.5、NO2、SO2、CO、O3共6种常规大气污染物浓度数据, 其中, 有8 d的日均浓度数据缺失, 采用天气后报网相应日均浓度数据作为补充, 具体缺失日期为:1月1日、11月11、12和14—18日.监测站点为鲁南制药厂、河东保险公司、沂河小区和新光毛纺厂.
大气污染物浓度确定:先计算出每个监测站点每日各污染物24 h算术平均浓度, 再平均4个站点各污染物浓度, 作为临沂市区各污染物的日均浓度.4个监测站点都位于市区内, 监测数据总体上能体现市区大气污染水平, 污染物日均浓度可作为临沂市区人群日均暴露水平.
2.2 气象资料选用位于临沂市区的中国气象局临沂站的气象观测数据, 包括逐时平均风速、相对湿度和温度, 并由逐时观测数据计算出逐日平均风速、相对湿度和温度.
2.3 疾病资料门诊数据来自临沂市区内唯一的三级甲等大型综合医院—临沂市人民医院(6000多员工, 共有5个分院, 分布于市区不同位置), 该医院门诊量占市区门诊量的80%以上, 样本量可以代表临沂市区的疾病情况(据临沂市卫健委), 并依据国际疾病分类标准(ICD10)对门诊资料进行分类整理, 统计了2015年1月1日—12月31日临沂市人民医院的呼吸、循环系统疾病日门诊人次.2015年该医院的总门诊量约为206万人次, 其中, 呼吸系统疾病总门诊量约为11万人次, 占总门诊量的5.5%, 循环系统疾病总门诊量约为5万人次, 占总门诊量的2.4%.选取循环系统疾病(I00-I99)和呼吸系统疾病(J00-J98)的门诊人次作为健康效应终点, 并剔除因意外、手术等人为原因造成的疾病.
2.4 数据质量控制大气污染物浓度数据来自临沂市4个国控监测站点, 缺少数据来自天气后报网, 每天数据公布前都经过环境保护部门的质量控制;气象数据来自中国气象局临沂站, 由气象部门进行质量审核控制;门诊数据资料按照国家三级甲等医院标准进行规范化管理和检查, 由医院网络-信息部专人负责管理, 并由门诊资料管理人员与信息管理人员对门诊数据进行筛选, 剔除门诊信息不全、重复门诊和诊断不清的病例.
2.4 数据分析方法 2.4.1 Spearman相关性分析采用国际广泛应用的R3.4.1软件对临沂市区主要大气污染物之间、气象要素之间及主要大气污染物与气象要素之间进行Spearman相关性分析, 确定它们之间的相关关系, 并运用该软件的有关模块建立GAM.
2.4.2 GAM构建方法大气污染物与呼吸、循环系统疾病之间多为非线性关系(Shen et al., 2017;Weichenthal et al., 2017), 且大气污染物浓度、气象因子和人群健康终点(门诊人次)为时序性数据, 可用时间序列的GAM拟合临沂市区大气污染物与暴露人群健康终点的非线性关系.相对临沂市区总人口而言, 居民每日门诊人次为服从泊松(Poisson)分布的小概率事件, 故可采用时间序列的广义相加Poisson回归模型进行模拟分析(Schwartz, 1994).为了避免非参数拟合出现计算量大、过度拟合等问题, 本研究采用时间序列半参数广义相加模型模拟分析2015年临沂市区主要大气污染物对呼吸、循环系统疾病每日门诊人次的影响.模型构建如下:
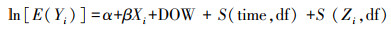
|
(1) |
式中, Yi为第i日呼吸或循环系统疾病就诊人数;E(Yi)是Yi的数学期望;α为截距;β为对应解释变量的回归系数, 表示某污染物每升高单位浓度时平均日门诊人次自然对数的变化量;Xi是第i日大气污染物的浓度;DOW (Day of the Week, 简称DOW)为“星期几”的哑变量;s为立方平滑样条函数, 用于控制长期趋势、季节变化和气象因子等混杂因素的影响;time为日历时间;Zi代表温度等气象因子;df是自由度.
自由度确定:时间立方平滑样条函数S(time, df)中的自由度df因确定方法不同而存在一定的差异(Kan et al., 2007;Wang et al., 2016), 一般采用7 df·a-1的自由度足以控制时间长期趋势和季节变化.本研究主要采用权威期刊报道的研究结果(Samet et al., 2000;Peng et al., 2006), 选择时间平滑函数中df为9, 并通过模型敏感性分析表明df≥9 a-1能够满足模型模拟稳定性要求.根据偏自相关函数(Partial Autocorrelation Function, PACF)方法(胥芹, 2017), 分别绘制温度、风速和相对湿度的PACF图, 获得气象因子平滑样条函数中温度、风速和相对湿度的自由度, 即温度df为4、风速df为5和相对湿度df为13.考虑到大气污染物对暴露人群健康效应的滞后效应(Pride et al., 2015;Zúñiga et al., 2016), 用污染物当天、1天前到7天前的浓度分别代入模型分析单日滞后效应, 即lag0, lag1, lag2, ……, lag7;用污染物浓度的前1天移动平均值到前7天的移动平均值分别代入模型分析累积滞后效应, 即lag01, lag02, ……, lag07.采用Akaike信息标准(AIC)作为评判标准, 对回归模型进行因子选择与优度检验.多污染物GAM模型模拟存在污染物间共线性、拟合结果标准差较大、不稳定和统计学意义较低等问题(Peters, 1997;Fusco et al., 2001;张莹等, 2015b;骆善彩等, 2016;Ren et al., 2017), 难以区分混合物中单个污染物的健康效应, 因此, 本研究只讨论单一污染物的暴露-反应关系.
2.4.3 危险度评估将式(1)计算获得的回归系数β代入式(2)(Tarvercarr et al., 2002), 计算大气污染物每增加10 μg·m-3时(CO每增加0.1 mg·m-3)呼吸或循环系统疾病门诊人次自然对数的相对风险(Relative Risk, 简称RR)改变的百分比, 即增加单位浓度(10 μg·m-3, CO的单位浓度为0.1 mg·m-3)的大气污染物导致呼吸、循环系统疾病健康效应终点(门诊人次)的超额危险度(Excess Risk, 简称ER)(李骊, 2015)或门诊人次增加百分比.
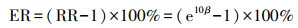
|
(2) |

|
(3) |
式中, ER为超额危险度;RR为相对风险, RR= e10β;β为回归系数;CI为ER的95%置信区间;SE为标准差.
分别根据式(2)、(3)计算ER及其95%置信区间(Confidence Intervals, CI), 检验所得结果是否存在显著性差异.
2.4.4 性别和年龄的分层分析将临沂市区2015年呼吸、循环系统疾病门诊人群按照性别分为男、女两个层次, 并根据就诊患者年龄特点将两种疾病门诊人群分为:≤6、7~17、18~40、41~65和≥66岁5个层次(兰天飞等, 2019).对6种大气污染物不同层次暴露人群分别进行时间序列的GAM分析, 探讨不同大气污染物对不同性别、不同年龄人群健康效应的影响.
2.4.5 统计软件采用Microsoft SQL Server 2012软件对收集的呼吸、循环系统疾病门诊数据进行筛查及简单的统计分析, 采用R3.4.1软件的mgcv、tseries、psych等程序包进行Spearman相关性分析和GAM建模(Tang et al., 2016).统计检验均采用双侧检验, 检验水准选为0.05, 当p < 0.05时, 表明污染物暴露健康效应具有统计学显著性.
3 结果(Results) 3.1 大气污染物和气象数据描述性统计表 1为临沂市区2015年6种大气污染物(PM2.5、PM10、SO2、NO2、CO、O3)和风速、温度、相对湿度3个气象指标的描述性统计分析.由表 1可以看出, 临沂市区2015年大气污染物PM2.5、PM10、SO2、NO2、O3、CO年均浓度(一年的日平均浓度的算术均值)分别为77.45 μg·m-3、145.32 μg·m-3、36.03 μg·m-3、48.03 μg·m-3、64.38 μg·m-3、1.36 mg·m-3. PM10和PM2.5远大于《环境空气质量标准》(GB3095—2012)规定的年均浓度二级标准限值, NO2整体污染水平稍高于二级标准限值40 μg·m-3, SO2低于年均浓度二级标准限值, CO和O3则低于一级小时平均浓度限值, 表明PM2.5和PM10为首要大气污染物, NO2、SO2次之, 而O3和CO浓度都较低.临沂市区2015年年平均温度为14.41 ℃, 日均温度为-5.27~31.58 ℃, 年平均相对湿度为63.60%, 日均相对湿度为23.74%~95.67%, 年平均风速为2.22 m·s-1, 日均风速变化范围为0.65~6.9 m·s-1, 气候特征为温带季风气候.
| 表 1 临沂市区2015年大气污染物和主要气象指标统计分析 Table 1 Statistical analysis of air pollutants and main weather indicators in Linyi City in 2015 |
图 1为2015年临沂市区大气污染物、气象指标和两个健康终点时间序列变化图.由图 1可以看出, 临沂市区2015年呼吸系统疾病每日总门诊人次的变化呈一定波动性, 循环系统疾病每日总门诊人次基本平稳;除臭氧外, 其他5种污染物浓度随时间变化呈一定波动性, 冬季污染物浓度水平较高;臭氧与气温两者的时序变化相一致, 温度高, 臭氧浓度高.
 |
| 图 1 2015年临沂市区大气污染物、气象指标和两个健康终点时间序列变化 Fig. 1 Time series change maps of air pollutants, weather indicators and two health endpoints in Linyi City in 2015 |
图 2为临沂市区6种大气污染物和两种健康终点随季节变化情况.6种大气污染物浓度水平都具有明显的季节性(3—5月为春季, 6—8月为夏季, 9—11月为秋季, 12月、1月、和2月为冬季), PM2.5、PM10、SO2、NO2和CO的浓度都呈夏季低、冬季高的特征, 而O3则反之.临沂市夏季气候潮湿多雨, 污染物易于去除和扩散, 浓度较低;春、秋季雨水减少, 污染物浓度稍有升高;冬季燃煤取暖排放和较少的雪、雨, 导致5种大气污染物浓度明显升高(王宝枝, 2016);临沂市夏季温度高、紫外线强、光化学反应强, 因而臭氧浓度高(聂丽曼等, 2018).
 |
| 图 2 临沂市区2015年大气污染物和两个健康终点季节平均变化曲线 Fig. 2 Lines of seasonal average changes of air pollutants and two health endpoints in Linyi City in 2015 |
呼吸系统疾病门诊人次随春、夏、秋、冬变化呈上升趋势, 与PM2.5、PM10、SO2、NO2、CO 5种污染物浓度的季节性变化趋势一致, 表明大气污染浓度越高, 呼吸系统疾病发病率越高, 呈正相关性;而循环系统疾病则随着春、夏、秋、冬变化呈小幅下降趋势, 说明循环系统疾病受大气污染季节性变化的影响小.
3.2 两种疾病门诊人次描述性统计表 2为临沂市区2015年不同性别和年龄的呼吸、循环系统疾病门诊人次分布情况.由表 2可以看出:①呼吸系统疾病门诊的年均门诊人次(一年的日平均门诊人次的算术均值)为310.8例, 其中, 男性189.3人, 女性121.5人, 男性患者数量明显多于女性;6岁以下儿童患者年均门诊人次为284人, 远多于其他年龄段, 约为年均门诊人次的50%, 有150名7~17岁少年患者, 大于66岁老年患者仅为39人, 人数最少;冬季就诊人数为363.6人, 高于其他季节(图 2), 春季就诊人数最少, 为278.4人.②循环系统疾病门诊的年均门诊人次为137.3例, 其中, 男性70.7人, 女性66.6人, 性别差异不明显;41~65岁中年患者为128人, 远多于其他年龄段, 约为年均门诊人次的52.2%, 有90名66岁以上的老年患者, 中年和老年患者的年均门诊人次之, 占总年均门诊人次的85.46%.可见, 呼吸系统疾病门诊人次呈现性别差异、年龄差异和季节性变化, 循环系统疾病门诊人次性别差异和季节性变化趋势都不明显, 但存在年龄差异性(图 2).
| 表 2 临沂市区2015年不同性别、不同年龄的呼吸和循环系统疾病门诊人次分布 Table 2 Distributions of outpatient visits of respiratory and circulatory disease for different gender and different age patient in Linyi City in 2015 |
图 3为大气污染物浓度和气象因素两两变量间的散点图、频率直方图、概率密度曲线和Spearman相关性分析结果.图 3对角线处为6种大气污染物和3个气象因子的频率直方图和概率密度曲线, 可以看出这些解释变量呈偏态分布, 不满足Pearson相关性分析条件(线性), 因此, 采用非参数Spearman法分析这些解释变量之间的相关性.图 3对角线右上方数据是解释变量间的相关系数, 其值越大, 说明两个解释变量间的相关程度越大.除O3外, 临沂市区5种大气污染物(PM10、CO、NO2、PM2.5、SO2)之间为显著正相关线性关系, 其中, PM10与PM2.5之间呈显著正相关, 两者的Spearman相关系数为0.92, 这与PM2.5是PM10的重要组成成分有很大关系(黄丽坤等, 2014);PM10、PM2.5与SO2、CO、NO2的相关系数为0.71~0.84(p < 0.001), 这可能与部分PM2.5源于SO2、NO2在大气中发生化学反应形成的气溶胶颗粒有关(杜欢欢, 2011);SO2与NO2、CO的相关系数分别为0.81、0.64, NO2与CO的相关系数为0.77, 也存在显著相关性, 提示它们可能来源于同一污染源(刘检琴, 2016);O3与其它污染物的相关性不显著, 这是由于夏季温度高、紫外线强、光化学反应强, 可产生较多臭氧, 而冬季则相反(聂丽曼等, 2018);风速、温度、相对湿度3个变量之间的Spearman相关系数比较小, 相关性不显著;O3与温度之间的Spearman相关系数为0.76(p < 0.001), 其他污染物与气象因素间呈负相关.由图 2可以看出, 临沂市区居民呼吸系统疾病门诊人次随春、夏、秋、冬季节的变化呈上升趋势, 这与PM2.5、PM10、SO2、NO2、CO 5种污染物浓度的季节性变化趋势一致, 呈现明显的正相关性;而循环系统疾病则随着春、夏、秋、冬季节的变化呈小幅下降趋势, 循环系统疾病受大气污染季节性变化的影响小.因此, 5种大气污染物之间、臭氧与气温之间和呼吸系统疾病门诊人次与5种大气污染物之间都存在显著的相关关系.
 |
| 图 3 解释变量散点图、频率直方图、概率密度曲线及Spearman相关系数(“***”表示极为显著, “**”表示高度显著, “*”表示显著, “·”表示不太显著, 没有记号为不显著) Fig. 3 Scatter diagram, frequency histogram, probability density line and Spearman correlation coefficient for explanatory variables |
图 4分别为临沂市区大气污染物PM2.5、PM10、SO2、NO2、CO和O3浓度每升高10 μg·m-3(CO为每升高0.1 mg·m-3)时每日呼吸、循环系统疾病人次自然对数的相对风险(RR)改变的百分比, 即6种污染物每升高单位浓度时呼吸、循环系统疾病门诊人次的ER及其95%置信区间(CI).
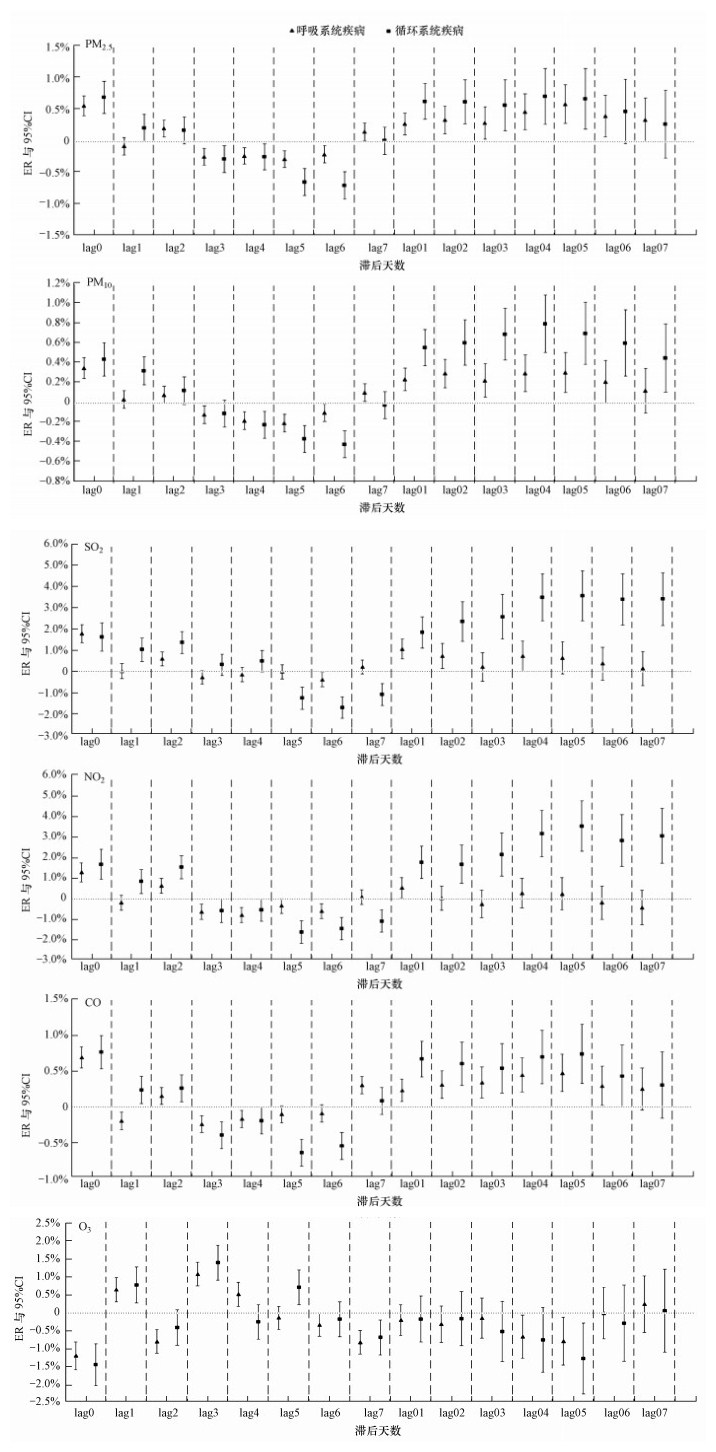 |
| 图 4 污染物每升高单位浓度呼吸、循环系统疾病日门诊人次的ER及其95%CI Fig. 4 Excess risk and its 95% confidence intervals of daily outpatient visits of respiratory and circulatory system diseases when increasing per unit concentration of pollutant |
图 4中标识为PM2.5的图是不同滞后天数时临沂市区PM2.5每升高10 μg·m-3引起每日呼吸、循环系统疾病门诊人次的ER值及其95%CI.对于呼吸系统疾病门诊, PM2.5日均浓度每升高10 μg·m-3, 单日滞后效应每日门诊人次的ER值只有在lag0和lag7有统计学意义, 最佳滞后天数为lag0(ER最大, 且有统计学意义), 此时门诊人次增加0.57%(95%CI:0.41%~0.73%);累计滞后效应每日门诊人次的ER值从lag01~lag06都有统计意义, ER最大值出现在lag05, 此时门诊人次增加0.60%(95%CI:0.29%~0.91%).对于循环系统疾病门诊, PM2.5日均浓度每升高10 μg·m-3, 单日滞后效应每日门诊人次的ER值只有在lag0有统计学意义, 此时门诊人次增加0.71%(95%CI:0.45%~0.96%);累计滞后效应门诊人次的ER值从lag01~lag05都有统计意义, ER最大值出现在lag04, 此时门诊人次增加0.72%(95%CI:0.28%~1.16%).其余5种污染物每升高单位浓度引起呼吸、循环系统疾病门诊人次的ER值及95%CI和最佳滞后天数列于表 3.
| 表 3 污染物在最佳滞后天数下每增加单位浓度引起呼吸、循环系统疾病日门诊人次的ER值及其95%CI Table 3 The ER and its 95% confidence intervals of daily outpatient visits of respiratory and circulatory system disease when increasing per unit concentration of pollutant at best lag time |
由表 3可以看出, 对于呼吸、循环系统疾病而言, PM2.5、PM10、SO2、NO2和CO 5种污染物的最佳单日滞后效应均在滞后当天(lag0), 相应的呼吸、循环系统疾病门诊人次的ER值最大, 且具有统计学意义(p < 0.05);O3的最佳单日滞后效应在第4 d(lag3), 相应的呼吸、循环系统疾病门诊人次的ER值最大, 且具有统计学意义(p < 0.05).对呼吸系统疾病而言, SO2和NO2的最佳累积滞后效应均在滞后2 d(lag01), PM2.5和CO的最佳累积滞后效应均在滞后6 d(lag05), PM10和O3累积滞后效应无统计学意义.对于循环系统疾病而言, PM2.5和PM10最佳累积滞后效应均在滞后5 d(lag04), SO2、NO2和CO的最佳累积滞后效应均在滞后6 d(lag05), O3累积滞后效应无统计学意义.
3.5 GAM模型分层分析结果 3.5.1 基于性别分层的分析结果基于上述单个污染物的最大效应(ER最大)及其最佳滞后日期(单日或累积), 进一步分析6种污染物每增加单位浓度对不同性别人群的呼吸、循环系统疾病门诊人次的ER影响, 结果见表 4.由表 4可以看出, 对呼吸系统疾病而言, 除SO2外, 其他5种污染物对男性呼吸系统疾病门诊人次的ER影响较女性显著, PM2.5、PM10、NO2、CO、O3浓度每增加单位浓度, 男性呼吸系统疾病门诊人次增加的百分比分别为0.67%、0.44%、1.41%、0.76%和1.25%.对循环系统疾病而言, 除SO2和NO2外, 其他4种污染物对男性循环系统疾病的健康影响较女性明显, PM2.5、PM10、CO、O3浓度每增加单位浓度, 男性循环系统疾病门诊人次增加的百分比分别为0.77%、0.80%、0.96%和1.65%, 而SO2和NO2浓度每升高10 μg·m-3, 女性循环系统疾病门诊人次增加的百分比分别为3.73%、3.88%, 高于男性的循环系统疾病门诊人次的增加量.可见, PM2.5、PM10、CO、O3对呼吸、循环系统疾病门诊人次的影响, 均表现为男性门诊人次的ER均大于女性;SO2对女性呼吸、循环系统疾病门诊人次的影响均高于男性;NO2对男性呼吸系统疾病门诊人次的ER值大于女性的效应值, 但对循环系统疾病门诊人次则表现为相反的趋势, 并且具有统计学意义.
| 表 4 污染物增加单位浓度对不同性别人群呼吸、循环系统疾病日门诊人次的ER及其95%CI的影响* Table 4 Effect of per unit concentration increase of pollutant on the ER and its 95% CI of daily outpatient visits of respiratory and circulatory disease in different gender groups |
基于上述单个污染物的最大效应(ER最大)及其最佳滞后日期(单日或累积), 分析了6种污染物每增加单位浓度对不同年龄层次人群的呼吸、循环系统疾病门诊人次的ER影响, 分析结果见表 5.由表 5可以看出, 对呼吸系统疾病而言, 除O3外, 其余5种污染物对少年(7~17岁)门诊人次ER的影响最大, 对青年(18~40岁)、中年(41~65岁)和儿童(≤6岁)门诊人次ER的影响较大, 且不同污染物对3个年龄段人群的影响存在差异, 对老年(≥66岁)人群的影响没有统计学意义;PM2.5、PM10、SO2、NO2、CO浓度每升高单位浓度, 少年呼吸系统疾病门诊人次增加的百分比分别为1.67%、0.76%、3.68%、3.28%、1.33%.对循环系统而言, 除O3外, 其余5种污染物对儿童、少年和青年的循环系统疾病门诊人次ER的影响无统计学意义;6种污染物对中年(41~65岁)的循环系统疾病门诊人次的ER均比对老年大, 且均有统计学意义, PM2.5、PM10、SO2、NO2、CO、O3浓度每升高单位浓度, 导致中年人群循环系统疾病门诊人次分别增加0.88%、0.92%、3.86%、3.92%、0.9%、1.33%.
| 表 5 污染物每增加单位浓度对不同年龄段人群呼吸、循环系统疾病日门诊人次的ER值及其95%CI的影响 Table 5 Effect of per unit concentration increaseof pollutant on the ER and its 95%CI of daily outpatient visits of respiratory and circulatory disease in different age groups |
由表 3可以看出, 对于呼吸、循环系统疾病门诊, O3最佳单日滞后效应(ER值最大)出现在第4 d(lag3), 其他5种污染物的最佳单日滞后效应出现在当天(lag0);O3暴露累积效应无统计意义, SO2、NO2两种气体的最佳累积滞后效应(ER值最大)出现在次日(lag01), PM2.5、PM10、CO 3种污染物的最佳累积滞后效应出现在第5、6 d(lag04、lag05).①就滞后时间而言, 本研究的PM2.5和PM10浓度高, 急性健康效应时间短, 导致最佳单日滞后效应出现在当日, SO2、NO2、CO 3种有毒气体的浓度虽较低, 但3种气体毒性大, 最佳单日滞后效应也出现在当日, 臭氧浓度为64.38 μg·m-3且低于一级限值(100 μg·m-3), 最佳单日滞后效应出现在第4 d;SO2、NO2最佳累积滞后效应出现在次日, 表明两种毒性气体的毒性效应快, 其他4种污染物的最佳累积滞后效应时间较长.②就呼吸、循环系统疾病门诊人次的ER值大小而言, PM2.5和PM10单日滞后效应的ER小于累积滞后效应的ER, 但相差较小(表 3), 表明颗粒物累积滞后效应不明显, 可能是模拟拟合的时长较短(7 d), 还没有达到颗粒物累积毒性效应所需的时间;PM2.5对循环系统滞后效应的ER大于对呼吸系统的ER(表 3), 说明颗粒物中, 尤其是PM2.5中的有害物质进入循环系统后毒性效应更强(薛树娟, 2012;张林林, 2017);SO2、NO2和O3 3种污染物对呼吸、循环系统的ER都大(表 3), 表明了3种物质的化学毒性对健康影响的主导作用, 尤其是SO2和NO2这两种物质对循环系统疾病累积滞后效应的ER分别达到3.55%和3.54%, 且远高于对呼吸系统疾病累积滞后效应的ER.这一方面是因为这两种气体容易对呼吸道粘膜产生氧化应激刺激损伤(Health et al., 1994), 甚至使肺泡上皮细胞死亡(Persinger et al., 2002), 导致呼吸系统产生急性毒性效应;另一方面说明这两种气体进入循环系统后与组织液或组织细胞作用, 导致循环系统疾病的风险加大(王任洪, 2015).③对于呼吸系统疾病门诊人次, SO2、NO2和CO 3种污染物的单日滞后效应的ER大于累积效应的ER(表 3), 而对循环系统疾病门诊人次, 这3种污染物的单日滞后效应的ER小于累积效应的ER(表 3), 表明较低浓度的这3种有毒气体对呼吸系统急性毒性效应强, 对循环系统的急性效应较弱, 累积毒性效应强.有研究显示, NO2与呼吸道疾病住院人数的相关性最大, 而不是大气颗粒物(Pannullo et al., 2017), 这与本研究中NO2对呼吸系统疾病门诊人次的ER高于颗粒物的ER相一致, 表明NO2的毒性效应强于颗粒物.由于污染物的毒性、暴露特征(水平、时间、频率)、暴露人群特征(年龄、性别和体重等)和环境条件, 以及模型中污染物的同源性和共线性等因素会影响最佳滞后效应的出现时间和ER值的大小, 因此, 这6种大气污染物对呼吸、循环系统疾病的暴露-健康效应, 相关研究结果存在一定的差异性.例如, 路凤等(2017)研究显示, PM2.5、PM10、SO2和NO2对呼吸系统疾病的最佳单日滞后效应都出现在当天(log0), 而骆善彩等(2016)研究表明这4种污染物对呼吸系统疾病的最佳单日滞后效应分别出现在log0、log4、log3和log0, 其他学者的研究与这两个研究结果也存在较大的差异(陶燕等, 2013;Nhung et al., 2018;张文增等, 2017;张莹等, 2014;2015a;蒋琴琴等, 2017;马利刚等, 2017;Dehghan et al., 2018;王荀等, 2019).但从这些研究结果可以看出, 污染物浓度高, 单日滞后时间短, 大部分研究结果报道的单日滞后效应最大值出现的时间都≤3 d.另外, 不同研究人员建立模型时考虑的因素及相关参数的确定存在差异, 会影响污染物健康效应的最佳滞后时间和ER值的大小.比如, 有的模型考虑“星期几”、“假日效应”和“流感爆发周”(胥芹, 2017), 有的模型未考虑假日效应和流感爆发等因素(陈献, 2016), 气象因素及其样条函数与自由度的选择也存在较大差异(于晓洁, 2011;董英, 2006);另外, 不同的地理环境和气象条件等因素也会影响模拟的结果(李骊, 2015;董继元等, 2016).
4.2 性别和年龄分层影响分析本研究显示(表 4):就呼吸、循环系统疾病而言, PM2.5、PM10、CO、O3对男性的健康效应(门诊人次的ER值大小)均大于对女性的健康效应, 这与Granados-Canal等的研究结果一致(Granados-Canal et al., 2005;Phung et al., 2016), SO2对女性的健康效应值均高于对男性的健康效应值, 这也与有关研究结果一致(Schwartz et al., 1996;王艳等, 2008), 显示女性对SO2更为敏感, 而NO2对男性呼吸系统疾病门诊人次的ER大于对女性的, 但对循环系统疾病门诊人次的ER则反之, 且具有统计学意义.关于NO2对不同性别人群呼吸系统急性健康效应的影响目前还存在争议, 有关文献研究结果显示女性对NO2的敏感程度略高于男性(Peng et al., 2006;王艳等, 2008;Phung et al., 2016), 而本文研究结果和相关文献(Granados-Canal et al., 2005)的研究结果显示男性对NO2更为敏感.另外, 关于PM10、NO2和SO2 3种单个污染物对不同性别人群的健康效应出现相反的研究结果, 有文献报道了这3种污染物对女性呼吸系统疾病门诊量影响的OR值(Odds Ratio)略高于男性, 但未发现不同性别之间的差异具有统计学意义(路凤等, 2017);也有文献报道这3种单个污染物对女性的影响较男性明显, 且具有统计学意义(王艳等, 2008).有研究显示(陶燕等, 2013), PM10和NO2对女性的影响较男性显著, SO2对男性的影响较女性显著.伊朗的Arak城市PM2.5、PM10、SO2、NO2、CO、O3 6种大气污染物对男性呼吸系统疾病入院人次的影响明显高于女性, 对循环系统疾病入院人次的影响无性别差异(Vahedian et al., 2017a;2017b).因此, 大气污染物对不同性别人群的健康效应具有一定的差异性和复杂性.差异性可能源于男女激素状态不同会导致血管扩张功能的差异(Prisby et al., 2008), 或男女肺生长和功能下降速率的差异会影响发生呼吸道炎症的差异(Hermes et al., 2006;Sood et al., 2008), 从而导致大气污染物对男女呼吸、循环系统健康效应不同.此外, 大气细颗粒物在女性肺中的沉积量比男性大, 导致女性更易患呼吸道疾病(Kim et al., 2006;Mitsakou et al., 2007).复杂性表现在不同性别人群的实际暴露环境及暴露特征、职业特征、吸烟行为、文化程度和种族等方面存在较大差异性, 会影响大气污染物暴露健康效应(Weichenthal et al., 2014).比如, 大气污染可使出租车驾驶员的循环系统疾病或呼吸系统疾病死亡率明显高于其他人群(Wu et al., 2010;Khanjani et al., 2012).因此, 有关影响大气污染物暴露的呼吸、循环系统疾病的这些修饰效应有待进一步分析研究.
本研究显示(表 5):①对呼吸系统疾病而言, 除O3外, 其余5种污染物对少年(7~17岁)的健康效应最大, 对青年(18~40岁)、中年(41~65岁)和儿童(≤6岁)的健康效应较大, 且不同污染物对3个年龄段人群的健康效应存在差异, 对老年(≥66岁)人群的影响没有统计学意义;对循环系统疾病而言, 除O3外, 其他5种污染物对儿童、少年和青年的健康效应影响没有统计学意义, 6种污染物对中年(41~65岁)循环系统疾病门诊人次的ER值均比老年的ER值大, 且均有统计学意义.②对于呼吸系统疾病而言, 相关研究显示, 儿童(≤14岁)和老年人(≥65岁)为大气污染物暴露健康效应的敏感人群或脆弱人群(Ko et al., 2007;孙兆彬等, 2010;陶燕等, 2013;张莹等, 2014;胥芹, 2017;姜彩霞等, 2018), 这与儿童、老年人的体质较弱有关(王艳等, 2008), 更易受到大气污染物影响.但本研究及相关研究(谷少华等, 2015;Phung et al., 2016)显示老年人不属于敏感人群, 儿童属于敏感人群, 可能与本研究及相关研究(谷少华等, 2015;Phung et al., 2016)的老年病例数过少有关, 也有可能是人群年龄分段不同造成的, 大部分研究将暴露人群年龄段分为≤14岁、15~54岁和≥65岁(张莹等, 2014;陶燕等, 2013;张林林, 2017;姜彩霞等, 2018).③本研究显示未成年人(≤17岁)呼吸系统对大气污染物的急性效应敏感, 循环系统不敏感, 表现在呼吸系统的最大健康效应滞后时间短, 而中年人和老年人则相反(表 5).原因可能是未成年人年龄小, 暴露累积时间较短, 污染物在循环系统中累积量小, 循环系统不敏感;中、老年人年龄大, 暴露累积时间相对较长, 呼吸体系对大气污染物不敏感(张燕萍等, 2008;徐清云等, 2013), 循环系统毒物累积毒性效应随暴露时间的延长而增大, 导致就诊循环系统门诊的中、老年人人数增多.当然, 也有研究报道≥65岁老人属于最敏感人群, ≤14儿童为最不敏感人群, 例如, 在韩国7个城市医院呼吸科哮喘急诊量与大气污染物暴露关系的研究中发现, ≥65岁老人属于最敏感人群, ≤14岁儿童为最不敏感人群(Park et al., 2013);北京市SO2、NO2和PM10 3种污染物对≥65岁老人心血管急诊人次的影响高于其他人群(Ma et al., 2017);土耳其伊斯坦堡尔≥65岁老人呼吸系统对SO2、NO2和PM10 3种污染物敏感, 而0~14岁儿童对3种污染物不敏感(Çapraz et al., 2017);长春市的≤14岁儿童对6种大气污染物最不敏感, ≥65岁老人属于最敏感人群(张林林, 2017).另外, 张燕萍等(2008)研究了空气颗粒物污染对0~5岁、5~10岁、11~15岁、16~6 4岁和≥65岁等5个年龄组人群呼吸系统疾病每日住院率的影响, 结果发现, 低剂量范围(暴露浓度较低)对5岁以下儿童和65岁以上老人影响较大, 而高剂量范围(如采暖季节), 则对5~15岁少年影响较大, 这一方面表明5岁以下儿童和老人的呼吸系统和免疫系统比较脆弱, 对大气污染物敏感(Cinar et al., 2012), 另一方面说明5~15岁少年户外活动受季节影响相对较小.有关研究显示(Cinar et al., 2012), 婴儿的肺、免疫系统和大脑还不成熟, 直到大约6岁时才快速发育, 比较脆弱, 难以抵御大气污染物毒性的影响;与成人相比, 相对于儿童的体重, 儿童的呼吸频率和呼吸空气量更多, 会吸入比较多的污染物;儿童和少年倾向于花更多的时间在户外做剧烈的活动, 比如运动, 所以他们呼吸的户外空气量比成年人多, 吸入污染空气的量较多.因此, ≤17岁的未成年人呼吸系统容易受到大气污染物的伤害, 出现各种呼吸系统、脑系统和免疫系统疾病, 以及非酒精型脂肪肝.而对于大于65岁的老年人, 其呼吸、循环系统的生理机能呈下降趋势, 表现为身体脆弱或虚弱, 免疫系统对外源性危害对抗能力下降, 或呼吸、循环系统已有疾病, 以及较长时间受到大气污染物伤害而产生的累积效应, 使得老年人成为大气污染物的易感人群(Eckel et al., 2012;Simoni et al., 2015).可见, 不同年龄段人群的大气污染物暴露健康效应与实际暴露水平、污染物暴露的敏感性(人群长期暴露敏感性变差, 清洁空气环境下的人比较敏感)、年龄生理特点和年龄分组情况等因素有关(张燕萍等, 2008;Samoli et al., 2008;李沛, 2016).
4.3 暴露-反应模型构建对模拟结果影响分析大气污染物暴露-反应模型经历了从采用广义线性模型(Wedderburn, 1974)拟合响应变量(如暴露健康效应)与多个解释变量(如多种污染物暴露水平)之间的线性关系, 到应用广义相加模型(Schwartz, 1994)拟合响应变量与解释变量之间的非线性关系, 并控制长期效应和气象因素等混杂因子, 再到利用广义相加混合模型(Generalized Additive Mixed Model)消除观察序列数据(如日门诊人次)的非独立性(张姣艳, 2013), 以获取可靠的参数估计值, 从而更为准确地阐明响应变量与解释变量之间的复杂关系(Complicated relationship between explanatory variables and response variables).对于大气污染物暴露-反应广义相加模型, 门诊人次、住院率和死亡率等健康效应作为模型中的响应变量, 污染物浓度水平作为线性变量, 假日效应、星期几效应和季节性流感等作为哑变量, 长期效应和季节变化趋势与气象因素作为非线性混杂因素纳入模型中.由于不同研究人员在模型建立过程中存在解释变量的筛选(尤其是相关性的解释变量)、哑变量的选择、混杂因素样条函数的选择及其自由度的确定、时间序列响应变量的非独立判断与否、实际暴露情况和人群特征的差异性等不同, 因此, 有关大气污染物暴露-反应关系的研究结果或结论会存在一定的差异(Peng et al., 2006).
另外, 空气中存在花粉颗粒、真菌孢子和流行病毒等不可测量的生物混杂因素对大气污染物暴露-反应关系会产生影响(Rosas et al., 1998;Lee et al., 2006);多种污染混合物(Multi-pollutant mixtures)、多种暴露(Multiple exposures, 如职业环境与非职业环境)、地理环境(包括城市建构筑物特征)、极端天气、社会经济条件(Socio-economic conditions)和生活方式等多因素会影响大气污染物暴露健康效应, 不仅增加了模型的复杂性(Jennifer et al., 2018), 也给模型模拟和预测带来了一定的不确定性, 促使大气污染物暴露健康模型及其求解方法朝着多维度、非线性、多种统计分析手段的方向发展(Stafoggia et al., 2017).
本研究建立的临沂市区主要大气污染物暴露-反应模型, 受制于原始数据信息内容不够全面的限制, 未能考虑“流感效应”对模型模拟结果的影响, 也未能考虑颗粒污染物的形态、组成和毒性, 以及暴露人群的实际暴露时间和暴露频率, 因此, 需要进一步考虑更为全面的因素完善模型, 用以准确地模拟预测临沂市区大气污染物的暴露-反应关系, 为临沂市大气污染防治和易感人群的健康防护提供科学依据.
5 结论(Conclusions)1) 临沂市区2015年6种大气污染物PM2.5、PM10、SO2、NO2、CO、O3存在不同程度的污染和季节性变化.PM2.5、PM10污染程度最严重, 其次为NO2, SO2, 而O3和CO污染较轻.O3浓度呈夏季高、冬季低的特点, 其它5种大气污染物浓度则相反.
2) 临沂市区的大气污染物和主要气象指标基本都呈偏态分布.PM2.5、PM10、SO2、NO2、CO 5种大气污染物之间呈显著正相关, 与气象因素之间呈负相关性.风速、温度、相对湿度3个变量之间的Spearman相关系数都较小.O3与温度呈显著正相关.
3) 临沂市区居民呼吸系统疾病门诊人次明显大于循环系统疾病门诊人次.呼吸系统疾病冬季门诊人次明显高于其他季节, 男性患者数量明显多于女性, 6岁以下儿童患者数量远高于其他年龄段患者数量.循环系统疾病门诊人次没有明显的季节和性别变化趋势, 41~65岁中年患者远高于其他年龄段.
4) 6种大气污染物对呼吸、循环系统疾病门诊人次的影响存在滞后效应.不同污染物对呼吸、循环系统疾病门诊人次的最佳滞后效应存在一定差异性, 表现在门诊人次的ER最大值出现的时间和大小不同.健康终点、污染物毒性及其毒性机理、暴露特征和模型组成结构等因素的差异性使得污染物暴露健康效应的大小和最佳滞后效应时间不同.
5) 6种大气污染物对不同性别、不同年龄组人群的呼吸、循环系统的健康效应不同, 受到种族、职业、生活习惯、生理和分组方式等因素的影响.
6) 大气污染物的实际暴露情况、暴露人群特征、回归模型的解释变量、哑变量和混杂因素及相关参数的选择确定方法等存在差异性, 使得诸多大气污染物暴露健康效应的研究结果不同.
Abe T, Tokuda Y, Ohde S, et al. 2009. The relationship of short-term air pollution and weather to ED visits for asthma in Japan[J]. American Journal of Emergency Medicine, 27(2): 153-159. |
Dehghan A, Khanjani N, Bahrampour A, et al. 2018. The relation between air pollution and respiratory deaths in Tehran, Iran- using generalized additive models[J]. BMC Pulmonary Medicine, 18: 49. |
鲍孟盈, 曹芳, 刘寿东, 等. 2017. 苏州郊区主要大气污染物的演变特征及其影响因素研究[J]. 生态环境学报, 26(1): 119-128. |
Beelen R, Raaschou-Nielsen O, Stafoggia M, et al. 2014. Effects of long-term exposure to air pollution on natural-cause mortality:an analysis of 22 European cohorts within the multicentre ESCAPE project[J]. Lancet, 383(9919): 785-795. |
Çapraz Ö, Deniz A, Doǧan N. 2017. Effects of air pollution on respiratory hospital admissions in stanbul, Turkey, 2013 to 2015[J]. Chemosphere, 181: 544-550. DOI:10.1016/j.chemosphere.2017.04.105 |
陈军, 李楠, 谭菊, 等. 2017. 长沙市人为源大气污染物排放清单及特征研究[J]. 环境科学学报, 37(3): 833-843. |
陈献.2016.北京市冬季PM 2.5污染对呼吸、循环系统疾病影响的时间序列分析[D].石家庄: 河北医科大学
|
刀谞, 张霖琳, 王超, 等. 2015. 京津冀冬季与夏季PM2.5/PM10及其水溶性离子组分区域性污染特征分析[J]. 环境化学, 34(1): 60-69. DOI:10.7524/j.issn.0254-6108.2015.01.2014032603 |
Cinar N, Dede C. 2012. Air pollution impacts on children:Why young children are more susceptible to air pollution's effects?[J]. Journal Health Scope, 1(3): 153-154. |
Davalos A D, Luben T J, Herring A H, et al. 2017. Current approaches used in epidemiologic studies to examine short-term multipollutant air pollution exposures[J]. Ann Epidemiol, 27(2): 145-153. |
Dominici F, Peng R D, Bell M L, et al. 2006. Fine particulate air pollution and hospital admission for cardiovascular and respiratory diseases[J]. Journal American Medical Association, 295(10): 1127-1134. |
董英.2006.上海市大气污染和气温对闵行区居民及全市医保人群的健康效应[D].上海: 复旦大学
|
杜欢欢.2011.上海大气气溶胶化学特征及其对灰霾形成影响[D].上海: 复旦大学
|
Eckel S P, Louis T A, Chaves P H, et al. 2012. Modification of the association between ambient air pollution and lung function by frailty status among older adults in the Cardiovascular Health Study[J]. American Jounal of Epidemiology, 176: 214-23. |
董继元, 刘兴荣, 张本忠, 等. 2016. 我国臭氧短期暴露与人群死亡风险的Meta分析[J]. 环境科学学报, 36(4): 1477-1485. |
方叠.2014.中国主要城市空气污染对人群健康的影响研究[D].南京: 南京大学
|
谷少华, 贾红英, 李萌萌, 等. 2015. 济南市空气污染对呼吸系统疾病门诊量的影响[J]. 环境与健康杂志, 32(2): 95-98. |
Fusco D, Forastiere F, Michelozzi P, et al. 2001. Air pollution and hospital admissions for respiratory conditions in Rome, Italy[J]. European Respiratoy Jounal, 17: 1143-1150. |
Gosai A, Salinger J, Dirks K. 2009. Climate and respiratory disease in Auckland, New Zealand[J]. Aust N Z J Public Health, 33(6): 521-526. |
Granados-Canal D J, Chardon B, Lefranc A, et al. 2005. Air pollution and respiratory hospital admissions in Greater Paris:exploring sex differences[J]. Archives of Environmental & Occupational Health, 60(6): 307-313. |
Health S K, Koenig J Q, Morgan M S, et al. 1994. Effects of sulfur dioxide exposure on African-American and Caucasian asthmatics[J]. Environmental Research, 66: 1-11. |
Hermes G L, Rosenthal L, Montag A, et al. 2006. Social isolation and the inflammatory response:sex differences in the enduring effects of a prior stressor[J]. Am J Physiol Regul Integr Comp Physiol, 290: 273-282. |
黄丽坤, 王琨, 王广智, 等. 2014. 哈尔滨市大气中TSP、PM10和PM2.5相关性分析[J]. 化学与粘合, 36(6): 463-465. |
姜彩霞, 朱冰, 张龙. 2018. 2013-2014年杭州市大气PM2.5与呼吸系统疾病就诊人次的时间序列研究[J]. 环境与职业医学, 35(7): 589-595. |
蒋琴琴, 施洁, 杨轶戬, 等. 2017. 广州市2015年大气PM2.5与呼吸系统疾病日门诊量的关系[J]. 中国热带医学, 17(6): 594-597. |
Jennifer F, Bobb J F, Henn B C, et al. 2018. Statistical software for analyzing the health effects of multiple concurrent exposures via Bayesian kernel machine regression[J]. Environmental Health, 17: 67. |
Jing C, Wei L, Chen H. 2018. Residential ambient traffic in relation to childhood pneumonia among urban children in Shandong, China:A cross-sectional study[J]. Int J Environ Res Public Health, 15(6): 1076-1096. |
Joel S. 1994. Nonparametric smoothing in the analysis of air pollution and respiratory illness[J]. Canadian Journal of Statistics, 22(4): 471-487. |
Kan H, London S J, Chen G, et al. 2007. Differentiating the effects of fine and coarse particles on daily mortality in Shanghai, China[J]. Environment International, 33(3): 376-384. |
Khanjani N, Ranadeh Kalankesh L, Mansouri F. 2012. Air pollution and respiratory deaths in Kerman, Iran (from 2006 till 2010)[J]. Iranian Journal Epidemiol, 8(3): 58-65. |
Kim C S, Hu S C. 2006. Total respiratory tract deposition of fine micrometer-sized particles in healthy adults:empirical equations for sex and breathing pattern[J]. Journal of Applied Physiology, 101: 401-412. |
兰天飞, 张曼, 石海云, 等. 2019. 8种常见食物过敏原在不同年龄段sIgE检测阳性率分析[J]. 解放军医学院学报, 40(3): 235-259. |
廖玉学, 彭朝琼, 余淑苑, 等. 2014. 深圳市大气PM10与呼吸系统疾病日门诊量的时间序列分析[J]. 华南预防医学, 40(4): 301-305. |
Lee S L, Wong W H, Lau Y L. 2006. Association between air pollution and asthma admission among children in Hong Kong[J]. Clin Exp Allergy, 36: 1138-1146. |
李骊.2015.广州市大气污染、气象与逐日人群死亡数的关系研究[D].广州: 南方医科大学
|
李沛.2016.北京市大气颗粒物污染对人群健康的危害风险研究[D].兰州: 兰州大学
|
李雯婧.2016.北京市主要大气污染物对居民死亡影响及其空间差异性分析[D].北京: 北京协和医学院
|
刘检琴.2016.长沙市主城区与城郊大气污染物时空分布特征研究[D].长沙: 湖南师范大学
|
刘准, 陈丹, 霍细香, 等. 2018. 武汉市大气污染物水平与儿童呼吸道疾病门诊量的滞后效应分析[J]. 环境与职业医学, (2): 124-130. |
路凤, 刘娅, 李小娟, 等. 2017. 大气污染对呼吸系统疾病门诊量影响的病例交叉研究[J]. 环境卫生学杂志, 7(5): 408-412. |
骆善彩, 杨娟, 徐志勇, 等. 2016. 淮安市城区大气污染与呼吸系统疾病门诊量的时间序列分析[J]. 现代预防医学, (23): 4225-4228. |
马利刚, 张志琴, 薛小平, 等. 2017. 2015年太原市空气污染与医院门诊量关系的病例交叉研究[J]. 预防医学论坛, 23(4): 244-247. |
Ma Y, Zhao Y, Yang S, et al. 2017. Short-term effects of ambient air pollution on emergency room admissions due to cardiovascular causes in Beijing, China[J]. Environmental Pollution, 230: 974-980. |
Ren M, Li N, Wang Z, et al. 2017. The short-term effects of air pollutants on respiratory disease mortality in Wuhan, China:comparison of time-series and case-crossover analyses[J]. Scientific Reports, 7: 40482. |
Mitsakou C, Housiadas C, Eleftheriadis K, et al. 2007. Lung deposition of fine and ultrafine particles outdoors and indoors during a cooking event and a no activity period[J]. Indoor Air, 17: 143-152. |
Nathan B, Matthew R, Ambarish V, et al. 2016. Short-term effects of ambient air pollutants on asthma-related emergency department visits in Indianapolis, Indiana, 2007-2011[J]. Journal of Asthma, 53(3): 245-252. |
Nhung N T T, Schindler C, Dien T M, et al. 2018. Acute effects of ambient air pollution on lower respiratory infections in Hanoi children:An eight-year time series study[J]. Environmental International, 110: 139-148. |
聂丽曼, 杜春峰, 尤新军. 2018. 我国中小型城市臭氧污染现状及防治措施研究[J]. 化工管理, (28): 121-122. |
Pannullo F, Lee D, Neal L, et al. 2017. Quantifying the impact of current and future concentrations of air pollutants on respiratory disease risk in England[J]. Environmental Health, 16: 29-43. |
Park M, Luo S, Kwon J, et al. 2013. Effects of air pollution on asthma hospitalization rates in different age groups in metropolitan cities of Korea[J]. Air Quality, Atmosphere & Health, 6(3): 543-551. |
Peng R D, Dominici F, Louis T A. 2006. Model choice in time series studies of air pollution and mortality[J]. Journal of the Royal Statistical Society.Series A, 169(2): 179-203. |
Persinger R L, Poynter M E, Ckless K, et al. 2002. Molecular mechanisms of nitrogen dioxide induced epithelial injury in the lung[J]. Molecular and Cellular Biochemistry, 234/235: 71-80. |
Peters A, Doring A, Wichmann H E, et al. 1997. Increased plasma viscosity during an pollution episode:a link to mortality[J]. Lancet, 349: 1582-1587. |
Pride K R, Peel J L, Robinson B F, et al. 2015. Association of short-term exposure to ground-level ozone and respiratory outpatient clinic visits in a rural location-Sublette County, Wyoming, 2008-2011[J]. Environmental Research, 137: 1-7. |
Prisby R D, Muller-Delp J, Delp M D, et al. 2008. Age, gender, and hormonal status modulate the vascular toxicity of the diesel exhaust extract phenanthraquinone[J]. Jounal of Toxicology Environmental Health Part A, 71: 464-470. |
Phung D, Hien T T, Linh H N, et al. 2016. Air pollution and risk of respiratory and cardiovascular hospitalizations in the most populous city in Vietnam[J]. Science of the Total Environment, 557-558: 322-330. |
Rosas I, McCartney H A, Payne R W, et al. 1998. Analysis of the relationships between environmental factors (aeroallergens, air pollution, and weather) and asthma emergency admissions to a hospital in Mexico City[J]. Allergy, 53: 394-401. |
Samet J M, Zeger S L, Dominici F, et al.2000.The national morbidity, mortality, and air pollution study, part ii, morbidity and mortality from air pollution in the United States[R].Research Report, Number 94.Boston: Health Effects Institute.1-79
|
Samoli E, Peng R, Ramsay T, et al. 2008. Acute effects of ambient particulate matter on mortality in Europe and North America:results from the APHENA study[J]. Environmental Health Perspect, 116: 1480-1486. |
Schwartz J. 1994. Nonparametric smoothing in the analysis of air pollution and respiratory illness[J]. Can J Stat, 22: 471-488. |
Schwartz J. 1996. Air pollution and hospital admissions for respiratory disease[J]. Epidemiology, 7(1): 20-28. |
Shen Y, Wu Y, Chen G, et al. 2017. Non-linear increase of respiratory diseases and their costs under severe air pollution[J]. Environmental Pollution, 224: 631-637. |
Simoni M, Baldacci S, Maio S, et al. 2015. Adverse effects of outdoor pollution in the elderly[J]. J Thorac Dis, 7(1): 34-45. |
Sood A, Cui X, Qualls C, et al. 2008. Association between asthma and serum adiponectin concentration in women[J]. Thorax, 63: 877-882. |
Stafoggia M, Breitner S, Hampe R, et al. 2017. Statistical approaches to address multi-pollutant mixtures and multiple exposures:The state of the science[J]. Current Environmental Health Reports, 4(4): 481-490. |
孙兆彬, 李栋梁, 陶燕, 等. 2010. 兰州市大气PM10与呼吸系统疾病入院人数的时间序列研究[J]. 环境与健康杂志, 27(12): 1049-1052. |
Su W, Wu X, Geng X, et al. 2019. The short-term effects of air pollutants on influenza-like illness in Jinan, China[J]. BMC Public Health, 19(1): 1319. |
Tang Y, Horikoshi M, Li W. 2016. ggfortify:Unified interface to visualize statistical results of popular R Packages[J]. The R Journal, 8(2): 478-489. |
陶燕, 羊德容, 兰岚, 等. 2013. 兰州市空气污染对呼吸系统疾病入院人数的影响[J]. 中国环境科学, 33(1): 175-180. |
陶燕, 刘亚梦, 米生权, 郭勇涛. 2014. 大气细颗粒物的污染特征及对人体健康的影响[J]. 环境科学学报, 34(3): 592-597. |
Tarvercarr M E, Powe N R, Eberhardt M S, et al. 2002. Excess risk of chronic kidney disease among African-American versus white subjects in the United States:a population-based study of potential explanatory factors[J]. Journal of the American Society of Nephrology, 13(9): 2363-2370. |
Vahedian M, Khanjani N, Mirzaee M, et al. 2017a. Associations of short-term exposure to air pollution with respiratory hospital admissions in Arak, Iran[J]. Journal of Environmental Health Science and Engineering, 15: 17. |
Vahedian M, Khanjani N, Mirzaee M, et al. 2017b. Ambient air pollution and daily hospital admissions for cardiovascular diseases in Arak, Iran[J]. ARYA Atheroscler, 13(3): 117-134. |
王宝枝. 2016. 临沂市大气污染的源头和综合治理研究[J]. 临沂大学学报, 38(5): 104-109. |
王亮, 张颖聪, 魏咏兰, 等. 2018. 成都市大气颗粒物对居民心脑血管疾病死亡的急性影响研究[J]. 现代预防医学, 45(19): 3504-3507. |
王任洪.2015.兰州市大气污染与呼吸、循环系统疾病死亡的时间序列分析[D].兰州: 兰州大学
|
王荀, 廖玉学, 刘丽红, 等. 2019. 深圳市龙岗区大气污染物与医院呼吸系统疾病门诊量门诊量的广义相加模型分析[J]. 实用预防医学, 26(1): 59-62. |
Wang X, Guo Y, Li G, et al. 2016. Spatiokmporal analysis for the effect of ambient particulate matter on cause-specific respiratory mortality in Beijing, China[J]. Environ Sci Pollut Res Int, 23(11): 10946-10956. |
王艳, 张宜升, 李欣鹏. 2008. 济南城区空气污染对呼吸道疾病门诊量的影响[J]. 中国环境科学, 28(6): 571-576. |
Wedderburn R W M. 1974. Quasi-likelihood functions, generalized linear models, and the Gauss-Newton method[J]. Biometrika, 61: 439-447. |
Weichenthal S, Hoppin JA, Reeves F. 2014. Obesity and the cardiovascular health effects of fine particulate air pollution[J]. Obesity, 22: 1580-1589. |
Weichenthal S, Pinault L L, Burnett R T. 2017. Impact of oxidant gases on the relationship between outdoor fine particulate air pollution and nonaccidental, cardiovascular, and respiratory mortality[J]. Scientific Reports, 7: 16401. |
Wu S, Deng F, Niu J, et al. 2008. Association of heart rate variability in taxi drivers with marked changes in particulate air pollution in Beijing[J]. Environ Health Perspect, 2010: 87-91. |
胥芹.2017.基于广义相加模型评价北京市颗粒物浓度对急诊量的影响效应[D].北京: 首都医科大学
|
徐清云, 马玉花, 李双明, 等. 2013. 广州市大气污染物与居民每日心血管疾病急诊人次关系的时间序列研究[J]. 环境与健康杂志, 30(11): 977-980. |
薛树娟.2012.南昌大学前湖校区室内外PM2.5和PM10及碳组分的分布与源解析[D].南昌: 南昌大学
|
Yang Y, Ca oY, Li W, et al. 2015. Multi-site time series analysis of acute effects of multiple air polluants on respiratory mortality:a population-based study in Beijing, China[J]. Sci Total Environ, 508: 178-187. |
于晓洁.2011.基于广义可加模型的等级模型用于估计PM10含量对居民健康的影响[D].太原: 山西医科大学
|
张姣艳.2013.气温及大气污染物对上海市儿童健康的影响[D].上海: 复旦大学
|
张林林.2017.长春市空气污染与呼吸系统和循环系统疾病急性发作的相关性研究[D].长春: 吉林大学
|
张文增, 甄国新, 陈东妮, 等. 2017. 北京市顺义区大气污染物对呼吸系统疾病门诊量的影响[J]. 中国卫生统计, 34(2): 275-279. |
张燕萍, 李晋芬, 张志琴. 2008. 太原市颗粒物空气污染与居民每日门诊率的暴露-反应关系[J]. 环境与健康杂志, 25(6): 479-482. |
张莹, 刘丽伟, 宁贵财, 等. 2015a. 兰州市大气污染物的分布特征及其对人体健康的影响[J]. 卫生研究, 44(5): 723-729. |
张莹, 宁贵财, 康延臻, 等. 2015b. 北京市大气污染物与呼吸系统疾病入院人数的时间序列[J]. 兰州大学学报(自然科学版), 51(1): 87-92. |
张莹, 邵毅, 王式功, 等. 2014. 北京市空气污染物对呼吸系统疾病门诊人数的影响[J]. 中国环境科学, 34(9): 2401-2407. |
Zúñiga J, Tarajia M, Herrera V, et al. 2016. Assessment of the possible association of air pollutants PM10, O3, NO2 with an increase in cardiovascular, respiratory, and diabetes mortality in Panama City:A 2003 to 2013 data analysis[J]. Medicine, 95(2): e2464. DOI:10.1097/MD.0000000000002464 |
 2020, Vol. 40
2020, Vol. 40


