2. 北京碧水源科技股份有限公司, 北京 102206
2. Beijing Origin Water Technology Co., Ltd., Beijing 102206
纳滤是一种新兴的膜法饮用水深度处理技术, 在我国及世界范围内正逐步得到推广应用(Ventresque et al., 2000;党敏等, 2017).在地表水处理领域, 纳滤主要用于去除水中的天然有机物以控制消毒副产物和提高水的生物稳定性(Shen et al., 2015), 同时还可用于水中农药(Saitúa et al., 2012)、药物和个人护理品(Radjenovic et al., 2008)等微量有机物的去除.流行病学研究表明, 安全、健康的饮用水应含有一定浓度的Ca2+、Mg2+和其它矿物元素(刘文君等, 2017).以NF270为代表的疏松型纳滤膜, 透水性能好, 对水中绝大多数微量有机物具有很好的去除效果(Zhao et al., 2017), 且对水中无机离子具有较高的分离选择性(Hilal et al., 2005a;2005b;Hilal et al., 2007), 具有微量有机物截留率高及Ca2+/Mg2+截留率低的特性, 在饮用水深度处理领域应用前景广泛.
纳滤机理是纳滤截留特性研究的归纳总结, 同时也广泛应用于纳滤截留特性的解析.一般认为, 纳滤对水中离子的截留源于空间位阻效应和静电效应, 而静电效应又分为道南效应和介电效应(Bowen et al., 2002;Bandini et al., 2003;Szymczyk et al., 2005).道南效应是由于在水中纳滤膜表面带有电荷, 这些电荷来源于膜表面酸性官能团(如—COOH)的离解(Oatley et al., 2012;Chen et al., 2017)、碱性官能团(如N—H)的质子化(Coronell et al., 2008)、水中阴阳离子在膜表面的物理性吸附(Afonso et al., 2001;Nicolini et al., 2016), 以及水中部分阳离子与膜表面官能团的络合(Bruni et al., 2008;Wang et al., 2018)等.道南效应的强弱与膜表面电势的高低及作用离子的电荷属性和电荷数直接相关.基于此, 一些研究者提出了优势离子(Dominant Ion)和同离子竞争(Co-ion Competition)概念, 认为对截留起决定性作用的是高电荷数离子(即优势离子)(Luo et al., 2013), 如SO42-和Ca2+/Mg2+等.若优势离子为同离子, 即与膜表面电荷属性相同, 则会提高反离子的截留率;反之若为反离子, 则会降低同离子的截留率.优势同离子会与其它同离子发生竞争关系, 降低低电荷数同离子的截留率.
NF270等商品化疏松型纳滤膜在水中膜表面一般带负电, 道南效应对无机离子截留的影响很大.理论上相较于单价离子Na+, Ca2+/Mg2+作为优势反离子更容易透过膜.但在实际应用中发现, 此类纳滤膜对天然水中Ca2+、Mg2+的截留率却高于Na+(吴玉超, 2016; 麦正军等, 2017), 较大程度上降低了纳滤在饮用水深度处理中的适用性.到目前为止, 针对纳滤这一截留特性的研究还极少.
饮用水原水中的主要阳离子为Ca2+、Mg2+和Na+.本研究以NF270为代表性纳滤膜, 基于纳滤机理, 解析该膜对MgCl2、CaCl2、NaCl单一盐溶液和MgCl2/CaCl2+NaCl混合盐溶液的截留特性, 提出限定性离子的概念, 并考察Ca2+/Mg2+在膜表面的络合或吸附及对膜表面电荷的屏蔽作用对静电效应和盐离子截留率的影响, 重点解决纳滤过滤天然水时对Ca2+、Mg2+截留率过高的机理问题, 以提升对反离子竞争关系和纳滤膜选择性截留的认识, 为制备具有“低Ca2+/Mg2+截留”特征、适用于饮用水处理的新型纳滤膜提供思路.
2 材料与方法(Materials and methods) 2.1 试验材料实验采用商品化纳滤膜NF270(DOW-FilmTec).采用流动电势法(Ortiz-Albo et al., 2019)测定NF270在1 mmol·L-1 KCl溶液中的Zeta电位随pH变化情况, 得到等电点(IEP)(表 1).此外, 其标称截留分子量(MWCO)、平均膜孔半径等主要性质均列于表 1.
| 表 1 NF270纳滤膜的主要性能参数 Table 1 Characteristics of the tested loose nanofiltation membrane (NF270) |
实验选用NaCl、CaCl2和MgCl2 3种无机盐, 分别配制单一溶质溶液和混合溶质溶液.考虑饮用水处理原水的离子强度范围(如文中某地下水的TDS约为300 mg·L-1), 3种无机盐的单一溶质溶液的总离子强度分别控制为1.5、3、6、12、24 mmol·L-1, 混合溶质溶液(NaCl+CaCl2/MgCl2)的总离子强度控制为6 mmol·L-1.各项试剂均为分析纯级, 具体浓度配比如表 2所示.
| 表 2 实验溶液类型及浓度 Table 2 Type and concentration of the tested solution |
使用Sterlitech公司生产的3组平行错流式纳滤单元(CF016D)装置(图 1)测试NF270纳滤膜的水渗透系数及对无机盐离子截留能力.该纳滤装置含可变频的隔膜泵(Hydrocell D10)、温度控制系统及压力和流量传感器.实验开始前, 膜样品需浸泡在超纯水(Milli-Q, Millipore, USA)中至少24 h.将经纯水浸泡后的膜片放置于过滤单元中, 在1.2×106 Pa压力下过滤纯水约2 h直至通量稳定.配制实验所需溶液, 并在各溶液中加入NaHCO3缓冲溶液, 最终浓度为0.1 mmol·L-1(配制表 2中各溶液时已将NaHCO3贡献的离子强度考虑在内), 使溶液pH维持在6.5~7.5.溶液配好后, 开始截留实验, 分别调节压力为2×105、4×105、6×105、8×105、10×105 Pa, 采用全循环方式运行, 错流速度控制在0.22 m·s-1, 以减轻浓差极化的影响.每个压力工况运行3~4 h, 待系统稳定后, 测定膜通量并分别取进出水样品进行测试.运行过程中溶液温度控制为20 ℃.
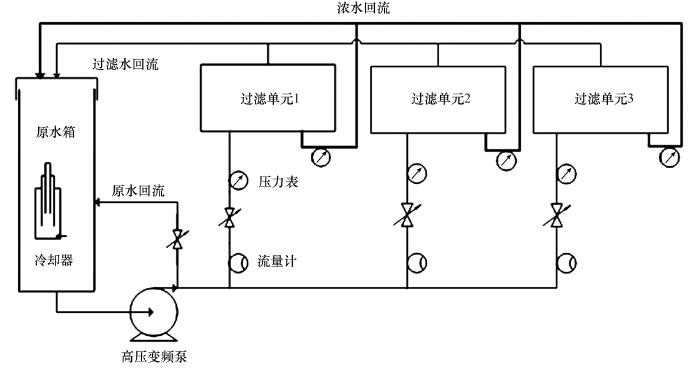 |
| 图 1 纳滤装置示意图 Fig. 1 Schematic diagram of the cross-flow filtration setup |
对于单一盐溶液, 采用电导率仪测定进出水水样浓度;对于混合盐溶液, 采用阳离子色谱测定各阳离子浓度.
3 实验结果(Results) 3.1 单一盐溶液实验结果表明, 当水通量低于90 L·m-2·h-1时, NF270对3种无机盐的截留率随水通量增加而升高, 而当水通量由90 L·m-2·h-1继续增加至160 L·m-2·h-1时, 截留率基本保持稳定, 这与已有的实验结果相符(Oatley et al., 2012).因此, 本实验控制水通量为150 L·m-2·h-1, 比较3种无机盐的稳定截留率随各自离子强度的变化关系, 结果如图 2所示.在实验离子强度范围内, ①离子强度一定时, 3种盐的稳定截留率关系为NaCl>MgCl2>CaCl2.②随着离子强度增加, NaCl截留率由75%持续降低至62%;CaCl2截留率先由53%减小至49%, 后又增加到53%;MgCl2截留率先由62%减小至56%, 后又增加到62%.总的来说, 随各溶液离子强度增加, NF270截留NaCl能力降低, 而对CaCl2和MgCl2的截留则变化不大.
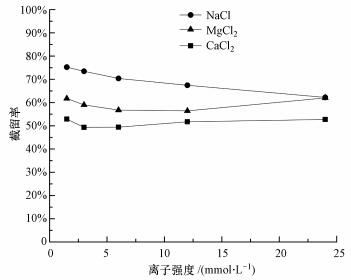 |
| 图 2 NF270对3种无机盐的稳定截留率随各自离子强度的变化 Fig. 2 Plateau rejections of NaCl, MgCl2 and CaCl2 by NF270 at different ionic strengths |
离子强度一定时, NF270对各阳离子在单一盐溶液和混合盐溶液中的截留率有明显差异.如图 3a所示, NF270过滤6 mmol·L-1的NaCl单一盐溶液时Na+的截留率为70%, 而在总离子强度同为6 mmol·L-1的NaCl+CaCl2混合溶液中, 随着CaCl2浓度增加, Na+截留率不断降低, 当CaCl2的离子强度在混合溶液中占75%时, Na+截留率仅为38.5%.相反地, Ca2+在混合溶液中的截留率(≥60%)却高于其在CaCl2单一盐溶液中的截留率(49.5%).混合溶液与单一溶液相比, Na+截留率下降, Ca2+截留率上升, 导致截留率关系为Ca2+>Na+.
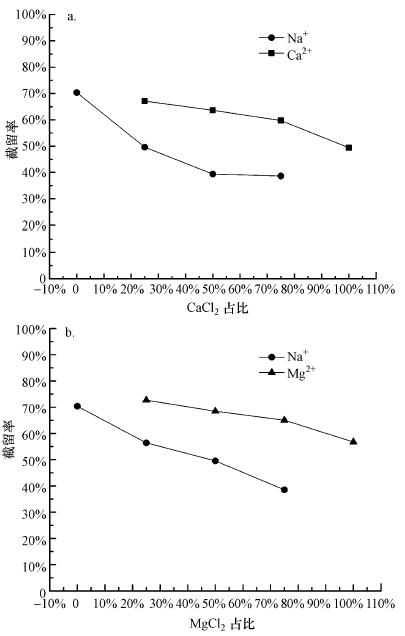 |
| 图 3 NF270过滤总离子强度6 mmol·L-1、不同配比的混合溶液(a.NaCl+CaCl2, b.NaCl+MgCl2)时各离子截留率比较(水通量约为150 L·m-2·h-1) Fig. 3 Rejection of Na+, Ca2+ and Mg2+ ions in 6 mmol·L-1 binary mixtures (a.NaCl+CaCl2, b.NaCl+MgCl2) by NF270 as a function of CaCl2 or MgCl2 percentage |
图 3b为总离子强度为6 mmol·L-1时, 不同浓度Mg2+对Na+截留率的影响, 结论与Ca2+相似, 即混合溶液与单一溶液相比, Na+截留率下降, Mg2+截留率上升, 截留率关系:Mg2+ > Na+.有所不同的是, 横向对比图 3a和图 3b, 当Ca2+和Mg2+在各自溶液中占比相同时, Mg2+截留率始终略高于Ca2+.
3.3 某地下水NF270过滤某实际地下水时, 对水中3种主要阳离子Na+、Ca2+、Mg2+的截留率随水通量变化如图 4所示.在实验压力范围内, 3种阳离子的截留率均随水通量增加而升高, 且最大截留率大小关系为:Mg2+ (69%) > Ca2+ (66%) > Na+(43%).当水通量一定时, NF270对天然水中Na+和Ca2+的截留能力均高于对混合溶液(3 mmol·L-1 NaCl+1 mmol·L-1 CaCl2)中Na+和Ca2+的截留能力(图 4), 同理类比Mg2+.
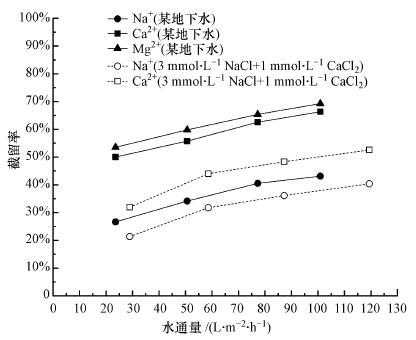 |
| 图 4 NF270过滤某地下水时对Na+、Ca2+、Mg2+的截留率比较 Fig. 4 Comparison of rejections of mineral ions in groundwater and synthetic water by NF270 |
为了探究混合盐溶液中Na+、Ca2+、Mg2+截留率大小关系不同于单一盐溶液的原因, 本实验结合不同离子环境中的NF270膜表面Zeta电位进行分析.如图 5所示, 实验测得NF270膜的IEP约为3.3.当pH值较低(pH < IEP)时, 膜表面带少量正电;而当pH值较高(pH>IEP)时, 膜表面电势由正转负, 且膜表面所带负电荷量随pH值增加而增大, 这与已有的研究结果一致(Wadekar et al., 2017).特别地, 当pH呈中性时, NF270在1 mmol·L-1 KCl溶液中的Zeta电位为-72 mV, 膜表面带有较多负电荷, 说明在截留无机离子时道南效应发挥重要作用.
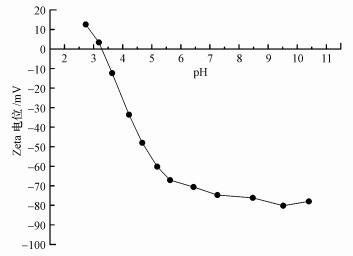 |
| 图 5 NF270纳滤膜在1 mmol·L-1 KCl溶液中的Zeta电位随pH值变化规律 Fig. 5 Zeta potential of NF270 in 1 mmol·L-1 KCl solution as a function of the pH |
所选NaCl、CaCl2、MgCl2 3种无机盐具有同种同离子(Cl-), 即与膜表面带电性相同的离子, 与膜表面负电荷之间存在静电排斥作用, 因此可看作是过滤过程中的限定性离子.当膜表面负电荷密度较高时, Cl-的限定性作用较强, 无机盐整体截留率也较高;而当膜表面负电荷密度较低时, Cl-的限定性作用较弱, 无机盐整体截留率也较低.
3种无机盐所不同的是反离子Na+、Ca2+、Mg2+, 即与膜表面带电性相反的离子, 与膜表面负电荷之间存在静电吸引作用, 其中, 二价离子Ca2+、Mg2+所带正电荷更多, 当膜表面带电量相同时, 受到静电吸引作用较单价离子Na+更强, 更能够促进同离子Cl-过膜以维持产水电中性.因此, 道南效应对3种阳离子的截留顺序为:Na+>Mg2+≈ Ca2+.空间位阻效应也称尺寸排斥效应, 即溶质的有效粒径越大, 越容易被截留.Tansel等(2006)研究了错流过滤模式下水合离子半径对致密型纳滤膜NF90(以空间位阻效应为主)截留无机离子的影响, 得到水中主要阳离子的水合离子半径关系为Mg2+>Ca2+>Na+, 因此, 空间位阻效应对3种阳离子的截留顺序为:Mg2+>Ca2+>Na+.Bandini等(2003)采用空间位阻道南模型(DSPM)拟合NF50带负电纳滤膜过滤1、5、10 mmol·L-1 CaCl2溶液的截留率时发现, 拟合值总是低于真实值, 而当考虑介电效应, 采用空间位阻道南介电模型(DSPM&DE)重新拟合时, 拟合值则接近于真实值.Szymczyk等(2005)在对AFC30带负电纳滤膜过滤10 eq·m-3和50 eq·m-3 MgCl2溶液的截留率进行拟合时也同样得到了相同结论.这说明介电效应对Ca2+、Mg2+截留率的贡献是不可忽视的.介电效应中的镜像力和Born能, 均与离子电荷数的平方成正比, 因此, 介电效应对3种阳离子的截留顺序为:Mg2+≈ Ca2+ >> Na+.
实验选定的离子强度范围(1.5~24 mmol·L-1)属于低浓度范围, 由图 6可知, 膜表面在此浓度范围内的3种溶液中均带负电, Ca2+和Mg2+浓度均不会使膜表面电性发生反转, 这与已有的实验结果相符(Déon et al., 2011).NF270在3种单一盐溶液中的膜表面电势, 以离子强度同为6 mmol·L-1时为例, 在NaCl溶液中为-65 mV, 在CaCl2溶液中为-32 mV, 在MgCl2溶液中为-33 mV(图 6).这说明在相同离子强度下, 当NF270截留NaCl时膜表面负电荷密度较高, 道南效应显著, 同时膜表面负电荷密度较高也意味着对镜像电荷排斥效应的屏蔽作用更强(Szymczyk et al., 2005), 介电排斥效应对Na+的截留更加被削弱.因此, NF270截留NaCl的主要机理是道南效应.在CaCl2和MgCl2溶液中, 膜表面电势近似相等, Ca2+、Mg2+所受道南效应和介电效应大致相同, 但空间位阻效应更有利于Mg2+截留, 因此, Mg2+截留率略高于Ca2+.更重要的是, 相较于NaCl, 处于CaCl2/MgCl2溶液中的膜表面电势(绝对值)降低了约50%, 因此, 当NF270截留CaCl2/MgCl2时, 道南效应较弱, 即Cl-的限定性较弱, 再加上Ca2+/Mg2+对Cl-过膜的促进性作用, 导致CaCl2/MgCl2的截留率小于NaCl, 截留率关系呈现:NaCl>MgCl2>CaCl2, 这与同样带负电的ESNA1纳滤膜实验结论一致(Wang et al., 2005).此外, 在CaCl2和MgCl2溶液中的膜表面电势较低意味着介电效应受膜表面固定电荷屏蔽作用较小, 这有利于Ca2+和Mg2+的截留, 但从实验结果来看, 此时(离子强度为6 mmo·L-1)CaCl2和MgCl2的截留还是主要受道南效应影响, 介电效应次之.
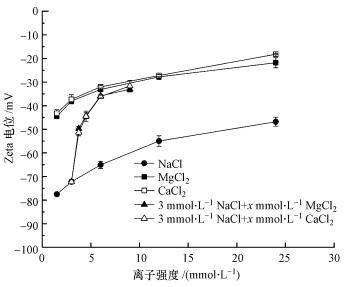 |
| 图 6 NF270膜表面Zeta电位随离子强度的变化规律 Fig. 6 Zeta potential of NF270 at different ionic strengths |
除3种无机盐的截留率大小关系外, 图 2还反映了单一盐随离子强度的变化规律.在实验离子强度范围内, NF270对NaCl的截留能力随溶液浓度增加而降低, 这与已有的实验结论相符(Tanninen et al., 2006).如前所述, NF270截留NaCl的主要机理是道南效应, 即Cl-的限定性作用, 当溶液离子强度增大时, 电荷屏蔽效应使得膜表面电荷/电势(绝对值)降低(图 6), 提高了限定性离子Cl-的透过潜势, 即Cl-的限定性作用减弱, 不利于NaCl截留.
目前有学者认为(Mazzoni et al., 2007), Ca2+作为高价反离子, 其与膜表面负电荷之间的静电吸引作用较Cl-更强, 因此, CaCl2的截留率主要由Ca2+决定.当CaCl2溶液浓度增加时, 除屏蔽效应增强外, Ca2+也更容易与膜表面带负电官能团产生较强的吸附效应或者络合反应, 导致膜表面负电荷密度降低, 道南效应减弱, CaCl2截留率升高.然而, 本实验中NF270对CaCl2的截留效果却随溶液浓度增加无明显变化.如图 6所示, 当离子强度一定时, 处于CaCl2和MgCl2溶液中的NF270膜表面电势(绝对值)明显低于NaCl溶液, 说明相同离子强度条件下, Ca2+、Mg2+对膜表面电势的影响较Na+更大, 即除电荷屏蔽效应影响外, Ca2+、Mg2+与膜表面带负电性官能团发生了吸附效应或络合反应.图 6中CaCl2和MgCl2两条曲线大致重合, 说明Ca2+和Mg2+对膜表面电势的影响相同, 参考Ca2+、Mg2+与常见有机羧酸的络合反应稳定常数可知, 2种离子与—COO-之间的络合能力不同, 因此, 络合之后对膜表面电势的影响也不同, 这与实验结果不符.不同于络合反应, 吸附效应是源于膜表面带负电官能团对阳离子的物理性静电吸附, Na+因带电量低而被吸附得少, Ca2+、Mg2+带电量高而被吸附得多, 因此, Ca2+、Mg2+对膜表面电势的影响更大且二者大致相同, 随着Ca2+、Mg2+浓度不断增加, 有可能出现吸附饱和的情况, 此时膜表面电势(绝对值)的降低只受电荷屏蔽效应影响.
如前4.1节所述, NF270截留CaCl2同时受道南效应、介电效应和空间位阻效应的影响.随着溶液浓度增加, 电荷屏蔽效应及Ca2+吸附效应均增强, 导致膜表面电势(绝对值)不断降低.如图 2所示, 当离子强度由1.5 mmol·L-1增加到6 mmol·L-1时, CaCl2截留率略有下降, 膜表面电势(绝对值)虽有所降低(≥32 mV)但膜表面负电荷密度仍较高, 因此, 道南效应虽有所减弱, 但此离子强度范围内的截留机理仍以道南效应为主.道南效应减弱即Cl-的限定性作用减弱, Cl-的透过潜势提高, 同时反离子Ca2+/Mg2+的透过潜势降低, 因此, CaCl2截留率略有下降.当离子强度由6 mmol·L-1增加到24 mmol·L-1时, CaCl2截留率略有上升, 此时膜表面电势(绝对值)仍在降低(最小至18 mV), 道南效应减弱的同时, 膜表面固定电荷对介电效应的屏蔽作用大大减弱, 介电效应增强, Ca2+截留率提高, 因此, CaCl2截留率略有上升.NF270对MgCl2在离子强度由1.5 mmol·L-1增加至24 mmol·L-1时的截留率变化与CaCl2一致.总的来说, NF270对CaCl2和MgCl2的截留率随离子强度增加变化不大.
4.3 反离子竞争效应与单一溶液不同, 混合溶液和天然水中同时存在多种离子, 不同的同离子之间在存在截留竞争效应, 反离子也存在.
在NaCl+CaCl2混合溶液中, 同离子仅有Cl-, 而反离子同时存在Na+和Ca2+, 因此, 在过滤时存在反离子竞争效应.如图 6所示, 当向3 mmol·L-1 NaCl溶液中逐渐引入Ca2+时, NF270膜表面电势(绝对值)呈持续下降的趋势.开始加入CaCl2至0.25 mmol·L-1时, 膜表面电势(绝对值)经历了一个突变, 即由-72 mV变化至-51 mV.这说明当Na+与Ca2+共存时, 吸附主要由Ca2+控制, 即Ca2+是影响膜表面电势的主要离子.当加入CaCl2至1 mmol·L-1时, 混合溶液总离子强度为6 mmol·L-1, 此时膜表面电势为-36 mV, 明显小于在离子强度同为6 mmol·L-1 NaCl溶液中的膜表面电势(-65 mV), 说明NF270过滤含Ca2+的混合溶液时受道南效应影响较弱, 同时存在介电效应.当Cl-的限定性作用一定时, 虽然Ca2+较Na+与膜表面负电荷之间的静电吸引作用更强, 不利于Ca2+截留, 但一方面Na+的有效粒径更小、扩散性更强, 有可能被迫大量过膜以维持产水电中性, 另一方面介电效应有利于Ca2+截留.Fridman-Bishop等(2018)采用NF270过滤NaCl+CaCl2混合溶液时, 得到结论:离子透过能力为Na+>Ca2+, 他认为Ca2+的吸附作用会在很大程度上掩蔽膜表面固定电荷, 导致负电荷密度降低.因此, 过滤混合溶液时对无机离子的截留主要是介电效应中的Born能贡献的, 而非道南势.因此, 虽然道南效应有利于Ca2+的透过, 但道南效应较弱, 且空间位阻效应和介电效应均有利于Ca2+截留, 使得在混合溶液中截留率Ca2+>Na+.
NaCl+MgCl2混合溶液与NaCl+CaCl2混合溶液的实验现象类似, 同样是Mg2+在反离子竞争中占据优势.此外, 横向对比两种混合溶液中Ca2+和Mg2+的截留率(图 3a和图 3b), 当Ca2+和Mg2+在各自溶液中所占比例相同时, Mg2+始终略高于Ca2+, 进一步证实空间位阻效应对NF270截留无机离子的贡献.
天然水中的离子截留特性也可以用反离子竞争效应解释.当水中限定性离子(不考虑多种同离子之间的竞争作用)作用一定时, 虽然道南效应能够吸引二价离子Ca2+、Mg2+透过, 但介电效应的存在有利于Ca2+、Mg2+截留, 迫使有效粒径更小、扩散性更强的Na+大量过膜, 以维持产水电中性.因此, Na+截留率最低, 而空间位阻效应使得Mg2+截留率略高于Ca2+.此外, 对比图 4中Na+和Ca2+分别在某地下水和NaCl+CaCl2混合溶液中的截留率随水通量变化可知, Na+和Ca2+在天然水中的截留率高于NaCl+CaCl2混合溶液.这是因为天然水中的主要阴离子除了单价离子Cl-, 还有二价离子SO42-, SO42-不仅能受到NF270膜表面负电荷较强的道南排斥作用, 还能受到很强的介电排斥作用, 为了维持产水电中性, 反离子不易传质过膜, 因此, 在天然水中的截留Na+和Ca2+率较高.同理类比Mg2+在天然水中的截留率同样高于NaCl+MgCl2混合溶液.另外, 当水中含有SO42-时, 有研究认为(Wadekar et al., 2017)被截留的SO42-更倾向于被二价离子电中和, 从而保证原水的电中性.因此, 天然水中截留关系为:Mg2+>Ca2+>Na+.
5 结论(Conclusions)1) pH中性条件下, 实验离子强度(特别是1.5~6 mmol·L-1)范围内, NF270过滤相同离子强度的3种单一盐溶液的截留率关系为NaCl>MgCl2≈CaCl2, Cl-的限定性作用越强, 越有利于无机盐截留, 空间位阻效应使得MgCl2截留率略高于CaCl2.
2) NF270膜表面负电荷对3种阳离子有吸附效应, 且对Ca2+、Mg2+吸附更强, 两者差别不大.当CaCl2/MgCl2溶液浓度增加时, 静电屏蔽效应及Ca2+/Mg2+吸附效应均增强, 使得膜表面电势持续降低.
3) NF270对NaCl的截留随溶液浓度增加而降低, 主要贡献在于Cl-的限定性作用.NF270对CaCl2和MgCl2的截留随溶液浓度增加变化不大, 离子强度为1.5~6 mmol·L-1时, 主要受道南效应影响, 介电效应、空间位阻效应次之;离子强度为6~24 mmol·L-1时, 道南效应有所减弱.
4) NF270过滤NaCl+CaCl2混合溶液、NaCl+MgCl2混合盐溶液及天然水时, 存在反离子竞争效应, 截留率关系呈现:Na+ < Ca2+≈Mg2+, 这是介电效应和空间位阻效应起更重要作用的结果.此外, 天然水中由于高价同离子(SO42-)的存在, 不利于水中各种阳离子传质过膜.
5) 通过对NF270膜截留水中主要阳离子的机理解析, 在不改变截留分子量的前提下, 为了降低纳滤膜对Ca2+、Mg2+的截留, 应提高膜表面负电荷密度, 以增强道南效应并削弱介电效应, 同时应最大程度地降低膜表面带负电性官能团对Ca2+、Mg2+的吸附作用, 这为制备具有“低Ca2+/Mg2+截留”特征、适用于饮用水处理的新型纳滤膜提供了技术思路.
Afonso M D, Hagmeyer G, Gimbel R. 2001. Streaming potential measurements to assess the variation of nanofiltration membranes surface charge with the concentration of salt solutions[J]. Separation and Purification Technology, 22-23: 529-541. DOI:10.1016/S1383-5866(00)00135-0 |
Bandini S, Vezzani D. 2003. Nanofiltration modeling:the role of dielectric exclusion in membrane characterization[J]. Chemical Engineering Science, 58(15): 3303-3326. DOI:10.1016/S0009-2509(03)00212-4 |
Bargeman G, Westerink J B, Guerra Miguez O, et al. 2014. The effect of NaCl and glucose concentration on retentions for nanofiltration membranes processing concentrated solutions[J]. Separation and Purification Technology, 134: 46-57. DOI:10.1016/j.seppur.2014.07.025 |
Bowen W R, Welfoot J S. 2002. Modelling the performance of membrane nanofiltration-critical assessment and model development[J]. Chemical Engineering Science, 57(7): 1121-1137. DOI:10.1016/S0009-2509(01)00413-4 |
Bruni L, Bandini S. 2008. The role of the electrolyte on the mechanism of charge formation in polyamide nanofiltration membranes[J]. Journal of Membrane Science, 308(1): 136-151. |
Chen D, Werber J R, Zhao X, et al. 2017. A facile method to quantify the carboxyl group areal density in the active layer of polyamide thin-film composite membranes[J]. Journal of Membrane Science, 534: 100-108. DOI:10.1016/j.memsci.2017.04.001 |
Coronell O, Mariñas B J, Zhang X, et al. 2008. Quantification of functional groups and modeling of their ionization behavior in the active layer of FT30 reverse osmosis membrane[J]. Environmental Science & Technology, 42(14): 5260-5266. |
Darwish N A, Hilal N, Al-Zoubi H, et al. 2007. Neural networks simulation of the filtration of sodium chloride and magnesium chloride solutions using nanofiltration membranes[J]. Chemical Engineering Research and Design, 85(4): 417-430. |
Déon S, Escoda A, Fievet P. 2011. A transport model considering charge adsorption inside pores to describe salts rejection by nanofiltration membranes[J]. Chemical Engineering Science, 66(12): 2823-2832. DOI:10.1016/j.ces.2011.03.043 |
党敏, 朱学武, 杜星, 等. 2017. 超滤-纳滤双膜工艺处理微污染水源水中试研究[J]. 给水排水, 43(1): 44-48. DOI:10.3969/j.issn.1002-8471.2017.01.010 |
Fridman-Bishop N, Tankus K A, Freger V. 2018. Permeation mechanism and interplay between ions in nanofiltration[J]. Journal of Membrane Science, 548: 449-458. DOI:10.1016/j.memsci.2017.11.050 |
Hilal N, Al-Zoubi H, Mohammad A W, et al. 2005a. Nanofiltration of highly concentrated salt solutions up to seawater salinity[J]. Desalination, 184(1/3): 315-326. |
Hilal N, Al-Zoubi H, Darwish N A, et al. 2005b. Nanofiltration of magnesium chloride, sodium carbonate, and calcium sulphate in salt solutions[J]. Separation Science and Technology, 40(16): 3299-3321. DOI:10.1080/01496390500423680 |
Hilal N, Al-Zoubi H, Darwish N A, et al. 2007. Performance of nanofiltration membranes in the treatment of synthetic and real seawater[J]. Separation Science and Technology, 42(3): 493-515. DOI:10.1080/01496390601120789 |
Li S, Luo J, Wan Y. 2018. Regenerable biocatalytic nanofiltration membrane for aquatic micropollutants removal[J]. Journal of Membrane Science, 549: 120-128. DOI:10.1016/j.memsci.2017.11.075 |
Luo J, Zeuner B, Morthensen S T, et al. 2015. Separation of phenolic acids from monosaccharides by low-pressure nanofiltration integrated with laccase pre-treatments[J]. Journal of Membrane Science, 482: 83-91. DOI:10.1016/j.memsci.2015.02.022 |
Luo J Q, Wan Y H. 2013. Effects of pH and salt on nanofiltration-a critical review[J]. Journal of Membrane Science, 438: 18-28. DOI:10.1016/j.memsci.2013.03.029 |
刘文君, 王小毛, 舒为群, 等. 2017. 人体所需必要元素与饮水健康[J]. 给水排水, 43(10): 9-12. DOI:10.3969/j.issn.1002-8471.2017.10.002 |
麦正军, 方振东, 姚吉伦, 等. 2017. 低压条件下纳滤膜去除地下水中无机盐的试验研究[J]. 后勤工程学院学报, 33(2): 44-52. DOI:10.3969/j.issn.1672-7843.2017.02.008 |
Mazzoni C, Bruni L, Bandini S. 2007. Nanofiltration:Role of the electrolyte and pH on Desal DK performances[J]. Industrial & Engineering Chemistry Research, 46(8): 2254-2262. |
Nicolini J V, Borges C P, Ferraz H C. 2016. Selective rejection of ions and correlation with surface properties of nanofiltration membranes[J]. Separation and Purification Technology, 171: 238-247. DOI:10.1016/j.seppur.2016.07.042 |
Oatley D L, Llenas L, Pérez R, et al. 2012. Review of the dielectric properties of nanofiltration membranes and verification of the single oriented layer approximation[J]. Advances in Colloid and Interface Science, 173: 1-11. DOI:10.1016/j.cis.2012.02.001 |
Ortiz-Albo P, Ibañez R, Urtiaga A, et al. 2019. Phenomenological prediction of desalination brines nanofiltration through the indirect determination of zeta potential[J]. Separation and Purification Technology, 210: 746-753. DOI:10.1016/j.seppur.2018.08.066 |
Radjenovic J, Petrovic M, Ventura F, et al. 2008. Rejection of pharmaceuticals in nanofiltration and reverse osmosis membrane drinking water treatment[J]. Water Research, 42(14): 3601-3610. DOI:10.1016/j.watres.2008.05.020 |
Saitúa H, Giannini F, Padilla A P. 2012. Drinking water obtaining by nanofiltration from waters contaminated with glyphosate formulations:process evaluation by means of toxicity tests and studies on operating parameters[J]. Journal of Hazardous Materials, 227-228: 204-210. DOI:10.1016/j.jhazmat.2012.05.035 |
Shen J, Schafer A I. 2015. Factors affecting fluoride and natural organic matter (NOM) removal from natural waters in Tanzania by nanofiltration/reverse osmosis[J]. Science Total Environmental, 527-528: 520-529. DOI:10.1016/j.scitotenv.2015.04.037 |
Szymczyk A, Fievet P. 2005. Investigating transport properties of nanofiltration membranes by means of a steric, electric and dielectric exclusion model[J]. Journal of Membrane Science, 252(1): 77-88. |
Tanninen J, Mänttäri M, Nyström M. 2006. Effect of salt mixture concentration on fractionation with NF membranes[J]. Journal of Membrane Science, 283(1): 57-64. |
Tansel B, Sager J, Rector T, et al. 2006. Significance of hydrated radius and hydration shells on ionic permeability during nanofiltration in dead end and cross flow modes[J]. Separation and Purification Technology, 51(1): 40-47. DOI:10.1016/j.seppur.2005.12.020 |
Ventresque C, Gisclon V, Bablon G, et al. 2000. An outstanding feat of modern technology:The mery-sur-oise nanofiltration treatment plant (340000 m3/d)[J]. Desalination, 131: 1-16. DOI:10.1016/S0011-9164(00)90001-8 |
Wadekar S S, Vidic R D. 2017. Influence of active layer on separation potentials of nanofiltration membranes for inorganic ions[J]. Environmental Science & Technology, 51(10): 5658-5665. |
Wang D X, Su M, Yu Z Y, et al. 2005. Separation performance of a nanofiltration membrane influenced by species and concentration of ions[J]. Desalination, 175(2): 219-225. DOI:10.1016/j.desal.2004.10.009 |
Wang Z, Xiao K, Wang X M. 2018. Role of coexistence of negative and positive membrane surface charges in electrostatic effect for salt rejection by nanofiltration[J]. Desalination, 444: 75-83. DOI:10.1016/j.desal.2018.07.010 |
吴玉超.2016.纳滤用于提升某微污染水源水厂出水水质的效果研究[D].北京: 清华大学 http://cdmd.cnki.com.cn/Article/CDMD-10003-1017817737.htm
|
Zhao Y Y, Kong F X, Wang Z, et al. 2017. Role of membrane and compound properties in affecting the rejection of pharmaceuticals by different RO/NF membranes[J]. Frontiers of Environmental Science Engineering, 11(6): 20. DOI:10.1007/s11783-017-0975-x |
 2020, Vol. 40
2020, Vol. 40
 . 2020. 疏松型纳滤膜对饮用水中无机阳离子的截留特性及分离选择性[J]. 环境科学学报, 40(8): 2700-2707.
. 2020. 疏松型纳滤膜对饮用水中无机阳离子的截留特性及分离选择性[J]. 环境科学学报, 40(8): 2700-2707.


