2. 昆明市生态环境科学研究院, 昆明 650032;
3. 中国环境科学研究院湖泊生态环境创新基地, 国家环境保护湖泊污染控制重点实验室, 北京 100012
2. Kunming Research Academy of Environment Sciences, Kunming 650032;
3. State Environmental Protection Key Laboratory for Lake Pollution Control, Research Center of Lake Eco-Environment, Chinese Research Academy of Environmental Sciences, Beijing 100012
河流是入湖(海)水循环的重要环节, 是陆源污染物汇入湖泊、海洋的重要通道.随着社会经济的快速发展, 人们对河流的开发活动加剧, 导致河流水质、河道底泥污染严重.水环境中的污染负荷主要来自于工农业生产污水、城镇生活废水、城市面源污水、农业面源污水等.由于污水来源不同, 其携带的污染物组分不同, 化学性质不同, 会对水生态安全带来潜在的风险.查阅相关资料发现, 我国大约有82%的河段受到不同程度的污染, 其中污染较严重的河段占30%, 有70%的城市河段水质达不到饮用水标准.当前最严重的水环境问题是水体富营养化, 由于大范围的河流-湖泊呈现严重的富营养化状态造成水体水质快速恶化, 进而严重威胁到水资源的利用和可持续发展.随着“碧水、蓝天、净土”攻坚战的展开, 国家环保部门加大了对环境的保护力度, 特别是对湖泊、河流等水体的保护.
随着对水体富营养化机理的深入研究, 学者发现水体富营养化并不是由单纯的氮、磷营养盐过量引起的.Nixon(1995)将有机质引入富营养化的研究范畴, 并对水体富营养化重新定义, 认为水体富营养化是由水体中有机质供给速率过快而导致的环境问题.将有机质拓展到水体富营养化的研究领域, 不仅将水体富营养化的内涵从氮、磷营养盐过剩问题拓宽到有机质含量过剩引起的环境问题, 而且将水体富营养化的研究范畴从水生态系统营养盐的迁移转化过程提高到水环境污染的生态效应问题, 突破了传统意义上以水体营养盐水平和营养级别来研究水环境特征(刘华丽等, 2011), 可以更科学、更全面、深层次地解释水体富营养化的发生机理.
溶解态有机质(Dissolved Organic Matter, DOM)是指能通过0.45 μm玻璃纤维水系膜的有机质, 是一类化学组成、结构复杂的溶解性物质(Wu et al., 2003;Barbara et al., 2009).水体中DOM的来源可分为外源输入和内源输入, 其中, 内源输入主要包括异养生物对环境中有机物的降解产物及其排泄物和沉积物间隙水释放的有机质.生物降解是指以浮游植物、沉水植物、海藻等生物降解行为为主, 如Kowalczuk等(2003)认为浮游植物降解生成的DOM是总DOM的重要组成部分;Sasaki等(2005)认为DOM是浮游植物细胞死亡降解后的副产品.沉积物间隙水释放的有机质是内源输入DOM的另一个来源, Burdige(2001)对切萨皮克湾水体沉积物中DOM的释放的控制因素进行探究, 发现风浪扰动会促进沉积物中DOM的释放.随着社会经济的快速发展, 外源输入逐渐成为DOM的主要来源, 并与人为活动有着密切的关系, 主要通过降雨径流和土壤淋洗、植被过滤等途径汇入水体.不同来源的DOM在水体中可以相互转化, 如李安定等(2018)对城市河道中DOM来源进行了研究, 结果显示, 藻类爆发后水体中DOM来源由陆源输入为主转变为以内源输入为主, 同时DOM分子结构由简单转变为复杂.滇池是世界范围内颇受关注的高原湖泊, 是长江上游生态安全格局的重要组成部分, 也是我国典型的半封闭高原湖泊.入湖河流水质对滇池生态环境的影响较大, 但目前对滇池流域入湖河流中有机质来源方面的研究很少, 因此, 本文拟针对滇池流域入湖河流上覆水中DOM的来源及组成进行研究.
DOM来源的复杂性决定了其物质组成、化学结构和化学性质的复杂性.目前, 三维荧光分析技术和平行因子分析技术成为研究DOM来源及组分应用最广泛的技术.陈乐等(2019)基于三维荧光分析技术和平行因子分析法对抚仙湖中DOM的丰富度进行分析, 发现不同季节水体中DOM丰富度不同;姚昕等(2014)基于三维荧光表征手段成功地分析了太湖草、藻水样中DOM的荧光组分.基于此, 本文采用三维荧光光谱和平行因子分析方法, 对2018年滇池流域主要入湖河流丰水期和枯水期水体溶解性有机质(DOM)的组成进行探究, 并结合主成分分析和多元线性回归分析方法对河流中DOM各荧光组分的相对贡献进行定量分析.以期为滇池流域水体富营养化治理提供科学依据和建议.
2 材料与方法(Materials and methods) 2.1 研究区域概况滇池流域是以昆明市为中心的云南省经济最发达的地区, 流域面积为2920 km2, 建城区面积为412 km2.据统计, 2018年滇池流域人口总数达到407.4万人, 人口数占昆明市总人口的60%.该地区干湿两季分明, 5—10月为雨季, 11月—次年4月为干季.目前, 除入湖河流以外, 滇池没有大额水源补水.但入湖河流流量小、流程短、污染负荷高、水质较差, 河流自净能力相对不足, 已有部分河流断面出现黑臭现象.滇池流域中高污染负荷河流已经严重威胁到滇池的生态安全和流域城市景观建设.表 1所示为2018年主要入湖河流中V类和劣Ⅴ类河流及其污染负荷来源.
| 表 1 2018年入湖河流水质现状及污染负荷来源 Table 1 Water quality status and pollution load sources of rivers entering the lake in 2018 |
在众多入湖河流中选取25条主要入湖河流为研究对象, 探究枯水期和丰水期入湖河流上覆水中DOM的荧光光谱特征及组分贡献率, 以期为滇池流域水体富营养化治理提供科学依据和建议.
沿滇池由北至南依次对新运梁河、老运粮河、乌龙河、大观河、西坝河、船房河、采莲河、金家河、盘龙江、海河、小清河、虾坝河、老宝象河、新宝象河、广普大沟、洛龙河、捞鱼河、南冲河、淤泥河、白鱼河、茨巷河、东大河、护城河、古城河、海口进行布点(图 1).布点原则主要是依据湖泊流域生态水文过程的完整性, 即采样点布设在入湖河流下游且避开滇池回水25~30 m的区域内.其中, 新运粮河-广普大沟等15条河流经人口数较多的主城区, 洛龙河-海口流经农村区域.于2018年5月(丰水期)和2018年11月(枯水期), 用有机玻璃采样器采集水样, 然后装在不透明的高密度聚乙烯瓶中带回实验室.水样上清液过0.7 μm滤膜(Whatman, UK.GF/F)进行低压抽滤, 再用0.22 μm滤膜过滤水样, 并置于4 ℃冰箱中冷藏避光保存, 在短期内测定.采样点的空间分布如图 1所示, 研究过程中常用的仪器及型号见表 2.
 |
| 图 1 入湖河流采样点空间分布 Fig. 1 Spatial distribution of sampling points |
| 表 2 实验主要仪器及型号 Table 2 Main instruments and models |
用HITACHIF-4500FL型荧光光谱仪对水样进行三维荧光光谱技术分析.测定条件为:激发光源采用150 W氙弧灯, PMT电压为700 V, 信噪比>110, 带通为λEx=5 nm, λEm=5 nm;响应时间选择自动;扫描速度为2400 nm·min-1.激发波长(λEx)范围为200~450 nm, 波长间隔为5 nm;发射波长(λEm)范围为250~600 nm, 波长间隔为1 nm.用Milli-Q超纯水做实验空白, 且每测10个水样, 用Milli-Q超纯水的拉曼光谱强度监控荧光仪的稳定性, 并用0.01 mg·L-1硫酸奎宁进行荧光定标.通过计算上覆水中DOM的荧光指数(FI)、腐殖化指数(HIX)和自生源指数(BIX)的值, 对入湖河流水体中DOM的来源及性质做出判断, 其特征参数FI、HIX和BIX表述如表 3所示.
| 表 3 光谱参数描述 Table 3 Description of spectral parameters |
平行因子分析法(PARAFAC)是解析DOM荧光组成最为有效的分析技术之一, 可以有效地解决三维荧光光谱中不能准确识别荧光峰的难题(Guimet et al., 2004).因此, 为了准确分析入滇河流DOM荧光组分, 用MatlabR2009a PARAFAC工具箱对所有水样的三维荧光光谱数据进行PARAFAC分析.分析步骤主要包括:扣除空白、去除拉曼散射和瑞丽散射、荧光数据异常值的去除、荧光组份数的确定与验证、残差分析验证、折半分析、绘制等高线及其相应的平行因子图谱.
2.4 DOM各组分贡献率计算方法为进一步了解入湖河流DOM各荧光组分的时空变异性及各荧光组分的贡献率, 对水样DOM荧光组分进行多元线性回归分析.具体步骤如下:①采用SPSS13.0软件中的检验模块对所有样品的荧光组分形成数据矩阵进行KMO度量和Bartlett球形度检验, 判断样品是否满足主成分分析;②在满足主成分分析的条件下, 进行主成分分析;③以样品主成分因子得分变量和总荧光强度(TF)正态标准化为变量进行多元线性逐步回归分析, 确定DOM中各荧光组分的贡献率.
3 结果与讨论(Results and discussion) 3.1 DOM荧光组分分析 3.1.1 DOM的荧光组分解析对所有水样DOM三维荧光图谱数据进行PARAFAC解析, 共识别出5种有效的荧光组分(图 2), 分别为C1(λEx/λEm=240, 290 nm/390 nm)、C2(λEx/λEm=230 nm/340 nm)、C3(λEx/λEm=270, 360 nm/480 nm)、C4(λEx/λEm=230, 280 nm/330 nm)、C5(λEx/λEm=245, 340 nm/410 nm).其中, 组分C1荧光峰的位置与陆源类腐殖质荧光峰A和海源类腐殖质荧光峰M位置相近(Wolfe, 2002;Nieto-Cid et al., 2006), 荧光峰A是紫外光区陆源类腐殖质产生的荧光, 主要与低分子量、高荧光效率有机化合物有关, 一般认为该类荧光组分主要以陆源方式输入;荧光峰M是海源类腐殖质产生的荧光, 主要与异养生物代谢产生的可溶性有机物有关(Battin, 1998);故组分C1可以认为是传统A峰和M峰的混合体, 以陆源方式输入.组分C2的最大波峰位置与类蛋白色荧光峰T2的位置相近, 该类荧光物质与类色氨酸物质的荧光光谱特征相似, 认为是由水体内部产生的有机质.组分C3的最大波峰位置与陆源类腐殖质荧光A峰和C峰的位置相近(Murphy et al., 2006), 主要为短波类富里酸和长波类富里酸产生的荧光.组分C4的最大波峰位置分别与类蛋白荧光峰T2和T1的位置相近(Yamashita et al., 2008), 主要为氨基酸和类色氨酸, 是由生物降解产生的内源物质形成的荧光(Chen et al., 2003).组分C5的最大波峰位置与陆源类腐殖质荧光峰A和C峰的位置相近, 认为是短波类富里酸和长波类富里酸产生的荧光.
 |
| 图 2 平行因子分析得到的5种荧光组分图和对半检验图 Fig. 2 Three dimensional fluorescence diagram of five components obtained by parallel factor analysis and its excited emission wavelength location |
对入湖河流上覆水中DOM的5种荧光组分进行相关性分析, 结果见表 4.组分C1、C3和C5之间存在显著的相关性(p < 0.01), 组分C2与C4之间的相关性显著(p < 0.05).初步判断入湖河流上覆水中DOM的5种荧光组分的来源之间存在较强的关联性.为了进一步明确入湖河流上覆水中DOM荧光组分的主要成分, 采用主成分分析模型确定其DOM的主成分, 结果显示, 对水样的三维荧光光谱数据处理后提取出2种主要成分, 其中, 第1主成分(PC1, 代表类腐殖质荧光)对总方差的解释达到53.9%, 第2主成分(PC2, 代表类蛋白色氨酸荧光)对总方差的解释达到32.1%, 累积达到86.5%, 说明主成分分析法对原数据的损失不大.
| 表 4 河流DOM五组分荧光强度相关性分析 Table 4 Correlation analysis of fluorescence intensity of DOM five components in River |
为了进一步分析入滇河流上覆水中DOM各荧光组分的影响因素, 分别对枯水期和丰水期河流上覆水中DOM的5种荧光组分进行分析, 结果见图 3.
 |
| 图 3 枯水期(a)、丰水期(b)入湖河流5种组分分布情况 Fig. 3 Distribution characteristics of different component concentrations in Dianchi Lake |
① 类腐殖质物质荧光强度分布特征.枯水期, 入湖河流上覆水中DOM中类腐殖质物质(C1、C3和C5)的总荧光强度占比整体偏小.其中, 洛龙河水样中荧光强度之和最低, 为381.98 QSU, 广普大沟水样中荧光强度最高, 为4645.1 QSU.丰水期, 海口水样中类腐殖质荧光强度最低, 为544.11 QSU, 虾坝河水样中类腐殖质荧光强度最高, 为2111.6 QSU.丰水期, 河流水样中类腐殖质荧光强度整体偏高的主要原因可能是:丰水期降雨量大幅度上升, 通过地表径流进入河流的陆源腐殖质含量增加, 导致类腐殖质荧光强度升高.
② 类蛋白物质荧光强度分布特征.枯水期, 入湖河流上覆水中DOM中类蛋白物质(C2和C4)总荧光强度占比较大.其中, 白鱼河水样中类蛋白质物质荧光强度最低, 为374.08 QSU, 广普大沟水样中类蛋白质物质荧光强度最高, 为6654.78 QSU.丰水期, 同样是白鱼河水样中类蛋白质物质荧光强度最低, 为159.55 QSU, 广普大沟水样中类蛋白质物质荧光强度最高, 为5579.51 QSU.枯水期类蛋白质物质总荧光强度升高的主要原因可能是:枯水期, 外源输入量减小, 同时沉水植物和藻类物质衰亡加速, 底泥中间隙水受其他因素的影响加速内源的释放, 导致水体类蛋白物质强度明显升高.
不管是枯水期还是丰水期, 老运粮河、西坝河和广普大沟水样中DOM的总荧光强度较高, 这3条河是市区污染最严重的河流, 汇集了沿线居民小区生活污水、城市面源污水、工业生产废水, 同时河道污染负荷较高, 河道底泥中累积的大量污染物质作为二次污染源严重影响水质, 导致部分断面出现黑臭现象.进一步说明频繁的人类活动是导致水体DOM增加的重要因素之一(Mcknight et al., 2001;Huguet et al., 2009;Osburn et al., 2011).而大部分农业河流, 枯水期类蛋白质物质荧光强度高于丰水期的主要原因可能是:入湖河口处的沉水植物及藻类衰亡加速, 导致DOM类蛋白色氨酸浓度显著上升.姚昕等(2014)研究发现, 太湖水体中藻类植物生长代谢会产生类蛋白色氨酸荧光, 解释了枯水期河流水样中DOM组分中类蛋白质物质荧光强度上升.总体来说, 人为影响和河道污染物本底值高是影响入湖河流DOM荧光强度分布的主要原因.
3.2 DOM荧光性质分析FI是用来判断DOM来源的特征参数, FI大于1.90表示主要是自养微生物或藻类活动产生的以内源输入为主的DOM, FI小于1.40表明是以陆源输入为主的外源DOM(Leenheer et al., 2003).枯水期, 入湖河流DOM的FI值为1.64~2.24, 其均值为1.92;丰水期FI为1.58~1.89, 其均值为1.73(图 4).枯水期和丰水期, 河流DOM的FI值的变化趋势说明入滇河流DOM是以外源输入和内源输入组成的混合型.BIX用来反映DOM组分中自生源的贡献(Leenheer et al., 2003), BIX值越大表明DOM的自生源特征显著, 自生源贡献大, BIX值越小说明受陆源输入的影响越大, 其自生源特征不显著, 自生源贡献小.研究发现, 当BIX < 0.8时, DOM组分中自生源的贡献较小;1.00>BIX>0.80时自生源贡献较大;BIX>1.00时DOM表现出显著的自生源特征.枯水期与丰水期, 入湖河流上覆水中DOM的BIX指数变化范围分别为0.85~1.10和0.82~0.99, 均值分别为0.91±0.09和0.90±0.07(图 4);对比两个时期水体DOM的BIX变化趋势, 说明入滇河流DOM组分中自生源的贡献率较大, 且DOM的生物可利用性较高.HIX表征DOM腐质化程度(Ohno et al., 2002), HIX值越大表明DOM的腐质化程度越高, DOM分子结构越稳定.当HIX值为10.0~16.0时, DOM的腐质化程度较高, 且主要为外源输入;当HIX < 4.00时, DOM的腐质化程度较低, 主要以内源输入为主.枯水期与丰水期, 入湖河流上覆水中DOM的HIX值范围分别为0.93~4.06和1.70~7.59, 均值分别为2.20和4.20(图 4).通过分析入湖河流DOM的FI指数、BIX指数和HIX指数的变化特征, 表明入湖河流上覆水中DOM的腐殖化程度较低, 特别是丰水期, 受到外来水体(城市面源、农业面源、城市生活污水等)的影响DOM腐殖化程度降低.
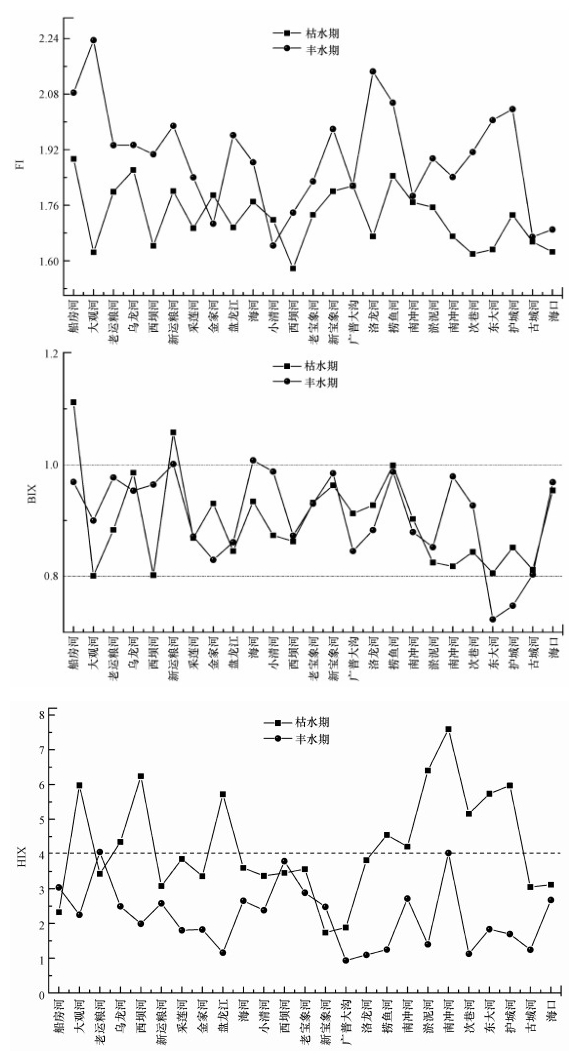 |
| 图 4 入湖河流FI、BIX、HIX值变化趋势 Fig. 4 Shifting trends of FI, BIX, HIX value of rivers that flow into the Dianchi Lake at different seasons |
通过对河流中DOM的荧光组分和荧光性质的分析, 发现滇池流域入湖河流上覆水中DOM主要由类蛋白物质和类腐殖质物质构成.为了确定这两类荧光物质的贡献率, 本文采用多元线性回归模型进行计算分析.图 5是丰水期和枯水期入湖河流上覆水中DOM两大类荧光组分的贡献率.由图可知, 枯水期入湖河流DOM中类腐殖质的平均贡献率为30.1%, 类蛋白色氨酸的平均贡献率为69.9%;丰水期类腐殖质的平均贡献率为54.3%, 类蛋白色氨酸的平均贡献率为45.7%.说明枯水期河流DOM以类蛋白色氨酸为主, 其次是类腐殖质物质, 而丰水期河流DOM以类腐殖质为主, 其次为类蛋白色氨酸.总体来讲, 入湖河流上覆水中DOM组分中类腐殖质的贡献特征是丰水期高于枯水期, 主要原因可能是丰水期降雨强度的增加导致土壤中腐殖质通过地表径流汇入水体.类蛋白色氨酸的贡献特征是枯水期高于丰水期, 主要原因可能是河道中水生植物衰亡后经过微生物降解增加了水体中类蛋白色氨酸.
 |
| 图 5 不同时期入湖河流DOM组分贡献率 Fig. 5 Contribution rate of DOM components of rivers entering the lake in different periods |
1) 运用平行因子分析技术解析出滇池流域入湖河流上覆水中DOM含5种有效荧光组分, 分别为C1(λEx/λEm=240, 290 nm/390 nm)、C2(λEx/λEm=230 nm/340 nm)、C3(λEx/λEm=270, 360 nm/480 nm)、C4(λEx/λEm=230, 280 nm/330 nm)、C5(λEx/λEm=245, 340 nm/410 nm).
2) 通过相关性分析发现DOM的5种荧光组分之间具有同源性, 且水质较差的河流总荧光强度相对较高.对DOM各项荧光指数(FI、BIX、HIX)的分析得出, 入湖河流上覆水中DOM以自生源为主, 且腐殖化程度底.多元线性回归分析结果显示, 枯水期和丰水期, 入湖河流DOM中类腐殖质的平均贡献率分别为30.1%、54.3%, 类蛋白色氨酸的平均贡献率分别为69.9%、45.7%, 两种荧光组分贡献率的趋势表明, 入湖河流上覆水DOM除受人为因素的影响外, 还与河流周边污水的输入及河道底泥严重污染有关.
3) 通过对DOM荧光光谱的研究, 建议入湖河流的污染治理应以内源污染的治理为主.下一步工作需要进一步确认水体DOM与水质指标之间的响应关系, 以期为河流管理提供更加科学的数据和理论支撑.
Battin T J. 1998. Dissiolved organic matter and its optical properties in a blackwater tributary of the upper Orinoco River, Venezuela[J]. Organic Geochemistry, 28(9/10): 561-569. |
Burdige D. 2001. Dissolved organic matter in Chesapeake Bay sediment pore waters[J]. Organic Geochemistry, 32(4): 487-505. |
陈乐, 周永强, 周起超, 等. 2019. 抚仙湖有色可溶性有机物的来源组成与时空变化[J]. 湖泊科学, 31(5): 1357-1367. |
Chen J, Le Boeuf Eugene J, Dai S, et al. 2003. Fluorescence spectroscopic studies of natural organic matter fractions[J]. Chemosphere, 50(5): 639-647. |
Guimet F, Ferré J, Boqué R, et al. 2004. Application of unfold principal component analysis and parallel factor analysis to the exploratory analysis of olive oils by means of excitation-emission matrix fluorescence spectroscopy[J]. Analytica Chimica Acta, 515(1): 75-85. |
Huguet A, Vacher L, Stéphane R, et al. 2009. Properties of fluorescent dissolved organic matter in the Gironde Estuary[J]. Organic Geochemistry, 40(6): 706-719. |
Hiroaki S, Tsuyoshi M, Sei-ichi S, et al. 2005. Seasonal variation of absorption by particles and colored dissolved organic matter (CDOM) in Funka Bay, southwestern Hokkaido, Japan[J]. Estuarine Coastal & Shelf Science, 64(2/3): 447-458. |
Kowalczuk P, Cooper W J, Whitehead F, et al. 2003. Characterization of CDOM in an organic-rich river and surrounding coastal ocean in the South Atlantic Bight[J]. Aquatic Sciences, 65(4): 384-401. |
李安定, 张彦, 周北海, 等. 2018. 城市景观河道中藻华暴发对水体中DOM特征的影响[J]. 光谱学与光谱分析, 38(1): 188-193. |
刘华丽, 曹秀云, 宋春雷, 等. 2019. 有机质在水体富营养化过程中的作用及其对有机农业管理的启示意义[J]. 农业资源与环境学报, 28(5): 12-16. |
Leenheer J A, Wershaw R L, Brown G K, et al. 2003. Characterization and diagenesis of strong-acid carboxyl groups in humic substances[J]. Applied Geochemistry, 18(3): 471-482. |
Mcknight D M, Boyer E W, Westerhoff P K, et al. 2001. Spectrofluorometric characterization of dissolved organic matter for indication of precursor organic material and aromaticity[J]. Limnology & Oceanography, 46(1): 38-48. |
Murphy K R, Stedmon C A, Waite T D, et al. 2006. Distinguishing between terrestrial and autochthonous organic matter sources in marine environments using fluorescence spectroscopy[J]. Marine Chemistry, 108: 40-58. |
Nieto-Cid M, álvarez-Salgado X A, Pérez F F. 2006. Microbial and photochemical reactivity of fluorescent dissolved organic matter in a coastal upwelling system[J]. Limnology & Oceanography, 51(3): 1391-1400. |
Nixon Scott W. 1995. Coastal marine eutrophication:A definition, social causes, and future concerns[J]. Ophelia, 41(1): 199-219. |
Ohno T. 2002. Fluorescence inner-filtering correction for determining the humification index of dissolved organic matter[J]. Environmental Science & Technology, 36(4): 742-746. |
Osburn C L, Wigdahl C R, Fritz S C, et al. 2011. Dissolved organic matter composition and photoreactivity in prairie lakes of the U.S.Great Plains[J]. Limnology & Oceanography, 56(6): 2371-2390. |
Sulzberger B, Kaiser E D. 2009. Chemical characterization of dissolved organic matter (DOM):A prerequisite for understanding UV- induced changes of DOM absorption properties and bioavailability[J]. Aquatic Sciences-Research Across Boundaries, 71(2): 104-126. |
Wolfe A P, Kaushal S S, Fulton J R, et al. 2002. Spectrofluorescence of sediment humic substances and historical changes of lacustrine organic matter provenance in response to atmospheric nutrient enrichment[J]. Environmental Science & Technology, 36(15): 3217-3223. |
Wu F C, Tanoue E, Liu C Q. 2003. Fluorescence and amino acid characteristics of molecular size fractions of DOM in the waters of Lake Biwa[J]. Biogeochemistry, 65(2): 245-257. |
姚昕, 张运林, 朱广伟, 等. 2014. 湖泊草、藻来源溶解性有机质及其微生物降解的差异[J]. 环境科学学报, 34(3): 688-694. |
Yamashita Y, Jaffe R, Maie N, et al. 2008. Assessing the dynamics of dissolved organic matter (DOM) in coastal environments by excitation emission matrix fluorescence and parallel factor analysis (EEM-PARAFAC)[J]. Limnol Oceanogr, 53: 1900-1908. |
 2020, Vol. 40
2020, Vol. 40



